温度和限食对花鲈早期幼鱼摄食与生长的影响
2017-10-10张凯强温海深张美昭李吉方
王 伟, 张凯强, 温海深, 张美昭, 李吉方
温度和限食对花鲈早期幼鱼摄食与生长的影响
王 伟, 张凯强, 温海深, 张美昭, 李吉方
(中国海洋大学水产学院, 海水养殖教育部重点实验室, 山东青岛266003)
为探索北方人工繁育花鲈()幼鱼冬季生长最佳温度及投饵模式, 本实验首次采用温度和限食双因素处理来研究花鲈幼鱼的补偿生长规律。实验设置3个温度水平(20℃、16℃和12℃)和2个投喂水平(100%投喂和50%投喂), 其中A组(20℃和100%投喂)为对照组, B组 (16℃和100%投喂)、C组 (12℃和100%投喂)、D组 (20℃和50%投喂)、E组 (16℃和50%投喂)和F组 (12℃和50%投喂)为处理组。实验分2个阶段: 第一阶段为30 d的处理阶段; 第二阶段为20 d的恢复阶段。结果表明, 花鲈幼鱼在不同温度及限食条件下具有不同的补偿生长能力和补偿生长机制。B组通过提高饵料转化率实现了超补偿生长; C组也是通过提高饵料转化率达到了完全补偿生长; D、E组则通过提高摄食率实现了完全补偿生长; F组的花鲈幼鱼则通过提高饵料转化率实现了部分的补偿生长。综合考虑花鲈幼鱼冬季培育成本及其生长, 建议北方花鲈幼鱼越冬培育温度为16℃, 投喂模式为100%投喂。
花鲈()幼鱼; 温度; 限食; 摄食; 补偿生长
花鲈()隶属于硬骨鱼纲(Osteichsthyes)、鲈形目(Perciformes)、科(Serranidae)、花鲈属(), 又称白花鲈、鲈子鱼、板鲈、青鲈、鲈鱼、寨花[1], 主要分布于中国沿海和朝鲜沿海。花鲈因其肉质细嫩、味道鲜美、营养价值高、广温广盐性、抗病力强等特点, 深受消费者的欢迎, 具有良好的养殖前景[2]。自然界中水产动物的生存条件易受外界环境的影响, 经常面临着如饵料不足造成的饥饿[3-5]以及温度变化[6-7]造成的胁迫等生存问题。花鲈属于秋末繁殖的鱼类, 此季节北方花鲈幼鱼生长受环境因素特别是温度和饵料的影响较为严重, 如果鱼类摄取的食物或者环境温度受限制不能维持生长需要, 鱼体的形态、摄食行为以及体内代谢过程都将会发生变化, 影响鱼类的生长发育及存活。花鲈虽属于耐饥饿程度很强的鱼类, 但其初摄食配合饲料阶段对环境变化敏感, 温度和饵料的变化对此阶段幼鱼的生长、代谢影响很大, 研究温度和限食对花鲈幼鱼生长的影响机制有助于掌握此时期花鲈幼鱼生长的最适宜培养模式。
目前国内外将温度、限食2个因素作为影响花鲈幼鱼补偿生长的研究还未见报道。本实验选择温度和限食2个因素来进行花鲈幼鱼补偿生长的研究, 旨在优化北方地区人工繁育花鲈幼鱼培育的最佳温度以及投饵模式, 进一步探究花鲈在环境变化后补偿生长的机制, 也为北方花鲈工厂化育苗和养殖提供科学依据。
1 材料与方法
1.1 实验材料
本实验在东营市利津县双瀛水产苗种有限责任公司进行, 实验对象为同一批该公司人工繁育的体质健壮、无外伤、体质量为(0.041±0.001) g、体长为(2.132±0.021) cm的花鲈幼鱼。实验所用容器为18个70 L的塑料圆桶(上外径: 540 mm; 下外径: 410 mm;高度: 460 mm)以及6个800 L的长方形塑料槽(157 cm×119 cm×58 cm)。温度由1 kW大功率加热棒以及控温器调节, 上下波动小于0.5℃。实验饲料来自珠海斗门区河口渔业研究所提供的花鲈全价配合饲料。
1.2 实验设计
本实验设置了3个温度水平, 分别是20、16和12℃; 2个投喂水平, 分别是50%投喂和100%投喂, 每个处理设3个重复。实验分2个阶段进行, 第一阶段30 d: 20℃和100%投喂的处理, 即对照组记为A组; 16℃和100%投喂的处理, 记为B组; 12℃和100%投喂的处理, 记为C组; 20℃和50%投喂的处理, 记为D组; 16℃和50%投喂的处理, 记为E组; 12℃和50%投喂的处理, 记为F组。第二阶段为恢复实验阶段, 共计20 d, 各组在20℃和100%投喂条件下进行。
1.3 养殖实验管理
1.3.1 实验鱼的驯化
实验用鱼先进行暂养以使其适应实验环境, 实验用水为经过沙滤、加热后的新鲜海水, 盐度控制在29.5±0.5。利用1周时间将原来16℃的海水保持或者升、降到各组设置的温度。在该条件下驯化、暂养5 d,每天早晚两次投喂配合饲料。光照周期设为12L: 12D, 24 h不间断充气。驯化结束后, 挑选健壮活泼、大小相近的个体放入圆桶中进行实验。
为保证每个处理的3个重复所处的外界环境相同, 实验开始前先将3个70 L圆桶放在1个800 L的塑料槽中, 然后将挑选出的1 440尾体质健壮、大小相近的花鲈幼鱼随机放入各个圆桶中, 每个圆桶中随机放入80尾花鲈幼鱼。第一阶段结束后, 利用5 d的时间将各组温度升到20℃。
1.3.2 日常管理
实验设置了3个温度水平, 分别是20、16和12℃。温度水平是综合鱼苗培育成本、鱼苗生长以及养殖场现实条件而设置的。实验同时设置了50%投喂和100%投喂两个日粮水平。日粮的设置方式如下: 在暂养结束前记录实验鱼的饱食日粮水平, 每次投喂前称量饲料, 使100%投喂组绝大部分花鲈幼鱼不再摄食即为饱食量, 然后根据摄食情况适时调整投喂量。50%投喂水平根据100%投喂水平按比例投喂。每隔1周, 抽样称量3个重复圆桶中鱼的体质量, 根据体质量调整投喂量。
本实验选择8: 00和16: 00 2个时间点进行投喂, 投喂前称量饲料, 待绝大多数花鲈幼鱼不再摄食即停止投喂, 此时称量剩余的饲料, 差值即为摄食量。投喂前停气清理粪便。实验期间每天换水1次, 换水率100%。实验期间各组溶解氧控制在5 mg/L以上, pH为7.98~8.04, 氨氮及亚硝酸盐含量均小于0.1 mg/L。
1.4 生长指标的测定
实验开始前以及各个阶段结束后, 均测量体质量、体长并根据它们计算出特定生长率(SG)、饵料转化率(FC)、摄食率(F)、肥满度():
SG(%/d)=(ln2–ln1)/(2–1)×100 %
FC(%)=100×(2–1)/%
F(%/d)=100×/[(2–1)×(2+1)/2] %
(%)=/3×100 %
式中,2、1分别表示2(d)、1(d)时花鲈幼鱼的体质量(g),为总摄食饲料量(g),是鱼体质量(g),为鱼体长(cm)。
1.5 样品的采集以及测定
实验开始前、实验第一、二阶段结束后, 每组随机捞取30尾鱼, 测定初始体质量和体长以及两个阶段后的体质量和体长。鱼由桶中取出, 立即放入盛有200 mg/L MS-222的水中麻醉30 s, 然后进行体质量、体长测量。
1.6 统计分析
实验数据均以平均值±标准差(M±SD)表示, 实验前、第一、二阶段结束后的数据用Excel和SPSS 19.0统计软件进行统计处理。运用单因素方差分析(One-way ANOVA)检验各组的各项生长指标, 应用Duncan多重比较检验各组数据间差异显著性, 同时用双因素方差分析(Two-factor ANOVA)对第一阶段结束后各组的生长数据进行交互作用的检验。以<0.05为显著性水平, 以<0.01为极显著性水平。
2 实验结果
2.1 不同温度、限食条件下花鲈幼鱼体质量、肥满度、存活率以及总投喂量
温度对处理阶段后花鲈幼鱼的体质量有极显著性影响(<0.01), 而限食、温度和限食交互作用对其无显著性影响(图1和表1)。A组终末体质量最大, 且与其他各组均存在显著性差异(<0.05)。在限食组中, 花鲈幼鱼的终末体质量均随温度的升高而增大。在100%投喂组中, 各组终末体质量之间差异显著(<0.05)。50%投喂组中, F组终末体质量与D、E组间均存在显著性差异(<0.05), 而D组终末体质量虽然大于E组, 但差异不显著。恢复阶段后, B组花鲈幼鱼的终末体质量最大, 且与其他各组存在显著性差异(<0.05), 图1)。A组终末体质量与C、D、E组相比存在差异但差异不显著, 但其显著高于F组(<0.05)。处理、恢复阶段结束后, 各组间肥满度均无显著性差异。处理阶段结束时, 存活率除F组外, 各组都在80%以上, 且各处理组均显著低于对照组(<0.05), 恢复阶段结束后, 各组的存活率在94%以上, 除D组外, 其他处理组均显著低于对照组。整个实验过程中的总投喂量, 各处理组均显著低于对照组((<0.05), 表2)。
同一阶段下, 柱状图上字母不同表示差异显著(<0.05), 否则差异不显著。下图同
At the same phase, different letters are significantly different (<0.05), otherwise no significant difference. The same as below
2.2 不同温度、限食条件下花鲈幼鱼的特定生长率
温度对处理阶段后的花鲈幼鱼的特定生长率有显著性影响(<0.05), 而限食、温度和限食的交互作用对其无显著性影响(图2和表1)。特定生长率最大是A组, 且与其他各组差异显著(<0.05), B、C、D和E组的特定生长率存在差异但差异不显著, F组特定生长率最小, 与其他各组相比存在显著性差异(<0.05)。在相同的投喂方式下, 随着温度的升高, 特定生长率逐渐上升。恢复阶段结束后, B组特定生长率显著高于A组(<0.05), 而F组特定生长率显著低于A组(<0.05)。C、D和E组的特定生长率高于A组, 但差异不显著(图2)。
2.3 不同温度、限食条件下花鲈幼鱼的摄食率
限食对处理阶段后的花鲈幼鱼的摄食率有显著性影响(<0.05), 而温度、温度和限食的交互作用对其无显著影响(图3和表1)。A组摄食率最大, E、F组摄食率最小且与其他各组间差异显著(<0.05)。相同投喂条件下, 随着温度的升高, 摄食率逐渐增加。同温度条件下, 各组随着投喂量的增加(50%~100%), 摄食率逐渐增加。恢复阶段结束后, D、E组的摄食率显著高于A组(<0.05), 而B、C组摄食率与A组之间差异不显著, 但F组摄食率显著低于A组((<0.05), 图3)。
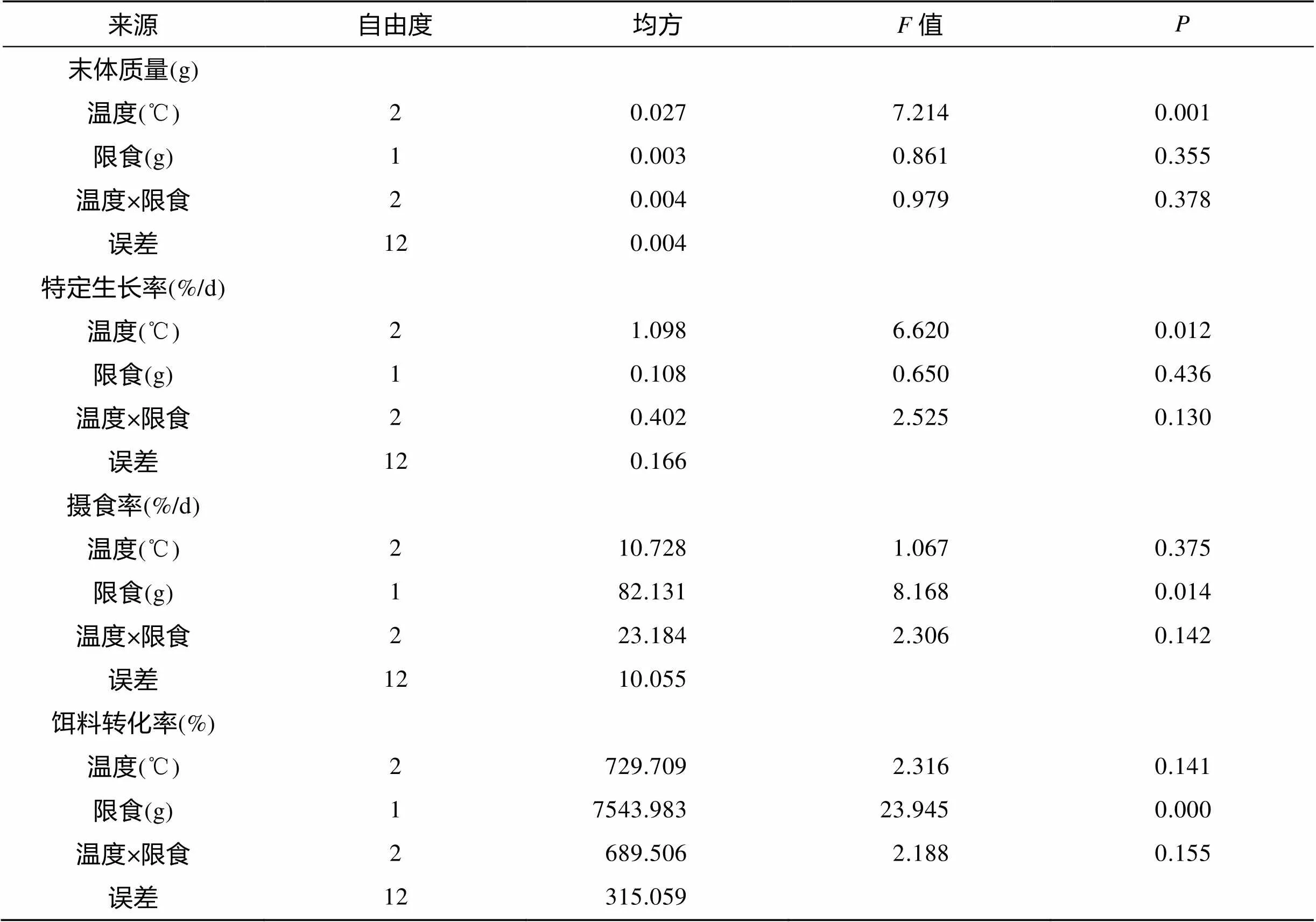
表1 双因素方差分析不同温度、限食条件对花鲈幼鱼处理阶段后末体质量、特定生长率、摄食率以及饵料转化率的影响
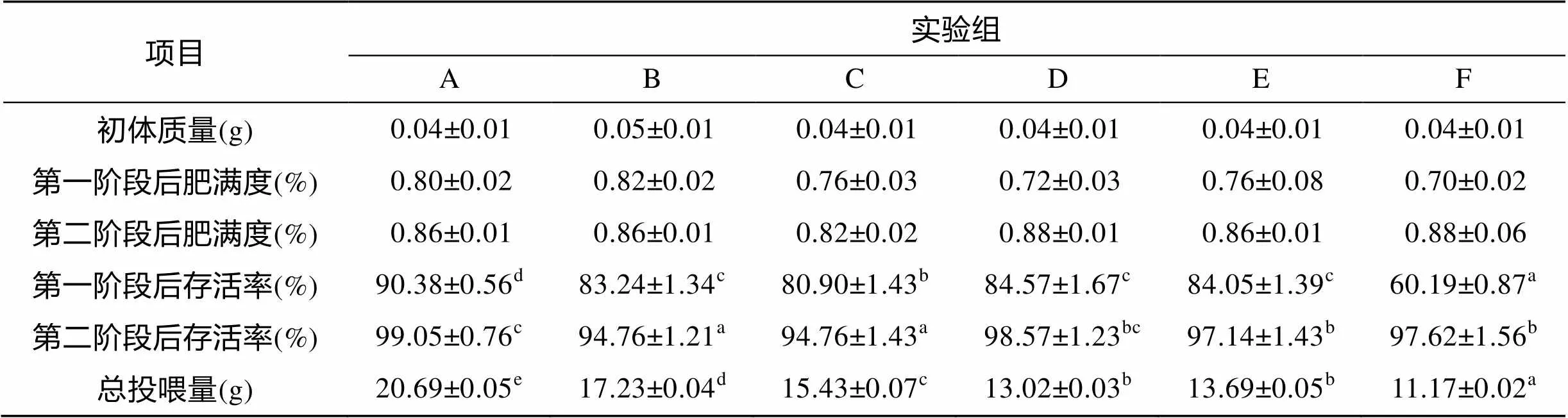
表2 不同温度、限食条件下花鲈幼鱼体质量、肥满度、存活率以及总投喂量(平均数±标准差)
注: 同一行中标有不同字母的数值表示差异显著(<0.05)
2.4 不同温度、限食条件下花鲈幼鱼的饵料转化率
限食对处理阶段后的花鲈幼鱼的饵料转化率有极显著性影响(<0.01), 而温度、温度和限食的交互作用对其无显著性的影响(图4和表1)。各组饵料转化率总体情况与末体质量相一致, 只是A、B组之间虽有差异但差异不显著。相同温度下, 随着投喂量的增加(50%~100%), 饵料转化率逐渐增大, 且差异显著(<0.05)。恢复阶段后, 各组变化趋势与此时末体质量一致, B、D和E组与处理阶段相比饵料转化率有不同程度的增加, 而D、E组与A组间饵料转化率差异不显著。F组饵料转化率显著低于A组((<0.05, 图4)。
3 讨论
3.1 不同温度和限食处理对花鲈幼鱼的补偿生长
花鲈幼鱼经过温度及限食处理后, 在恢复阶段中各组表现出不同程度的补偿生长现象。本实验中, 处理阶段结束后B组花鲈幼鱼的末体质量和特定生长率显著低于A组, 而恢复阶段结束后两值都显著高于A组, 明显出现了超补偿生长现象, 这种超补偿生长现象在曾庆民[8]对花鲈饥饿5和10 d后恢复投喂的研究中出现过, 也在崔阔鹏等[9]对三疣梭子蟹()溞状Ⅰ期幼体饥饿胁迫8和16 h组出现过, 同时也与饥饿处理的虹鳟()[10]、真鲷()[11]及美国红鱼()[12]研究结果一致, 但与以上研究不同的是本实验超补偿生长是由于温度恢复而获得的。鱼类中因温度恢复而达到超补偿生长的研究较少, 粉色斑点虾()[13]中的相关研究发现经过21℃、24℃、27℃、30℃和33℃5个不同温度处理的粉色斑点虾在温度恢复至30℃补偿生长15 d后, 各处理组粉色斑点虾体质量均相应的增加, 其中前期21℃处理的粉色斑点虾在温度恢复至30℃生长15 d后, 出现了超补偿生长的现象。B组超补偿生长的获得可能与花鲈幼鱼的摄食行为相关。处理阶段, B组花鲈幼鱼对饲料的敏感程度远远不及A组, 没有出现成群游动现象。而恢复阶段, B组花鲈幼鱼的抢食现象与A组相比更加明显, 群游现象显著, 此状况一直持续到实验结束。C、D和E组的花鲈幼鱼在处理阶段结束后其末体质量及特定生长率显著低于A组, 而恢复阶段结束后与A组无显著性差异, 说明花鲈幼鱼经过恢复阶段后达到了完全补偿生长, 这与朱艺峰等[14]进行的花鲈饥饿再投喂实验所获得的结果相似, 这种现象在受环境胁迫的鱼类中经常出现, 如异育银鲫()、长吻()[15], 亚马逊石脂鲤()[16]及腹石脂鲤()[17], 而有的鱼类如大西洋鲑()[18]在6周的50%投喂及6周的恢复饱食投喂后仅达到了部分补偿生长, 推测本实验D、E组温度的恢复可能是其达到完全补偿生长的重要原因。F组处理、恢复阶段末体质量和特定生长率均显著低于A组, 但末体质量、特定生长率与A组之间的差值有明显的减小, 因此F组的花鲈幼鱼属于部分补偿生长。受环境胁迫后, 在恢复适宜条件时表现出部分补偿生长的鱼类很常见, 比如大西洋鲑[18]、黄鳍金枪鱼()[19]、红点鲑()[20]、大西洋庸鲽()[21]及许氏平鲉()[22]。本实验的结果表明, 北方地区花鲈幼鱼培育的最佳温度是16℃, 投喂水平是100%投喂。
3.2 不同温度和限食处理对花鲈幼鱼的补偿生长的机制
目前有关补偿生长理论某种观点认为, 鱼类受环境因素胁迫后其体内基础代谢降低, 当条件恢复后, 较低的代谢水平会维持一段时间, 这种较低的代谢水平使得鱼类用于支出的能量降低而用于生长的能量随之增加, 从而提高了饵料转化率, 鱼类出现了补偿生长[10, 23]。在本实验中, B、C、F组补偿生长的机制皆是通过提高饵料转化率来实现, 支持上述观点。经过温度和限食处理后B组饵料转化率与A组差异不显著, 而经过恢复阶段后B组饵料转化率显著高于A组, 经过温度和限食处理后C组饵料转化率值显著低于A组, 而恢复阶段后C组饵料转化率值与A组差异不再显著。而B、C两组两阶段的摄食率均与A组无显著性差异, 因此B、C组是通过提高饵料转化率实现了补偿生长。F组两阶段饵料转化率、摄食率均显著低于A组, 但恢复阶段结束后F组饵料转化率与A组相比差值有明显的减小, 而恢复阶段结束后摄食率与A组的差距没有明显减小,因此推测F组是通过提高饵料转化率来实现了补偿生长。与本实验研究结果相似的鱼类也有报道, 例如美国红鱼[12]、红大马哈鱼()[24]及虹鳟[10]。同时, 还有一种观点认为, 鱼类受环境因素胁迫后恢复适宜条件时, 鱼类体内立即进行大量的合成作用, 代谢水平迅速升高, 补偿生长的产生是鱼类在适宜条件恢复后食欲增强, 大幅度提高摄食水平实现的[25]。本实验中, 恢复阶段后D、E组的花鲈幼鱼摄食率显著高于A组, 而饵料转化率与A组相比差异不显著, 因此D、E组是通过提高摄食率, 实现了补偿生长, 与上述观点相一致。短周期饥饿处理后恢复投喂的水产动物通常是通过提高摄食量, 增加代谢水平来实现补偿生长, 如杂交太阳鱼 ()[26]、斑点叉尾()[25]、南方鲇()[27]、三刺鱼()[28-29]、异育银鲫[15, 30]以及皱纹盘鲍()[31]等。
总之, 经过温度和限食处理后恢复适宜条件的花鲈幼鱼得到了不同程度的补偿生长。从生长方面考虑, B组最终体质量比A组高20%, 且存活率较高, B组是生长最快的处理组。从成本方面考虑, F组饲料投喂量最少, 与A组相比节约了近50%饲料量, 且节约了电能。F组为最经济的处理组, 但F组因低温和低投喂量造成的花鲈幼鱼死亡率较高, 从存活率方面考虑, F组不是最佳选择。C、D、E组各方面情况介于A、F组之间。可以根据不同的需要, 综合利弊, 选择不同的温度条件和投喂模式。
[1] 温海深, 钱焜, 张美昭, 等. 花鲈繁殖生理及人工养殖模式探析[J]. 现代农业科技, 2013, 5: 281-282. Wen Haishen, Qian Kun, Zhang Meizhao, et a1. Analysis on reproductive physiology and artificial cultivation model of[J]. Modern Agricultural Science and Technology, 2013, 5: 281-282.
[2] 张璐, 李静, 谭芳芳, 等. 饲料中不同维生素A含量对花鲈生长和血清生化指标的影响[J]. 水产学报, 2015, 39(1): 88-96. Zhang Lu, Li Jing, Tan Fangfang, et a1Effects of different dietary vitamin A levels on growth and serum biochemical parameters for Japanese sea bass ()[J]. Journal of Fisheries of China, 2015, 39(1): 88-96.
[3] 钱周兴, 徐永清, 方一峰. 饥饿对鱼类的影响[J]. 生物学通报, 2006, 41(6): 9-11. Qian Zhouxing, Xu Yongqing, Fang Yifeng. Effects of starvation on fish[J]. Biological Bulletin, 2006, 41(6): 9-11.
[4] 高鹏程, 周朝生, 吴洪喜, 等. 饥饿及恢复投喂对刺参生长、耗氧率和排氨率的影响[J]. 渔业科学进展, 2014, 35(1): 125-132.Gao Pengcheng, Zhou Chaosheng, Wu Hongxi, et al. Effects of starvation on growth, oxygen consumption and ammonia excretion rate of sea cucumber[J]Progress in Fishery Sciences, 2014, 35(1): 125-132.
[5] 贾瑞锦, 陈超, 孔祥迪, 等. 饥饿对条纹锯鮨仔鱼的存活、摄食及生长的影响[J]. 海洋科学, 2014, 38(4): 44-49. Jia Ruijin, Chen Chao, Kong Xiangdi, et al. Effects of starvation on suriving, feeding and growth of the Yolk-sac larval of[J]. Marine Sciences, 2014, 38(4): 44-49.
[6] 纪利芹, 蒋克勇, 韩龙江, 等. 连续降温对大菱鲆成鱼代谢机能的影响[J]. 海洋科学, 2014, 38(5): 46-53. Ji Liqin, Jiang Keyong, Han Longjiang, et al. Effect of continuous cooling on metabolic function of adultL.[J]. Marine Sciences, 2014, 38(5): 46-53.
[7] 徐奇友, 黄金凤. 环境温度和蛋白质水平对鱼类生长和代谢的影响[J]. 东北农业大学学报, 2011, 42(12): 1-8. Xu Qiyou, Huang Jinfeng. Effect of environmental temperature and protein level on growth and metabolism of fish[J]. Journal of Northeast Agricultural University, 2011, 42(12): 1-8.
[8] 曾庆民. 饥饿对花鲈生长效果的比较研究[J]. 集美大学学报(自然科学版), 2004, 9(2): 122-126. Zeng Qingmin. A comparative study on intermittent feeding and compensatory growth of sea bass[J]. Journal of Jimei University (Natural Science), 2004, 9(2): 122-126.
[9] 崔阔鹏, 马甡. 三疣梭子蟹溞状Ⅰ期幼体的饥饿实验[J]. 海洋科学, 2009, 33(8): 40-43. Cui Kuopeng, Ma Shen. Starvation experiments with the larvae ofin zoea stage[J]. Marine Sciences, 2009, 33(8): 40-43.
[10] Dobson S H, Holmes R M. Compensatory growth in the rainbow trout,Richardson[J]. Journal of Fish Biology, 1984, 25(6): 649-656.
[11] 张波, 孙耀. 饥饿对真鲷生长及生化组成的影响[J]. 水产学报, 2000, 24(3): 206-210. Zhang Bo, Sun Yao. The effects of starvation on growth and biochemical composition in[J]. Journal of Fisheries of China, 2000, 24(3): 206-210.
[12] 姜志强, 贾泽梅. 美国红鱼继饥饿后的补偿生长及其机制[J]. 水产学报, 2002, 26(1): 67-72. Jiang Zhiqiang, Jia Zemei. The compensatory growth and its mechanism of red drum,after food deprivation[J]. Journal of Fisheries of China, 2002, 26(1): 67-72.
[13] Hostins B, Braga A, Lopes D L A, et al. Effects of temperature on nursery and compensatory growth of pink shrimpreared in a super-intensive biofloc system[J]. Aquacultural Engineering, 2015, 66: 62-67.
[14] 朱艺峰, 林霞, 关文静, 等. 花鲈在短期周期性饥饿下的补偿生长[J]. 水产科学, 2007, 26(11): 597-600. Zhu Yifeng, Lin Xia, Guan Wenjing, et al. Compensatory growth in Japanese sea perchduring short period starvation[J]. Fisheries Science, 2007, 26(11): 597-600.
[15] Zhu X, Xie S, Zou Z, et a1Compensatory growth and food consumption in gibel carp,and Chinese longsnout catfish,experiencing eye’s of feed deprivation and refeeding[J]. Aquaculture, 2004, 241(1): 235-247.
[16] Urbinati E C, Sarmiento S J, Takahashi L S. Short-term cycles of feed deprivation and refeeding promote full compensatory growth in the Amazon fish matrinxã ()[J]. Aquaculture, 2014, 433: 430-433.
[17] Kojima J T, Leitão N J, Menossi O C C, et alShort periods of food restriction do not affect growth, survival or muscle development on pacu larvae[J]. Aquaculture, 2015, 436: 137-142.
[18] Stefansson S O, Imsland A K, Handeland S O. Food- deprivation, compensatory growth and hydro-mineral balance in Atlantic salmon () post-smolts in sea water[J]. Aquaculture, 2009, 290(3): 243-249.
[19] Paul A J, Paul J M, Smith R L. Compensatory growth in Alaska yellowfin sole,following food deprivation[J]. Journal of Fish Biology, 1995, 46(3): 442-448.
[20] Jobling M, Jørgensen E H, Siikavuopio S I. The influence of previous feeding regime on the compensatory growth response of maturing and immature Arctic charr,[J]. Journal of Fish Biology, 1993, 43(3): 409-419.
[21] Heide A, Foss A, Stefansson S O, et al. Compensatory growth and fillet crude composition in juvenile Atlantic halibut: Effects of short term starvation periods and subsequent feeding[J]. Aquaculture, 2006, 261(1): 109- 117.
[22] Oh S Y, Noh C H, Kang R S, et al. Compensatory growth and body composition of juvenile black rockfishfollowing feed deprivation[J]. Fisheries Science, 2008, 74(4): 846-852
[23] Mlglavs I, Jobling M. Effects of feeding regime on food consumption, growth rates and tissue nucleic acids in juvenile Arctic charr,, with particular respect to compensatory growth[J]. Journal of Fish Biology, 1989, 34(6): 947-957.
[24] Bilton H T, Robins G L. The Effects of starvation and subsequent feeding on survival and growth of fulton channel sockeye salmon fry ()[J]. Journal of the Fisheries Research Board of Canada, 1973, 30(1): 1-5.
[25] Kim M K, Lovell R T. Effect of restricted feeding regimens on compensatory weight gain and body tissue changes in channel catfishin ponds[J]. Aquaculture, 1995, 135(4): 285-293.
[26] Robert Hayward, Douglas Noltie, Ning Wang. Use of compensatory growth to double hybrid sunfish growth rates[J]. Transactions of the American Fisheries Society, 1997, 126(2): 316-322.
[27] 邓利, 张波, 谢小军. 南方鲇()继饥饿后的恢复生长[J]. 水生生物学报, 1999, 23(2): 168-173. Deng Li, Zhang Bo, Xie Xiaojun. The recovery growth in the southern catfish () following starvation[J]. Journal of Aquatic Biology, 1999, 23(2): 168-173.
[28] Ali M, Wootton R J. Capacity for growth compensation in juvenile three-spined sticklebacks experiencing cycles of food deprivation[J]. Journal of Fish Biology, 2001, 58(6): 1531-1544.
[29] Wu L, Xie S, Cui Y, et al. Effect of cycles of feed deprivation on growth and food consumption of immature three-spined sticklebacks and European minnows[J]. Journal of Fish Biology, 2003, 62(1): 184-194.
[30] Xie S, Zhu X, Cui Y, et al. Compensatory growth in the gibel carp following feed deprivation: temporal patterns in growth, nutrient deposition, feed intake and body composition[J]. Journal of Fish Biology, 2001, 58(4): 999-1009.
[31] 任黎华, 张继红, 王文琪, 等. 周期性断食对皱纹盘鲍生长、摄食、排粪和血细胞组成的影响[J]. 渔业科学进展, 2012, 33(2): 86-91. Ren Lihua, Zhang Jihong, Wang Wenqi, et al. Effects of periodic starvation on growth, feeding, defecation and granulocyte of Pacific abaloneIno[J]. Progress in Fishery Sciences, 2012, 33(2): 86-91.
Temperature and food restriction effect on ingestion and growth in early-stagejuveniles
WANG Wei, ZHANG Kai-qiang, WEN Hai-shen, ZHANG Mei-zhao, LI Ji-fang
(The Key Laboratory of Mariculture, Ministry of EducationCollege of Fisheries, Ocean University of China, Qingdao 266003, China)
This study aims to find the optimum growth temperature and feeding mode for the artificial breeding ofjuveniles in the northern region during winter. This is the first instance in which different temperature and food restriction treatments were used to study the compensatory growth regularities ofjuveniles. We set up three levels of temperature (20, 16, 12℃) and two levels of food restriction (50% and 100%). Group A (20℃ and 100%) was the control group; B (16℃ and 100%), C (12℃ and 100%), D (20℃ and 50%), E (16℃ and 50%), and F (12℃ and 50%) were the treatment groups. The experiment was divided into two phases in which phase 1 comprised treatment for the duration of 30 days and phase 2 comprised recovery for the duration of 20 days. The results showed that after different temperature and food restriction treatments,juveniles obtained different degrees of compensatory growth ability and compensatory growth mechanism. Group B achieved over-compensatory growth by improving food conversion efficiency. Group C achieved full compensatory growth by also increasing food conversion efficiency. Both groups D and E achieved full compensation growth by increasing the feeding ratio. In addition, the results showed that thejuveniles of group F achieved compensation growth by increasing food conversion efficiency. Considering the cultivation cost and growth ofjuveniles, it is suggested that the culturing optimum temperature ofjuveniles in the northern region is 16℃, and that the feeding mode is satiation.
juveniles; temperature; food restriction; ingestion; compensatory growth
(本文编辑: 谭雪静)
Aug. 11, 2016
[Science and Technology Support Program, No.2011BAD13B03; Fisheries Science and Technology of Dongying City, No.20150217]
S917.4
A
1000-3096(2017)06-0001-08
10.11759//hykx20160811001
2016-08-11;
2016-10-25
国家“十二五”国家科技支撑计划课题(2011BAD13B03); 东营市渔业科技资助项目(20150217)
王伟(1990-), 男, 安徽芜湖人, 硕士研究生, 主要从事鱼类繁殖生理学研究, E-mail: wwscyz1213@163.com; 温海深, 通信作者, 教授, E-mail: wenhaishen@ouc.edu.cn
