不同寄主植物对韭菜迟眼蕈蚊生长发育、繁殖和保护酶活力的影响
2017-10-09杨玉婷史彩华程佳旭张友军
杨玉婷, 史彩华, 程佳旭, 张友军
(1.长江大学, 荆州 434025; 2. 中国农业科学院蔬菜花卉研究所, 北京 100081)
不同寄主植物对韭菜迟眼蕈蚊生长发育、繁殖和保护酶活力的影响
杨玉婷1,2, 史彩华1,2, 程佳旭1,2, 张友军2*
(1.长江大学, 荆州 434025; 2. 中国农业科学院蔬菜花卉研究所, 北京 100081)
为了明确韭菜迟眼蕈蚊幼虫(韭蛆)取食不同寄主植物对其生长发育的影响,并试图从其体内保护酶活力的差异分析不同寄主植物对其生长发育造成影响的原因。选取4种寄主植物(韭菜、生菜、大葱和马铃薯)饲养韭蛆,统计不同寄主条件下韭菜迟眼蕈蚊卵、幼虫、蛹的发育历期和繁殖力,并分别测定不同寄主饲养后韭蛆的三大保护酶系(超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD))的活性。结果表明:韭菜迟眼蕈蚊幼虫取食生菜后下一代的卵期(3.23 d)最长,幼虫期(23.83 d)最短;与取食韭菜的下一代的卵期(3.05 d)和幼虫期(24.16 d)差异显著。取食大葱的发育期(卵期+幼虫期+蛹期)合计最长(31.91 d),与取食生菜的差异显著(30.96 d),但与取食马铃薯和韭菜的差异不显著,后两者分别为31.87 d和31.64 d。与取食其他3种寄主的韭蛆相比,取食韭菜的成虫(雌和雄)寿命最长,产卵量最多。取食马铃薯的韭菜迟眼蕈蚊幼虫的SOD活力最低,取食其他寄主的SOD活力之间差异不显著。取食大葱的幼虫POD活力最高,其次是取食韭菜的。取食韭菜的幼虫CAT活力最高,显著高于取食其他寄主。因此,韭菜迟眼蕈蚊的生长发育与寄主植物有一定的关联,寄主植物不同,韭蛆体内保护酶系的活力也不尽相同。
韭菜迟眼蕈蚊; 寄主植物; 发育历期; 保护酶
韭蛆是韭菜迟眼蕈蚊BradysiaodoriphagaYangetZhang的幼虫,属双翅目、长角亚目、眼蕈蚊科、迟眼蕈蚊属[1]。韭菜迟眼蕈蚊是我国特有的地下害虫,分布于东北、华北、华中、西北等地[2]。该虫取食范围广,可为害7科30多种植物,尤其喜欢取食韭菜的假茎和鳞茎等部位,导致一般田块减产40%~60%,严重田块绝收甚至毁种[3-6]。近年来,关于寄主植物对韭蛆生长发育的影响已有研究报道[7-8],学者推测可能是不同寄主植物的营养成分所致。然而,在漫长的进化过程中,昆虫与植物之间早已形成良好的协同进化关系,尤其是植食性昆虫,需要直接通过取食植物来获取生命所需要的营养成分,来完成其各个虫态的生长发育。寄主不同,昆虫做出的响应也不尽相同。为了适应不同寄主植物对其生长发育造成的影响,昆虫体内会发生一系列生理生化的变化。
保护酶是昆虫体内的重要酶系,在昆虫对抗逆境以及维持正常的生命活动中起着重要的作用[9-10]。超氧化物歧化酶(superoxidedismutase, SOD)、过氧化物酶(peroxidase, POD)和过氧化氢酶(catalase,CAT)是生物体内非常重要的三大保护酶,在正常情况下生物体细胞内自由基在这3种保护酶的互相协调下达到平衡状态,使自由基处于较低的水平,从而防止了自由基对生物体的伤害[11]。本文选取韭菜、生菜、大葱和马铃薯4种寄主分别饲养韭蛆,分析其对韭蛆生长发育和虫体内三大保护酶活力的影响。
1 材料与方法
韭菜AlliumtuberosumRottlerexSprengel(‘平韭5号’)、生菜Lactucasativavar.romana(‘生菜王’)、马铃薯SolanumtuberosumLinn.(‘中薯2号’)和大葱Alliumfistulosumvar.giganteumMakino(‘山东章丘大葱’)均种植于中国农业科学院蔬菜花卉研究所温室,未使用任何化学药剂。分别切取韭菜的假茎、生菜的叶片、马铃薯的块茎和大葱的假茎,用清水清洗、晾干备用。
1.2 供试虫源
韭菜迟眼蕈蚊幼虫采自中国农业科学院蔬菜花卉研究所试验农场,经COⅠ鉴定[12]后的种群于培养箱(MLR-352H-PC)内饲养,成虫养虫笼(直径6 cm,高5 cm)由2.5%琼脂保湿的培养皿(d=6 cm)套上带有小孔的塑料杯组成。培养箱条件:温度(25±1)℃,相对湿度70%±3%,光周期L∥D=14 h∥10 h。由于韭蛆是群集昆虫,单头饲养死亡率较高,因此采用群集饲养。试验前,种群均采用未接触过任何化学药剂的韭菜饲养至少5代。
1.3 试剂与主要仪器
培养箱(MLR-352H-PC,日本);高速冷冻型离心机(Centrifuge 5417R)购自Eppendorf公司;测定酶活性采用SpectraMax M2/M2e型酶标仪(Molecular Devices,美国);电热恒温水槽(DK-80);蛋白定量试剂盒及保护酶活性测定试剂盒购自南京建成生物工程研究所;0.9%生理盐水购于山东华鲁制药有限公司。
1.4 不同寄主植物对韭菜迟眼蕈蚊后代适合度的影响
顶空固相微萃取(HS-SPME)装置、DVB/CAR/PDMS(50/30 μm)、固相微萃取纤维头和SPME采样瓶,美国Supelco公司;气相色谱-质谱联用仪(GC-MS)型号7890B-5977A,美国Agilent公司;Milli-Q超纯水系统,美国Millipore公司。
将不同寄主植物饲养的韭菜异迟眼蕈蚊成虫适量配对,待其交配产卵后,移除成虫保留卵块,共4皿,每皿卵粒数不少于110粒。每天定时观察卵的孵化情况,待卵块孵化后,分别用韭菜、生菜、马铃薯和大葱4种寄主饲养。观察并记录每种寄主饲养韭蛆的生长情况,直到化蛹。蛹羽化后,将相同寄主饲养条件下的成虫单头雌雄配对放入养虫笼(规格同上)中,让其交配产卵。每天观察并记录每一寄主条件下的蛹期及雌雄成虫的寿命。如果雌虫死亡,记录雌虫的产卵量;如果雄虫比雌虫寿命短,则选取相同条件下的一头活雄虫补充,尽量使每头雌虫都有雄虫与之配对。所有的试验程序均在培养箱(温度25±1℃,相对湿度70%±3%,光周期L∥D=14 h∥10 h)内进行,保证试验条件一致,减少误差。
1.5 韭菜迟眼蕈蚊保护酶活性测定
1.5.1 酶液的制备
分别取不同寄主饲养的4龄幼虫15~20头,放入1.5 mL的离心管中,称重并记录。每寄主饲养的韭蛆为1个处理,每处理3次重复。参照酶液制备试剂盒的方法,向离心管中加入样品重量9倍体积的生理盐水,用塑料研磨棒在冰上充分研磨,再将匀浆置于3 000 r/min高速冷冻型离心机中离心10 min,取上清液放入4℃备用。
1.5.2 酶源蛋白质含量和保护酶活性的测定
参照试剂盒说明书上的方法,依次加入试剂盒中的各种试剂,再用酶标仪(SpectraMax M2/M2e)分别在595、450、420 nm和405 nm波长下测定酶源蛋白质、SOD、POD 和CAT的吸光值,双蒸水调零,每处理3次重复。
蛋白质含量测定:待测样本蛋白浓度(g/L)=OD测定-OD空白/OD标准-OD空白×标准浓度(0.563 g/L);
组织匀浆中酶活力:其中保护酶活力单位为U/mg。
SOD=SOD抑制率/50%×反应体系(0.24 mL)/稀释倍数(0.02 mL)/待测样本蛋白浓度(mg/mL);
SOD抑制率(%)=

POD=(OD测定-OD空白)/[12×比色光径(1.0 cm)]×[反应液总体积/样本量(mL)]/反应时间/待测样本蛋白浓度(mg/mL);
CAT=(OD对照-OD测定)×271×反应液总体积(60×取样量)/待测样本蛋白浓度(mg/mL)。
1.6 数据分析
试验数据采用SPSS Statistics.17.0软件进行处理,采用单因子方差分析(ANOVA),平均数采用Tukey法进行多重比较, 分析不同寄主植物饲养条件下韭菜迟眼蕈蚊发育历期、成虫寿命、雌虫产卵量以及幼虫酶活性的差异性。
2 结果与分析
2.1 不同寄主植物对韭菜迟眼蕈蚊生长发育和繁殖力的影响
不同寄主对韭菜迟眼蕈蚊的主要生物学参数具有显著影响。取食大葱的韭菜迟眼蕈蚊发育期合计最长(31.91 d),与取食生菜的差异显著(30.96 d),但与取食马铃薯和韭菜的差异不显著,后两者分别为31.87 d和31.64 d(F3,330=3.110,P=0.027)。其中幼虫取食韭菜的雌、雄成虫寿命最长,分别为3.2 d(F3,165=15.906,P<0.001)和2.36 d(F3, 158=10.225,P<0.001),显著长于其他3种寄主饲养的成虫;且取食韭菜的单雌产卵量最多(90.23粒)(F3,155=33.872,P<0.001)(表1)。
表1不同寄主植物对韭菜迟眼蕈蚊生长发育和繁殖的影响1)
Table1EffectsofdifferenthostplantsondevelopmentandfecundityofBradysiaodoriphaga

参数Parameter生菜 LettucenMean±SE大葱 ChinesespringonionnMean±SE马铃薯 PotatonMean±SE韭菜 ChinesechivesnMean±SE卵期Eggduration110(3.23±0.04)a110(3.00±0.05)b110(3.13±0.003)ab110(3.05±0.06)b幼虫期Larvalduration100(23.83±1.04)b102(24.52±0.18)a87(24.62±0.22)a108(24.18±0.23)a蛹期Pupalduration96(3.91±0.08)a93(4.25±0.13)a72(4.04±0.10)a106(4.25±0.10)a发育期合计Totalpre⁃adultduration90(30.96±0.19)b83(31.91±0.28)a60(31.87±0.28)ab100(31.64±0.26)ab雌成虫寿命Femalelongevity48(2.05±0.11)b42(2.32±0.17)b27(2.30±0.18)b53(3.20±0.18)a雄成虫寿命Malelongevity42(1.50±0.09)b41(1.59±0.11)b33(1.41±0.12)b47(2.36±0.18)a单雌产卵量Fecundityperfemale38(71.33±4.75)b34(37.71±6.44)c30(52.00±5.83)c47(90.23±1.87)a
1) 表中数据为平均数±标准误,同行数据后标有不同小写字母表示差异显著(P<0.05)。 Data in the table are mean±SE, and different letters within the same row indicate significant difference (P<0.05).
2.2 不同寄主植物对韭菜迟眼蕈蚊4龄老熟幼虫保护酶的影响
取食马铃薯的韭蛆SOD活力(12.86±0.60 U/mg)最小,显著低于取食生菜(22.24±0.07 U/mg)、大葱(24.62±0.87 U/mg)和韭菜(23.76±0.60 U/mg)的韭蛆SOD活力(F3,8=35.471,P=0.001)(图1)。
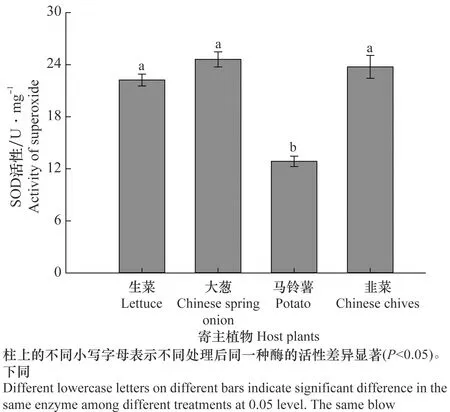
图1 不同寄主植物对韭菜迟眼蕈蚊4龄幼虫超氧化物歧化酶活性的影响Fig.1 Effects of different host plants on the activity of superoxide in the 4th-instar larvae of Bradysia odoriphaga
取食马铃薯(10.45±0.21 U/mg)和生菜(11.08±0.14 U/mg)的韭蛆POD的活力显著低于取食大葱(15.93±0.31 U/mg)和韭菜(13.27±0.15 U/mg)的韭蛆POD的活力,其顺序依次为:大葱>韭菜>生菜,马铃薯(F3,8=135.171,P=0.000)(图2)。
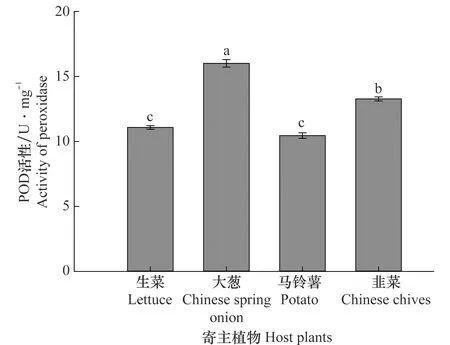
图2 不同寄主植物对韭菜迟眼蕈蚊4龄幼虫过氧化物酶活性的影响Fig.2 Effects of different host plants on the activity of peroxidase in the 4th-instar larvae of Bradysia odoriphaga
取食韭菜的韭蛆CAT的活力(1.09±0.01 U/mg)最高;取食其他3种寄主(生菜,0.05±0.01 U/mg;大葱,0.35±0.24 U/mg;马铃薯,0.13±0.16 U/mg)韭蛆CAT的活力之间差异不显著(F3,8=15.794,P=0.001)(图3)。
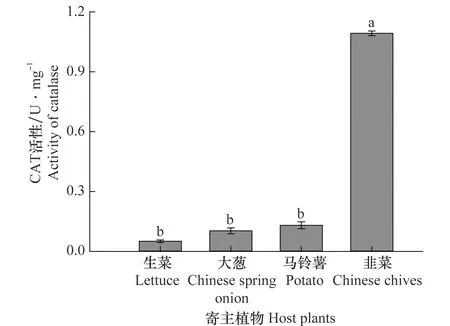
图3 不同寄主植物对韭菜迟眼蕈蚊4龄幼虫过氧化氢酶活性的影响Fig.3 Effects of different host plants on the activity of catalase in the 4th-instar larvae of Bradysia odoriphaga
3 讨论
植食性昆虫的生长发育和繁殖与寄主植物中含有的蛋白质、碳水化合物等营养成分密不可分。寄主植物决定了昆虫能否完成正常的生命活动,比如,寄主的找寻、个体发育、交配和产卵等[13-14]。本文研究发现韭蛆取食不同寄主植物后对其发育历期有一定的影响,取食生菜、马铃薯和韭菜的韭菜迟眼蕈蚊卵期长于取食大葱的,而取食生菜和韭菜的幼虫发育历期短于取食大葱和马铃薯这两种寄主植物的。这与Zhang 等[7]研究韭蛆在人工饲料、韭菜、生菜、黄瓜、洋葱及大白菜上卵和幼虫的发育历期的结果一致。而幼虫期取食韭菜的雌、雄成虫寿命明显长于其他3种寄主饲养的成虫寿命;且取食韭菜的单雌产卵量最多。薛明[8]也发现不同寄主饲喂韭菜迟眼蕈蚊后其存活率和单雌产卵量均存在显著差异,其中以取食韭菜的最高。通过比较4种寄主植物,发现韭菜迟眼蕈蚊在韭菜上的各种生命参数比其他几种寄主植物好,因此认为韭菜对韭菜迟眼蕈蚊生长发育和繁殖有一定的促进作用。
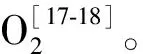
[1] 杨集昆,张学敏.韭菜蛆的鉴定迟眼蕈蚊属二新种[J].北京大学学报,1985,11(2): 153-156.
[2] 冯惠琴,郑方强. 韭蛆发生规律及防治研究[J].山东农业大学学报, 1987, 18(1):71- 80.
[3] 刘长珉,张美燕,张万吉,等.韭菜地蛆生长规律及防治[J].北方园艺,1991,79(10): 6-7.
[4] 腾玲,童贤明.杭州市郊韭菜迟眼蕈蚊(韭蛆)的发生与防治[J].中国蔬菜,2000(6):39-40.
[5] 党志红,董建臻,高占林,等.不同种植方式下韭菜迟眼蕈蚊发生为害规律的研究[J].河北农业大学学报,2001,24(4):65-68.
[6] 薛明,王永显.韭菜迟眼蕈蚊无公害治理药剂研究[J].农药,2002,41(5):29-31.
[7] Zhang Peng, Liu Feng, Mu Wei, et al. Comparison ofBradysiaodoriphagaYang and Zhang reared on artificial diet and different host plants based on an age-stage, two-sex life table[J]. Phytoparasitica, 2015,43:107-120.
[8] 薛明,王承香,庞云红.韭菜迟眼蕈蚊对寄主植物的适应性研究[M]∥成卓敏. 农业生物灾害预防与控制研究. 北京:中国农业科学技术出版社,2005:545-548.
[9] 邱宝利,任顺祥,林莉,等. 不同寄主植物对烟粉虱发育和繁殖的影响[J].生态学报,2003,23(6):206-121.
[10] 安志兰,褚栋,郭笃发,等.寄主植物对B型烟粉虱(Bemisiatabaci)几种主要解毒酶活性的影响[J].生态学报,2008,28(4): 1536-1543.
[11] Krishnan N, Kodrík D. Antioxidant enzymes inSpodopteralitoralis(Boisduval):are they enhanced to protect gut tissues during oxidative stress [J].Journal of Insect Physiology, 2006, 52(2):11-20.
[12] 肖金花,肖晖,黄大卫.生物分类学的新动向——DNA条形编码[J].动物学报,2004,50(5): 852-855.
[13] Wassermann S S, Futuyma D J.Evolution of host plant utilization in laboratory populations of the southern cowpea weevilCallasobruchusmaculatusFabricius (Coleopteran: Bruchidae)[J]. Evolution, 1981, 35(4):605-617.
[14] Facknath S, Lalljee B.Effect of soil-applied complex fertilizer on an insect-host plant relationship:LiriomyzatriffoliionSolanumtuberosum[J].Entomologia Experimentalis et Applicata, 2005,115(1):67-77.
[15] 方允中,李文杰.自由基与酶基础理论及其在生物学和医学中的应用[M].北京:科学出版社,1989.
[16] 周奋启,陆艳艳,姚远,等.不同寄主植物对B型烟粉虱种群保护酶和解毒酶的影响[J].江苏农业学报, 2011, 27(1):57-61.
[17] Felton G W, Summers C B.Antioxidant systems in insects [J].Archives of Insect Biochemistry and Physiology, 1995, 29: 187-197.
[18] Dubovskiy I M, Martemyanov V V, Vorontsova Y L, et al. Effect of bacterial infection on antioxidant activity and lipid peroxidation in the midgut ofGalleriamellonellaL. larvae ( Lepidoptera: Pyralidae)[J].Comparative Biochemistry and Physiology,2008,148: 1-5.
[19] 张林林,李艳红,仵均祥.不同寄主植物对小地老虎生长发育和保护酶活性的影响[J].应用昆虫学报,2013,50(4):1049-1054.
[20] 高广春,李军,郑许松,等.香根草提取物对二化螟生长发育及体内保护酶活力的影响[J].科技通报,2015,31(5):97-101.
[21] 赵俊红,刘军侠,姜文虎,等.SO2胁迫对异色瓢虫的生长发育及保护酶的影响[J].河北农业大学学报,2011,34(1):87-91.
(责任编辑: 田 喆)
Effectsoffeedingondifferenthostplantsondevelopment,reproductionandprotectiveenzymesofBradysiaodoriphaga
Yang Yuting1,2, Shi Caihua1,2, Cheng Jiaxu1,2, Zhang Youjun2
(1.YangtzeUniversity,Jingzhou434025,China; 2.InstituteofVegetablesandFlowers,ChineseAcademyofAgriculturalSciences,Beijing100081,China)
In order to explore the influence ofBradysiaodoriphagalarvae feeding on different host plants on their development, and try to find out the cause of the variance of development by analyzing the protective enzymes ofB.odoriphaga. Four host plants (Chinese chives, lettuce, Chinese spring onion, potato) were chosen to feed the larvae ofB.odoriphaga; generation period (egg stage, larval stage, pupal stage) and fecundity were counted, and the protective enzyme system (superoxide dismutase (SOD), catalase (CAT) and peroxidase (POD)) of the larvae ofB.odoriphagafeeding on three different hosts were assayed. The next generation of egg stage ofB.odoriphagawas the longest (3.23 d) and the larval stage was the shortest (23.83 d) when feeding on lettuce and was significantly different from that when feeding on Chinese chives (3.05 d and 24.16 d, respectively). The developmental duration (egg stage + larvae stage + pupal stage) ofB.odoriphagawas the longest (31.91 d) when feeding on Chinese spring onion and significantly different that when feeding on lettuce (30.96d), but not significantly different from those when feeding on potato and Chinese chives (31.87d and 31.64d, respectively). Compared with those feeding on the other three host plants, the longevities of adults (female and male) were longest when feeding on Chinese chives, and the fecundity was maximum. The activities of superoxide dismutase (SOD) on lettuce, Chinese chives and Chinese spring onion were significantly higher than on potato, and there was no significant difference in the three host plants; the activity of peroxidase (POD) on Chinese spring onion was the highest, followed by on Chinese chives; the activity of catalase (CAT) on Chinese chives was significantly higher than on the other three host plants. We concluded that the growth ofB.odoriphagawas related to the host plant, and the activities of the three major protective enzyme systems (SOD, CAT, POD) ofB.odoriphagawere not the same.
Bradysiaodoriphaga; host plant; generation period; protective enzyme
S 436.33
: ADOI: 10.3969/j.issn.0529-1542.2017.05.019
2016-11-05
: 2017-02-13
公益性行业(农业)科研专项(201303027);“十三五”国家重点研发计划(2016YED0201000)
* 通信作者 E-mail:zhangyoujun@caas.cn
