紧实度对青贮玉米有氧稳定期发酵品质、微生物数量的效应研究
2017-09-26王旭哲贾舒安张凡凡鲁为华张前兵马春晖
王旭哲,贾舒安,张凡凡,鲁为华,张前兵,马春晖*
(1.石河子大学动物科技学院,新疆 石河子 832003;2.新疆维吾尔自治区动物卫生监督所,新疆 乌鲁木齐 830011)
紧实度对青贮玉米有氧稳定期发酵品质、微生物数量的效应研究
王旭哲1,贾舒安2,张凡凡1,鲁为华1,张前兵1,马春晖1*
(1.石河子大学动物科技学院,新疆 石河子 832003;2.新疆维吾尔自治区动物卫生监督所,新疆 乌鲁木齐 830011)
本研究旨在分析不同紧实度对全株玉米青贮有氧暴露期间发酵品质和微生物变化的影响,为生产实践选择适宜的青贮紧实度提供参考。以新饲玉10号青贮玉米为材料,发酵装料密度设计为5个梯度(350,400,500,600,700 kg/m3),发酵期为50 d,检测开窖后各紧实度处理第12,24,36,60,108 h青贮发酵品质和主要微生物的变化,并用多通道温度记录仪监测温度变化。结果表明,有氧暴露时间与紧实度的交互作用对pH、乳酸、乙酸和氨态氮含量以及乳酸菌、霉菌、酵母菌和好氧细菌数量产生极显著影响(P<0.01)。开窖108 h后,紧实度为600 kg/m3青贮饲料的乳酸菌数量最多,达到8.17 lg cfu/g FW,其pH值和氨态氮含量最低,霉菌和酵母菌数量最少,分别为5.38和7.72 lg cfu/g FW;且紧实度600 kg/m3有氧暴露后稳定的时间显著高于其他处理(P<0.05),达到100 h。通过综合评价,在有氧暴露后紧实度为600 kg/m3的全株玉米青贮发酵品质及有氧稳定性最好,建议600 kg/m3为全株玉米最佳青贮紧实度。
青贮玉米;有氧稳定期;发酵品质;微生物数量;紧实度
青饲料在厌氧条件下经乳酸菌发酵并得以保存称为青贮饲料,是奶牛日粮中必不可少的组成部分[1]。调制青贮饲料的目的就是最大限度地保持青贮原料原有的营养价值并将营养物质的损失降至最低。用于调制青贮的牧草或饲料作物表面附着有多种微生物,它们在青贮过程的某一阶段或全过程都有繁殖活动,或多或少的影响青贮的发酵品质[2]。青贮容器开封的同时青贮饲料的好氧变质便启动,大量好氧微生物的活动变得活跃,腐败进程开始[3]。好氧微生物大量繁殖,利用有机酸、水溶性碳水化合物和蛋白质,导致乳酸、水溶性碳水化合物等含量下降,pH值和氨态氮含量升高,同时产生热量导致温度上升[4]。青贮饲料在青贮容器开封后的稳定程度称为青贮饲料有氧稳定性,即青贮饲料暴露于空气中温度超过室温2 ℃的时候所记录的时间(h)即为有氧稳定时间[5-7]。因此,控制空气的流入和空气的接触面积是控制好氧变质的关键。
优质的青贮与紧实度有关,在实践中,青贮的压实不足可能会导致有氧腐败,填压紧实的青贮窖有助于pH的降低以及厌氧条件的形成[8-9]。无论在青贮发酵过程中还是在开窖后,高紧实度的青贮可以减少氧气的渗入,进而降低空气中以及饲料作物表面附着的好氧微生物的活性,对青贮微生物群落组成和有氧稳定性均有重要影响[10]。通过控制适当的青贮紧实度进而改善青贮饲料的发酵品质[11-13],因为其对有机物的氧化具有一定影响,是影响其干物质保存的关键参数[14]。高密度青贮窖可有效降低干物质损失[15]。所以紧实度的控制对青贮品质尤为重要[16]。但目前,有关全株玉米青贮紧实度系统研究报道较少。由于重型压实设备的需求以及压实时间的延长,导致较高的青贮紧实度在一定程度上增加制作成本。因此,在生产实践中很少量化控制青贮的紧实度,缺乏可供参考的适宜范围。
由于紧实度大小对青贮开窖后发酵品质产生较大影响。因此,本研究设置不同紧实度的青贮处理,探究紧实度对有氧暴露后全株玉米青贮品质、微生物变化规律以及有氧稳定性的影响,同时结合有氧稳定性综合比较有氧暴露后,各紧实度下的全株玉米青贮发酵品质和微生物的变化,旨在选出合适的青贮紧实度,为生产实践提供参考。
1 材料与方法
1.1材料和样地
青贮原料:以玉米品种新饲玉10号(新疆农垦科学院作物所选育的早中熟品种)为青贮材料。试验地位于新疆石河子大学牧草试验站(44°20′ N, 88°30′ E,海拔420 m)。生长期为2015年4月10日-7月20日(生长期101 d),乳熟末期至蜡熟初期刈割,当场切碎为1~2 cm 长的物料,待贮。发酵罐规格:直筒,直径19.4 cm,高102 cm,壁厚0.6 cm,容积为30.2 L,采用PVC管制作。
1.2试验设计
将发酵装料密度设计为5个梯度,分别为 350,400,500,600,700 kg/m3,每个梯度3次重复,分别在青贮装罐完成后50 d时开窖,同时检测发酵罐开窖后第12,24,36,60,108 h青贮的变化。全程动态监测各处理青贮温度变化。对青贮pH值、乳酸(lactic acid,LA)、乙酸(acetic acid,AA)、氨态氮(NH3-N)、水溶性碳水化合物(water soluble carbohydrates,WSC)含量和乳酸菌、霉菌、酵母菌以及好氧细菌数量进行分析。应用隶属函数法对青贮发酵品质以及微生物数量进行综合评判。
1.3测定方法
干物质(dry matter,DM)采用105 ℃烘干法测定[17];总氮(total nitrogen,TN)根据凯氏定氮法利用全自动凯氏定氮仪(KT8400,FOSS)测定[17];水溶性碳水化合物(WSC)采用蒽酮比色法测定[18];pH值利用酸度计(PHS-25,上海雷磁)测定;氨态氮含量采用苯酚-次氯酸钠比色法测定[3];有机酸(乳酸、乙酸、丙酸、丁酸)含量用液相色谱法测定[7],微生物数量采用平板计数法[2]进行计数,乳酸菌、霉菌、酵母菌以及好氧细菌分别用MRS(de man rogosa sharpe,MRS)培养基、高盐察氏培养基、麦芽糖浸粉琼脂培养基和营养琼脂培养基(nutrient agar)进行培养。有氧稳定性测定在发酵50 d后打开全部实验室青贮发窖罐,罐口用双层纱布包裹,防比果蝇等其他杂质污染和水分散失,空气可自由进入发酵罐中,置于室温条件下保存。将多点式温度记录仪(i500-E3TW,玉环智拓仪器科技有限公司)的多个探头分别放置于发酵罐的几何中心,同时在环境中放置3个探头,用于测定环境温度,温度记录仪测量时间间隔设置为5 min,每个处理放置3个温度探头。如果样品温度高于环境温度2 ℃,说明青贮开始腐败变质。
1.4数据处理
在Excel中作数据的基本处理,用SPSS 17.0对各处理的DM、WSC、pH值、氨态氮、乳酸、乙酸、丙酸、丁酸含量和乳酸菌、霉菌、酵母菌、好氧细菌数量以及有氧稳定时间进行方差分析,通过Duncan法对各处理间的差异进行比较。采用Origin 8.0进行绘图。应用Fzuuy数学中隶属函数法进行青贮发酵品质以及微生物数量的综合评判。其中,与发酵品质呈正相关的指标(WSC、乳酸、乙酸、乳酸菌、有氧稳定性)采用公式Fij+=(Xij-Xmin)/(Xmax-Xmin)计算,与发酵品质呈负相关的指标(pH、NH3-N、霉菌、酵母菌和好氧细菌)采用公式Fij-=1-Fij+计算,式中:Fij为第i个处理第j个指标的隶属度;Xij为第i个处理第j个指标测定值;Xmax、Xmin为所有参试材料中第j项指标的最大值和最小值。
2 结果与分析
2.1不同紧实度下全株玉米青贮前后发酵特性及营养品质对比分析
对不同紧实度下全株玉米青贮前后发酵特性和营养品质对比分析(表1),发现在青贮开窖后各处理与青贮原料在DM、pH值、乳酸、乙酸、氨态氮、水溶性碳水化合物、乳酸菌、霉菌和酵母菌数量上均有显著差异(P<0.05),但在好氧细菌数量上差异不显著(P>0.05)。且各处理DM、pH值、WSC以及霉菌和酵母菌数量均降低,乳酸、乙酸、氨态氮以及乳酸菌和好氧细菌数量逐步上升。处理600 kg/m3的乳酸菌数量最高;处理700 kg/m3的乳酸和WSC含量显著高于其余处理(P<0.05),霉菌数量显著低于其预处理(P<0.05)。
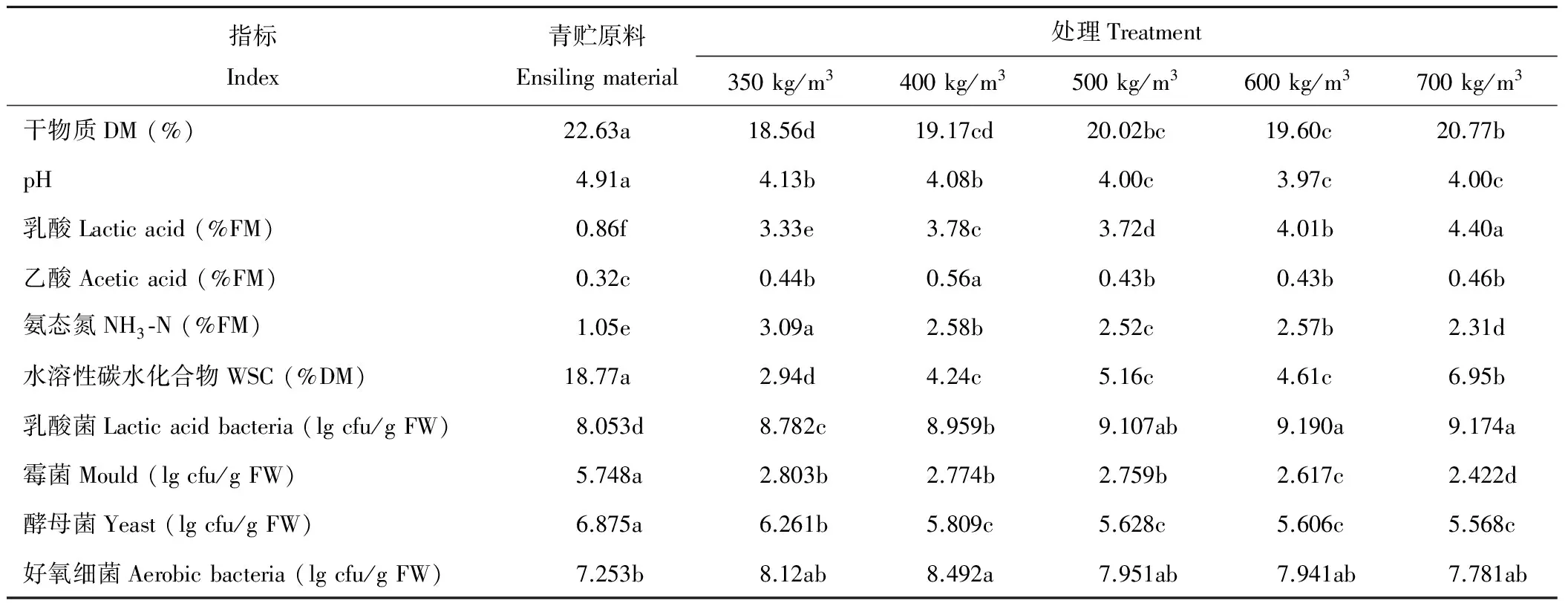
表1 不同紧实度下全株玉米青贮前后发酵品质及微生物数量对比分析Table 1 Analysis of fermentation characteristics and microbial quantity of whole-plant corn silage at different compaction around ensilage
注:各处理间不同字母表示差异显著(P<0.05)。
Note:The different letters mean significant differences atP<0.05 among the groups.
2.2不同紧实度对全株玉米青贮有氧稳定性的影响

图1 不同紧实度玉米青贮的有氧稳定性 Fig.1 Aerobic stability of different compaction corn silage 各处理间不同字母表示差异显著(P<0.05)。The different letters mean significant differences at P<0.05 among the groups.
各处理玉米青贮的有氧稳定性如图1所示。随着紧实度的增加,有氧稳定时间逐渐延长,处理350~700 kg/m3有氧暴露后稳定的时间分别为15,49,62,100和73 h。各处理间均存在显著差异(P<0.05),其中600 kg/m3有氧稳定时间最长,达到100 h。
2.3不同紧实度全株玉米青贮在有氧稳定期发酵品质的动态变化
pH值在有氧稳定期变化明显(表2)。开窖后,处理350 kg/m3的pH值始终高于其他处理。有氧暴露60 h后处理350和400 kg/m3的pH值均超过劣质青贮的规定值4.80,之后继续上升,在有氧暴露108 h时,处理350和400 kg/m3的pH值显著高于其余处理(P<0.05),处理600和700 kg/m3的pH值均属于青贮品质一般的pH值范围且差异不显著(P>0.05)。玉米青贮各组WSC含量都明显下降(表2),直至开窖108 h后各处理间的WSC含量均差异不显著(P>0.05),但是处理700 kg/m3的WSC含量在有氧暴露过程中始终高于其余处理,处理350 kg/m3WSC含量开窖108 h后最低,只有2.262%。
开窖后各处理乳酸含量均呈逐渐下降趋势(表2),开窖12 h处理700 kg/m3的乳酸含量最高,与其余处理差异显著(P<0.05),直至开窖108 h其乳酸含量仍然显著高于其余处理(P<0.05),此时处理500 kg/m3的乳酸含量最低,与其余处理差异显著(P<0.05)。自开窖后,各处理乙酸含量同样逐渐减少(表2),开窖12 h处理700 kg/m3的乙酸含量高于其他处理,随后开始迅速下降。处理400和600 kg/m3均在开窖24 h后乙酸含量缓慢上升,且处理600 kg/m3在开窖36 h开始缓慢下降。直至开窖108 h处理400 kg/m3的乙酸含量较高,且与处理700 kg/m3差异不显著(P>0.05),但显著高于其余处理,此时处理500 kg/m3的乙酸含量最低,与其余处理差异显著(P<0.05)。对有氧稳定阶段的各处理全株玉米青贮进行检测发现,丙酸和丁酸的含量均低于最低检出限(表2)。
有氧暴露24 h后处理350 kg/m3的NH3-N含量显著高于其他处理组(P<0.05)(表2)。随后各处理的NH3-N含量均呈现出上升趋势,直至有氧暴露108 h各处理的NH3-N含量均达到最大值,且处理350 kg/m3显著高于其余处理(P<0.05),处理500,600和700 kg/m3的NH3-N含量差异不显著(P>0.05),但显著低于处理350和400 kg/m3(P<0.05)。由图3可知,随着有氧暴露时间的延长,各处理NH3-N/TN值逐步增加,但自有氧暴露开始至12 h期间,除处理350 kg/m3外,其余处理NH3-N/TN值出现缓慢下降趋势,随后逐步升高,开窖24 h后处理350 kg/m3的NH3-N/TN值均高于其余处理,之后随着有氧暴露时间的进一步延长,NH3-N/TN值迅速上升,其余处理均缓慢上升。直至开窖36 h后,除了处理350,400 kg/m3外,其余处理NH3-N/TN值增速减慢,尤其处理700 kg/m3的NH3-N/TN值增长较其余处理更为平缓,并在开窖60 h时开始缓慢下降。持续至开窖108 h,处理350 kg/m3的NH3-N/TN值最大,处理600 kg/m3的NH3-N/TN值最小。
2.4不同紧实度全株玉米青贮在有氧稳定期微生物的动态变化
全株玉米青贮开窖后,各处理乳酸菌的变化如表3所列,开窖后24 h各处理乳酸菌数量均出现短暂的上升,此时处理700 kg/m3的乳酸菌数量显著高于其余处理(P<0.05)。但随后各处理乳酸菌数量均开始下降,随着紧实度的降低乳酸菌数量逐渐减少。处理350 kg/m3的乳酸菌数量在开窖后36 h迅速下降,此时显著低于其余处理(P<0.05)。直至开窖108 h后各处理乳酸菌数量出现差异,处理600 kg/m3的乳酸菌数量显著高于其余处理(P<0.05)。
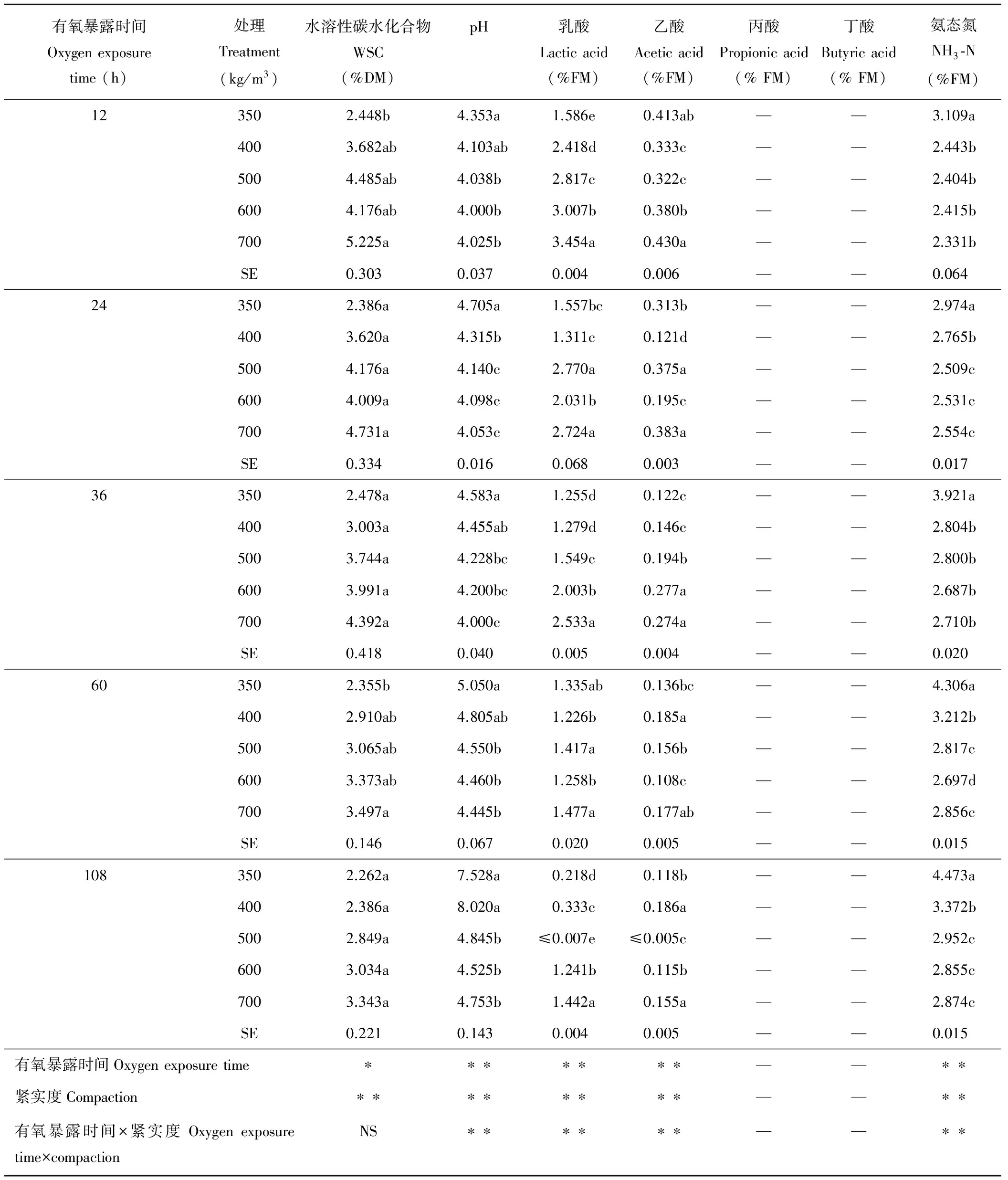
表2 有氧暴露过程中不同紧实度下全株玉米青贮发酵品质变化及双因素方差分析Table 2 Change of the fermentation characteristics of whole-plant corn silage at different compaction and two-way analysis of variance in the oxygen exposure process
注:同一小时各处理间不同字母表示差异显著(P<0.05);*表示差异显著(P<0.05),**表示差异极显著(P<0.01),NS表示无显著差异。SE为标准误差。“—”表示低于检出限。
Note:The different letters mean significant differences atP<0.05 among the groups on the same hour. *and** stand for significant differences at the level ofP<0.05 andP<0.01, respectively. NS means no significant. SE means standard error. “—”express less than detection limit.
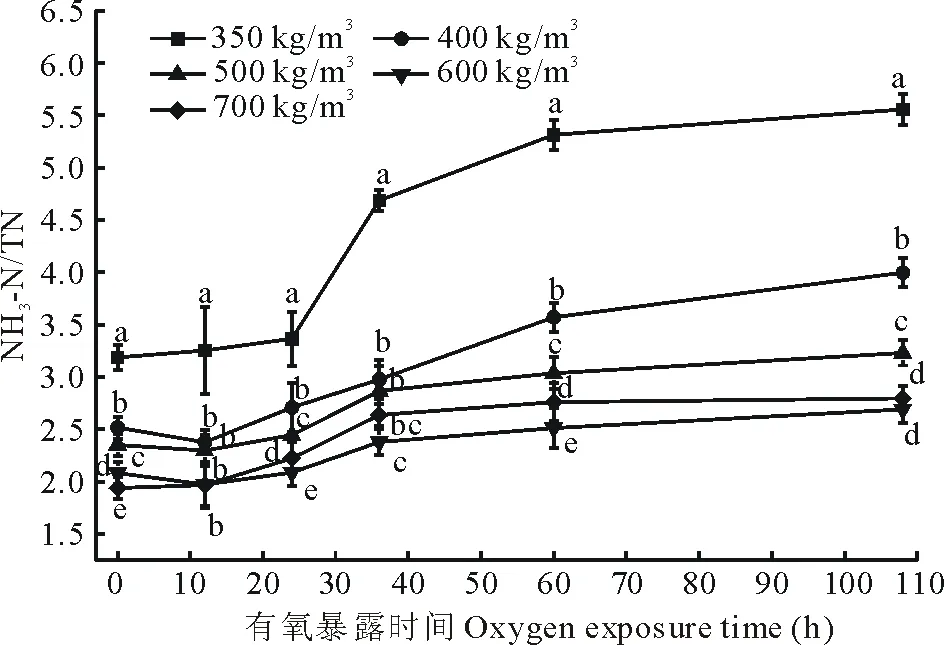
图2 不同紧实度下全株玉米青贮NH3-N/TN值变化Fig.2 Change of the NH3-N/TN of whole-plant corn silage at different compaction 同一小时各处理间不同字母表示差异显著(P<0.05)。The different letters mean significant differences at P<0.05 among the groups on the same hour.
各处理开窖12 h后霉菌数量均出现不同程度的增加(表3),此时各处理间均出现显著差异(P<0.05),处理700 kg/m3的霉菌数量显著低于其余处理(P<0.05),随着有氧暴露时间的延长,各处理的霉菌数量均逐步升高,但随着紧实度的提高,霉菌数量的增速逐渐减慢,处理500,600和700 kg/m3的霉菌数量进入稳定状态,直至开窖后108 h,随着紧实度增大霉菌数量明显降低,处理600和700 kg/m3的霉菌数量显著低于其余处理(P<0.05)。
酵母菌在玉米青贮有氧暴露过程中变化较为明显(表3),自有氧暴露后各处理酵母菌数量均呈现上升趋势,第12 h时处理350 kg/m3的酵母菌数量显著高于其余处理(P<0.05)。随后各处理逐步上升,但处理600 kg/m3的酵母菌数量上升较为缓慢,且显著低于其余处理,至开窖第36 h处理600 kg/m3的酵母菌数量上升至最大值后开始缓慢下降,此时处理600 kg/m3的酵母菌数量显著低于其余处理(P<0.05)。随着紧实度的增大,酵母菌数量逐渐减少,直至有氧暴露108 h后,处理350 kg/m3的酵母菌数量显著高于其余处理(P<0.05)。
自开窖后,各处理好氧细菌数量均缓慢上升(表3),开窖12 h时处理600 kg/m3的好氧细菌数量显著低于其余处理(P<0.05)。随后各处理好氧细菌数均缓慢上升,直至开窖24 h处理600 kg/m3显著低于处理350和400 kg/m3(P<0.05)。但之后各处理的好氧细菌数均出现不同程度的下降,至开窖后60 h各处理好氧细菌数开始缓慢增加,随着紧实度的增大,好氧细菌数逐渐降低,直至开窖后108 h处理700 kg/m3显著低于其余处理(P<0.05)。
2.5紧实度及有氧暴露时间对全株玉米青贮发酵特性以及微生物数量的交互作用
有氧暴露时间对于WSC、pH、有机酸和NH3-N含量以及乳酸菌、霉菌、酵母菌和好氧细菌数量的变化有极显著影响(P<0.01)(表2、3),同时设置的不同处理对于上述各指标均产生极显著影响(P<0.01)。从表中可知有氧暴露时间与处理的交互作用对pH、乳酸、乙酸和NH3-N含量以及乳酸菌、霉菌、酵母菌和好氧细菌数量产生极显著影响(P<0.01),但对WSC含量的变化无显著影响(P>0.05)。
2.6有氧稳定期不同紧实度全株玉米青贮发酵特性以及微生物数量的综合评价
采用模糊数学隶属函数值法,以pH 值、WSC、乳酸、乙酸、NH3-N、有氧稳定性、乳酸菌、霉菌、酵母菌和好氧细菌数量10个指标,对不同紧实度下全株玉米青贮发酵品质及微生物数量进行综合评价(表4)。综合评价分值越高,则青贮品质越好,反之越差。因此,在有氧暴露108 h后,不同紧实度的全株玉米青贮发酵特性以及微生物数量的综合指标大小排序为:处理600 kg/m3>处理700 kg/m3>处理500 kg/m3>处理400 kg/m3>处理350 kg/m3。
3 讨论
3.1不同紧实度对玉米青贮饲料有氧稳定性的影响
本试验中不同紧实度玉米青贮饲料的有氧稳定性存在显著差异(P<0.05)。随着青贮紧实度的增大,玉米青贮饲料的有氧稳定时间逐渐延长。较高的青贮密度可提供较为稳定的pH环境,可抑制好氧微生物的生长[19]。因此处理350 kg/m3有氧暴露后稳定的时间仅有15 h,而处理600 kg/m3达到100 h,显著高于其他处理(P<0.05)。但在处理700 kg/m3的WSC含量较高,相对于处理600 kg/m3为好氧微生物创造了更有利的生存条件, 因此600 kg/m3的有氧稳定时间长于700 kg/m3。 直至最后一组处理暴露于空气中高于室温2 ℃时开窖结束。与Santos等[20]研究结果相似,正是由于开窖后随时间延长,好氧微生物的活动增强,其利用发酵底物产生水、二氧化碳和热量[5]。因此,温度随有氧暴露时间延长而上升。

表3 有氧暴露过程中不同紧实度下全株玉米青贮微生物数量变化及双因素方差分析Table 3 Change of the microbial quantity of whole-plant corn silage at different compaction and two-way analysis of variance in the oxygen exposure process
注:同一小时各处理间不同字母表示差异显著(P<0.05);*表示差异显著(P<0.05),**表示差异极显著(P<0.01),NS表示无显著差异。SE为标准误差。
Note:The different letters mean significant differences atP<0.05 among the groups on the same hour. *and** stand for significant differences at the level ofP<0.05 andP<0.01, respectively. NS means no significant. SE means standard error.

表4 有氧暴露后不同紧实度下全株玉米青贮发酵品质及微生物数量的隶属函数分析Table 4 Analysis of the membership function of fermentation characteristics and microbial quantity of whole-plant corn silage at different compaction after exposure to oxygen
3.2不同紧实度对玉米青贮饲料发酵品质的影响
pH可反映青贮饲料是否保存较好以及其被腐败菌分解的程度,品质优良的青贮饲料pH为3.8~4.5[21]。开窖后各处理的pH值均出现回升,与Shi[22]的研究结果一致,空气的大量供给促进好氧微生物利用WSC、乳酸、乙酸等营养物质大量繁殖,大量WSC、乳酸、乙酸被好氧微生物代谢,致使pH值逐渐上升,乳酸和乙酸含量逐渐减少[23-24]。填装紧实度的增加,在一定程度上削弱了氧气的穿透能力,降低了氧气的深入,减缓了好氧微生物的大量繁殖,因此紧实度较高的处理pH上升较慢且显著低于紧实度低的处理。乳酸是促进青贮发酵的有益酸,虽然乳酸是青贮饲料的主要发酵产物,但也有适量的乙酸存在[25],主要来源于异型乳酸菌和肠内细菌对糖类的分解发酵[5]。发酵结束时高紧实度的处理乳酸含量较高,开窖后短期内仍然有抑制好氧微生物生长的作用,但是较低的紧实度处理在发酵结束时所剩余的乳酸含量相对较低,因此在有氧暴露后其中的好氧微生物大量生长繁殖,其中的乳酸、乙酸被大量消耗[26],这也正是造成紧实度较高的全株玉米青贮中乳酸和乙酸含量高于紧实度较低的处理的原因。
NH3-N含量是青贮饲料品质评价的一个重要指标,从动物利用的角度,氨基酸与蛋白质的价值变化不大,而NH3-N的利用价值较低,所以说青贮饲料中NH3-N含量越高,青贮饲料的品质越差[27]。试验中NH3-N含量逐步增加,与Schmidt等[28]的试验结果相似。随着有氧暴露的进行,各处理的NH3-N含量均缓慢上升。且低紧实度处理上升较快,主要是由于随着有氧暴露时间的延长,低紧实度处理的pH上升较快,当pH>4.2时,由于不良微生物的活动,氨基酸被分解成氨、硫化氢和胺类,氨基酸的降解率增大[5],即NH3-N的含量升高。而青贮紧实度较高,可在开窖后降低氧气进入量,减少乳酸损失,使pH 值在短期内维持一个稳定的水平,可有效降低一些不耐酸的腐败菌的活力,从而将NH3-N被限制在很低的水平,同时也保留了原料中相对较多的粗蛋白[29]。然而评定蛋白质在青贮饲料中的降解程度有时考虑NH3-N/TN值,这也是衡量青贮发酵品质的关键因素[30]。青贮干物质的采食量与NH3-N/TN值呈显著负相关,NH3-N的比例增加,将会间接减少动物采食量,对青贮的有效营养价值造成严重影响[5]。因此较低的紧实度处理NH3-N/TN值较高,正是由于其NH3-N含量较高的原因。因此,开窖后NH3-N/TN值逐步升高,且高紧实度处理的NH3-N/TN值较低。
3.3不同紧实度处理对玉米青贮饲料微生物数量的影响
乳酸菌是指发酵可以用碳水化合物主要产物为乳酸的细菌的总称。是青贮饲料进行乳酸发酵的驱动者[31]。有氧暴露后各处理乳酸菌数量在开窖后24 h内出现短暂上升趋势,之后逐渐下降,且随着紧实度的降低,乳酸菌数量逐渐减少。是由于在开窖后接触到氧气,好氧微生物开始大量繁殖,与乳酸菌争夺利用青贮中的营养物质,短时间内刺激乳酸菌的繁殖,但随着氧气的进一步渗入,其有氧环境不适于乳酸菌继续生长,致使乳酸菌数量开始缓慢下降。又因为紧实度提高,减缓了氧气渗入的速度,一定程度上延缓了乳酸菌的生长。因此紧实度较高的处理乳酸菌数量多。
Cavallarin等[32]在实验室和农场的青贮试验中进行有氧暴露,据统计,集约化养殖场青贮开窖15 d,会有霉菌生长并出现黄曲霉毒素。霉菌分布在青贮窖的不同部分:上半部分通常更容易受到真菌污染,中段是保存最完好的部分,其次是下半部分,每个部分的污染程度明显不同[33-34]。开窖后各处理的霉菌数量均有不同程度的增加,与Shi[22]和Spadaro等[35]的研究结果相似,且紧实度低的处理,霉菌数量较高。这是开窖后的有氧环境造成的,霉菌对于生境要求比较简单,只要有水、氧和基本生长底物存在,增殖就可实现。开窖后暴露在有氧环境中,霉菌通过呼吸作用糖、乳酸、纤维素及其他细胞壁物质大量增殖,同时部分可产生霉菌毒素。随着乳酸被分解,青贮中pH逐步升高利于霉菌生长导致数量增多。紧实度高的处理由于青贮料间隙较小,氧气渗入能力较弱,可有效的延缓这一过程的发生,但随着有氧暴露时间的延长,氧气的不断渗入,紧实度较高的处理霉菌数量依然会增加。
Borreani等[36]研究表明,开窖时酵母菌数量与有氧稳定性具有相关性,且酵母菌数量的降低促进有氧稳定性的增强。参与好氧变质的酵母菌按照生理特性差异可分为两类:在有氧暴露过程中酵母菌是主要导致青贮饲料变质的微生物之一,在此过程中酵母菌迅速增殖[22]。试验中各处理酵母菌在开窖后36 h内迅速增殖,之后趋于稳定,随着紧实度的增加酵母菌数量有所减少。这是由于开窖后氧气的进入刺激了酵母菌的生长,同时充足的糖类为酵母菌生长提供能量[37]。并且大多数酵母菌在有氧的条件下生长的pH范围为3~8,外界有利的条件促进酵母菌的繁殖[35],并伴随着霉菌引起温度的上升,处理紧实度的增加在一定程度上降低了氧气的渗入量,因此低紧实度的青贮中酵母菌较多。
试验过程中各处理在开窖后好氧细菌均有不同程度的增加,与Tabacco等[26]的研究结果一致,但与有氧暴露时间没有显著相关(P>0.05)。随着紧实度的增加,其数量降低。由于开窖后青贮饲料接触到氧气,好氧细菌利用WSC快速繁殖。同时利用乳酸产生CO2,使温度上升进一步加剧好氧变质,随着pH的逐渐升高好氧细菌数量增加。因此紧实度较低处理好氧细菌数多且有氧稳定性较低。
4 结论
综上所述,本试验在有氧稳定期内设置的不同紧实度对青贮饲料发酵品质、有氧稳定性、微生物数量影响显著。随着紧实度的增大,青贮饲料的品质增加,有氧稳定性提高,但紧实度过大,品质变化不显著,有氧稳定性降低;通过综合评价,开窖后紧实度600 kg/m3的全株玉米青贮品质及有氧稳定性最好,建议600 kg/m3为最佳紧实度。
References:
[1] Kleinschmit D H, Kung L J. The effects ofLactobacillusbuchneri40788 andPediococcuspentosaceusR1094 on the fermentation of corn silage. Journal of Dairy Science, 2006, 89(10): 3999-4004.
[2] Wan X R, Wu J P, Lei Z M,etal. Effect of lactic acid bacteria on corn silage quality and stability after aerobic exposure. Acta Prataculturae Sinica, 2016, 25(4): 204-211. 万学瑞, 吴建平, 雷赵民, 等. 优良抑菌活性乳酸菌对玉米青贮及有氧暴露期微生物数量和pH的影响. 草业学报, 2016, 25(4): 204-211.
[3] Jia C W, Yuan X J, Xiao S H,etal. Effect of substituting hulless barley straw for tall fescue on early fermentation quality and aerobic stability of mixed-ration silage in Tibet. Acta Prataculturae Sinica, 2016, 25(4): 179-187. 贾春旺, 原现军, 肖慎华, 等. 青稞秸秆替代苇状羊茅对全混合日粮青贮早期发酵品质及有氧稳定性的影响. 草业学报, 2016, 25(4): 179-187.
[4] Chen L, Guo G, Yuan X,etal. Effect of applying molasses and propionic acid on fermentation quality and aerobic stability of total mixed ration silage prepared with whole-plant corn in Tibet. Asian Australasian Journal of Animal Sciences, 2014, 27(3): 349-356.
[5] Xu C C. Silage Science and Technology[M]. Beijing: Science Press, 2013. 徐春城. 现代青贮理论与技术[M]. 北京: 科学出版社, 2013.
[6] Guan H, Guo X S, Gan Y M,etal. Effect of different Italian additives on fermentation quality and aerobic stability of ryegrass silage ensiled at different moisture. Acta Agrestia Sinica, 2016, 24(3): 669-675. 关皓, 郭旭生, 干友民, 等. 添加剂对不同含水量多花黑麦草青贮发酵品质及有氧稳定性的影响. 草地学报, 2016, 24(3): 669-675.
[7] Ding L, Yuan X J, Wen A Y,etal. Effects of additives on fermentation quality and aerobic stability of total mixed ration silage containing wet brewers’grains in Tibet. Acta Prataculturae Sinica, 2016, 25(7): 112-120. 丁良, 原现军, 闻爱友, 等. 添加剂对西藏啤酒糟全混合日粮青贮发酵品质及有氧稳定性的影响. 草业学报, 2016, 25(7): 112-120.
[8] Gonzalez Pereyra M L, Alonso V A, Sager R,etal. Fungi and selected mycotoxins from pre- and post-fermented corn silage. Journal of Applied Microbiology, 2008, 104(4): 1034-1041.
[9] Keller L A M, Keller K M, Monge M P,etal. Gliotoxin contamination in pre- and post fermented corn, sorghum and wet brewer’s grains silage in Sao Paulo and Rio de Janeiro State, Brazil. Journal of Applied Microbiology, 2012, 112(5): 865-873.
[10] Graf K, Ulrich A, Idler C,etal. Bacterial community dynamics during ensiling of perennial ryegrass at two compaction levels monitored by terminal restriction fragment length polymorphism. Journal of Applied Microbiology, 2016, 120(6): 1479-1491.
[11] Geyer S, Hoffmann T. Metrological prerequisites for determination of silage density compacted in a bunker silo using a radiometric method. Agricultural Engineering International: CIGR Journal, 2012, 14(4): 134-143.
[12] Mceniry J, O’Kiely P, Clipson N J W,etal. The relative impacts of wilting, chopping, compaction and air infiltration on the conservation characteristics of ensiled grass. Grass & Forage Science, 2008, 91(62): 470-484.
[13] Tavares V B, Pinto J C, Evangelista A R,etal. Effects of different compaction degrees, inclusion of absorbent additive and wilting on the chemical composition of Tanzania grass silages. Revista Brasileira De Zootecnia, 2009, 38(1): 40-49.
[14] Franco R T, Buffière P, Bayard R. Ensiling for biogas production: Critical parameters. A review. Biomass & Bioenergy, 2016, 94: 94-104.
[15] Amaral R C D, Bernardes T F, Siqueira G R,etal. Fermentative and chemical characteristics of Marandugrass silage submitted to four compaction pressures. Revista Brasileira De Zootecnia, 2007, 36(3): 532-539.
[16] Szucs J P, Suli A, Meszaros A,etal. Biological inoculants in forage conservation. Scientific Papers Animal Science & Biotechnologies, 2011, 44(1): 136-140.
[17] Zhang L Y. Forage Analysis and Forage Quality Detection Technology[M].Version 2. Beijing: Agriculture Press of China, 2002. 张丽英. 饲料分析及饲料质量检测技术[M]. 第2版. 北京: 中国农业出版社, 2002.
[18] Gao J F. Plant Physiology Experimental Guidance[M]. Beijing: Higher Education Press, 2006. 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006.
[19] Gerlach K, Büscher W, Südekum K H,etal. Aerobic exposure of grass silages and its impact on dry matter intake and preference by goats. Small Ruminant Research, 2014, 117(2/3): 131-141.
[20] Santos A O,vila C L S, Pinto J C,etal. Fermentative profile and bacterial diversity of corn silages inoculated with new tropical lactic acid bacteria. Journal of Applied Microbiology, 2016, 120(2): 266-279.
[21] Cheng Y H, Lei X Q, Xu T S,etal. Changes of pH and microorganism during the fermentation of microbial and traditional silages with corn straw knead wire. Journal of Northwest A&F University: Natural Science Edition, 2014, 42(5): 17-21. 程银华, 雷雪芹, 徐廷生, 等. 玉米秸秆揉丝微贮与传统青贮饲料发酵过程中pH和微生物的变化. 西北农林科技大学学报: 自然科学版, 2014, 42(5): 17-21.
[22] Shi J. Effects of different bacterial inoculants on the fermentation and aerobic stability of whole-plant corn silage. African Journal of Agricultural Research, 2012, 7(2): 164-169.
[23] Li Y, Nishino N. Effects of inoculation ofLactobacillusrhamnosusandLactobacillusbuchnerion fermentation, aerobic stability and microbial communities in whole crop corn silage. Scandinavian Journal of Urology & Nephrology, 2011, 57(4): 184-191.
[24] Ding L, Wang J, Wen A Y,etal. Fermentation quality, nutritional values and aerobic stability of the total mixed ration after replacing whole-plant corn with different proportions of bamboo shoot shell. Acta Prataculturae Sinica, 2016, 25(6): 158-166. 丁良, 王坚, 闻爱友, 等. 笋壳替代全株玉米 TMR 发酵品质及有氧稳定性研究. 草业学报, 2016, 25(6): 158-166.
[25] Qiu X Y, Yuan X J, Guo G,etal. Effects of molasses and acetic acid on fermentation and aerobic stability of total mixed ration silage in Tibet. Acta Prataculturae Sinica, 2014, 23(6): 111-118. 邱小燕, 原现军, 郭刚, 等. 添加糖蜜和乙酸对西藏发酵全混合日粮青贮发酵品质及有氧稳定性影响. 草业学报, 2014, 23(6): 111-118.
[26] Tabacco E, Piano S, Revello-Chion A,etal. Effect ofLactobacillusbuchneriLN4637 andLactobacillusbuchneriLN40177 on the aerobic stability, fermentation products, and microbial populations of corn silage under farm conditions. Journal of Dairy Science, 2011, 94(11): 5589-5598.
[27] Hashemzadeh-Cigari F, Khorvash M, Ghorbani G R,etal. Interactive effects of molasses by homofermentative and heterofermentative inoculants on fermentation quality, nitrogen fractionation, nutritive value and aerobic stability of wilted alfalfa (MedicagosativaL) silage. Journal of Animal Physiology & Animal Nutrition, 2013, 98(2): 290-299.
[28] Schmidt R J, Hu W, Mills J A,etal. The development of lactic acid bacteria andLactobacillusbuchneriand their effects on the fermentation of alfalfa silage. Journal of Dairy Science, 2009, 92(10): 5005-5010.
[29] Zhao Z F. Isolation and Screening of Lactic Acid Bacteria From Corn Silage and the Effect of Adding it on Corn Silage Quality and Aerobic Stability[D]. Hohhot: Inner Mongolia Agricultural University, 2009. 赵子夫. 乳酸菌的分离筛选及其对玉米青贮品质和有氧稳定性的影响[D]. 呼和浩特: 内蒙古农业大学, 2009.
[30] Gong M L. Study on the Nutrient Dynamic of Corn Stalks in Silage[D]. Taian: Shandong Agricultural University, 2013. 公美玲. 玉米秸秆青贮过程中的营养动态研究[D]. 泰安: 山东农业大学, 2013.
[31] Yang Y G, Zhang Y L, Du X,etal. Study on the major microorganism changes during the silage processing of two kinds of corn silage. Chinese Journal of Animal and Veterinary Sciences, 2012, 43(3): 397-403. 杨云贵, 张越利, 杜欣, 等. 2种玉米青贮饲料青贮过程中主要微生物的变化规律研究. 畜牧兽医学报, 2012, 43(3): 397-403.
[32] Cavallarin L, Tabacco E, Antoniazzi S,etal. Aflatoxin accumulation in whole crop maize silage as a result of aerobic exposure. Journal of the Science of Food and Agriculture, 2011, 91(13): 2419-2425.
[33] Garon D, Richard E, Sage L,etal. Mycoflora and multimycotoxin detection in maize silage: Experimental study. Journal of Agricultural and Food Chemistry, 2006, 54(9): 3479-3484.
[34] Kim E, Maragos C, Kendra D,etal. Liquid chromatographic determination of fumonisins B1, B2, and B3 in corn silage. Journal of Agricultural and Food Chemistry, 2004, 52(2): 196-200.
[35] Spadaro D, Bustos-Lopez M P, Gullino M L,etal. Evolution of fungal populations in corn silage conserved under polyethylene or biodegradable films. Journal of Applied Microbiology, 2015, 119(2): 510-520.
[36] Borreani G, Piano S, Tabacco E. Aerobic stability of maize silage stored under plastic films with different oxygen permeability. Journal of the Science of Food & Agriculture, 2014, 94(13): 2684-2690.
[37] Wang H L. Succession of Yeast Populations with Prolonged Ensiling and During Aerobic Exposure of TMR[D]. Beijing: China Agricultural University, 2015. 王慧丽. TMR在发酵过程中及有氧状态下酵母菌群落演替规律研究[D]. 北京: 中国农业大学, 2015.
Fermentationqualityandmicrobialquantityduringaerobicstorageofcornsilage
WANG Xu-Zhe1, JIA Shu-An2, ZHANG Fan-Fan1, LU Wei-Hua1, ZHANG Qian-Bing1, MA Chun-Hui1*
1.CollegeofAnimalSciencesandTechnology,ShiheziUniversity,Shihezi832003,China; 2.InstituteofAnimalHealthSupervisionofXinjiangUygurAutonomousRegion,Urumqi830011,China
The objective of this study was to analyze the effect of density on the fermentation quality and microbial content of whole plant corn (Zeamays) silage, to provide a reference for selecting the appropriate density for silage in practice. The silage material was Xinsiyu 10, which was compacted to varying densities (350, 400, 500, 600, and 700 kg/m3) and then fermented for 50 days. The fermentation quality, microbial content, and aerobic stability of silage samples after 12, 24, 36, 60 and 108 h exposure to air were evaluated using an online multi-channel data logger temperature recorder. The results indicated that the pH value, lactic acid content, acetic acid content, NH3-N content, and amounts of lactic acid bacteria, molds, yeasts, and aerobic bacteria significantly decreased during ensilage (P<0.05). Oxygen exposure time had a significant effect on the above indicators (P<0.01) during aerobic exposure. At 108 h after opening silos, the 600 kg/m3treatment had the highest lactic acid bacteria content (up to 8.17 lg cfu/g FW) and the lowest pH value, NH3-N content, fungi content (5.38 lg cfu/g FW) and yeasts content (7.72 lg cfu/g FW). The 600 kg/m3treatment also showed the highest stability among the treatments (100 h in air;P<0.05). In summary, these results indicate that 600 kg/m3is the best density for producing corn silage with high fermentation quality and aerobic stability.
corn silage; aerobic stability; fermentation characteristics; microbial quantity; compaction
10.11686/cyxb2016450
http://cyxb.lzu.edu.cn
王旭哲, 贾舒安, 张凡凡, 鲁为华, 张前兵, 马春晖. 紧实度对青贮玉米有氧稳定期发酵品质、微生物数量的效应研究. 草业学报, 2017, 26(9): 156-166.
WANG Xu-Zhe, JIA Shu-An, ZHANG Fan-Fan, LU Wei-Hua, ZHANG Qian-Bing, MA Chun-Hui. Fermentation quality and microbial quantity during aerobic storage of corn silage. Acta Prataculturae Sinica, 2017, 26(9): 156-166.
2016-11-29;改回日期:2017-02-10
国家自然科学
基金项目(31460637),国家牧草产业技术体系(CARS35)和新疆研究生科研创新项目(XJGRI2015037)资助。
王旭哲(1991-),男,吉林九台人,在读博士。E-mail:690953197@qq.com*通信作者Corresponding author. E-mail: chunhuima@126.com
