东莞地区临床分离耐碳青霉烯的鲍曼不动杆菌的耐药特点及其机制研究
2017-09-19郭主声林偲思朱学海张丽张丽华胡继华周谋清阎红霞郭少卿
郭主声,林偲思,朱学海,张丽,张丽华,胡继华,周谋清,阎红霞,郭少卿
(中山大学附属东莞东华医院 1.检验科,2.感染科,3.呼吸科,4.急诊科,广东 东莞 523110)
东莞地区临床分离耐碳青霉烯的鲍曼不动杆菌的耐药特点及其机制研究
郭主声1,林偲思1,朱学海1,张丽1,张丽华1,胡继华2,周谋清2,阎红霞3,郭少卿4
(中山大学附属东莞东华医院 1.检验科,2.感染科,3.呼吸科,4.急诊科,广东 东莞 523110)
目的回顾分析东莞东华医院2011~2013年临床分离的鲍曼不动杆菌的临床分布及耐药特点,为临床合理用药和防止医源性感染提供依据。方法选取2011~2013年东华医院临床分离的非重复鲍曼不动杆菌菌株30株,采用琼脂稀释法检测该菌对11种抗菌药物的最低抑菌浓度(MIC),采用乙二胺四乙酸纸片协同实验检测待检菌株的金属酶表型,采用三维实验检测待检菌株的AmpC酶表型和改良Hodge实验筛查碳青霉烯酶,聚合酶链反应进行OXA-23、OXA-24编码基因的检测,应用脉冲场凝胶电泳进行同源性分析。结果在监测的14种抗菌药物MIC中,耐药率>60%的达13种,其中只有头孢哌酮舒巴坦耐药率<50%,共筛选出耐碳青霉烯酶的鲍曼不动杆菌30株,其中金属酶表型和基因检测均为阴性,AmpC酶阳性者21株,改良Hodge实验阳性24株,其中26株OXA-23基因扩增阳性,未检出OXA-24基因,可见OXA-23基因为主要的流行克隆株。结论东莞地区临床分离的鲍曼不动杆菌多重耐药十分严重,产OXA-23碳青霉烯酶是鲍曼不动杆菌对碳青霉烯酶类药物耐药的重要机制,且碳青霉烯酶耐药菌株存在克隆流行。
鲍曼不动杆菌;耐碳青霉烯酶;药敏实验;耐药基因
鲍曼不动杆菌实质上就是临床上经常出现的一种革兰阴性杆菌,尤其是在重症监护室(intensive care unit,ICU)中,其分布范围十分广泛,主要存在于机体的泌尿生殖道、呼吸道及皮肤,在土壤、水中也有分布,传播途径主要为接触,是导致院内感染状况发生的主要病原菌。鲍曼不动杆菌主要由感染专科的脑脊液、呼吸道分泌物、脓液、尿液及血液等一系列标本中分离出现,极易诱发脑膜炎、败血症、尿路感染及获得性肺炎等感染状况。现阶段因为临床上对于抗菌药物的使用不合理、不规范,导致鲍曼不动杆菌对β-内酰胺类、氨基糖苷类及喹诺酮类等一系列抗菌药物产生耐药性越来越强,造成多重耐药的鲍曼不动杆菌的数量越来越多,尤其是碳青霉烯类药物的耐药性,这在很大程度上增大临床治疗难度[1-4]。本文主要通过对30株多重耐药的鲍曼不动杆菌,特别是耐碳青霉烯的鲍曼不动杆菌予以检测,为临床合理用药提供有价值的参考依据。
1 材料与方法
1.1 实验菌株来源
选取2011年1月-2013年12月本院临床分离的30株耐耐碳青霉烯的鲍曼不动杆菌,其中20株痰标本,3株伤口分泌物,3株引流液,2株咽拭子,2株尿标本,均为不重复标本。
1.2 试剂与仪器
选取M-H琼脂平板和乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)纸片(广州迪景微生物试剂公司),蛋白酶K(德国Merck公司),Sea Kemgold Agarose(美国Cambrex公司),XbaⅠ酶(美国Promega公司),比浊仪(美国Dade Behring公司),GEL Doc EQ凝胶成像分析系统、Chef Mapper脉冲场凝胶电泳仪购自美国Bio-Rad公司,VITEK-2-COMPACT系统与配套GN鉴定卡(广州华鑫行试剂有限公司)。低温高速离心机(美国Sigma公司,2-16PK);d3H2O纯水仪器(美国Bio-Rad公司,仪器型号:CaSCada Bio.water.pallcorporation),聚合酶链反应(polymerase chain reaction,PCR)仪为Biometra PCR仪(美国Bio-Rad公司),电泳仪为BG·Power600(北京百晶生物技术有限公司),PCR反应体系、引物及分子标准(广州东盛生物科技有限公司),置入-70℃冰箱冷冻保存(美国赛默飞公司),-20℃冰箱冷冻保存(青岛海尔公司)。
1.3 鉴定菌株
根据第3版《全国临床检验操作规程》[5]对细菌予以分离、培养及鉴定等相关操作,先分离出要鉴定的纯菌后,根据菌落生长形态、革兰染色镜下形态及相应的生化实验鉴定到种[6]。
1.4 药敏实验
采用采用琼脂稀释法,按美国临床和实验室标准协会推荐的琼脂稀释法进行,用手工接种法将鲍曼不动杆菌菌液接种于预先制备好一系列浓度梯度的含药琼脂表面,细菌接种量为1×104菌落形成单位(colony forming units,CFU)/点,37℃培养18 h,无菌落形成的最低抗菌药物浓度为最小抑菌浓度(minimum inhibitory concentration,MIC),药敏实验所使用抗菌药物为本院临床的常用抗菌药物。
1.5 质控菌株
实验质控标准菌株主要包括:金黄色葡萄球菌(ATCC25923)、铜绿假单胞菌(ATCC27853)及大肠埃希菌(ATCC25922),所有质控菌株来源于国家卫计委临床检验中心,产超广谱β-内酰胺酶(extended spectrum beta-lactamases,ESBLs)肺炎克雷伯ATCC 700603和产KPC酶的肺炎克雷伯菌为北京协和医院检验科谢秀丽老师赠送。
1.6 Am pC酶检测
根据郑力等[7]在相关研究报道中提出的三维实验方法,①制备酶粗提物:选取血平板上已经培养18~24 h的3~5个菌株,在营养肉汤中进行接种操作,温度控制在35℃左右,培养时间6 h,于规定时间内混合均匀,2 600 r/min离心30 min,弃上清液,将其沉淀于35℃和80℃,反复冻融8次左右,冻融时间≥2 h/次,冻融完成后加入0.01 mol磷酸盐缓冲液,4℃、12000r/min离心20min,酶提取物即上清液;②三维实验:欣二(Mueller-Hinton,MH)琼脂平板上涂抹大肠埃希菌,其浓度为0.5麦氏单位,然后在平板中心黏贴头孢西丁药敏纸片,在距离头孢西丁药敏纸片边缘5 mm位置,使用无菌刀片切1个小槽,将50μl酶提取物置于小槽中,进行培养,温度控制在35℃左右,于第2天清晨观察培养结果。若是抑菌圈处于不完整状态,抑菌圈与头孢西丁纸片端交接处发生趋向于平皿中心扩大状况,即判定为AmpC酶阳性,若是抑菌圈处于完整状态,即可判定为AmpC酶阴性。
1.7 ED TA纸片实验
根据纸片扩散法,按照药物敏感性实验流程,对细菌进行配置,将其浓度制备为0.5麦氏单位,均匀涂布于MH琼脂平板上,张贴2张亚胺培南药敏纸片,且2张亚胺培南药敏纸片中心距离≥25 mm。同时将5μl 500 mmol/L EDTA溶液滴入1张亚胺培南药敏纸片上,培养温度控制在35℃左右,培养20 h后进行观察。金属酶阳性的判定指标为单纯亚胺培南纸片与亚胺培南+EDTA纸片的抑菌圈直径差值≥7 mm。
1.8 检测产灭活酶基因
1.8.1 制备模版 从MH平板中提取细菌,数量控制在3、4个,于300μl 0.85%生理盐水制备细菌悬液,混合均匀。12 000 r/min离心5 min,弃上清液,加入无菌双蒸水300μl,混合均匀,置于100℃左右水中,15 min后15 000 r/min离心2 min,离心处理后DNA模板即为上清液。
1.8.2 扩增PCR 总反应体系为50μl,其中0.36u/L DH2O,0.25μl Taq酶,1μl正向引物,1μl反向引物,3μl DNA模板,4μl dNTPs mixture,5μl 10×缓冲液。反应条件:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,共30个循环,72℃继续延伸7 min。1.2%琼脂糖凝胶电泳处理PCR产物,观察特异性扩增条带。采用PCR检测OXA-23型酶的编码基因。见表1。
1.9 脉冲场凝胶电泳同源性
胰蛋白胨大豆肉汤培养基接种单个菌落,维持温度在35℃左右,振荡、孵育过夜。1ml肉汤加入1.5 ml离心管(eppendorf tubes,EP),离心收集细菌沉淀。加入500μl SE buffer,充分混合均匀,12 000 r/min离心1 min,弃上清液。加入300μl SE buffer,重新悬浮沉淀。制备2%低熔点琼脂糖,将0.2g低熔点琼脂糖加入10 ml SE buffer,用微波炉溶化处理,保持温度在60℃~70℃,避免出现凝固。混充分合2%低熔点琼脂糖与菌悬液,置于模具中制作成胶块,4℃固化30 min左右。裂解液的制备:500μg/ml蛋白酶K、pH 9.5、0.5 mol/L EDTA及1%N-十二烷基肌氨酸钠。破裂过程中从-20℃条件下取出20 mg/ml蛋白酶K母液,配置所需浓度。将1 ml裂解液置于EP管中并推入固化胶块,56℃孵育过夜;次日更换裂解液,保持裂解液的新鲜,56℃再次孵育过夜。将裂解液吸出,防止胶块碎裂。加入1 ml TE buffer,上下颠倒,4℃条件下放置30 min,重复3次后洗涤。4℃、TE缓冲液中存储胶块,存储时间可≥6个月,每间隔1个月需要更换TE缓冲液。酶切:将胶块切成长条,长度在1 mm左右,每一个标本切2条。置入100μl 1×酶切缓冲液,4℃条件下平衡1h左右。将酶切缓冲液吸出,酶切处理,100μl酶切体系,其中包含30 u ApaⅠ,10μl 10×酶切缓冲液,离子双蒸水补足体积,35℃消化过夜。酶切液吸出后,加入2 00μl TE buffer,混合均匀,4℃条件下放置30 min左右,重复3次后洗涤。加入100μl 0.5×TBE缓冲液,4℃条件下放置30 min。80 ml 0.5×TBE缓冲液中置入0.8g电泳用琼脂糖,混合均匀,制备1%脉冲场凝胶电泳。配置5×TBE母液:20 ml 0.5 mol/L EDTA,27.5g硼,54g Tris碱,pH 8.0,定容至1 L。取出经酶切处理后的胶条,与加样孔的前壁上样紧靠,1%电泳琼脂糖液封闭每个加样孔。6 v/cm、14℃、线性变化时间控制在5~8 s,电泳20 h后溴化乙锭染色,紫外凝胶成像仪进行拍摄。结果评价:将图谱完全一致的作为同一型,相差1个条带的作为同一型的不同亚型,相差2或3个条带的判定为亲缘关系十分密切,相差4~6个条带的判定为可以有一定联系,相差≥7个条带的判定为无任何亲缘关系,同时随机选取字母分型,按照A、B、C、D的顺序。
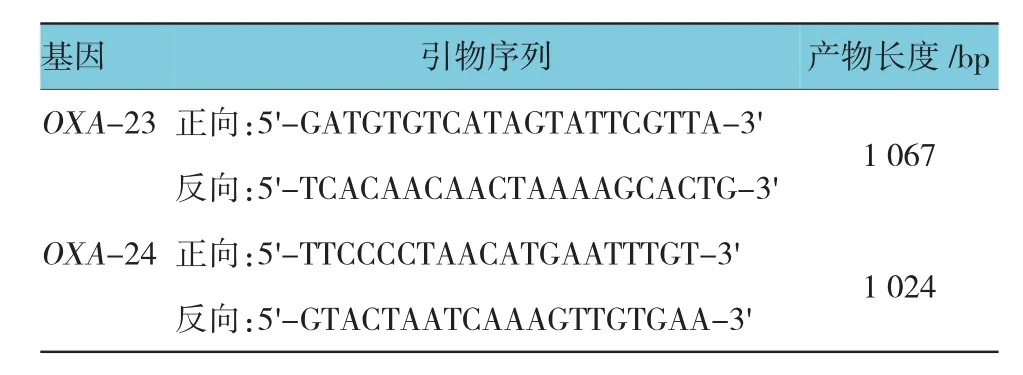
表1 靶基因PC R扩增引物序列
2 结果
2.1 鲍曼不动杆菌对常用抗生素的药敏结果
本院分离的21株产AmpC酶、24株产碳青霉烯酶、24株产AmpC酶和碳青霉烯酶的鲍曼不动杆菌对14种常用抗生素的药敏结果见表2。
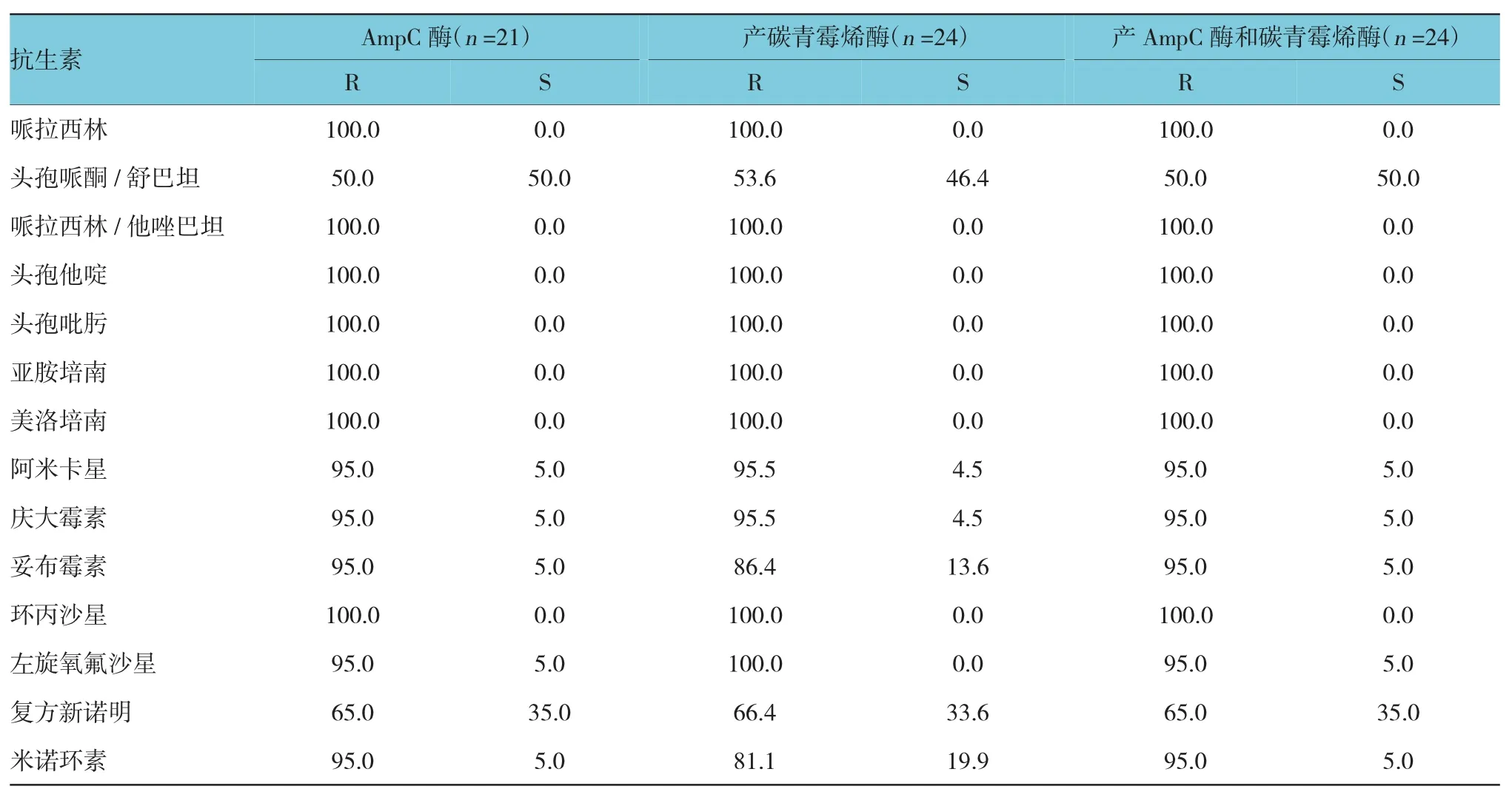
表2 鲍曼不动杆菌对14种常用抗生素的药敏结果 %
2.2 产酶表型和基因表型检测结果
所有菌株EDTA为阴性,Hodge实验阳性菌株为24株,三维实验阳性菌株为21株,26株菌株的OXA-23阳性,所有菌株OXA-24为阴性。见表3和图1、2。
2.3 PFG E结果
1~3、6、7、9、11~13、15~17、19~21为同一克隆株,4、5、10、14、18与上述菌株仅差1个条带,为同一克隆株的不同亚型。见图3。
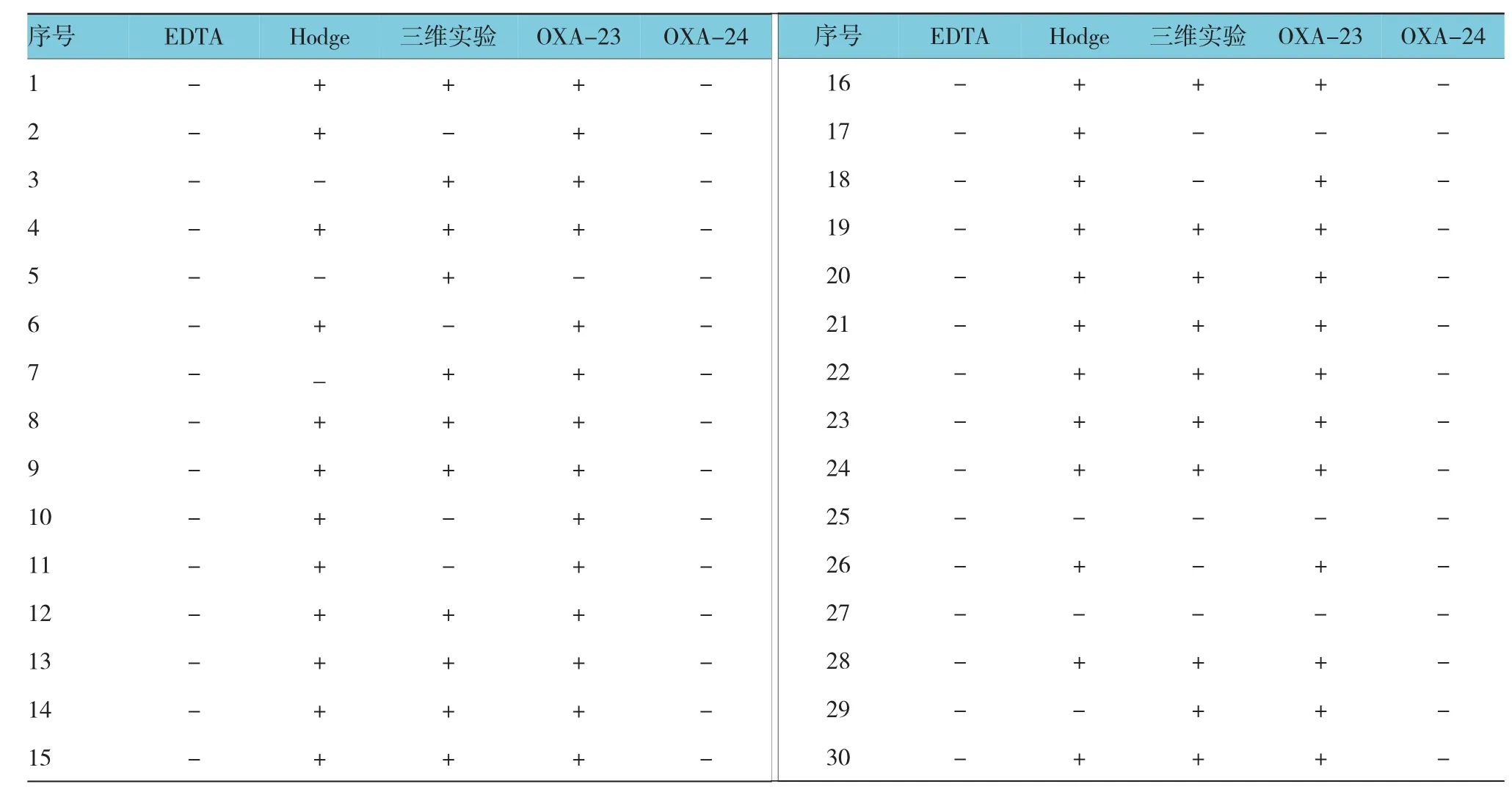
表3 30株鲍曼不动杆菌产酶表型和基因表型检测结果
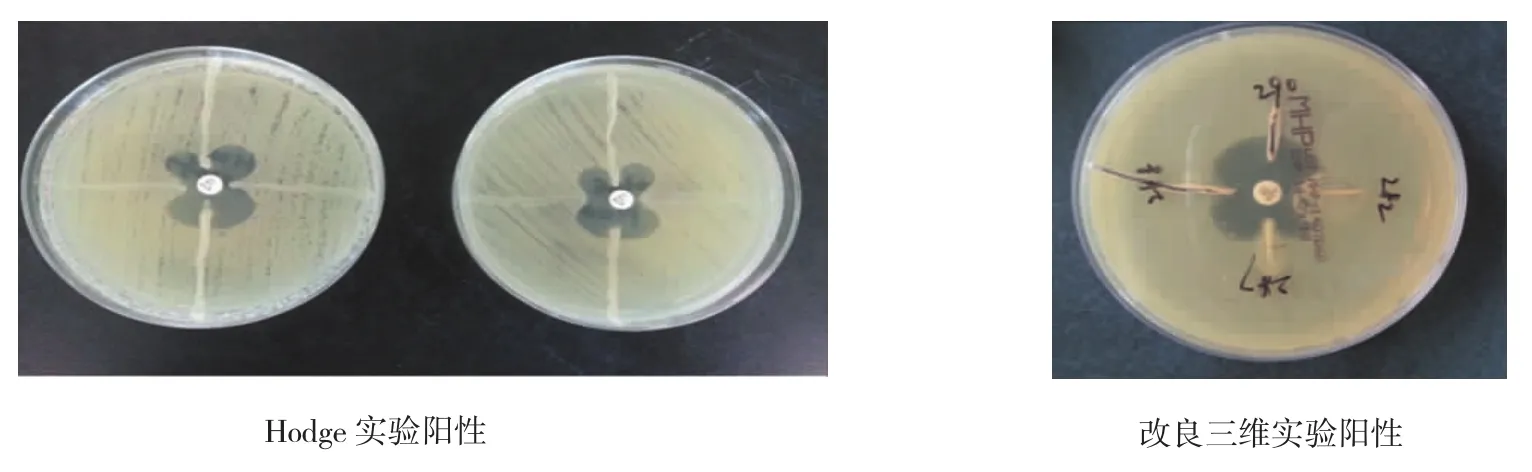
图1 H odge实验和改良三维实验结果
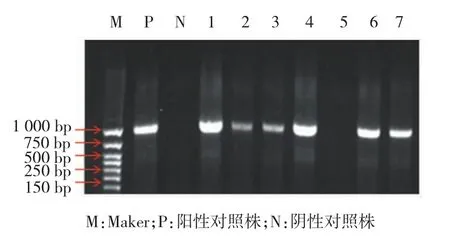
图2 O XA-23 PC R电泳图
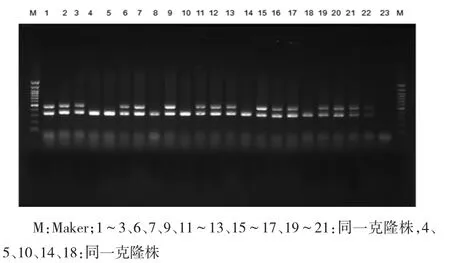
图3 鲍曼不动杆菌PFG E结果
3 讨论
鲍曼不动杆菌是医院内不动杆菌感染爆发流行最主要的菌株。据文献报道,由于临床对三代头孢菌素的广泛使用或甚至滥用,导致鲍曼不动杆菌在医院病原菌分离所占比例呈上升趋势,特别是重症监护病房、急诊病区及呼吸内科病房[7-9]。而且从临床分离的药敏资料来看,鲍曼不动杆菌对临床常用的抗菌药物呈现不同程度的耐药。而鲍曼不动杆菌对β-内酰胺类抗菌药物的耐药机制有以下几个方面:药物靶位修饰和药物外排泵作用、外膜通透性降低、产β-内酰胺酶等。其中最主要的是产β-内酰胺酶[10],主要有AmpC酶、广谱β-内酰胺酶、ESBLs、碳青霉烯酶及金属β-内酰胺酶。
Ampc酶实质上就是一种β-内酰胺酶,根据其产生方式,可以将其划分为:持续低产酶、持续高产酶及诱导高产酶[11]。前两者与β-内酰胺类抗生素的存在有关。近年来研究表明,随着β-内酰胺类抗生素,尤其是头孢菌素的广泛应用,AmpC酶不仅可由染色体上的基因编码,而且可由质粒介导[12]。
本研究收集的30株鲍曼不动杆菌的B内酰胺酶实验、改良三维实验法及Hodge实验结果中,头孢噻吩纸片法检测到产β-内酰胺酶菌株30株,阳性率为100.0%;改良三维实验法检测到AmpC酶阳性株21株,阳性率为70.0%;Hodge实验检测到碳青霉烯酶阳性株24株,阳性率为80.0%。同时产AmpC酶和碳青霉烯酶阳性株24株,阳性率为70.0%。
碳青霉烯酶实质上就是一种可以水解亚胺培南的β-内酰胺酶,包含Ambler分子,主要分为A、B、D 3类酶;其中,B类酶是一种金属酶,可由转座子介导。其碳青霉烯酶主要有金属酶和OXA类酶。碳青霉烯类抗菌药物是目前临床治疗革兰阴性菌感染最为有效的抗菌药物之一。然而随着其在临床治疗中广泛应用,对碳青霉烯类抗菌药物呈耐药的菌株也逐渐被发现和证实,临床应用前景面临着巨大的挑战。不动杆菌对碳青霉烯类抗菌药物有关的耐药机制为:外膜孔蛋白缺失、药物主动外排表达、青霉素结合蛋白改变、产碳青霉烯酶等,其中产碳青霉烯酶的关注度最高[13-16]。进一步了解与掌握耐碳青霉烯类鲍曼不动杆菌在耐药方面的机制,其研究更加趋向于选用分子生物方法,并在此基础上寻找更加有效的方式。
本研究对30株耐碳青霉烯酶的鲍曼不动杆菌进行PCR反应,检测出26株OXA-23阳性菌株,但未检测出OXA-24菌株,说明OXA-23是东莞地区碳青霉烯酶抗生素耐药鲍曼不动杆菌主要的碳青霉烯酶基因型。通过鲍曼不动杆菌PFGE检测结果显示,东莞地区碳青霉烯类抗生素耐药鲍曼不动杆菌绝大多数为同一克隆株。同一克隆株可以在同一医院病房内或不同病房内,甚至是不同医院间造成克隆传播。因此微生物室一旦发现高耐菌株,应立即与院感部门和临床科室沟通联系,落实做好各项预防措施,防止耐药克隆株的院内播散流行。
本研究药敏结果显示,产AmpC酶和产碳青霉烯酶是本院鲍曼不动杆菌对临床常用抗菌药物耐药的主要原因,呈多重耐药性。鲍曼不动杆菌的特点主要是使其具有多重耐药基因,而且够将该基因转移至其他细菌上,与其他具有耐药基因的细菌相结合,因此对于一系列抗生素具有一定耐药性,在很大程度上增加临床抗感染治疗难度,所以应当充分重视产酶菌株的检出。在对抗生素进行选取的时候,应当充分考虑抗生素具备的细菌耐药突变适应能力和抗菌活性,根据药敏结果,选取抗菌活性强的抗生素药物,避免高耐药株细菌出现。同时对于一些反复运用广谱抗生素、反复感染、病程长,以及基础疾病严重的产酶菌株感染患者,应当给予精心护理,避免产酶菌株大量传播。除此之外,应提高医务人员对院内下呼吸道感染的认识,加强医院环境消毒,防止医源性感染。
[1]王娟,王磊,李志奎,等.综合性医院ICU鲍曼不动杆菌分布及耐药性变迁分析[J].中华肺部疾病杂志:电子版,2013,6(5):15-18.
[2]刘江波,蒋萍.ICU病房患者下呼吸道感染鲍曼不动杆菌的临床分析及耐药性分析[J].中国慢性病预防与控制,2011,19(6):586-588.
[3]杜坤,应春妹,汪雅萍,等.上海地区四家医院鲍曼不动杆菌产β-内酰胺酶研究[J].检验医学,2012,27(2):103-109.
[4]HUANG J,CHEN E Z,QU H P,et al.Sources of multidrug-resistant Acinetobacter baumannii and its role in respiratory tract colonization and nosocomial pneumonia in intensive care unit patients[J].Chinese Medical Journal,2013,126(10):1826-1831.
[5]叶应妩,王毓三,申子瑜,等.全国临床检验操作规程第3版[S].南京:东南大学出版社,2006:917-918.
[6]郭主声,朱学海,林偲思,等.重症监护病房病原菌分布及耐药性分析[J].国际检验医学杂志,2014,35(3):286-289.
[7]郑力,高永红,陈予新,等.呼吸机相关性肺炎中鲍曼不动杆菌耐药性的动态分析[J].中国现代医药杂志,2011,13(3):11-13.
[8]孙茜,李耘,王珊,等.呼吸监护室搬迁前后亚胺培南耐药鲍曼不动杆菌的流行病学及碳青霉烯酶基因型研究[C].广州:中华医学会呼吸病学年会,2011.
[9]KARAGEORGOPOULOS D E,FALAGAS M E.Current control and treatment of multidrug-resistant acinetobacter baumannii infections[J].Lancet Infect Dis,2008,8(12):751.
[10]汤荣睿,龚雅利,张晓兵.碳青霉烯耐药鲍曼不动杆菌耐药性分析及金属β-内酰胺酶检测[J].重庆医学,2011,40(21):2094-2095.
[11]张丽梅,苏丹虹,徐韫健.鲍曼不动杆菌AmpC酶和AmpC耐药基因检测分析[J].检验医学与临床,2012,9(21):2683-2685.
[12]JAMALI S,SHAHID M,FARRUKH S,et al.Molecular characterization ofgenes encoding Amp C beta-lactamases in clinical isolates of pseudomonas and acinetobacter species[J].Journal of Applied Pharmaceutical Science,2015,5(10):48-51.
[13]郭主声,张丽,朱学海,等.2000-2014年我院临床分离鲍曼不动杆菌的分布及耐药性分析[J].海南医学杂志,2015,26(22):3329-3332.
[14]郭主声,梁思远,林偲思,等.300株鲍曼不动杆菌琼脂稀释法与纸片扩散法药敏检测结果比较[J].现代生物医学进展杂志,2016, 16(12):2281-2283.
[15]韩爽,于文静,杨瑞林,等.多药耐药鲍曼不动杆菌ADC型AmpC酶基因的检测研究[J].世界最新医学信息文摘,2015,15(67):1-2.
[16]万琼,谢忆红.1126株鲍曼不动杆菌的耐药变迁及来源分布[J].医学理论与实践,2014(11):1509-1510.
(童颖丹 编辑)
Study ongenotyping of beta-lactamase in Carbapenem-resistant Acinetobacter baumanniiseparated in Dongguan area
Zhu-shengguo1,Si-si Lin1,Xue-hai Zhu1,Li Zhang1,Li-hua Zhang1, Ji-hua Hu2,Mou-qing Zhou2,Hong-xia Yan3,Shao-qingguo4
(1.Clinical Laboratory;2.Department of Infectious Diseases;3.Department of Respiratory Medicine;4.Emergency Department,Tungwah Hospital Affiliated to Sun Yat-sen University, Dongguan,Guangdong 523110,China)
ObjectiveTo analyze clinical distribution and drug resistance ofAcinetobacter baumannii isolated in Tungwah Hospital,to learn β-lactamasegene ofAcinetobacter baumanniiresistant to Carbapenem so as to provide the basis for clinical use of drugs and prevention of nosocomial infections.MethodsThirty strains of non-repetitiveAcinetobacter baumanniiresistant to Carbapenem which were isolated in Tungwah Hospital from January 2011 to December 2013 were collected.Agar dilution method was used to detect the minimal inhibitory concentrations (MIC)of 11 kinds of antimicrobial agents.Pidemiological analysis was conducted.Carbapenemase was screened by modified Hodge test.The metalloenzyme phenotype and AmpC enzyme phenotype of the tested strains were detected by EDTA-disk synergy test and three-dimensional test respectively.PCR amplification ofOXA-23,OXA-24and pulsed fieldgel electrophoresis (PFGE)homology analysis were used to analyze the moleculer type andgenetic relationship between the resistant strains.MethodsIn the 14 antimicrobial agents with monitored MIC,the resistance rate of 13 species was over 60%, only that of SCF was lower than 50%.Totally 30 strains of Carbapenem-resistantAcinetobacter baumannii were screened out,of which the metalloenzyme phenotype andgene were both negative,21 strains had AmpCenzyme and 24 strains showed positive modified Hodge test;among whichOXA-23gene was amplified in 26 strains whileOXA-24gene was not detected.ConclusionsThe resistance ofAcinetobacter baumanniiisolated in clinic of Dongguan area is very severe.OXA-23gene is the main carbapenemasegene,and Carbapenemresistant strains are prevalent in this area.
Acinetobacter baumannii;resistance to carbapenemase;drug sensitive test;drug resistancegene
R446
A
2016-05-25
10.3969/j.issn.1005-8982.2017.20.007
1005-8982(2017)20-0034-06
