钙调蛋白激酶Ⅱ抑制剂KN-93对大鼠离体肥厚心肌电生理特性的影响
2017-09-17温霞高江峰
温霞 高江峰
钙调蛋白激酶Ⅱ抑制剂KN-93对大鼠离体肥厚心肌电生理特性的影响
温霞 高江峰
作者单位:010000 内蒙古自治区呼和浩特市,内蒙古自治区人民医院急诊科
目的 探讨钙调蛋白激酶Ⅱ(CaMKⅡ)抑制剂KN-93对大鼠离体肥厚心肌电生理特性的影响及其抗心律失常的特性。方法 雄性SD大鼠40只,随机分为假手术组(Sham组)和心肌肥厚组(Hypertrophy,HY组)。缩窄腹主动脉制作心肌肥厚模型。手术6周后,超声心动图评价模型。运用Langendorff心脏离体灌流电生理技术检测整体心肌电生理特性,微电极阵列技术评价心脏传导情况。结果 手术6周后,左室后壁舒张末期厚度及室间隔舒张末期厚度明显增厚,提示心肌肥厚造模成功。与Sham组相比,HY组心室各部位的单向动作电位时程(APD90)显著延长(70.0±5.9比 56.0±3.8,P<0.01),有效不应期(ERP)也显著延长(52.0±5.4比 39.0±6.3,P<0.01);诱发动作电位电交替阈值中位数明显增大(130比 90,P<0.01);传导的时间离散度明显增大(31.9±3.8比 5.8±0.32,P<0.01),且室性心律失常的诱发率明显升高(RV 9/12比 2/12,P<0.05)。HY组使用CaMKⅡ抑制剂KN-93后,APD90(70±5.9比71±4.5,P>0.05)和ERP(52±5.4比53±4.4,P>0.05)并无显著变化,APD电交替阈值也无明显改变(HY组130比HY+KN-93组130,P>0.05),但传导的时间离散度明显减小(4.4±0.33比31.9±3.8,P<0.01),室性心律失常的诱发率减少(RV HY组9/12比HY+KN-93组2/12,P<0.05)。结论 CaMKⅡ抑制剂KN-93对大鼠离体肥厚心肌APD90、ERP、APD电交替阈值均无明显影响,但能显著减小传导速度离散度;对传导的影响可能是KN-93抗心律失常的重要机制。
钙调蛋白激酶Ⅱ; KN-93; 心肌肥厚; 心脏电生理; 心律失常
室性心律失常的发生机制复杂,目前尚未完全明了。近些年研究表明,钙调蛋白激酶Ⅱ(CaMKⅡ)过度表达和持续激活与室性心律失常关系密切。一方面,CaMKⅡ激活后可增大晚钠电流,延长心肌细胞复极时程,导致早后除极的发生,引起触发活动。另一方面,CaMKⅡ过度激活可使兰尼碱Ⅱ型受体(RYr2)持续磷酸化,导致舒张期经RyR2漏至细胞的钙增多,胞内钙浓度的升高使Na+/Ca2+交换体逆向转运增强,此过程会产生内向电流,容易引发迟后除极,增加心律失常的发生风险[1]。
KN-93是CaMKⅡ特异性抑制剂。研究表明,KN-93通过抑制心脏晚钠电流和肌浆网“钙漏”来发挥抗心律失常的作用,具有潜在的临床应用价值[2]。我们前期的研究也发现,KN-93能调节异丙肾上腺素引起的心肌细胞电生理特性的改变,包括L型钙电流的增大和心肌细胞钙紊乱[3]。本研究使用大鼠肥厚心肌模型,利用离体灌流电生理技术,观察KN-93对整体心脏电生理的影响,阐明KN-93抗心律失常的特性。
1 材料与方法
1.1 实验分组、模型制作和评价 实验用雄性SD大鼠(由湖南斯莱克景达实验动物有限公司提供)40只,体重220~250g,随机分为2组:假手术组(Sham 组,n=20)和心肌肥厚组(HY 组,n=20)。经腹腔给予10%浓度水合氯醛(0.3 ml/kg)进行麻醉。将麻醉好的大鼠取右侧卧位固定于手术台,沿左侧腹部划3~5 cm的切口,分离浅筋膜和深筋膜,暴露腹主动脉,在双肾动脉上端游离一段大约2 mm的腹主动脉,将游离的动脉与21F(约6 mm)针头共同结扎,拔出针头,造成腹主动脉管腔环形缩窄50%~60%。假手术组开腹不结扎作对照。术后青霉素5000 U/只肌肉注射1周,预防感染。手术6周后,超声心动图评价心功能,分别记录左室射血分数(LVEF)、短轴缩短率(FS)、左室后壁舒张末期厚度(LVPWs)、室间隔舒张末期厚度(IVDs)。
1.2 离体电生理研究 给予大鼠1200 U/kg充分肝素化,10%水合氯醛麻醉后,迅速取出心脏,置于100%氧饱和的4℃普通台式液(NaCl 130 mmol/L,KCl 5.4 mmol/L,MgCl21 mmol/L,Na2HPO40.3 mmol/L,HEPES 10 mmol/L,glucose 10 mmol/L,CaCl21.8 mmol/L,pH 7.35)中剪去心包及周围结缔组织,洗净残血,连接Langendorff心脏灌流装置,经主动脉逆行灌流,灌流液为普通的台式液。HY组离体心脏检测完各项电生理指标后换用加有KN-93(1μmol/L)的台式液灌流,待30 min后重新测量各项电生理指标。
1.3 心脏各部位单相动作电位(MAP)、有效不应期、APD电交替阈值与心律失常 ①MAP记录:刺激电极置于高位右心室(起搏周长分别为250 ms、200 ms、150 ms、100 ms,脉宽 2 ms,刺激强度为舒张期起搏阈值的2倍),分别记录左室前壁基底部(LAB)、左室前壁心尖部(LAA)、左室后壁基底部(LPB)、左室后壁心尖部(LPA)四个部位的 MAP。待MAP稳定后取8个连续的MAP,应用Chart 7.3软件测量动作电位复极程度达到90%的时间(APD90)。②各部位有效不应期测量:将刺激电极置于上述心室4个部位,记录电极置于刺激电极周围1~2 cm处进行有效不应期的测量。在连续发放8个起搏刺激波(S1)后发放期前收缩刺激波(S2)(S1S1 间期=250 ms,S1S2起始间期=100 ms)。以每次减少10 ms的幅度降低S1S2间期,如S2能诱发出动作电位,则继续降低S1S2间期10 ms;如不能诱发出动作电位,则将S1S2增加10 ms,然后以-1 ms反扫至S2不能诱发出动作电位。此时的S1S2间期即为心动周期(CL),为250 ms时各个部位的ERP。③APD电交替测量:于左室前游离壁行程控S1S1增频电刺激,记录电极置于刺激电极周围1~2 cm处。初始PCL为200 ms,依次递减10 ms直至出现APD电交替。APD电交替定义为快频率刺激下标测部位连续2个动作电位的时程呈长短交替,其中短APD较长APD少10 ms以上。④VA诱发:将刺激电极分别置于左室前游离壁和右室游离壁,记录电极置于刺激电极周围1~2 cm处,给予50 Hz持续时间2 s的Train刺激进行VA诱发,连续发放20串。VA持续时间超过2 s记为VA可诱发,VA超过30 s记为持续性VA。
1.4 离体微电极阵列记录 记录使用的微电极为32导多电极,大小为3×3 mm(每个电极的距离为500μm),能够记录接触的心外膜场电位。记录位置固定在左室前游离壁,记录时间为1 min。从最早被激动的点至最晚被激动的点所需的时间定义为总的激动时间(TAT),传导速度(CV)为总的激动时间与传导距离的比值,传导速度的标准差定义为传导离散度。
1.5 统计学方法 采用SPSS 17.0软件(SPSS Inc,Chicago,Illinois)进行统计分析。计量资料采用±s表示,三组间比较采用方差分析,组间两两比较采用Tukey′s方法,两组比较采用两独立样本t检验,配对样本采用配对样本t检验;计数资料用百分比表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组超声心动图各项指标比较 与Sham组比,HY组左室后壁舒张末期厚度[(0.33±0.03)cm比(0.28±0.03)cm,P<0.05]、室间隔舒张末期厚度[(0.34±0.03)cm 比(0.29±0.03)cm,P<0.05]均显著增厚,而左室射血分数[(86.6±4.6)%比(84.6±6.5)%,P=0.21]和短轴缩短率[(50.8±6.2)%比(48.2±2.7)%,P=0.44]无明显变化。以上均提示心肌肥厚造模成功。见图1。
2.2 造模之后APD90、ERP的变化及KN-93对其的影响 腹主动脉缩窄6周后,起搏周长250 ms、200 ms、150 ms下 APD90均延长(P 均<0.01),而CaMKⅡ抑制剂KN-93对其均无影响(表1、图2)。与 APD90类似,心脏各部位(LAB、LAA、LPB、LPA)ERP在模型组明显延长(P均<0.01),而KN-93对心脏各部位ERP无明显影响(表2)。
表1 两组在不同起搏周长下APD90情况;心肌肥厚组使用KN-93 后 APD90变化情况(±s)

表1 两组在不同起搏周长下APD90情况;心肌肥厚组使用KN-93 后 APD90变化情况(±s)
注:Sham:假手术组;HY:心肌肥厚组;APD90:复极到幅值90%所需的时间;PCL:起搏周长。与Sham组相比,aP<0.01
组别 PCL=250 PCL=200 PCL=150 PCL=100 Sham 组 58.0±3.8 56.0±3.7 55.0±4.3 55.0±3.3 HY 组 72.0±7.7a 72.0±5.5a 71.0±6.7a 66.0±4.5aHY+KN-93 组 74.0±5.4 73.0±4.4 71.0±3.7 68.0±5.0
表2 两组各部位有效不应期情况;心肌肥厚组使用KN-93后ERP 变化情况(±s)
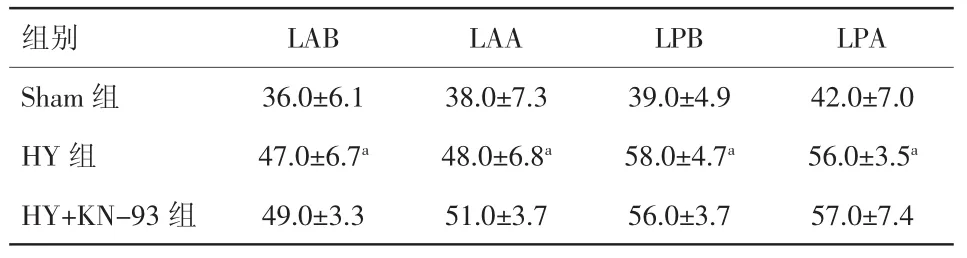
表2 两组各部位有效不应期情况;心肌肥厚组使用KN-93后ERP 变化情况(±s)
注:LAB:左室前壁基底部;LAA:左室前壁心尖部;LPB:左室后壁基地部;LPA:左室后壁心尖部;ERP:有效不应期。与Sham组相比,aP<0.01
组别 LAB LAA LPB LPA Sham 组 36.0±6.1 38.0±7.3 39.0±4.9 42.0±7.0 HY 组 47.0±6.7a 48.0±6.8a 58.0±4.7a 56.0±3.5aHY+KN-93 组 49.0±3.3 51.0±3.7 56.0±3.7 57.0±7.4
2.3 APD电交替阈值、传导速度离散度的变化 造模之后,APD电交替阈值明显增大(中位数Sham组 90,HY 组 130,P<0.01);HY 组使用 KN-93后,APD电交替阈值无明显变化(中位数HY组130,HY+KN-93 组 130)(图 3、4)。与 Sham 组相比,HY组传导速度明显不稳定,1 min传导速度离散度明显增大,而KN-93可以明显稳定HY组心脏的传导(P<0.01)(图 5)。
2.4 室性心律失常的诱发 在Burst的刺激诱发下,与Sham组相比,HY组室性心律失常的诱发率明显升高(LV 4/12比 0/12;RV 9/12比 2/12,P均<0.05);KN-93可以明显抑制HY组室性心律失常的诱发率(RV 2/12 比 9/12,P<0.05)(表 3、图 6)。
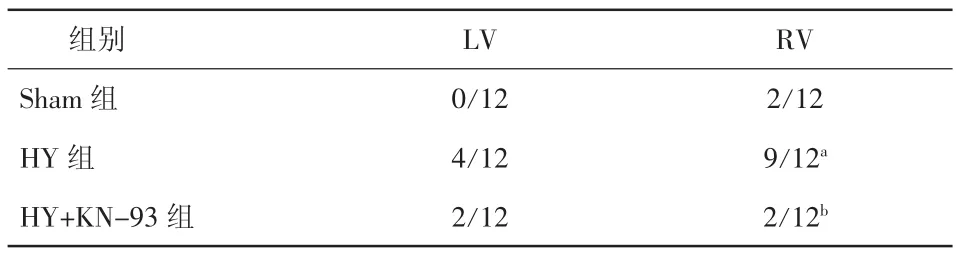
表3 两组Burst刺激左、右室室性心律失常的诱发情况;心肌肥厚组使用KN-93室性心律失常的诱发情况
3 讨论
心肌肥厚或心衰时,由于复极外向电流(钾电流等)的减少[4,5]及内向电流的增加(晚钠电流等),细胞复极时程明显延长[6]。复极时程的延长容易引起早后除极和晚后除极,引发触发活动,增加心律失常发生的风险[6]。此外,心室各部位复极时程延长的不一致性,容易形成折返环,增加折返性心律失常的发生风险[7]。在本研究中我们也观察到造模后心脏APD90明显延长。
研究表明,CaMKⅡ的过度表达和持续激活可增大晚钠电流,而增大的晚钠电流又可促使CaMKⅡ的持续激活,形成正反馈[1]。KN-93是CaMKⅡ特异性抑制剂,被广泛应用于基础研究,且显现出良好的抗心律失常效果[1]。既往研究表明,KN-93可以显著抑制晚钠电流[8]。然而在本研究中,我们并未观察到由KN-93抑制晚钠电流带来的APD缩短效应。我们发现KN-93对大鼠离体肥厚心肌在不同频率起搏下的APD90并无显著改变。最近Bence等报道,KN-93对心肌细胞外向复极K+有直接的抑制作用[9],故我们推测KN-93对复极外向K+电流的直接作用抵消了KN-93对晚钠电流的间接作用,使复极时程无明显变化。
目前关于心脏APD电交替机制尚不清楚,研究认为APD电交替的细胞机制为钙交替,与肌浆网上钙泵SERCA2a和RyR2功能的受损密切相关,不协调性APD电交替与心律失常的发生密切相关[10]。在本研究中我们观察到,造模之后APD电交替阈值明显增大,提示造模之后发生心律失常的风险增大。研究表明,KN-93能稳定RyR2的功能,减少舒张期细胞“钙漏”[1],故有理由认为KN-93能够抑制APD电交替的发生。但令人意外的是,在本研究中我们发现,KN-93并不能减小肥厚心肌APD电交替的阈值。我们推测可能是因为KN-93在稳定RyR2功能的同时,也会抑制与SERCA2a结合的PLB-S17蛋白的磷酸化,进而抑制SERCA2a的功能;而SERCA2a功能的抑制则会促进“钙交替”的发生,使心肌APD电交替阈值增大[11]。这也可能是KN-93的一大副作用。
很有意思的是,通过微电极阵列技术我们观察到KN-93可以明显稳定肥厚心肌的传导,具体机制目前尚不清楚,故需进一步研究。肥厚心肌传导速度的不稳定可能会增加折返性心律失常的风险[12],而KN-93可以明显减小传导速度的离散度。因此我们认为,KN-93减少Burst诱发的室性心律失常与这一作用相关,至少部分与此相关。
作为CaMKⅡ特异性抑制剂,KN-93已显现出较好的抗心律失常作用,但既往研究偏重于KN-93对细胞和离体通道的作用,而关于KN-93对整体心脏的抗心律失常特性知之甚少。本研究发现KN-93并不能明显缩短离体肥厚心肌APD90,也不能减小离体肥厚心肌APD电交替阈值,但却可以改善传导。本研究丰富了我们对KN-93抗心律失常特性的认识,为推动KN-93的临床应用提供了更多的依据。
(本文图片见后插六)
[1]Mustroph J,Neef S,Maier L,et al.CaMKⅡ as a target for arrhythmia suppression.Pharmacol Ther,2016,176:22-31.
[2]Liang F,Fan P,Jia J,et al.Inhibitions of late INa and CaMKⅡ act synergistically to prevent A TX-Ⅱ induced atrial fibrillation in isolated rat right atria.J Mol Cell Cardiol,2016,94:122-130.
[3]黄燕,黄从新,王丹丹,等.钙调蛋白激酶Ⅱ抑制剂对心肌细胞电生理特性的调节作用.中华心律失常学杂志,2016,20:229-235.
[4]Steng M,Ramaker C,Donker DW,et al.Temporal patterns of electrical remodeling in canine ventricular hypertrophy:focus on IKs downregulation and blunted beta-adrenergic activation.Cardiovasc Res,2016,72:90-100.
[5]Nuss HB,Kaab S,Kass DA,et al.Cellular basis of ventricular arrhythmias and abnormal automaticity in heart failure.Am J Physiol,1999,277:80-91.
[6]Karagueuzian HS,Pezhouman A,Angelini M,et al.Enhanced late Na and Ca currents as effective ahtiarrhythmic drug targets.Front Pharmacol,2017,8:36.
[7]Liu T,Shi SB,Qin M,et al.Effects of dantrolene treatment on ventricular electrophysiology and arrhythmogenesis in rats with chronic β-adrenergic receptor activation.J Cardiovasc Pharmcol Ther,2015,20:414-427.
[8]Saq CM,Mallwitz A,Wagner S,et al.Enhanced late INa induces proarrhythmogenic SR Ca leak in a CaMKⅡ-dependent manner.J Mol Cell Cardiol,2014,76:94-105.
[9]Hegyi B,Ye CL,Zhong J,et al.KN-93 inhibits Ikr in mammalian cardiomyocytes.J Mol Cell Cardiol,2015,89:173-176.
[10]Narayan SM,Bayer JD,Lalani G,et al.Action potential dynamics explain arrhythmic vulnerability in human heart failure:a clinical and modeling study implicating abnormal calcium handling.J Am Coll Cardiol,2008,52:1782-1792.
[11]Culter MJ,Wan XP,Plummer BN,et al.Targeted SERCA2a gene delivery to restore electrical stability in the failing heart.Circulation,2012,126:2095-2104.
[12]Sedmera D,Neckar J,Benes J,et al.Changes in myocardial composition and conduction properties in rat heart failure model induced by chronic volume overload.Fornt Physiol,2016,7:367.
The influence of KN-93,the inhibitor of CaMKⅡ,on the cardiac electrophysiology of hypertrophy rats
WEN Xia,GAO Jiang-feng.The Department of Emergency,Inner Mongolia Autonomous Region People′s Hospital,Hohhot 010000,China
GAO Jiang-feng,E-mail:wangdandan0806@126.com
Objective The aim of the study was to explore the effect of KN-93 on the cardiac electrophysiology in vitro hypertrophic heart.SD rats were randomly divided into sham group(Sham),hypertrophy group(HY).Methods A rat model of Cardiac hypertrophy in vivo was established by constriction of abdominal aorta.Cardiac function was evaluated via echocardiography.The cardiac electrophysiology was tested in perfused hearts and the electrical conduction was measured by microelectrode array.Results The left ventricular diastolic wall thickness(LVPWd)and ventricular septal diastolic thickness(IVSd)were significantly increased after 6 weeks of abdominal aortic constriction.Compared with Sham group,both of the action potential duration at 90%(APD90)(56±3.8 vs 70±5.9,P<0.01)and the effective refractory period(ERP)(39±6.3 vs 52±5.4,P<0.01)were significantly increased in HY group.Furthermore,the threshold of APD alternate(ADP-ALT)(Sham:90 vs HY:130,P<0.01),the dispersion of conduction velocity(5.8±0.32 vs 31.9±3.8,P<0.01)and the incidence of VA(RV Sham:2/12 vs HY:9/12,P<0.05)were also significantly increased in HY group compared with Sham group.The APD90(70±5.9 vs 71±4.5,P>0.05),ERP(52±5.4 vs 53±4.4,P>0.05),and APD-ALT(HY:130 vs HY+KN93:130,P>0.05)were showed no significant change in HY group after administration KN-93.However,the increased dispersion of conduction velocity(31.9±3.8 vs 4.4±0.33,P<0.01)and incidence of VA(RV HY:9/12 vs HY+KN-93:2/12,P<0.05)in HY group were decreased by administration of KN-93.Conclusion CaMKⅡ inhibitor KN-93 had no significant effect on the APD,ERP,and APD alternans,but it could significantly reduce the dispersion ofconduction velocity in hypertrophy hearts.The effect of KN-93 on the conduction velocity may be an important mechanism of antiarrhythmic.
CaMKⅡ; KN-93; Cardiac electrophysiology; Hypertrophy; Arrhythmias
高江峰,E-mail:wangdandan0806@126.com
10.3969/j.issn.1672-5301.2017.09.022
Q95-33;R542.2
A
1672-5301(2017)09-0854-04
2016-12-07)
