苜蓿镰刀菌根腐病病原菌的分离鉴定与致病性分析
2017-09-13丛丽丽康俊梅张铁军龙瑞才杨青川
丛丽丽, 康俊梅, 张铁军, 龙瑞才, 杨青川*
(1.中国农业科学院北京畜牧兽医研究所, 北京 100193; 2.青岛农业大学动物科技学院, 山东 青岛 266109)
紫花苜蓿(MedicagosativaL.)是世界上分布最广泛的多年生豆科牧草,由于较高的产量和优良的品质使之享有“牧草之王”的美誉[1]。它的另一优势是一次种植可利用多年,但因利用年限较长,根腐病已成为产量下降和植株衰败的一个极其重要的原因。该病害是世界性病害,几乎在所有苜蓿产区都有发生,据估计,每年全世界由该病造成的产量损失在20% 左右,有些严重发生的地块甚至达到40%[2-3]。随着种植面积的增加和种植年限的延长,病害问题会越来越严重,不仅降低了苜蓿的产量,还降低了品质,有些甚至失去了加工和利用价值,同时也会给奶业带来隐患,因为根腐病的主要致病菌如镰刀菌属(FusariumLink ex Fr.)的三线镰孢菌(F.tritinctum)以及腐皮镰孢菌(F.solani)等菌种可以产生毒素[2]。其中,玉米赤霉烯酮(zearalenone, ZEN)和脱氧雪腐镰刀菌烯醇(deoxynivaleno, DON)是较为常见、影响较大的两种毒素[5]。ZEN具有较强的生殖发育、免疫和细胞毒性,对肿瘤的产生也有一定影响[6];DON对人畜具有高度危害性,可致急性中毒症状[7]。如果牛羊等家畜采食了含有这些毒素的苜蓿饲料,不仅对家畜本身带来了影响,而且也会间接对消费者带来伤害。因此,苜蓿根腐病致病菌的分离鉴定对后续的防治及抗病品种的培育具有重要意义。
由镰刀菌引起的苜蓿根腐病迄今已在加拿大、美国、新西兰、日本、澳大利亚等许多国家有所报道[8-13]。该病对紫花苜蓿生长的各个时期均可造成严重危害。2003年,李敏权[14]等对甘肃定西苜蓿根腐病的病原研究中发现了3种镰刀菌,即尖孢镰刀菌(F.oxysporum)、锐顶镰刀菌(F.acuminatum)和半裸镰刀菌(F.semitectum),这是我国首次对该病病原系统的研究报道。
过去我国关于苜蓿根腐病的研究一直集中在田间症状、防治等方面,对病原系统的研究报道不多。另外,镰刀菌是真菌中最难鉴定和最具经济价值的属之一,其形态复杂,又易受外界环境影响发生变异,通过形态学观察很难准确鉴定到种。本试验在形态学观察的基础上,结合分子生物学手段,确保致病菌鉴定的准确性。本研究拟通过对河北廊坊、内蒙古临河和山西阳高县栽培苜蓿的田间调查、致病菌的分离鉴定,确定苜蓿镰刀菌根腐病的主要病原,为指导根腐病的田间防治提供依据。
1 材料与方法
1.1 材料来源与准备
对河北省廊坊市、内蒙古临河和山西阳高县栽培2年以上的苜蓿田定点调查,观察根腐病的田间症状。采集具有典型症状的镰刀菌根腐病病株标样带回实验室分离鉴定。为了能分离优势致病菌,采样后迅速进行病原菌的分离和鉴定。
1.2 病原菌的分离纯化
病斑处切取约5 mm×5 mm的小块组织,用75%的酒精处理30 s,0.1%的升汞处理3 min,无菌水冲洗3~5次。PSA培养基上,25°C暗培养4 天,挑取菌丝于PSA培养基上纯化3次。再经过MGA培养基纯化3次后通过在水琼脂(WA) 平板上单孢梯度稀释分离法进一步纯化到种。将单孢分离纯化的镰刀菌接到PSA的试管斜面培养基中4°C保存,每6个月转管一次,用于后续的菌种鉴定。
1.3 病原菌形态学观察
参考王拱辰的《常见镰刀菌鉴定指南》以及Booth《镰刀菌属》的方法进行菌种鉴定[15-16]。25°C培养4 d后,依据PSA培养基上的培养性状,包括菌落形态和色泽及菌落生长速度;由于部分镰刀菌株在PSA培养基和MGA培养基很难长孢子,所以本试验通过VBC[17]和SNA[18]限定营养缺乏培养基上对大、小分生孢子的有无,分生孢子的形态及产生方式,厚垣孢子的有无以及着生方式等特征进行形态鉴定。
1.4 分子生物学鉴定
为了鉴定的准确性,在形态学特征鉴定的基础上对分离菌株的核糖体基因内转录间隔区域 (rDNA-ITS)和翻译延长因子1α基因(TEF-1α)序列进行扩增。取PSA培养基培养10 d的气生菌丝,根据Simon G. Edwards[19]的方法提取基因组DNA。RDNA-ITS区域采用通用引物ITSl (5’-TCCGTAGGTGAACCTGCGG-3’) 和ITS4 (5’-TCCTCCGCTTATTGATAT- GC- 3’)PCR扩增。TEF-1α序列采用通用引物ef1(5’-ATGGGTAAGGAGGACAAGAC-3’)和ef2(5’-GGAAG TACCAGTGATCATGTT-3’)进行扩增。扩增产物回收纯化,连接到pEASY-T1载体中并转化大肠杆菌DH5α,阳性克隆送交上海英俊生物技术公司测序。DNAMAN软件对测序结果进行剪切分析,剪切后在线比对分析。
1.5 进化树的构建
获得的RDNA-ITS序列和TEF-1α的序列分别与GenBank数据库(http://www.ncbi.nlm.nih.gov/blast)和鉴定镰刀菌的数据库FUSARIUM-ID[20](http://isolate.fusariumdb.org/) 中的镰刀菌的rDNA-RDNA-ITS和TEF-1α序列进行比较, 利用MEGA 5软件进行聚类分析,构建系统发育树。
1.6 致病性鉴定
参照Wang等[21]的接种方法,6个锥形瓶中分别放置200粒大小均匀的燕麦种子,加水浸泡过夜,除去多余水分,高压灭菌2次。每个瓶中分别加入4个直径1 cm的接种菌株的琼脂块。直到燕麦种子完全接种镰刀菌后备用(约3周)。选择饱满健康的‘中苜2号’种子,75%的酒精消毒10 min,灭菌水洗5次后置于培养皿中催芽1天,播于直径15 cm (高度13 cm)的盆中,营养土∶蛭石∶石英砂体积比为3∶1∶1,每盆15株,培养箱中培养(25℃光照/20℃黑暗,相对湿度80%)。待出苗10天后,每盆定苗10株,3个重复,每个重复30株。待植株培养40天后,将提前准备好的燕麦接种于植株地下1 cm 根颈处,每株接种2粒,不接菌的为对照。接种85 d后观察病害情况。根据病斑占根系面积的百分比进行病害分级。分级标准为:0级,无症状;1级,根部轻度变色,根部坏死面积在1%~30%;2级,根部严重变黑褐色,坏死面积在30%~60%;3级,主根基本坏死,侧根较少,坏死面积60%~100%。统计发病率(Disease incidence,DI)和病害严重指数(Disease severity index,DSI)。
DI(%)=(病株数/总株数)×100
DSI(%)= ∑(各级病株数×该级代表值)/(调查总株数×最重级别代表值)× 100
接种85 d后,切取5 mm×3 mm感病根组织,70%乙醇消毒1 min,无菌水漂洗3次后接种于PSA平板上进行分离和纯化,并采用上述形态学观察和分子鉴定的方法与最初的接种物进行比较和鉴定。
2 结果与分析
2.1 病原的分离纯化
分离具有代表性镰刀菌菌株6个,分别命名为C1,C2,C3,C4,C5和L1。其中河北廊坊分离的菌株为C1,内蒙古临河分离的菌株为C2和C3,山西高阳县的为C4,C5 和L1。
2.2 病原的形态学鉴定
C1,C2,C3,C4,C5和L1菌株根据在 PSA,MGA,VBC和SNA培养基上的形态特征,初步鉴定如下:
C1:PSA培养基上,气生菌丝丛卷毛状(图1-A),培养基底部为青黑红色,表面粉红至白色,随着生长天数的增加,变成棕色或红棕色;气生菌丝有隔,且具有侧生分枝(图1-E)。 在MGA培养基上呈白色絮状菌落(图1-B),不易产生小型分生孢子和大型分生孢子;SNA培养基上菌落不规则(图1-C),产生大量的小型分生孢子(图1-F),多呈长椭圆型,2.5~7.1 μm×1.7~3.5 μm;在VBC促孢培养基上,中心白色周围黄色的特殊菌落(图1-D),能产生大孢子(图1-G),镰状至弯曲、纺锤形,1端锐尖,多为3隔,17.0~30.6 μm×3.0~5.0 μm。
C2:PSA培养基上气生菌丝丛卷毛状,培养基底部为深黑红色,表面中心为黄棕色,向外为粉红色至白色(图2-A);在MGA培养基上呈白色絮状菌落(图2-B);菌丝少有隔,分支较多(图2-E);SNA培养基表面呈粉红色(图2-C),可产生大量的小型分生孢子(图2-F),小孢子长椭圆形或倒卵形,2.5~6.8 μm×1.7~3.2 μm,培养14天后可观察到串生的厚垣孢子,球形或椭圆形(图2-H);在VBC培养基上呈桃红色(图2-D),该培养基上大孢子稍弯曲或梨形,多为1隔(图2-G),17.4~29.8 μm×3.5~5.0 μm。
C3:PSA培养基基部灰蓝色至无色,周围为白色,气生菌丝绒毛状(图3-A),表面有明显的环状纹,气生菌丝少隔,单轴分支(图3-E);MGA培养基为白色菌落,棉絮状(图3-B);在VBC培养基上呈白色菌落(图3-D),产生的大型分生孢子两端较钝圆,镰状或棒状,1~3隔,16.4 ~30.7 μm × 3.2~4.8 μm(图3-G);SNA培养基上菌落为白色,气生菌丝稀疏(图3-C),小型分生孢子长椭圆形或肾形,2.5~8.2 μm × 1.8~2.9 μm(图 3-F)。
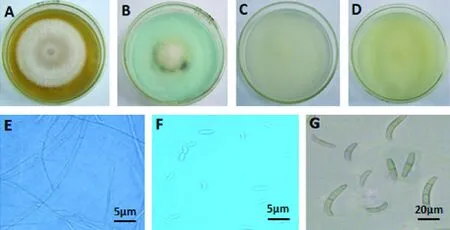
图3 菌株C3的形态特征Fig.3 The morphological characteristics of strain C3
C4:PSA培养基菌落为白色,气生菌丝较稀疏(图4-A),菌丝有隔,单轴分支(图4-E); MGA培养基上生长较慢,呈白色菌落(图4-B);VBC培养基上呈不规则的白色菌落(图4-D),大型分生孢子短而粗,肾形或棒状(图4-G),两端较钝圆,1隔,17.4~34.7 μm×3.2~5.8 μm;SNA培养基上表现为白色絮状菌落(图4-C),小型分生孢子长椭圆形、卵形,3.1~8.0 μm×1.6~3.8 μm(图 4-F)。
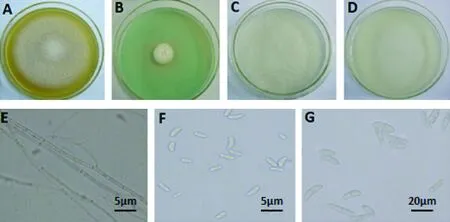
图4 菌株C4的形态特征Fig.4 The morphological characteristics of strain C4
C5:PSA培养基上菌落呈白色,菌落基部培养基呈无色或乳黄色,气生菌丝稀疏(图5-A);菌丝多隔(图5-E);MGA培养基上呈白色絮状菌落(图5-B);在VBC培养基上呈白色稀疏菌落(图5-D),大型分生孢子镰状(图5-G),1隔,14.4~25.7×3.4~5.5 μm;SNA培养基上呈白色菌落(图5-C),产生的小型分生孢子椭圆形、卵形,大小差异较大,2.0~7.2 μm×1.6~3.8 μm(图5-F)。
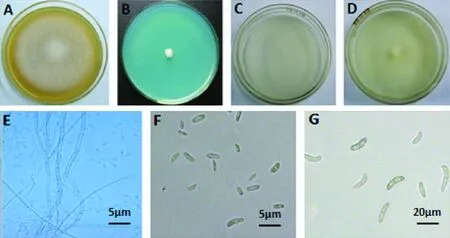
图5 菌株C5的形态特征Fig.5 The morphological characteristics of strain C5
L1:PSA培养基上气生菌丝白色,绒毛状,边缘整齐(图6-A),菌落培养后期中央基部白色变为紫灰色;MGA培养基上白色菌落(图6-B);SNA培养基上菌落为白色(图6-C),产生的小型分生孢子无隔、棒状、少数梨形,2.0~7.5×1.0~2.5 μm(图6-F);菌丝有隔和分支(图6-E);VBC培养基上菌落为白色(图 6-D),大型分生孢子微弯,镰刀形,2~5个隔膜(图6-G),20~36.3×3.8~5.0 μm,以单瓶梗或复瓶梗假头状产孢(图6-H)。
2.4 镰刀菌的分子生物学鉴定
2.4.1分离镰刀菌菌株rDNA-ITS和TEF-1α片段的克隆 6个菌株的rDNA-ITS序列大约为560 bp (图 7-A),TEF-1α序列大小约为 700 bp (图7-B)。将扩增产物纯化后连接到T载体,经抗性筛选和菌液PCR鉴定(图7-C,D),将阳性单克隆送交上海英俊生物公司测序。
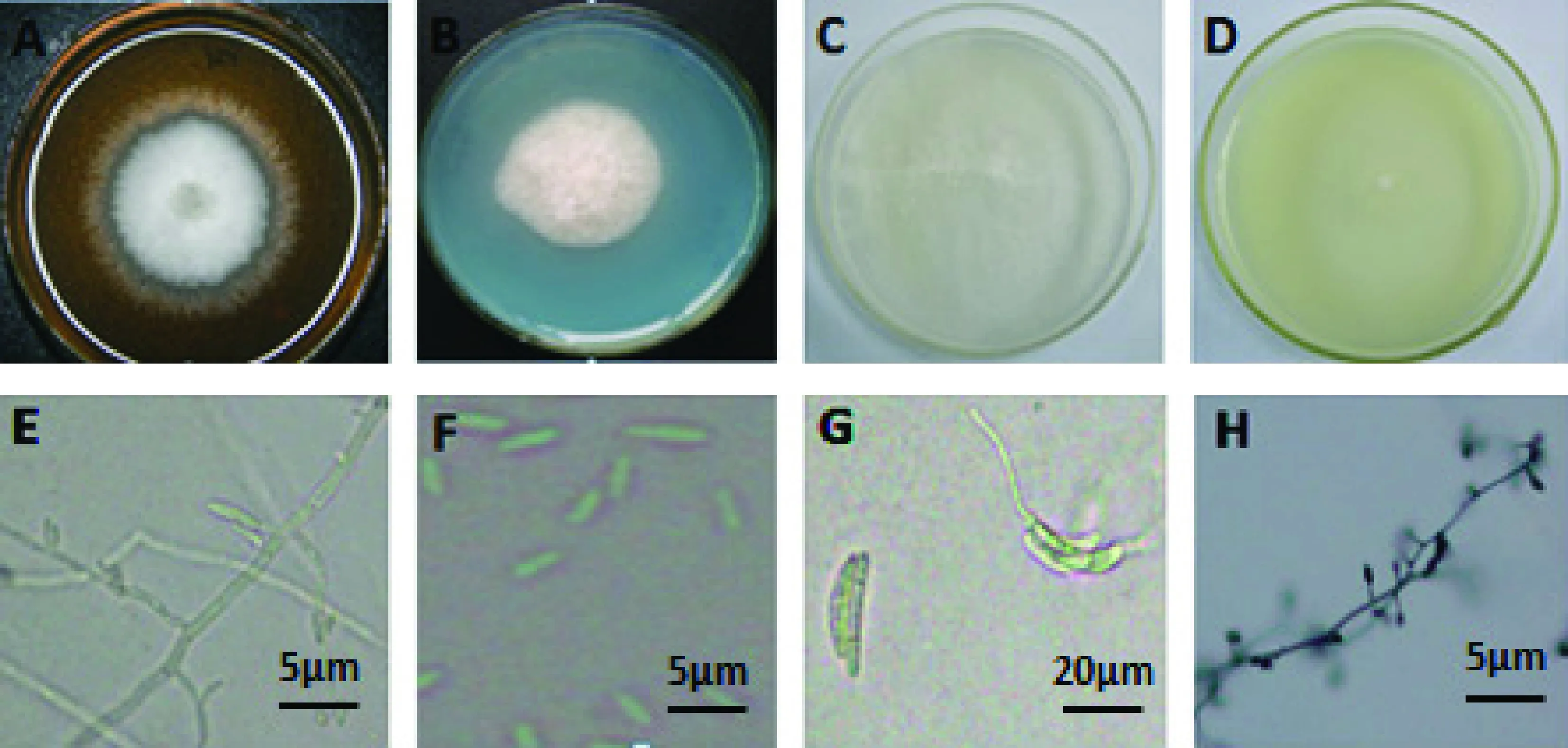
图6 菌株L1的形态特征Fig.6 The morphological characteristics of strain L1
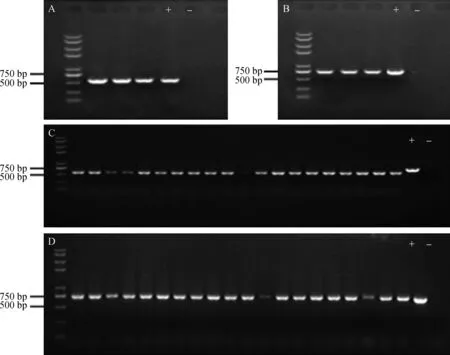
图7 菌株rDNA-ITS片段和 TEF-1α片段的PCR扩增图谱及菌液PCR鉴定图谱 Fig. 7 Agarose gel electrophoretic analysis of rDNA-ITS and TEF-1α fragments
2.4.2rDNA-ITS和TEF-1α序列比对及分析 测序结果显示,菌株间的rDNA-ITS和TEF-1α序列均有不同程度的变异。将序列提交到GenBank,登录号见表1。所获得的序列在NCBI和镰刀菌Fusarium-ID数据库进行比对,结果如表1所示,每个株系的rDNA-ITS区序列和TEF-1α序列的同源性均在99% ~100%之间,而且每个株系两种序列的比对结果均为同一镰刀菌种,进一步证明了分离纯化的纯度高和鉴定结果的可靠。
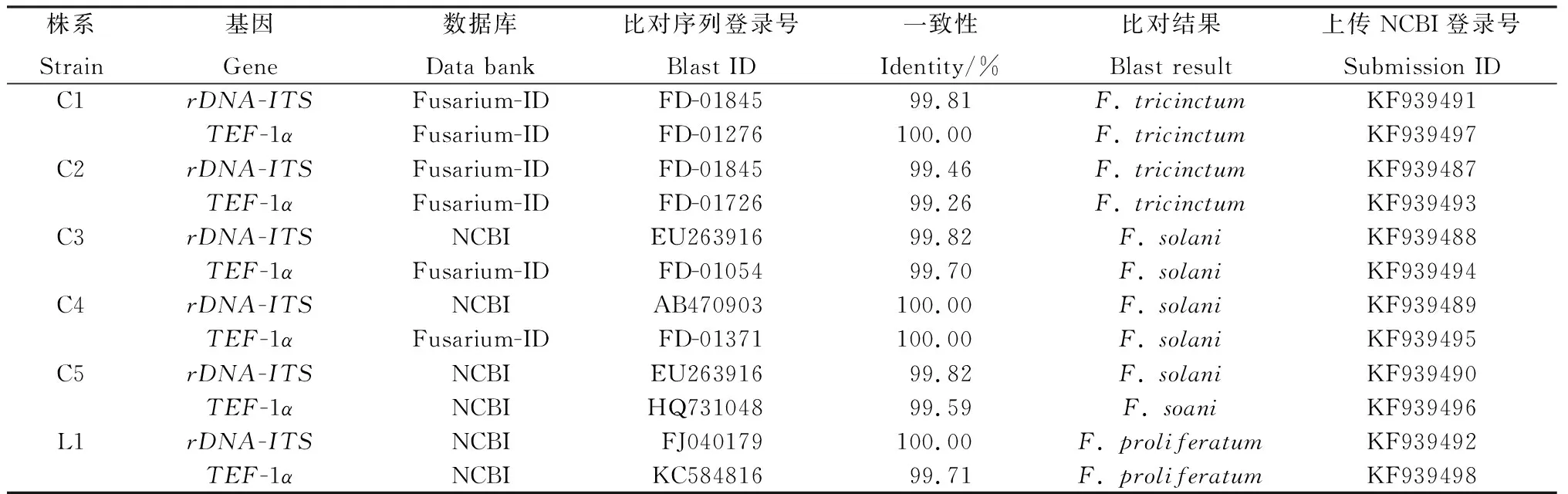
表1 rDNA-ITS 和 TEF-1α 序列比对及鉴定结果Table 1 Blast and identification results of rDNA-ITS and TEF-1α
2.5 系统发育树的构建
2.5.1基于rDNA-ITS区序列构建系统发育树 在基于rDNA-ITS序列构建的系统发育树中(图8),C1与C2菌株与NCBI和Fusarium-ID数据库中的三线镰刀菌(FJ233196,FD-01845,FD-01726)相聚于同一群,自举值大于90%;C3,C4和C5与已上传的腐皮镰刀菌(AB470903,EU263916)聚为一类,其中C3与C5亲缘关系较近;L1与层出镰刀菌(FJ040179)聚一类,而与其他菌种距离较远。
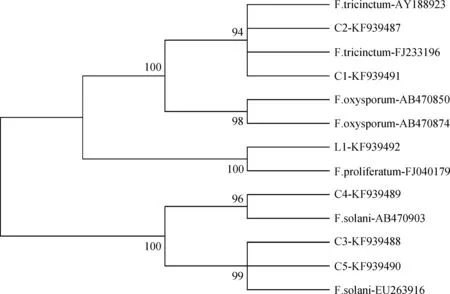
图8 基于rDNA-ITS区序列构建的系统发育树Fig.8 Phylogenetic tree constructed with the program Neighbor-Joining(NJ)based on rDNA-ITS sequences
2.5.2基于TEF-1α区序列构建系统发育树 基于转录延伸因子TEF-1α序列构建的进化树中(图9),聚类结果与以rDNA-ITS序列构建的进化树结果相似。C1和C2与NCBI(JX3978650.1,JX397855.1)和Fusarium-ID(FD-01726- EF-1α)数据库的三线镰刀菌聚为一类;菌株C3,C4和C5与数据库中已上传的腐皮镰刀菌(FD-01371-EF-1α,FD-01054-EF-1α,HQ731048.1)聚为一类;L1单独与层出镰刀菌(KC584816.1)聚为一类。
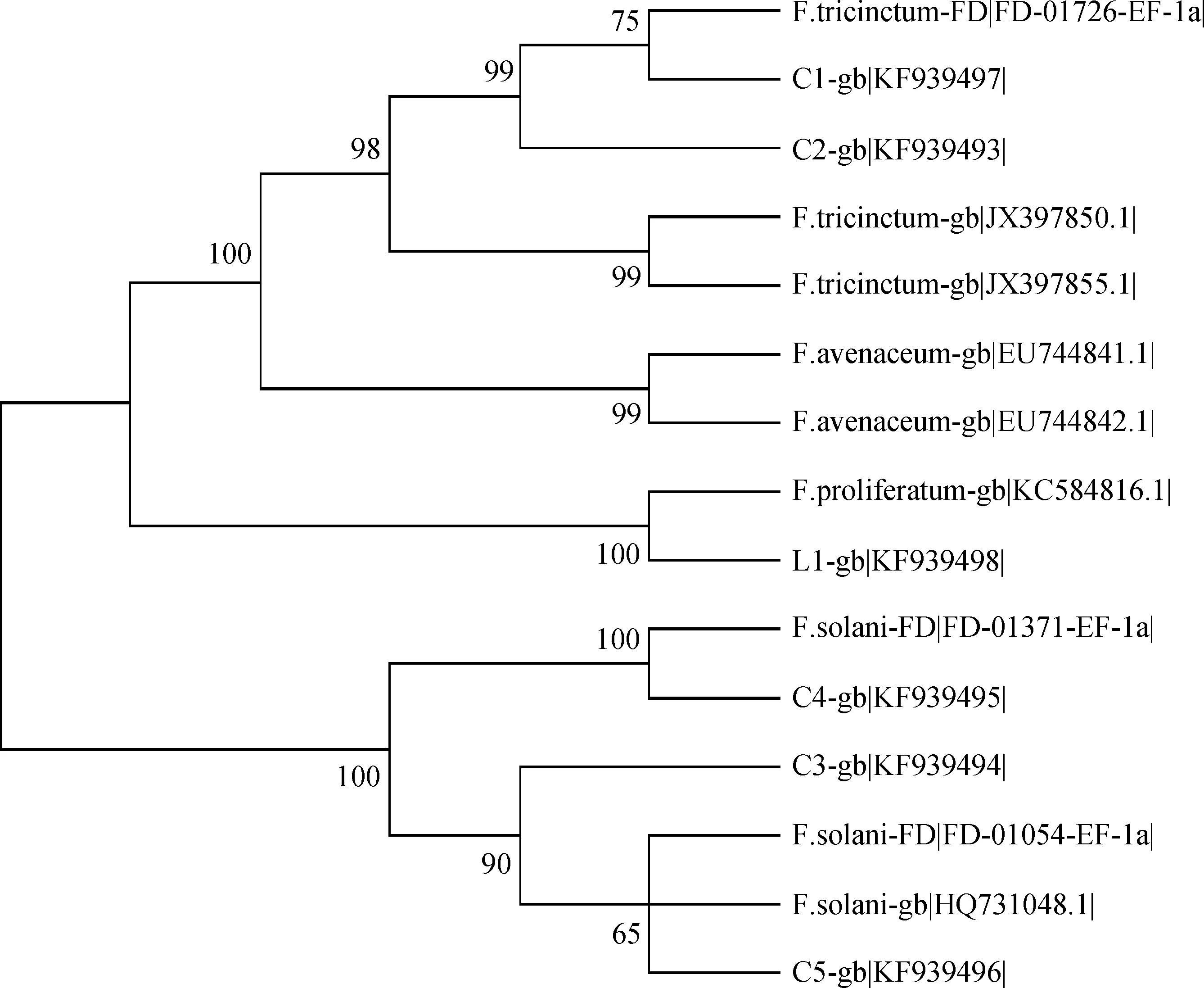
图9 根据TEF-1α序列应用邻接法(NJ)构建的系统发育树Fig.9 Phylogenetic tree constructed with the program Neighbor-Joining(NJ)based on TEF-1α sequences
2.6 不同病原分离物的致病性分析
通过回接试验,发病植株症状表现与田间的症状基本一致,经过形态观察与分子鉴定确定从发病植株分离得到的镰刀菌与用于接种的镰刀菌相同,表明这6株镰刀菌是苜蓿根腐病的致病菌。6个菌株的致病性有差异(表2),其中L1 菌株和C4菌株的致病性较强,发病率均大于80%,病害严重指数均约为60%。C2 株系致病性最弱(DI 54.44%,DSI 29.63%)。 C1、C3和C5 菌株的发病率和致病性均无显著差异,发病率分别为66.66%,62.22%和65.55%;病害严重指数分别为42.59%,40.37%和38.89%。

表2 不同病原分离物的致病性Table 2 Variation in virulence among isolates of Fusarium spp.
3 讨论
镰刀菌是真菌中最难鉴定和最具经济价值的属之一,其形态复杂,又易受外界环境影响发生变异,通过形态学观察很难准确鉴定到种。本研究在形态学鉴定的基础上, 采用了rDNA-ITS和TEF-1α两个基因进行分子生物学鉴定。其中rDNA-ITS是介于18S rDNA、5.8S rDNA 和28S rDNA 之间的区域,该区域进化速度较编码区快,被普遍用来进行真菌种间或种内的遗传相似性的分子系统研究[22-24]。而TEF-1α在镰刀菌中为单一拷贝,在种内表现较高的保守性,TEF-1a已经成为镰刀菌鉴定的有效工具。目前,已经通过该序列鉴定出禾谷镰刀菌(F.graminearum)[22]、层出镰刀菌[25]、串珠镰刀菌(F.moniliforme)[22]、尖孢镰刀菌(F.oxysporum)[26]等多个镰刀菌种。因此,利用rDNA-ITS和TEF-1α序列对镰刀菌种的鉴定,是对形态学鉴定的验证和补充,避免因种间的高度相近带来的鉴定错误。
通过了致病性鉴定试验,明确了各菌株的致病性,特别是层出镰刀菌株表现了高的致病能力。在之前的研究报道中,层出镰刀菌多认为是弱致病菌,近几年,层出镰刀菌的致病性报道的越来越多,如引起番茄(Solanumlycopersicum)、豇豆 (Vignaunguiculata) 和蓝莓 (SemenTrigonellae) 等植物的根部病害或叶部病害[27-29]。由此可见,不同层出镰刀菌的株系或寄主都有可能影响其治病能力。
4 结论
根据形态学和分子生物学共同鉴定结果,C1和C2为三线镰刀菌的不同变异种,C3、C4和C5为腐皮镰刀菌的不同变异种,L1为层出镰刀菌;河北廊坊苜蓿根腐病优势致病菌为三线镰刀菌;内蒙古临河采样区该病害优势致病菌为三线镰刀菌和腐皮镰刀菌、山西阳高县采样区的优势致病菌为腐皮镰刀菌和层出镰刀菌。其中,层出镰刀菌是首次报道可引起我国苜蓿根腐病的病原菌。
