刈割高度对粮饲兼用小麦抗逆性及保护性酶活性的影响
2017-09-13王玉平杨景宁王丹丹张小明沈禹颖
王玉平, 杨景宁, 王丹丹, 杨 倩, 张小明, 沈禹颖
(兰州大学草地农业科技学院 草地农业生态系统国家重点实验室 草业科学国家级实验教学示范中心(兰州大学), 甘肃 兰州 730020)
籽粒作物在营养生长期刈牧利用、成熟后收获籽粒的利用方式称之为粮饲兼用(dual-purpose),已在美国、加拿大和澳大利亚等国推广应用,是利用作物生长冗余释放、粮草兼顾、提高农户收益的举措[1-4]。已有研究表明刈牧后植物光合器官受损,可溶性糖在植株内的积累与分布及酶代谢活性随之改变,如刈牧强度影响长芒草(Stipabungeana)、牛枝子(Lespedezapotanimii)和糙隐子草(leistogenessquarrosa)的可溶性糖含量[5];随着刈割次数的增加,沙葱(AlliummongolicumRegel)可溶性糖含量降低,可溶性蛋白含量增加[6],多次刈割后苜蓿(MedicagosativaL.)根系过氧化物酶(POD)、超氧化物歧化酶(SOD)等保护性酶活性降低[7]。可溶性糖、可溶性蛋白通过调节渗透浓度来启动脱落酸的形成,诱发蛋白质的合成,提高小麦苗期的抗逆性[8]。POD和SOD对提高植物抗寒性有重要作用[8-9],亦是植物抗逆性的鉴定指标[9-10]。实践中冬小麦刈牧主要发生在冬春时节,刈牧后的冬小麦恢复生长能力与其抗逆性相关,因此,探究刈割高度对冬小麦可溶性糖、可溶性蛋白积累及保护性酶活性的影响,理解刈牧后冬小麦的生理代谢规律,可为制定适宜的冬小麦粮饲兼用管理措施提供理论指导。
1 材料与方法
1.1 试验材料
参试材料为甘肃庆阳适用冬小麦‘陇育4号’(Triticumaestivum.‘LY 4’)。温室试验于2014年在兰州大学榆中校区智能温室进行,日间温度25~30℃,夜间温度15~20℃,每天光照时间10~12 h。采用水培法培养,选取大小均一,饱满无破损的‘陇育4号’种子,2%次氯酸钠消毒5 min,转入蒸馏水中浸泡12 h,置于22℃恒温培养箱中催芽24 h后,于4℃中春化30 d,接着在25℃恒温环境下催芽,待胚芽3~5 cm时,移栽至栽培容器(长20 cm,宽15 cm,高20 cm)中。培养期间每盆盛3 L 1/2浓度Hoagland营养液,留苗10株,培养至5~6个分蘖期时进行刈割处理。
1.2 试验设计与处理
设2个刈割高度处理,分别为留茬6 cm(RE-6)和留茬3 cm(RE-3),以不刈割作为对照(CK),每个处理重复40 盆。
1.3 取样与测定
1.3.1植株生物量测定 分别于刈割后第8,12,16,20 d取样,采用破坏性取样法取样,每次每个处理各取4盆。取样后清洗植株各部位,茎、叶、根分离,鲜样 (105℃下杀青10 min)称重后,65℃烘至恒重,称重。
1.3.2生理生化指标测定 于生物量测定同期取样,每次每个处理取4盆,取样后将植株分为茎、叶、根3部分,于-70℃保存,测定时,称取待测小麦鲜样0.5 g,加6 mL PVP和少量的石英砂,冰浴研磨成匀浆,在4℃、8 000 r·min-1下离心15 min,取上清液即酶浸提液,进行各指标测定。可溶性糖含量采用蒽酮法测定;可溶性蛋白含量采用考马斯亮蓝法测定;SOD用氮蓝四唑(NBT)法测定;POD活性采用愈创木酚法测定[11]。
1.4 数据分析
采用GenStat(Edition17)软件进行统计分析,F测验检验处理效应,用LSD法比较刈割处理下的平均数差异(P=0.05)。
2 结果与分析
2.1 刈割高度对植株各部位干物质积累和分配的影响
刈后20 d内各部位干物质均未超过对照。刈后16, 20 d,RE-6处理下茎干物质分别较对照显著降低48%和31% (P<0.05)(图1a),叶干物质分别较对照显著下降49%和35%(P<0.05)(图1b),根干物质分别较对照显著下降18%和41%(P<0.05)(图1c),RE-3下茎干物质分别较对照显著降低73%和53%(P<0.05)(图1a),叶干物质分别较对照显著下降57%和53(P<0.05)(图1b),根干物质分别较对照显著下降30%和51%(P<0.05)(图1c)。2个刈割处理下各部位干物质分配占比也发生了变化,刈后第8 d,RE-6和 RE-3茎干物质占比较对照分别提高8%和6%,刈后12 d,RE-6和 RE-3叶片干物质分配分别较对照明显下降14%和19%,刈后16~20 d,叶片干物质逐渐恢复,根干物质分配在刈后第8~16 d均高于对照,刈后20 d,根干物质分配与对照无明显差异(图2)。
2.2 刈割高度对植株各部位干物质生长速率的影响
刈后20 d内,‘陇育4号’地上部干物质平均积累速率随着刈割留茬高度的增加而降低(表1),其中,茎干物质积累速率随刈后天数的推后而增加,刈后16~20 d均高于对照。叶干物质积累速率在刈后第12~16 d高于对照。根干物质积累速率在2个刈割处理下均高于对照,RE-3处理仅在16~20 d低于对照。
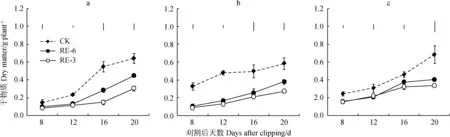
图1 刈后20 d内冬小麦茎(a)、叶(b)、根(c)干物质积累动态Fig.1 Dry matter dynamics of stem (a), leaf (b) and root (c) within 20 days after clipping
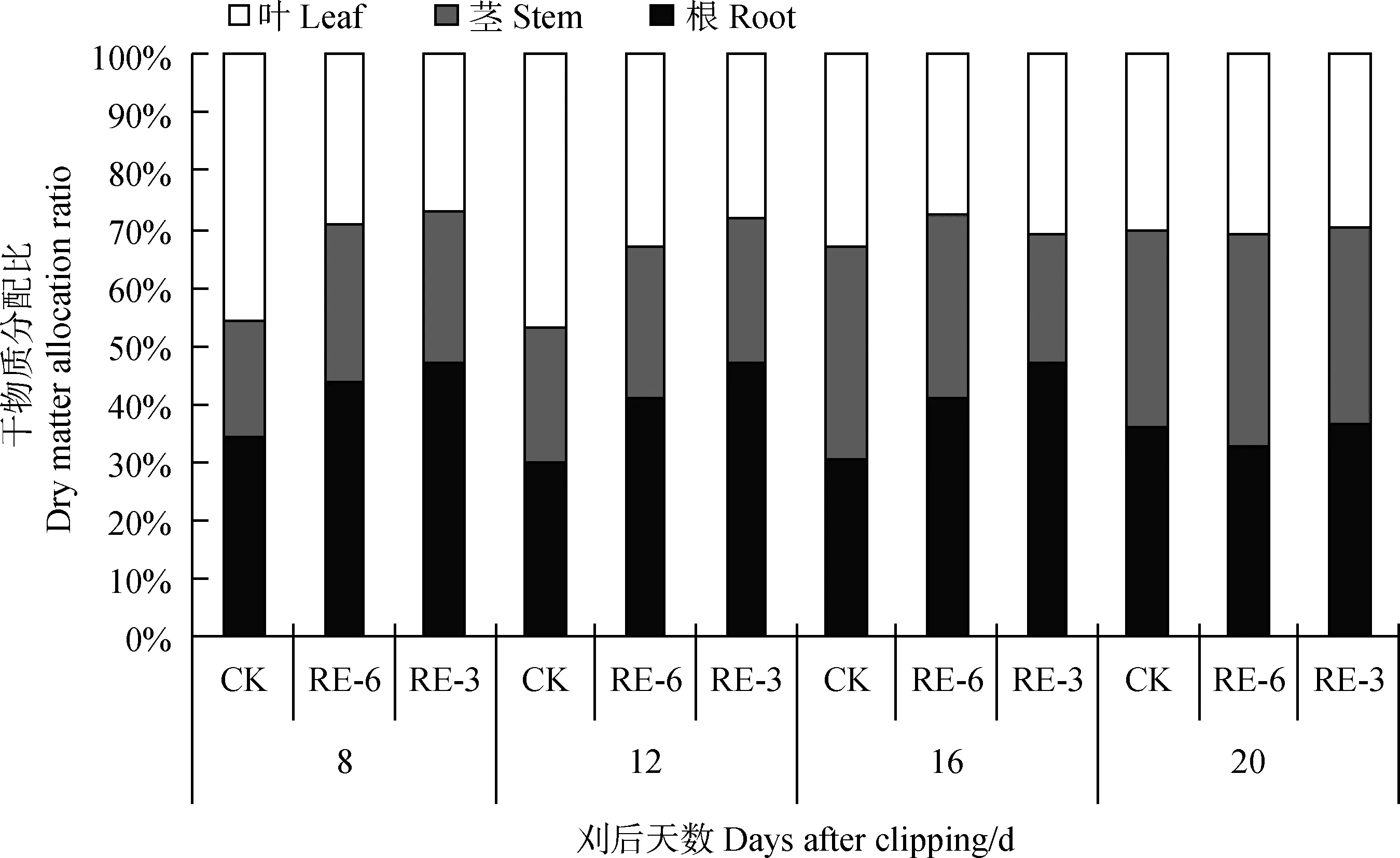
图2 刈后20 d内冬小麦植株各部位干物质分配比Fig.2 Dry matter allocation ratio of winter wheat within 20 days after clipping
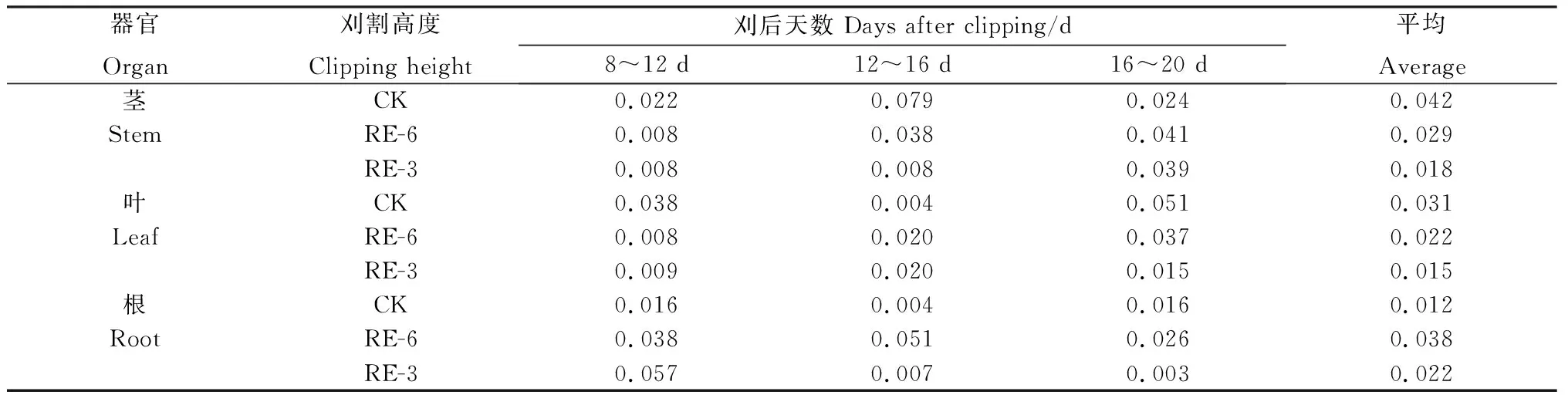
表1 刈后20 d内冬小麦各部位生长速率Table 1 Growing rates of winter wheat within 20 days after clipping/g·plant-1 ·d-1
2.3 刈割高度对植株各部位可溶性糖含量的影响
刈割降低了‘陇育4号’各器官可溶性糖含量(P<0.05)。刈后第20 d,RE-6和RE-3处理茎可溶性糖含量分别较对照显著减少37%和 43%(P<0.05)(图3a),叶可溶性糖含量分别较对照显著下降52%和39%(P<0.05)(图3b)。刈后20 d内,根可溶性糖含量随时间均呈增加趋势,且RE-6、RE-3根可溶性糖含量较对照显著减少26%和49%(P<0.05)(图3c)。
刈割后,‘陇育4号’各器官的可溶性糖平均积累速率均低于对照(表2)。刈后20 d内,各处理下茎可溶性糖积累速率均先上升后降低,RE-6和RE-3处理下茎可溶性糖平均积累速率分别较对照降低69%和86%;叶可溶性糖积累速率分别在刈后16~20 d,8~12 d低于对照,在刈后第12~16 d高于对照。RE-6和RE-3处理下根可溶性糖含量平均积累速率分别比对照低56%和73%。
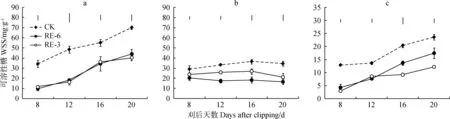
图3 刈后20 d冬小麦茎(a)、叶(b)、根(c)可溶性糖含量动态Fig.3 Water soluble carbohydrate of stem (a), leaf (b) and root (c) of winter wheat within 20 days after clipping
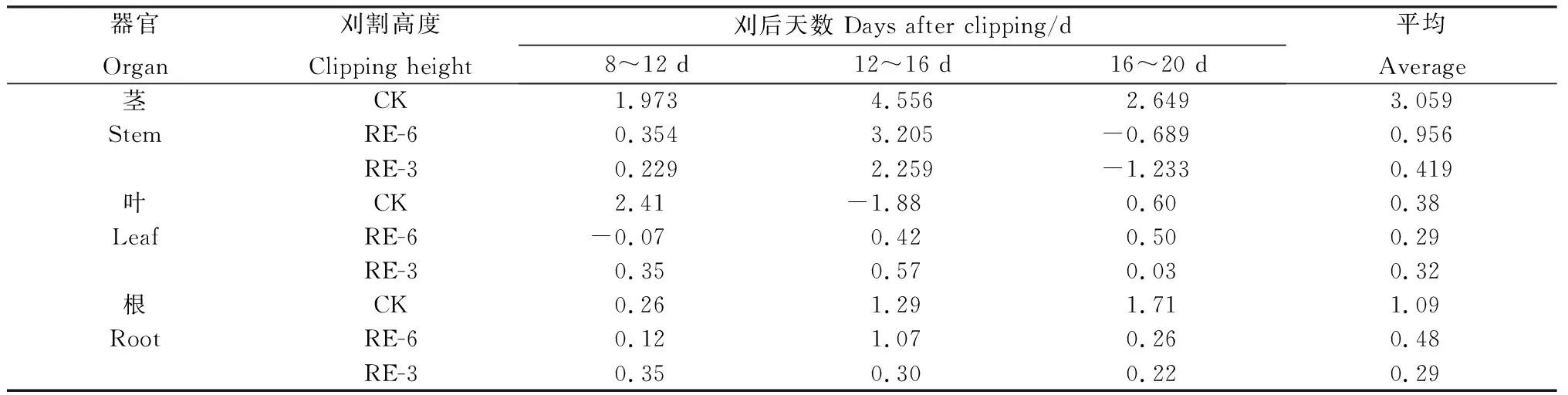
表2 刈后20 d冬小麦各部位可溶性糖积累速率动态/mg·plant-1·d-1Table 2 Dynamics of growing rates of water soluble carbohydrate of winter wheat within 20 days after clipping
2.4 刈割高度对植株各部位可溶性蛋白含量的影响
刈后20 d内,‘陇育4号’各处理下茎可溶性蛋白含量无明显变化,且RE-6、RE-3茎可溶性蛋白含量与对照无显著性差异(图4a)。刈后第8 d,刈割处理叶可溶性蛋白含量与对照无显著性差异,刈后第12 d各处理下叶可溶性蛋白达到最大值,RE-6和RE-3分别较对照显著提高16%和18%,至第20 d提高23%和25%(P<0.05)(图4b)。各处理下根可溶性蛋白含量在刈后20 d内均无显著差异(图4c)。
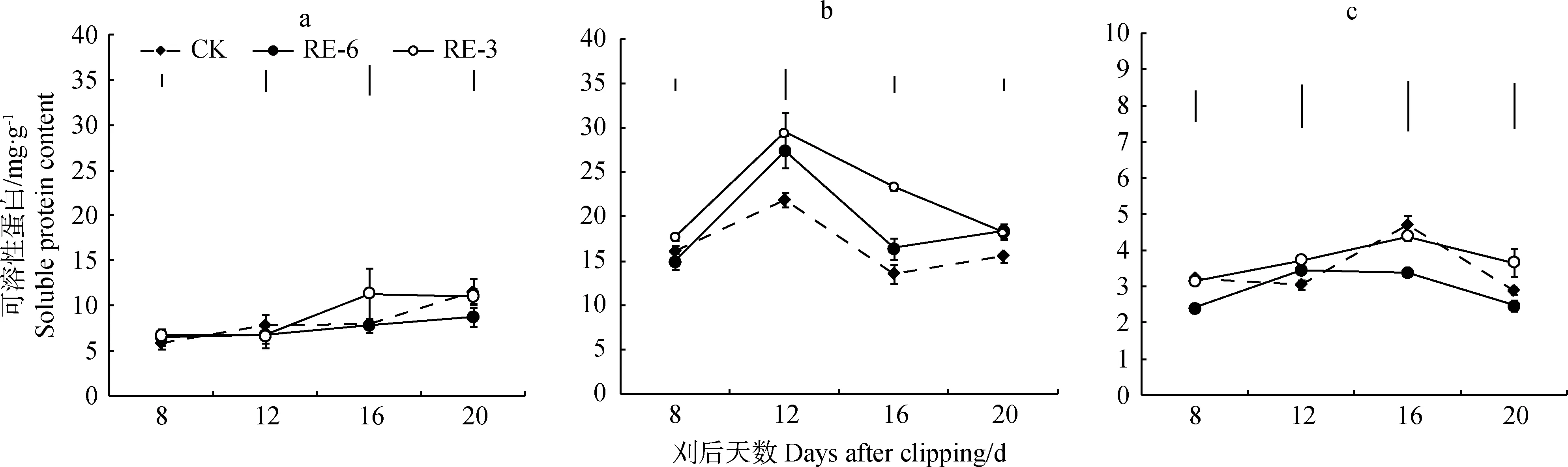
图4 刈后20 d内冬小麦茎(a) ,叶(b) ,根(c)可溶性蛋白含量Fig.4 Soluble protein content of stem (a), leaf (b) and root (c) of winter wheat after clipping
2.5 刈割高度对植株各部位保护性酶活性的影响
刈割处理下,茎、叶POD活性较对照均有所提高,刈后第8 d ,茎POD活性较对照显著提高30%,但刈割处理下茎、叶POD活性与对照间差异逐渐缩小(图5a,5b)。RE-3下根POD活性在刈后第12 d比对照显著低54%,至刈后第20 d与对照无显著差异(图5c)。
刈割处理20 d内, RE-6处理下茎和叶SOD活性与对照相比无显著差异,RE-3处理下茎和叶片SOD活性高于对照10%和18%~30%。6 cm留茬下根系SOD活性恢复早于3 cm留茬,在刈后20 d 高于对照(图6c)。刈割不同程度提高了冬小麦地上部POD、SOD活性,降低了地下部POD活性。
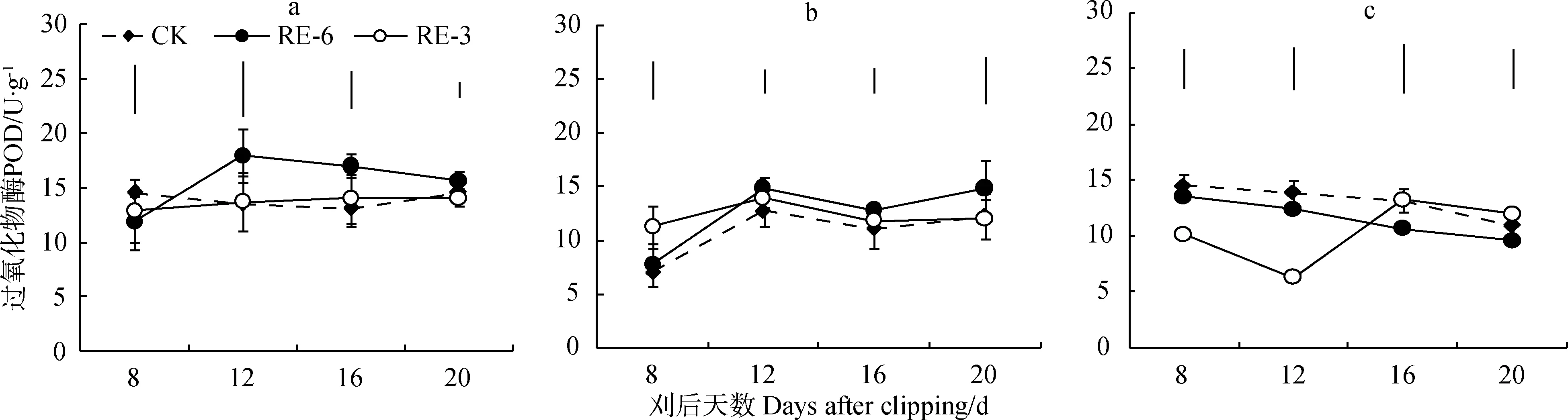
图5 刈后20 d内冬小麦茎(a)、叶(b)、根(c)POD动态Fig.5 Dynamics of POD activity of stem (a), leaf (b) and root (c) of winter wheat within 20 days after clipping
图6 刈后20 d冬小麦茎(a)、叶(b)、根(c)SOD活性动态Fig.6 Dynamics of SOD activity of stem (a), leaf (b) and root (c) of winter wheat within 20 days after clipping
3 讨论
3.1 刈割高度对冬小麦干物质积累和分配的影响
刈牧是草地主要利用方式,适度刈牧是草地合理管理的环节[12-14]。刈割后植物地上干物质损失,各器官资源分配格局发生变化,将光合产物优先分配给茎部,以提高对光的截获量,从而提高再生速率,尽快恢复冠层光合能力[15]。本研究发现,刈后20 d内,‘陇育4号’茎、叶、根各器官干物质量均随刈割留茬高度的降低而降低,短期内再生冬小麦干物质量随刈割留茬高度的降低而降低[16],春小麦于苗期、分蘖期刈割后40 d内干物质量始终低于对照[17],未在短时间内实现补偿生长。轻度刈割下冷蒿(Artemisiafrigida)和伊犁绢蒿(Seriphidiumtransiliense)干物质均较重度刈割下高[15,18],‘陇育4号’地上部干物质平均积累速率随着刈割强度的增加而降低,但地下部分干物质平均积累速率均高于对照,说明刈割下冬小麦根系生长速率增加,以获取养分供给地上部分保证恢复生长。
3.2 刈割高度对植株可溶性糖和可溶性蛋白的影响
可溶性糖与可溶性蛋白是植物细胞内重要的渗透调节物质[8],通过调整细胞渗透压维持细胞膜完整性,进而保证叶片的光合作用。可溶性糖又是植株再生的重要物质和能量来源[19-20]。刈割后植物大量绿色部分突然被移除,同化产物的积累低于异化作用引起的消耗,使可溶性糖等储存物质含量降低[13],轻牧下冷蒿、羊草地上部可溶性糖含量较不刈割对照提高[21-22],燕麦茎部可溶性糖含量在移去1/4叶片时高于对照,移去3/4时则显著低于对照[23],本研究中,2个刈割高度下‘陇育4号’各器官可溶性糖含量均较对照显著降低,尤其是茎干部下降明显,说明刈割后20天的再生过程,以消耗茎部可溶性糖为主,叶片可溶性糖含量平稳,而茎和根可溶性糖含量逐渐升高,说明在叶片受损情况下,植物以活化根系及茎储存的可溶性糖来保证植物的正常生长[24]。
可溶性蛋白含量的变化可反映植物遭受环境胁迫的状态和程度[25-26],同时可溶性蛋白有较强亲水性,有利于植物保持更多的水分,使原生质在遭受低温冻害时减少因结冰致死的机会,从而提高抗寒性[27]。刈割促进了叶片可溶性蛋白积累,对茎、根可溶性蛋白含量无明显影响,燕麦、油菜和羊草刈牧后有同样规律21,23,28],频繁刈割抑制了沙葱根系可溶性蛋白的积累[6],这是由于刈割损伤光合器官,刺激了抗逆反应,可溶性蛋白含量增加。伊犁绢蒿可溶蛋白含量不受刈割处理的影响[18],这可能是由于植物种类不同,可溶性蛋白对逆境伤害的响应不同而导致。
3.3 刈割高度对植株保护性酶活性的影响
SOD和POD是植物体内重要的抗氧化酶,分别清除超氧阴离子自由基、羟自由基,可称为自由基清除酶[29],逆境胁迫下,植株保持较高的抗氧化酶类活性可以提高抗逆性[30]。抗氧化物酶活性的高低也可以在一定程度上能够反映植物抗寒性[29,31]。前人研究发现,刈割次数和不同的刈割时间均会影响植物保护性酶活性[7,32]。本研究中‘陇育4号’地上部POD和SOD活性在不同刈割强度下有不同程度的增加,但保护性酶活性对刈割强度的响应不尽一致,其中RE-6下POD活性最高,RE-3下SOD活性最高,根系POD、SOD活性与对照差异不明显。因为刈割后植株地上部受到直接伤害,刺激其保护性酶活性升高以保证植株正常生长,而地下部应激反应则相对滞后。并且有研究表明,小麦在逆境胁迫下POD、SOD活性升高[8-10],说明逆境胁迫确实可以促进小麦的保护性酶活性。当然也有研究表明紫花苜蓿刈割后根系POD、SOD活性均下降[7],这可能是因为禾本科植物和豆科植物对于刈割的响应有所差异。
4 结论
刈割后,冬小麦‘陇育4号’各部位干物质量随留茬高度的降低而降低,植株通过调动茎部和根部可溶性糖保障再生生长,刈割留茬3 cm和6 cm处理下地上部可溶性蛋白含量和保护性酶活性表现出补偿效应,抗逆性增加,为植株安全越冬及后期生长提供了物质保障,是刈割后冬小麦恢复生长的生理生态机制。
