哺乳动物促卵泡素氨基酸序列特征及其单克隆抗体的制备与鉴定
2017-09-13李红飞王海花李德印叶晓敏米俊宪
李红飞,王 军,王海花,李德印,叶晓敏,米俊宪
(河南牧业经济学院 动物医学院,河南 郑州 450046)
哺乳动物促卵泡素氨基酸序列特征及其单克隆抗体的制备与鉴定
李红飞,王 军,王海花,李德印,叶晓敏,米俊宪
(河南牧业经济学院 动物医学院,河南 郑州 450046)
为制备哺乳动物促卵泡素(FSH)单克隆抗体,比对了人类、家畜、部分野生动物、鼠类等哺乳动物FSH氨基酸序列,分析其种间同源性,结果发现,多种哺乳动物FSH β亚基氨基酸序列的同源性高于80%,且线性抗原表位高度保守。从奶牛垂体组织扩增FSH β亚基CDS片段,构建pET28a-FSH重组质粒,诱导表达FSH重组蛋白,免疫Balb/c小鼠,取免疫小鼠的脾细胞与SP2/0骨髓瘤细胞融合,间接ELISA法筛选阳性杂交瘤细胞孔,取效价最高孔进行克隆和亚克隆,获得1株能够分泌抗FSH的单克隆抗体细胞株,命名为B4A5。B4A5细胞株经过数次传代培养、反复冻融后生长状态良好,且能够稳定分泌抗体。采用细胞株体外培养和小鼠腹水诱生法均制备了抗FSH的单克隆抗体,其效价分别为1∶640、1∶106。分别采用Western blot和间接ELISA法鉴定单克隆抗体的结合特异性和交叉反应性,结果显示,制备的单克隆抗体与FSH反应呈阳性,与促黄体素(LH)、促甲状腺素(TSH)、促乳素(PRL)、人绒毛膜促性腺激素(hCG)均无交叉反应性。综上,获得了1株能够稳定分泌单克隆抗体的杂交瘤细胞株,其分泌的单克隆抗体可特异性结合FSH蛋白。
哺乳动物; 促卵泡素; 序列特征; 单克隆抗体
促卵泡素(follicle stimulating hormone,FSH)是一种糖蛋白类促性腺激素[1],由α亚基和β亚基以共价键形式连接,2个亚基均有糖基化位点,糖基以N-糖苷键方式与之连接[2]。研究表明,FSH广泛存在于人、牛、羊、马、猪、犬、猫、鹿、虎、大熊猫等多种哺乳动物和鸡、鸭、鹅等禽类及部分鱼类[3-4]。FSH由垂体前叶合成和分泌[5-6],通过血液循环作用于卵巢、睾丸等靶器官,能够促进母畜卵泡生长发育,刺激卵巢生长,增加卵巢质量[7];刺激公畜曲细精管上皮和次级精母细胞的发育,促进精子释放[8]。FSH分泌量不足或者不分泌,会引起母畜发情延迟甚至不发情,造成母畜不孕[9];可引起公畜性欲降低、精子数目减少、活性降低,造成公畜不育[10]。FSH分泌不足或缺乏是家畜不育的一个重要病因,能够造成家畜生产能力下降,经济效益降低。不育对野生保护动物繁育过程影响更大,能引起后代的数量减少、质量降低,严重者会造成种群灭绝[11-12]。因此,测定血液中FSH含量对于分析哺乳动物不育症的发病原因有重要的临床意义。而抗FSH的单克隆抗体可以用来测定血液中FSH含量,鉴于此,比对了常见哺乳动物FSH的氨基酸序列特征,表达其种间同源性高、抗原表位保守的区域,制备抗FSH的单克隆抗体,旨在为检测哺乳动物血液FSH含量及研究哺乳动物不育原因奠定基础。
1 材料和方法
1.1主要试剂和仪器
TRIZol试剂购自Invitrogen公司;M-MLV逆转录酶、Oligo d(T)引物、DNA聚合酶、DNA Marker、DNA胶回收试剂盒、pMD18-T载体、T4 DNA 连接酶、质粒抽提试剂盒、限制性内切酶XhoⅠ/EcoR Ⅰ、BCA蛋白质定量试剂盒、荧光标记的羊抗小鼠二抗均购自TaKaRa公司;蛋白质分子质量Marker购自Fermentas公司;His-Bind Resin树脂购自Merck公司;PEG4000、弗氏不完全佐剂(IFA)、弗氏完全佐剂(CFA)购自Sigma公司;FSH、促黄体素(LH)、促甲状腺素(TSH)、促乳素(PRL)粉剂(猪垂体组织提取物)和人绒毛膜促性腺激素(hCG)粉剂均购自宁波市第二激素厂。
PCR仪、高速低温台式离心机由Eppendorf公司生产;凝胶成像仪由GE公司生产;电泳仪、转印仪购自Bio-Rad公司;双色红外激光成像仪购自Odyssey公司。
1.2供试材料
体质量约20 g的雄性Balb/c小鼠、SP2/0骨髓瘤细胞购自郑州大学医学院;大肠杆菌感受态细胞DH5α、BL21(DE3)购自北京天根生化科技有限公司;pET28a(+)表达载体由河南牧业经济学院动物医学院中心实验室保存;奶牛垂体组织由河南牧业经济学院动物饲养基地提供。
1.3常见哺乳动物FSH氨基酸序列特征分析
通过NCBI分别查找了牛、人、猴、马、猪等常见哺乳动物FSH、LH、TSH等垂体激素α亚基的氨基酸序列,将同一物种的垂体激素α亚基和不同物种FSH的α亚基分别进行比对。通过NCBI分别查找牛、人、绵羊、山羊、马、猪、犬、梅花鹿、虎、大熊猫、麝鹿、家鼠、裸鼠、金仓鼠等哺乳动物的FSH β亚基氨基酸序列,分别比对人与部分家畜、牛与常见野生动物、牛与部分啮齿类动物的氨基酸序列,分析哺乳动物FSH β亚基种间氨基酸序列特征。同时应用线性抗原表位在线软件(http://www.cbs.dtu.dk/services/BepiPred/)预测FSH β亚基的线性抗原表位。
1.4奶牛垂体组织cDNA的制备
称取100 mg奶牛垂体组织,加入1.5 mL TRIZol试剂,用玻璃匀浆器研磨均匀。按TRIZol试剂说明进行操作,提取奶牛垂体组织总RNA。按照试剂使用说明,用M-MLV逆转录酶和Oligo d(T)引物进行反转录获得cDNA。
1.5FSH重组质粒的构建与表达
根据1.3比对结果,选择奶牛FSH β亚基氨基酸序列为原核表达的目的片段。根据GenBank中奶牛FSH β亚基的mRNA序列,除去编码信号肽的碱基,设计引物进行扩增,预计扩增长度为387 bp。引物序列为 F:5′-GTGAATTCAGCTGCGAGCTGACCAACATCA-3′;R:5′-GTCTCGAGATCTTGGATGTTTTGGTCCTTTA-3′。上、下游引物下划线部分分别为引入的EcoRⅠ和XhoⅠ限制性内切酶位点,引物由上海英俊生物工程有限公司合成。
取2 μL cDNA进行PCR扩增,反应条件为:95 ℃ 3 min;95 ℃ 45 s,60 ℃ 45 s,72 ℃ 1 min,共30个循环;72 ℃延伸10 min。将PCR产物纯化后与pET28a(+)载体分别进行EcoRⅠ/XhoⅠ双酶切后连接,将连接产物转化DH5α感受态细胞。挑选阳性克隆抽提质粒,分别用双酶切及测序法鉴定,将获得的重组质粒命名为pET28a-FSH。
将pET28a-FSH重组质粒转入BL21(DE3)感受态细胞,用0.8 mol/L IPTG进行诱导表达FSH重组蛋白,将收集菌液进行反复冻融、超声裂解,取上清和沉淀进行SDS-PAGE电泳。用His-Bind Resin树脂纯化FSH重组蛋白,BCA蛋白质定量检测试剂盒测定其质量浓度。
1.6FSH单克隆抗体的制备
1.6.1 免疫脾细胞的制备 用生理盐水将纯化的FSH重组蛋白质量浓度配制为1 mg/mL,与弗氏佐剂等体积混匀,背部皮下分点注射法免疫小鼠,剂量0.2 mL/只。首次免疫用弗氏完全佐剂,第2、3次加强免疫用弗氏不完全佐剂,每次免疫间隔2周。于第3次加强免疫后第7天,眼眶静脉丛采血,分离血清,间接ELISA法测定抗体效价。
间接ELISA条件:包被抗原工作质量浓度为10 μg/mL,包被液为pH值9.6、浓度为0.05 mol/L的碳酸盐缓冲液,37 ℃条件下反应2 h;封闭液为1.0%的脱脂奶粉,37 ℃条件下封闭1 h;荧光标记的羊抗小鼠二抗按1︰1 200稀释。
1.6.2 细胞融合及筛选 收集小鼠腹腔细胞,作为饲养层细胞。选择抗体效价高的小鼠,处死后取脾细胞。取处于对数生长期的SP2/0骨髓瘤细胞,与脾细胞融合,融合剂为PEG4000,脾细胞和骨髓瘤细胞的量分别为1×107个和2×106~5×106个。将融合后的细胞悬液加入到铺有饲养细胞的96孔板中,每孔加入0.1 mL进行培养。
每3 d半量换液1次,第12天时吸取少量上清液,用间接ELISA法进行筛选,以10 μg/mL FSH重组蛋白为包被抗原。同时以SP2/0骨髓瘤细胞培养上清液为阴性对照,筛选阳性孔。
1.6.3 杂交瘤细胞克隆及稳定性检测 取1.6.2筛选的效价最高的阳性孔,采用有限稀释法克隆杂交瘤细胞。将克隆成功的杂交瘤细胞连续扩大培养20代,每5代测1次上清效价。将杂交瘤细胞冻存,分别于30、180 d后复苏,扩大培养后检测其效价。
1.6.4 单克隆抗体体外制备 将杂交瘤细胞置于培养瓶中,扩大培养。在培养过程中逐渐降低培养基中血清含量,当细胞铺满整个瓶底时停止换液,继续培养至细胞全部死亡。收集上清液,采用间接ELISA法测定其效价。
1.6.5 单克隆抗体腹水制备 接种杂交瘤细胞前7 d,选择体格健壮的小鼠,腹腔注射无菌石蜡油,0.5 mL/只。取对数生长期的杂交瘤细胞,用基础培养液将其稀释为2×106个/mL,将细胞悬液注入小鼠腹腔,0.5 mL/只。
当小鼠腹部明显隆起,触之有波动感,并出现精神、饮食变差时,收集腹水。4 ℃、3 000 r/min离心20 min,弃去上层石蜡油,收集中间微黄色、透明腹水,采用间接ELISA法测定其效价。
1.6.6 单克隆抗体结合特异性分析 将FSH粉剂用生理盐水适量稀释后进行SDS-PAGE电泳(蛋白质用量为20 μg/孔)。电泳结束后按常规方法将蛋白质转移到NC膜,漂洗,封闭;以含有抗FSH的单克隆抗体的杂交瘤细胞上清液为一抗,孵育、漂洗;加入 1∶2 000稀释的荧光标记的羊抗小鼠二抗孵育、漂洗,红外荧光扫描成像系统分析显色结果。设置阴性对照,以SP2/0骨髓瘤细胞培养上清液为一抗,操作过程相同。
1.6.7 单克隆抗体交叉反应性鉴定 用PBS液将FSH、LH、TSH、PRL、hCG稀释至10 μg/mL,分别作为包被抗原与阳性杂交瘤细胞培养上清反应,采用间接ELISA法分别测定其吸光值,判定单克隆抗体的交叉反应性。以SP2/0骨髓瘤细胞培养上清液为阴性对照,以灭菌水为空白对照。
2 结果与分析
2.1FSH蛋白序列特征
分别比对了人和多种哺乳动物FSH α亚基、β亚基的种间序列特征,结果表明,同一物种的FSH具有相同的α亚基,不同物种间FSH α亚基有较大的差异。不同哺乳动物的FSH β亚基同源性较高(图1),分析发现,牛与常见家畜及人类,牛与梅花鹿、虎、大熊猫等野生动物,牛与家鼠、裸鼠等啮齿类动物的氨基酸序列同源性均高于80%,最高达95%以上。
线性抗原表位预测结果显示,在59—66位存在6个连续的抗原表位,序列位点为DPARPNI(T)Q,在104—116位间存在13个连续的抗原表位,序列位点为KCD(N)SDSTDCTVRG。人类、常见家畜、部分野生动物及鼠类的FSH β亚基的线性抗原表位高度保守。
2.2pET28a-FSH重组质粒构建
从奶牛垂体组织cDNAs中扩增到与预期大小相符合的核酸片段(387 bp)(图2),且测序结果表明扩增片段序列正确。重组质粒双酶切鉴定结果表明,目的片段插入pET28a(+)载体,成功构建了pET28a-FSH重组质粒。

*表示该氨基酸序列在种间完全相同; :表示除一个物种外该 氨基酸序列在其他种间完全相同; 下划线表示保守抗原表位图1 常见哺乳动物FSH β亚基种间序列比对结果
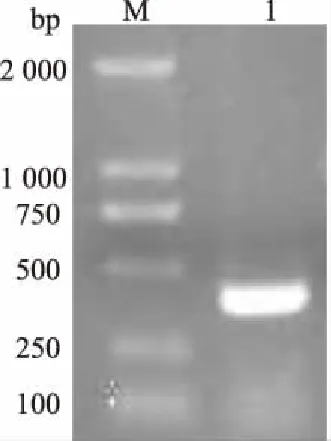
M:DNA Marker; 1:FSH β亚基图2 FSH β亚基片段扩增结果
2.3FSH重组蛋白的表达及纯化
从图3可以看出,在约14.4 ku处出现目的蛋白条带,与预期重组蛋白大小一致,表明FSH重组蛋白成功表达。将收集菌液进行反复冻融、超声裂解,取上清和沉淀进行SDS-PAGE电泳,结果表明,FSH重组蛋白主要位于上清中。

M:蛋白质Marker; 1:pET28a(+)空载体; 2:pET28a-FSH重组质粒; 3:菌液裂解上清; 4:菌液裂解沉淀; 箭头标示为重组蛋白图3 pET28a-FSH重组质粒的诱导表达(A)及重组蛋白可溶性分析(B)
2.4分泌抗FSH重组蛋白的杂交瘤细胞筛选结果
表达的FSH重组蛋白免疫Balb/c小鼠后效价高于1∶5 000,达到脾细胞融合要求,可以用于细胞融合。小鼠腹腔细胞经24 h体外培养后,其中的巨噬细胞贴壁、变形,活力增强。融合后第6~7天可在部分孔内观察到针状克隆(图4),证明细胞融合成功。

A:贴壁腹腔巨噬细胞; B:杂交瘤细胞图4 融合后产生的杂交瘤细胞
2.5分泌抗FSH重组蛋白的杂交瘤细胞稳定性分析
取抗体效价最高培养孔,经过多次有限稀释法进行克隆、亚克隆,最终获得1株阳性单克隆细胞株,命名为B4A5。杂交瘤细胞经过数代培养、冻存后复苏培养,细胞生长状态良好,且具有稳定分泌抗体的能力,上清效价均在1∶640以上,最高效价达到1∶1 280(表1)。

表1 杂交瘤细胞抗体分泌稳定性测定
2.6单克隆抗体效价检测
间接ELISA法检测结果表明,B4A5杂交瘤细胞上清的效价高于1∶640,腹水效价为1∶106。
2.7分泌抗FSH单克隆抗体的结合特异性
来源于哺乳动物垂体组织的FSH是由α和β 2个亚基组成,经过SDS-PAGE解离成2条电泳带,其中β亚基分子质量约为14.61 ku。Western blot结果表明,利用重组蛋白片段制备的单克隆抗体和天然的FSH激素在分子质量为14.4 ku处呈现特异性反应条带,而阴性对照无条带(图5),表明制备的单克隆抗体能够与天然FSH蛋白β亚基特异性结合。

M:蛋白质分子质量Marker; 1:单克隆抗体上清液; 2:SP2/0骨髓瘤 细胞上清液; 箭头标示特异性结合条带图5 抗FSH单克隆抗体结合特异性分析结果
2.8分泌抗FSH单克隆抗体的交叉反应性
B4A5杂交瘤细胞株分泌的单克隆抗体与FSH呈阳性反应,与LH、TSH、PRL、hCG等糖蛋白类激素均呈阴性反应(表2)。

表2 单克隆抗体的交叉反应性分析结果
注:+表示发生交叉反应;-表示不发生交叉反应。
3 结论与讨论
造成哺乳动物不育的原因非常复杂[1],其中疾病性不育在哺乳动物不育中所占的比例最高。疾病性不育包括卵巢和睾丸等生殖器官疾病、子宫内膜炎、生殖激素分泌不足或紊乱等[13]。下丘脑-垂体-性腺轴是哺乳动物最关键的生殖内分泌轴,下丘脑释放的促性腺激素释放激素(GnRH)通过垂体门脉系统作用于垂体前叶,引起FSH释放入血液[14-15]。
FSH是由垂体前叶合成和分泌的一种蛋白质类激素,垂体前叶还合成LH、TSH、PRL等同样由α亚基和β亚基结构组成的激素[16],这些垂体激素间有一定的序列同源性。本研究表明,同一物种垂体激素家族有相同的α亚基;人、家畜、常见野生动物及鼠类FSH β亚基氨基酸序列同源性均高于80%,最高同源性达95%以上。比对结果表明,常见哺乳动物FSH β亚基种间线性表位高度保守,可以作为抗体识别的共同位点。
本研究根据比对结果,利用单克隆抗体技术,制备了能够稳定分泌抗奶牛FSH β亚基单克隆抗体的杂交瘤细胞株,制备的单克隆抗体能够特异性结合动物源性FSH,与其他垂体激素无交叉反应,可用来测定奶牛血液中FSH含量。序列比对结果表明,人类、家畜、鼠类及常见野生动物FSH的β亚基同源性高。因此,本研究制备的单克隆抗体还可用于测定多种家畜、野生动物、鼠类等其他哺乳动物血液FSH含量。
[1] 赵兴绪.兽医产科学[M].4版.北京:中国农业出版社,2014:29-31.
[2] Nagirnaja L,Rull K,Uusküla,etal.Genomics and genetics of gonadotropin beta-subunit genes:Unique FSHB and duplicated LHB/CGB loci[J].Molecular and Cellular Endocrinology,2010,329(1/2):4-16.
[3] Fan Q R,Hendrickson W A.Structure of human follicle-stimulating hormone in complex with its receptor[J].Nature,2005,433:269-277.
[4] 郭景茹,杨焕民,蔡军,等.籽鹅促卵泡激素α亚基基因的克隆、序列分析及其原核表达载体的构建[J].中国畜牧兽医,2009,36(11):77-81.
[5] 郝建明,刘平.黄体生成素和卵泡刺激素在大鼠垂体前叶的细胞共定位研究[J].解剖学报,1997,28(1):53-56.
[6] 韩福鹏.卵泡刺激素与促黄体素的提取[J].中国疗养医学,2002,11(1):47-48.
[7] Keene J L,Matzuk M M,Otani T,etal.Expression of biologically active human follitropin in Chinese hamster ovary cells[J].The Journal of Biological Chemistry,1989,264(9):4769-4775.
[8] Patel H,Bhartiya D.Testicular stem cells express follicle-stimulating hormone receptors and are directly modulated by FSH[J].Reproductive Sciences,2016,23(11):1493-1508.
[9] Kottler M L,Chou Y Y,Chabre O,etal.A new FSH beta mutation in a 29-year-old woman with primary amenorrhea and isolated FSH deficiency:Functional characterization and ovarian response to human recombinant FSH[J].European Journal of Endocrinology,2010,162(3):633-641.
[10] Phillip M,Arbelle J E,Segev Y,etal.Male hypogonadism due to a mutation in the gene for the beta-subunit of follicle-stimulating hormone[J].The New England Journal of Medicine,1998,338(24):1729-1732.
[11] Dias J A.Endocrinology:Fertility hormone in repose[J].Nature,2005,433:203-204.
[12] Santi D,Granata A R,Simoni M.FSH treatment of male idiopathic infertility improves pregnancy rate:Ameta-analysis[J].Endocrine Connections,2015,4:46-58.
[13] Ruth K S,Beaumont R N,Tyrrell J,etal.Genetic evidence that lower circulating FSH levels lengthen menstrual cycle,increase age at menopause and impact female reproductive health[J].Human Reproduction,2016,31(2):473-481.
[14] Banerjee A A,Dupakuntla M,Pathak B R,etal.FSH receptor-specific residues L501 and I505 in extracellular loop 2 are essential for its function[J].Journal of Molecular Endocrinology,2015,54(3):193-204.
[15] Saxena R,Georgopoulos N A,Braaten T J,etal.Han Chinese polycystic ovary syndrome risk variants in women of European ancestry:Relationship to FSH levels and glucose tolerance[J].Human Reproduction,2015,30(6):1454-1459.
[16] Chauvigné F,Zapater C,Crespo D,etal.Fsh and Lh direct conserved and specific pathways during flatfish semicystic spermatogenesis[J].Journal of Molecular Endocrinology,2014,53(2):175-190.
Sequence Signature of Mammal Follicle Stimulating Hormone and Preparation and Identification of Its Monoclonal Antibody
LI Hongfei,WANG Jun,WANG Haihua,LI Deyin,YE Xiaomin,MI Junxian
(College of Veterinary Medicine,Henan University of Animal Husbandry and Economy,Zhengzhou 450046,China)
In orer to prepare specific monoclonal antibody against mammal FSH,amino acid sequence of FSH orthologs among human,livestock,wildlife and murids were analyzed.The results showed that the beta subunit of FSH had extremely high homology(>80%).The CDS of FSH beta subunit was amplified using cow pituitary gland cDNAs and then subcloned into pET28a(+) vector to express recombinant protein.The purified recombinant protein was used as antigen for immunization with Balb/c mice.Splenocytes of mice with the highest titer were fused with SP2/0 myeloma cells and indirect ELISA was used to select positive hybridoma cells.By series cloning and subcloning of hybridoma cells,a hybridoma named B4A5 that producing monoclonal antibody against FSH was obtained.B4A5 could successively secrete McAb with the treatment of serial subcultivation and freeze thawing for several times.The ELISA titers of McAb of cell supernatant-derived and ascites-derived was 1∶640 and 1∶106,respectively.Western blot indicated the McAb had specific binding with native FSH and indirect ELISA proved the McAb had no cross-reactivity with other gonadal hormones including LH,TSH,PRL and hCG.
mammal; FSH; sequence signature; monoclonal antibody
2017-03-22
河南省教育厅高等学校重点科研计划项目(16B230003);河南牧业经济学院学术带头人培养计划项目(25000231)
李红飞 (1982-),男,河南汝州人,讲师,博士,主要从事兽医产科学的教学与科研工作。 E-mail:15136249092@163.com
S857.2+1
: A
: 1004-3268(2017)09-0139-05
