雷竹笋蛋白的双向电泳分析
2017-09-11潘雁红杨慧敏吴良如高贵宾
潘雁红,杨慧敏,吴良如,高贵宾,钟 浩
(1.国家林业局竹子研究开发中心,浙江 杭州 310012; 2.浙江省竹子高效加工重点实验室,浙江 杭州 310012)
雷竹笋蛋白的双向电泳分析
潘雁红1,2,杨慧敏1,2,吴良如1,2,高贵宾1,2,钟 浩1,2
(1.国家林业局竹子研究开发中心,浙江 杭州 310012; 2.浙江省竹子高效加工重点实验室,浙江 杭州 310012)
以雷竹笋为材料,采用改良TCA-酚法提取竹笋总蛋白,Bradford法测定其质量浓度为7.865 g·L-1,上样量为1 500 μL,采用pH 3~10线性IPG预制胶条(24 cm)进行了总蛋白的双向电泳实验,并用PDquest 8.0软件分析了凝胶图谱。结果表明,雷竹笋的蛋白点数共有812个,等电点主要集中在pH 9~10,以碱性蛋白为主,占71.67%;相对分子质量主要集中在45~116 kDa范围内,占60.59%。与相同提取方法和电泳条件的毛竹冬笋的总蛋白双向电泳相比,其相对分子质量的分布范围相似,不同的是,雷竹笋以碱性蛋白为主,而毛竹冬笋酸性蛋白却多于碱性蛋白;两者表达差异量超过2倍的蛋白点有180个,其中上调表达75个,下调表达105个,差异大。
雷竹;竹笋蛋白;双向电泳
雷竹(Phyllostachyspraecox) 是禾本科竹亚科刚竹,属早竹的变种,是中国特有的优良笋用竹种。竹笋是竹鞭或秆基上的芽萌发分化而成的膨大的芽和幼嫩的茎,据分析,每100 g雷竹鲜笋的粗蛋白(凯氏定氮法)为2.74 g[1],可溶性蛋白(Bradford法)为2.95 g[2],是蛋白含量较高的蔬菜之一。
近年来,对雷竹笋的研究主要集中在次生代谢产物黄酮类、萜类、生物碱类、醌类、木脂素类化合物,以及挥发性成分、酚酸和它们的衍生物等,而对其含量最丰富的初级代谢产物的蛋白或肽类成分研究极少。
从植物的蛋白质类成分中寻找新的药物是今后一个重要的发展方向,药用活性蛋白(多肽)的开发是国内外的研究热点。已有的研究表明,植物蛋白具有具有免疫调节、抗肿瘤、抗菌、抗病毒等多方面的生物活性,如灵芝蛋白、白果清蛋白、天花粉蛋白等,特别是蛋白的酶解产物多肽的药用活性非常强,如从枸杞降血压肽、鹿萁免疫调节肽等[3]。Wang等[4]利用色谱层析的方法从麻竹笋中得到抗真菌蛋白;Masatoshi等[5]利用亲和色谱从毛竹笋中分离出2种抗菌肽Pp-AMP1和 Pp-AMP2;林倩等[6]选用Protamex和Papain两种蛋白酶对毛竹笋蛋白同步复合酶解,得到多肽BSPs和BSP-IV的抗氧化活性的强于大豆肽和花生肽。
天然存在的竹笋蛋白种类繁多、结构复杂。不同基源品种的竹笋蛋白具有不同的谱带模式即差异性蛋白成分;相同基源品种的竹笋在其不同发育时期,蛋白在表达上也存在差异。大多数的蛋白质在植物细胞内的含量极低,低丰度蛋白质反而更具有研究意义。
双向电泳(two-dimensional electrophoresis, 2-DE)仍是目前分离蛋白的最有效方法,利用蛋白质的等电点和分子量的不同,并通过等电聚焦电泳(isoelectric focusing,IEF)和十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)两次电泳分离蛋白质[7]。双向电泳所得的蛋白质二维排列图中的每一点都代表样品中的一种或几种蛋白质,据此,分离出数千种蛋白质,并且各种蛋白质的等电点、分子量和含量等信息均可同时显示出来[8],并结合基于MALDI或ESI的质谱技术进行蛋白质的鉴定。
本研究以雷竹笋为材料,对其进行了总蛋白的提取及双向电泳实验,通过PDquest软件分析,得到了竹笋蛋白的等电点和分子量的分布情况,然后进一步与毛竹笋的总蛋白双向电泳图进行了比较,为竹笋蛋白的分离纯化、开发利用、蛋白质组学的研究提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 供试竹笋 雷竹笋(覆盖雷竹笋)2014年12月21 日采自杭州市余杭区径山镇。
1.1.2 主要仪器设备 分光光度仪(UV1800型,美谱达仪器公司);IPGhor等电聚焦仪(GE Healthcare);超声细胞破碎仪(浙江新芝);电泳仪(DALT-SIX SDS-PAGE,GE Healthcare);Ettan-DALT-Six系统水浴循环仪;Image Scanner 扫描仪(GE Healthcare)。
1.1.3 主要试剂与试剂盒 ImmobilineTM DryStrip pH3-10 NL,24 cm(GE)、IPG Buffer pH 3-10 NL (GE)、尿素(AR)、硫脲(AR)、二硫苏糖醇(AR)、3-[(3-胆酰胺丙基)-二乙胺]-丙磺酸(AR)、溴酚蓝(AR)、碘乙酰胺 (AR)、十二烷基磺酸钠 (AR)、丙烯酰胺 (AR)、甲叉双丙烯酰胺(AR)、过硫酸铵(AR)、TEMED(AR)、甘氨酸(AR)、乙醇(AR)、冰醋酸(AR)、2D电泳样品提取缓冲液系列(上海生工PL039)、2D Equilibration Buffer(上海生工SD6030)、无毒型蛋白质快速染色试剂盒(上海生工SK3011)、Bradford法蛋白质浓度测定试剂盒(上海生工SK3031)。
1.2 方法
1.2.1 样品总蛋白提取
采用改良TCA-酚法提取竹笋的总蛋白。取出冷冻的样品,加入液氮,并充分研磨。按照1∶10的比例加入预冷的TCA(10%)的丙酮,沉淀1 h(-20 ℃)。在4 ℃下,15 000g离心15 min,取出沉淀,再加入预冷丙酮,沉淀1 h(-20 ℃)。重复上述步骤一次。15 000g离心15 min后(4 ℃),取沉淀,进行真空冷冻干燥。将干燥后的固体加入到酚抽提液(0.7 M蔗糖,0.1 M KCl,0.5 M Tris-HCl(pH 7.5),50 mM EDTA,0.2% DTT)混合。用等体积的酚-Tris-HCl(pH 7.5)饱和溶液在4 ℃下混合30 min。5 000g离心30 min(4 ℃),收集酚上层。然后,加入等体积的酚抽提液,重复以上步骤,得到酚上层。加入预冷0.1 mol·L-1醋酸铵-甲醇溶液(5倍体积),-20 ℃沉淀1 h。在4 ℃下,5 000g离心30 min,收集沉淀。按照前面酚抽提液的比例,加入2倍体积的预冷甲醇以清洗,轻微混合。5 000g离心10 min(4 ℃),得到沉淀。重复以上步骤3次,来充分去除酚和其它杂质。用丙酮代替甲醇重复以上步骤3次,甲醇被充分去除。4 ℃,5 000g离心10 min,收集沉淀。将干燥后的粉末溶解液于样品裂解液中,充分溶解蛋白(30 ℃恒温水浴溶解1 h)。将溶液于室温下离心15 min(15 000g),取上清液,并再次离心取上清液,除去不溶杂质,该上清液即为毛竹笋的总蛋白溶液。
1.2.2 蛋白定量
采用Bradford法蛋白质浓度(上海生工)测定试剂盒(SK3031)测定竹笋总蛋白的浓度,并以牛血清蛋白(BSA)为标准蛋白。
1.2.3 双向电泳
1.2.3.1 IEF 蛋白上样量:蛋白上样量为1 500 μg,用 pH 3-10 NL IPG预制干胶条进行第一向等电聚焦。50 V预电泳12 h后,正式电泳条件为500 V 1 h,1 000 V 1 h,1 000~10 000 V 1 h,10 000 V 11 h。
1.2.3.2 胶条平衡 将聚焦完成的胶条加 2D Equilibration Buffer(加1% DTT)10 mL,并摇动平衡15 min。清洗胶条后,加入2D Equilibration Buffer(加2.5% IAA),摇动平衡15 min。
1.2.3.3 SDS-PAGE 将平衡后的胶条放入凝胶板后,同时加入低熔点琼脂糖封胶液(0.5%低熔点琼脂糖+电泳缓冲液),室温静置 20 min,结束后,开始第二向电泳。第二向SDS-PAGE 凝胶浓度为12.5%,其电泳参数设定为:100 V·胶-1,电泳45 min;200 V·胶-1,至溴酚蓝离胶下沿0.5 cm 处停止;设定冷循环温度为15 ℃。电泳结束后,取出凝胶并进行染色。
1.2.3.4 凝胶染色 采用考马斯亮蓝染色法,具体操作如下:固定时间为2 h,考马斯亮蓝染色 12 h,用水洗背景使其清晰。
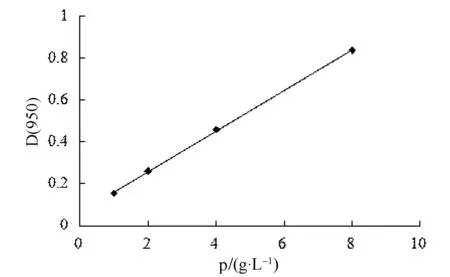
图1 牛血清白蛋白的标准曲线Fig.1 The standard curve of BSA
1.2.3.5 凝胶图像扫描 采用ImageScanner 扫描仪扫描染色好的聚丙烯酰胺凝胶,分辨率为300 dpi。然后,用 PDquest 8.0软件对电泳图谱进行蛋白点的检定、匹配与编辑、数据分析和输出,计算出蛋白点的等电点、相对分子质量、标注毛竹笋总蛋白的表达差异点与分析。
2 结果与分析
2.1 蛋白定量
用紫外分光光度计测定标准品溶液在595 nm处的吸光度。以吸光度为纵坐标,蛋白浓度为横坐标,绘制标准曲线,结果如图1所示。

图2 雷竹笋总蛋白双向电泳图谱Fig.2 The 2-DE profile of total protein of bamboo shoots of Phyllostachys praecox
通过测定不同浓度牛血清蛋白的吸光度得到的线性回归方程式为y=0.097 2x+0.064 1,R2=0.999 6。雷竹笋总蛋白稀释1倍后测得的的吸光度分别为0.445、0.449和0.445,平均吸光度为0.446,计算得到的蛋白质量浓度为3.932 g·L-1,故雷竹笋总蛋白的实际质量浓度为7.865 g·L-1。
2.2 蛋白双向电泳
雷竹笋总蛋白的双向电泳图谱如图2所示,经PDquest 8.0 软件分析,共分离出约812个蛋白点。
2.3 不同等电点范围的蛋白点数
雷竹笋总蛋白的双向电泳图谱上各不同等电点范围内的蛋白点数目如图3所示。结果表明,竹笋蛋白分布在pH 3~10范围内,主要集中在pH 9~10;pH 7以下的蛋白点数为230个,占28.33%;pH 7以上的蛋白点数有582个,占71.67%;以碱性蛋白为主。
2.4 不同相对分子质量范围的蛋白点数
雷竹笋总蛋白的双向电泳图谱上各不同相对分子质量范围内的蛋白点数目见图4。由图4可知,竹笋蛋白的分子量分布在11~120 kDa,蛋白点的相对分子质量分布以45~116 kDa为峰并呈偏态分布,即竹笋蛋白主要集中在45~116 kDa范围内,占60.59%。
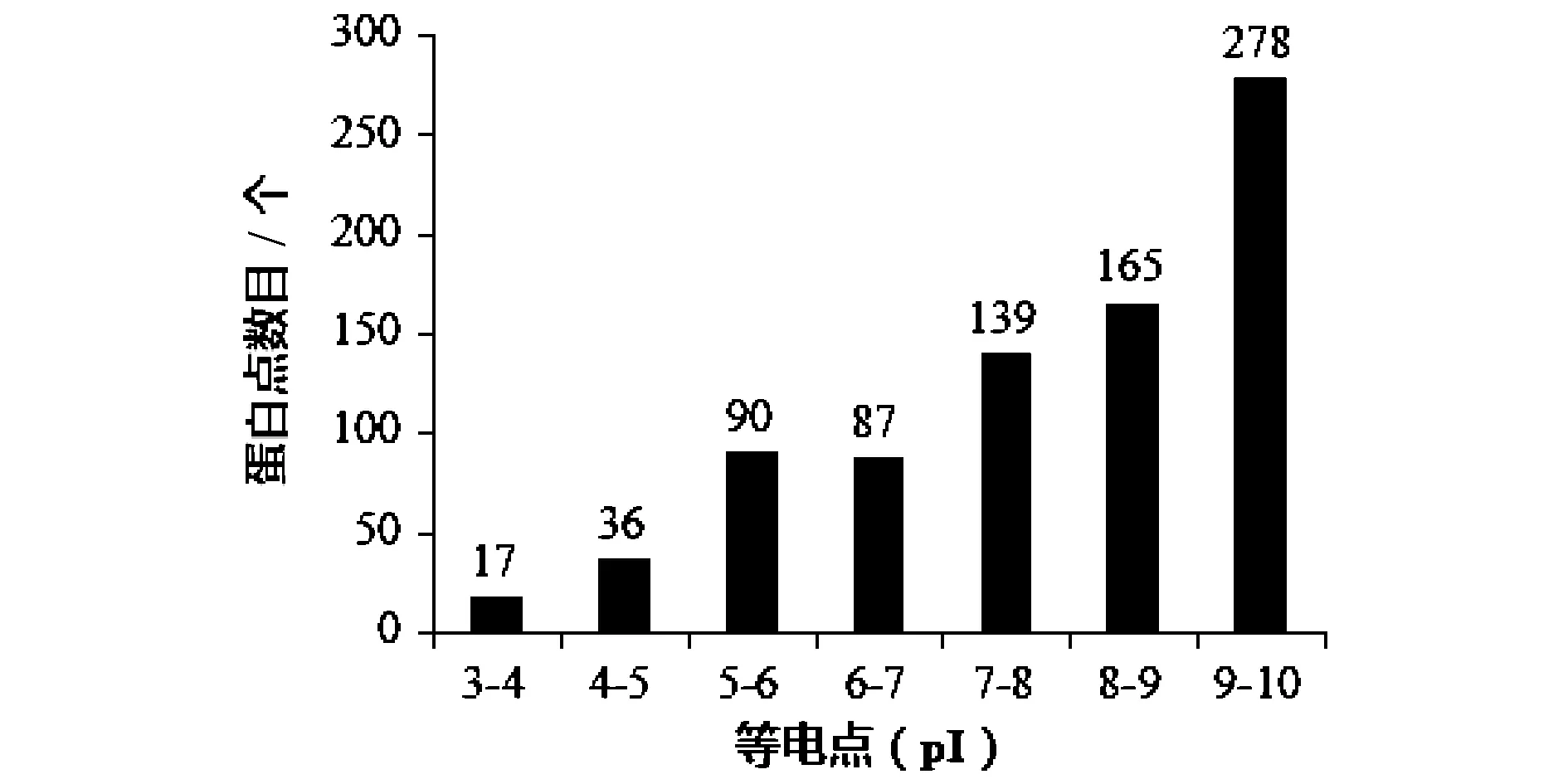
图3 雷竹笋蛋白双向电泳凝胶中不同等电点范围的蛋白点数Fig.3 The isoelectric point distribution of protein spots in 2-DE gel of bamboo shoots of Phyllostachys praecox
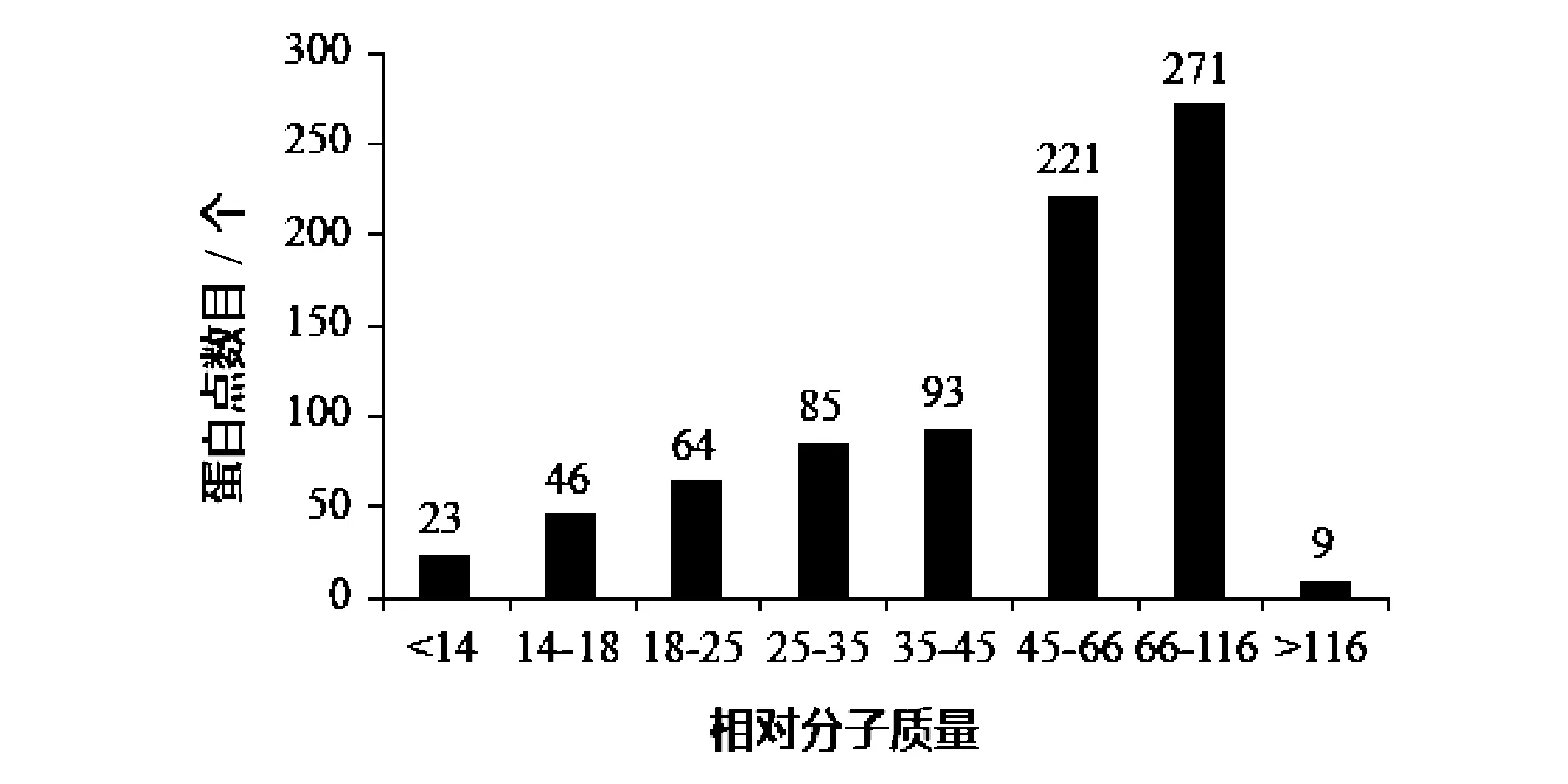
图4 雷竹笋蛋白双向电泳凝胶中不同相对分子质量分布范围的蛋白点数Fig.4 The protein spots for various molecular mass in 2-DE gel of bamboo shoots of Phyllostachys praecox
2.5 与毛竹笋2-DE图谱的蛋白表达差异分析
将雷竹笋2-DE图谱与同一天采集的同属刚竹属采用相同蛋白提取方法和相同电泳条件的毛竹冬笋的2-DE图谱[9],利用PDquest 8.0 软件进行蛋白的比较和差异分析,结果见图5。毛竹笋的蛋白点数有1 014个,等电点主要集中在pH 6.0~7.0范围,而雷竹笋则主要集中在pH 9~10,以碱性蛋白为主,两者蛋白点分子量均集中在45~116 kDa范围。若将强度差异倍数大于2的蛋白质点视为表达有差异,两者存在表达差异的蛋白点有180个,其中上调表达75个,下调表达105个。可见,两者虽同属刚竹属,但其笋蛋白的差异性很大。
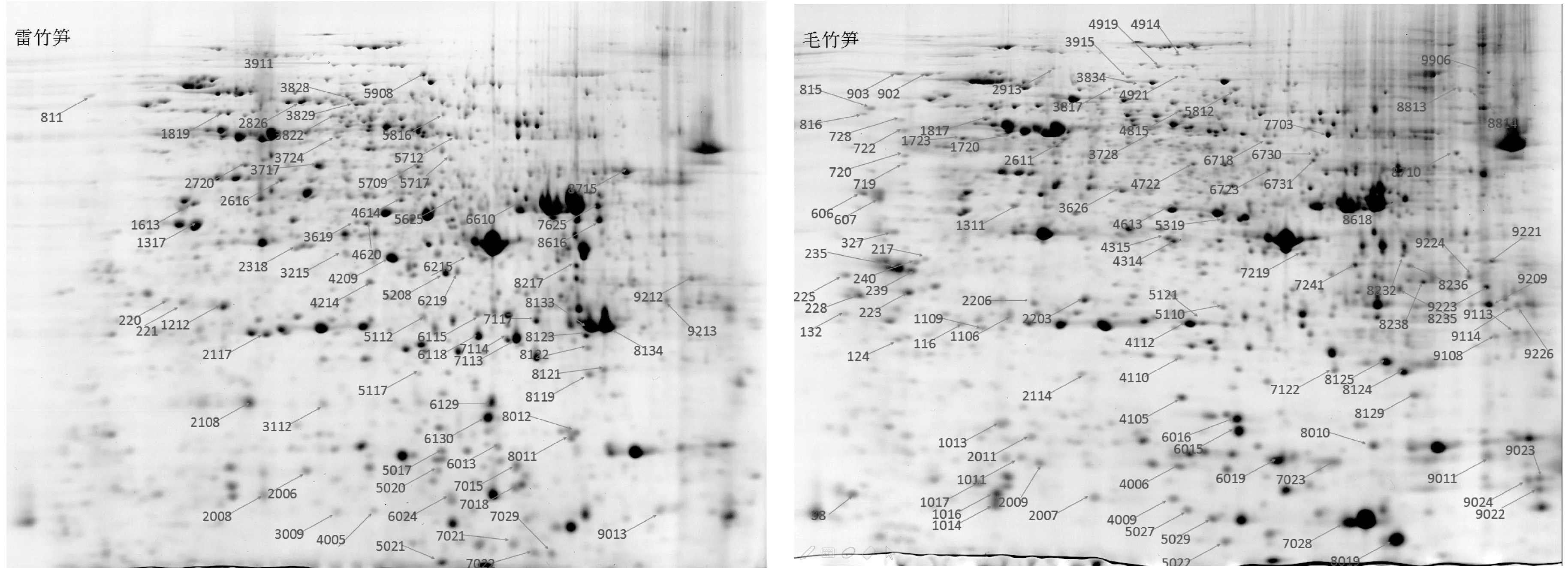
图5 雷竹笋和毛竹笋差异显著蛋白点的2-DE标注图Fig.5 2-DE labeling maps of significantly different proteins of Phyllostachys praecox and Phyllostachys edulis
3 讨论
蛋白质样品的提取为得到高清晰双向电泳的第一步,其效果的好坏直接影响蛋白质的分离和结果的可靠性。因此,提高蛋白质样品的制备质量是非常重要的。本研究采用改良TCA-酚法提取雷竹笋的总蛋白,TCA可以有效地抑制蛋白酶对蛋白质的水解作用,具有降低次生代谢物质的干扰、减少蛋白降解等优点[10];丙酮溶液可以除去样品中的酚类和色素等干扰物质,同时高速离心办法能较好地去除多糖的影响;抽提蛋白至酚相中,而干扰物质,如酚类物质、多糖、核酸、盐离子等则存在于水相中,采用多次离心去除水相中的杂质,而酚相中的蛋白也得到了纯化和浓缩;与此同时,酚能使蛋白水解酶失活,从而阻止了蛋白质的降解。Bradford法测定改良TCA-酚法提取的毛竹冬笋总蛋白浓度为9.470 g·L-1,这表明提取效果较佳。
样品制备的目的是将样品中的蛋白质完全溶解、变性、分离和还原[11]。为得到蛋白双向电泳的最佳的清晰度和分辨率,须使样本蛋白处于变性状态,变性剂尿素可打开蛋白的三维结构,暴露出蛋白的电荷使其易于溶解;洗涤剂40 g·剂-13-[(3-胆酰胺丙基)-二乙胺]-丙磺酸(CHAPS)保证蛋白完全溶解,防止了蛋白通过疏水基团的相互作用而聚集;用还原剂0.2% DTT裂解双硫键,并使样品蛋白处于完全还原状态;在室温下,样品保持溶解 30 min以上,以达到蛋白的充分变性与溶解;固定pH梯度缓冲液(20 g·剂-1IPG Buffer)可提高蛋白的溶解度,防止蛋白通过所带电荷互相聚集。本实验得到的雷竹笋蛋白的双向凝胶电泳图谱效果较好,具有背景清晰,分辨率高,重复性好,分离出的蛋白点数量多等优点。
本研究采用pH 3~10的宽范围的线性IPG预制胶条,可以在同一块凝胶上显示雷竹笋蛋白的整体分布。雷竹笋总蛋白在pH 3~10都有分布,但主要集中在pH 9~10,以碱性蛋白为主,这与Ong等[12]报道的生物中大部分蛋白的等电点在pH 4~8之间的结果不一致,显示了雷竹笋蛋白的独特性。雷竹笋蛋白的分子量主要为45~116 kDa之间,与毛竹笋的分布范围相似,非常适合用低蛋白吸附的切向流超滤的方法进行竹笋蛋白的提取和纯化。
与同属刚竹属的毛竹冬笋的蛋白表达图谱相比,蛋白总数,酸性、中性、碱性蛋白种类和含量均表现出较大的差异性,雷竹笋主要以碱性蛋白为主,毛竹笋虽以酸性蛋白为多,但碱性蛋白含量也比其他生物的高。该研究揭示了竹笋蛋白种类的丰富性和多样性特征,为今后进一步探究竹笋蛋白的生物活性组分奠定基础。
[1] 周芳纯. 笋用竹林的培育[J]. 竹类研究, 1998(1): 134-144.
[2] 张规富, 张玲玲, 杜六甫. 雷竹笋营养成分的分析测定[J]. 安徽农业科学, 2008, 36(3): 841-842.
[3] 李晓波, 金鑫, 李妍, 等. 植物类中药活性蛋白成分研究进展[J]. 中草药, 2004, 35(6): 111-113.
[4] Wang H X, Ng T B. Dendrocin, a distinctive antifungal protein from bamboo shoots [J]. Biochemical and Biophysical Research Communications, 2003, 307(3): 750-755.
[5] Masatoshi F, Mineo I, Yuji M. Amino acid sequence and antimicrobial activity of chitin-binding peptides, Pp-AMP1and Pp-AMP2, from Japanese bamboo shoots (Phyllostachyspubescens) [J]. Bioscience Biotechnology Biochemistry, 2005, 69(3): 642-645.
[6] 林倩, 王强, 刘红芝, 等. 酶法制备竹笋短肽的工艺优化[J]. 农业机械, 2011(8): 98-101.
[7] Scheele G A. Two-dimensional gel analysis of soluble proteins. J Biol Chem, 1975, 250: 5375-5385.
[8] Kim E K, Lee S J, Moon S H,etal. Free radical scavenging activity and comparative proteomic analysis of antioxidative protein against H2O2-induced oxidative stress in neuronak cells[J]. Food Chemistry, 2009, 117(2): 232-240.
[9] 杨慧敏, 吴良如, 潘雁红, 等.毛竹笋蛋白的双向电泳分析[J]. 竹子研究汇刊, 2015, 34(3): 35-38.
[10] Wang W, Tai F, Chen S. Optimizing protein extraction from plant tissues for enhanced proteomics analysis[J]. Journal of Separation Science, 2008, 31(11): 2032-2039.
[11] Gorg A, Weiss W, Dunn M J. Current two-dimensional electrophoresis technology for proteomics[J]. Proteomics, 2004, 4(12): 3665-3685.
[12] Ong S E, Pandey A. An evaluation of the use of two-dimensional gel electrophoresis in proteomics[J]. Biomolecular Engineering, 2001,18(5):195-205.
Two-dimensional Electrophoresis Analysis of Bamboo Shoot Protein ofPhyllostachyspraecox
PAN Yan-hong1,2, YANG Hui-min1,2,WU Liang-ru1,2,GAO Gui-bin1,2,ZHONG Hao1,2,YE Xiao-dan1,2
(1.China National Bamboo Research Center, Hangzhou 310012,Zhejiang, China;2.Key Laboratory of High Efficient Processing of Bamboo of Zhejiang Province, Hangzhou 310012,Zhejiang, China)
The total protein of bamboo shoots inPhyllostachyspraecoxwas extracted by the improved TCA-phenol method, and its content was 7.865 g·L-1as detected by Bradford method. Two-dimensional electrophoresis was carried out with 1500μg loading amount on 24 cm linear IPG strips at pH 3-10. Then, the Gel image was analyzed with PDquest 8.0 software. The results showed the bamboo shoots had 812 protein spots. The isoelectric points mainly concentrated in pH 9-10, and the basic protein accounted for 71.67%. Their relative molecular mass mainly ranged 45-116 kDa, and accounted for 60.59%. In comparison with Moso bamboo shoots with the same extraction method and electrophoresis conditions, the range of relative molecular mass was similar. The bamboo shoots ofPhyllostachyspraecoxcontained mainly alkaline protein, and that of Moso bamboo had more acid protein than the basic one. The number of protein spots of expression differences being more than 2 times amounted to 180. Of which, 75 protein spots were up-regulated and 105 were down-regulated. The difference betweenPhyllostachyspraecoxand Moso bamboo shoots was great.
Phyllostachyspraecox; Protein of bamboo shoots; Two-dimensional gel electrophoresis
2015-11-06
“十三五”国家重点研发计划课题(2016YFD0600903);国际合作项目(PRSD-026-13);“十二五”浙江省农业重大成果转化工程项目(2012T201-05); 科研院所省级重点实验室建设(2014F10047)
潘雁红,硕士,工程师,从事竹林培育及竹资源食品研究。通信作者:吴良如,副研究员,从事笋(竹)资源高值利用研究。E-mail: boteatree@163.com
