二氧化碳电化学还原概述
2017-09-08张琪许武韬刘予宇张久俊
张琪,许武韬,刘予宇②†,张久俊②††
①上海大学理学院,上海 200444;②上海大学可持续能源研究院,上海 200444
二氧化碳电化学还原概述
张琪①,许武韬①,刘予宇①②†,张久俊①②††
①上海大学理学院,上海 200444;②上海大学可持续能源研究院,上海 200444
在过去的几十年里,二氧化碳(CO2)电化学还原技术的迅猛发展越来越引起国际国内的广泛关注。此技术可以利用太阳能、风能、潮汐能等可再生能源及核电/水电的弃电,将温室气体CO2还原为低碳燃料和有经济价值的化学品。这一技术可以促进废弃物(气体)利用以实现能源储存与转换,变废为宝,被认为是一种绿色环保、有发展潜力的CO2处置方法。使用的催化剂和电解质不同,CO2电化学还原过程给出的产物也不尽相同。本文概述了CO2电化学还原的原理以及催化剂、电解质和反应器的发展现状。
CO2电化学还原;催化剂;电解质;反应器
大气中天然二氧化碳(CO2)一般通过化石燃料的燃烧、动植物的呼吸作用、有机物的腐烂等过程产生,而近年大气中CO2浓度快速增加是工业革命以来社会飞速发展所引发的后果,源于化石燃料的大量使用[1]。从2017年5月美国国家海洋和大气管理局(National Oceanic and Atmospheric Administration)公布的过去60年大气中CO2的浓度变化趋势(图1)可以看出,大气中CO2浓度一直处于急速增长之中。一个需要关注的事实是,在2015年4月到5月期间,大气CO2浓度首次突破了400 ppm(parts per million, 10-6)。CO2浓度的增加对环境造成了显著的负面影响,使地面吸收的太阳光的热量不易散失,导致全球变暖,进而引起两极冰川融化、海平面上升等。有研究表明,目前的CO2浓度即使不再增加,靠地球的自身消化能力,也要近1 000年才能消除从前所累计的温室效应的影响[2]。因此,CO2减排和有效的回收利用,成为当前一个重要的热点话题。
随着人口数量急剧增长与经济高速发展,能源需求急剧上升,全球能源短缺问题会变得日渐突出。把目前因无法直接并入区域电网而利用率不高的可再生能源(风能、太阳能、潮汐能等)储存和利用起来,是缓解这种危机的有效途径之一。利用可再生能源将CO2还原成低碳燃料和有经济价值的化学品,不仅能达到CO2减排和保护地球环境的目的,还能将闲散的非常规能量加以储存,从而可以极大地缓解能源危机[3]。

图1 大气中CO2浓度变化趋势(图片来源:www.esrl.noaa.gov/ gmd/)(红线表示月平均数据,黑线表示修正后数据)
CO2是碳的最高氧化态产物之一,其标准摩尔生成焓为-394.38 kJ/mol。它也是C1家族中最为廉价和丰富的碳资源,其化学性质稳定,结构不易被破坏。目前,有很多CO2处置方法还在探索中,例如:①地下储存,即将分离回收之后的CO2注入到即将耗竭的油气储层和不可开发的甲烷煤层。通过向油田中注入CO2,可以提高石油回采率。这是一种非常有前景的碳埋存技术。②深海封存,也就是把CO2注入到深海中进行长时间的存储。目前深海封存在全世界还未被真正采用,也未开展试点示范,仍处于研究阶段[4]。实际上,这些方法只能把CO2转移,并不能真正地将CO2消减,治标不治本。于是,人们把目光转向CO2的转化和利用技术,包括化学法、电催化法、光催化法和光电催化法等方法。
电催化CO2还原方法实际上有高温和低温两种,本文着重介绍的是低温还原技术。这种技术因以下优点受到广泛关注:①整个还原过程的电势电压可控,易于操作;②整个还原过程几乎无废水产生;③整个还原过程所需要电能可来自太阳能、风能、地热能、潮汐能等可再生能源,以及核电站、水电站低谷用电时的弃电,没有新的CO2排放;④系统可根据需要进行任意调整。因此,电化学转化技术很适合不同规模的工业应用[5]。
CO2电化学还原就是一个利用电能将CO2在电解池的阴极上还原的过程,而OH-在阳极上被氧化成氧气。由于还原CO2需要的活化能较高,施加一定高电压后才能实现,而作为阴极过程的竞争氢析出反应(hydrogen evolution reaction,HER)也同时随电压的增高而变得越发严重,抑制了CO2的还原,导致过多的能量消耗。因此,寻找合适的催化剂,降低CO2还原活化能和抑制氢析出是实现高效还原的关键。CO2电化学还原的流程如图2所示。从图中看出,整个CO2电化学还原过程是利用太阳能、风能、地热能、潮汐能等可再生能源提供的电能以及用电高峰期以外的所发多余核能/水电能把CO2电化学还原生成燃料和有经济价值的化学品,从而实现CO2资源的高度回收与利用,达到减排的目的。可见,CO2电化学还原是一种绿色环保、变废为宝的处理CO2的方法。
在介绍低温CO2电化学还原技术之前,有几个首先需要明确的概念:①产物的选择性(selectivity),指特定还原产物的量占总还原产物的量的比率(%);②催化剂的稳定性(stability),指在催化过程中催化活性的持久时间(小时);③法拉第效率(Faradaic efficiency),指实际生成物和理论生成物的百分比(%);④电流密度(currentdensity),指单位面积所通过的电流(mA·cm-2),和催化剂的活性有一定的关系。
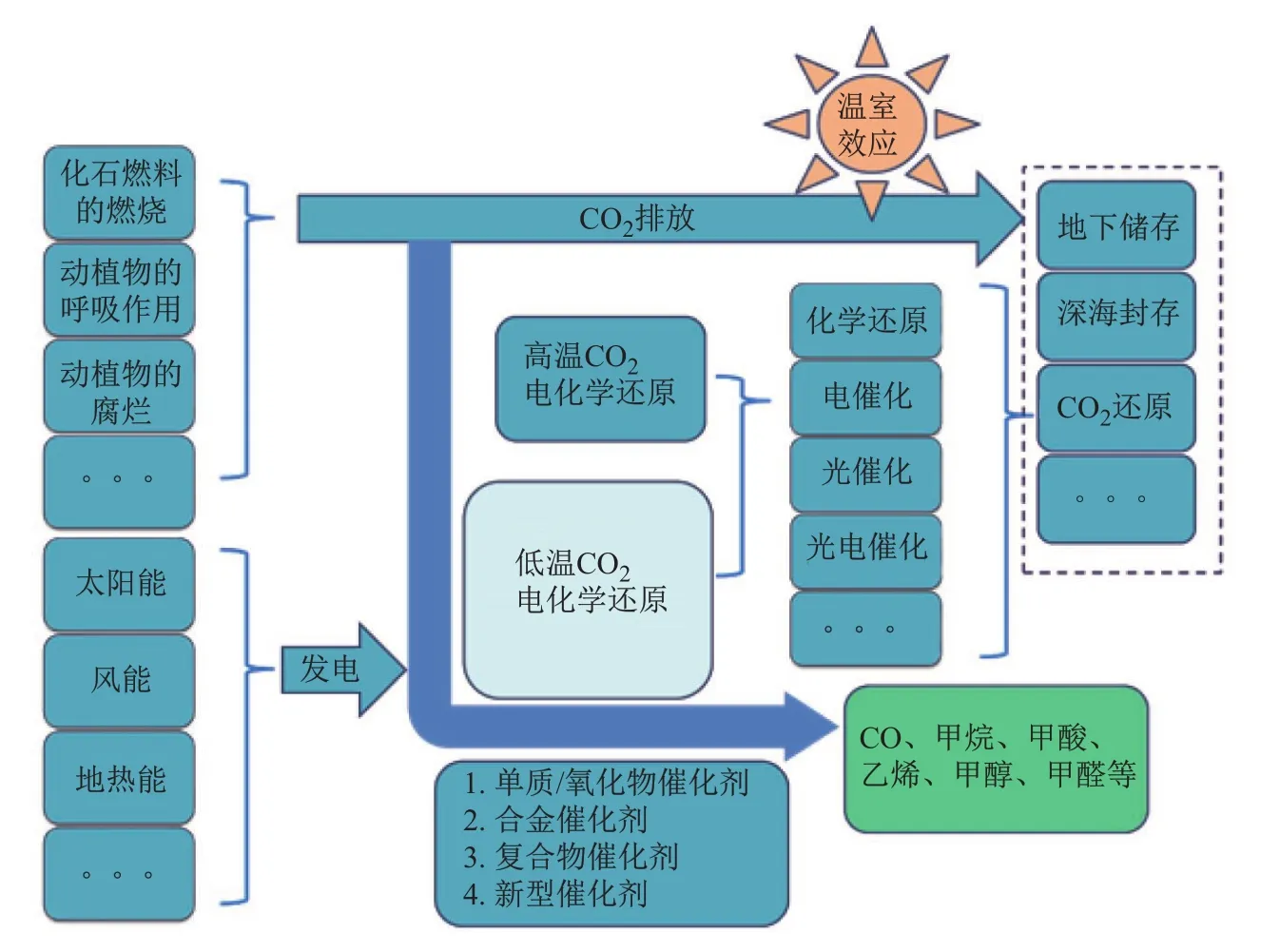
图2 CO2电化学还原的流程图
1 电化学还原CO2的原理
CO2电化学还原及其竞争H2逸出反应在水溶液中进行时的部分阴极反应机理简单描述如下:

在电化学还原反应的初始阶段,CO2将首先被吸附在阴极催化剂表面,形成中间产物由于超电势和电阻损耗的存在,往往施加至少2V的阴极电势,才能使电解反应实际进行。出的电解产物也不同,如一氧化碳(CO)、甲酸(HCOOH)、甲烷(CH4)、乙烷(C2H6)和乙烯(C2H4)等。由于是在水溶液中,反应式(9)和(10)表示的析氢反应也会发生,从而产生氢气。如果还原电势过高,产生氢气也越多。因此,在CO2电化学还原中,一般会使用合适的催化剂来降低电化学还原CO2反应的过电势,促进电催化还原,提高产物选择性和电流效率。表1给出在CO2还原过程中不同得失电子数所对应的产物以及对应的还原电势[6]。

表1 根据反应中反应物的标准吉布斯能计算得到的CO2在水溶液中部分标准电势(1.0 atm,25℃)[6]
2 CO2电化学还原技术的几个关键问题
2.1 催化剂
电催化过程中,具有碳氧双键(C=O)结构的CO2将会与催化剂的核心元素(主要是有空原子d轨道的金属元素)发生配位作用,使C原子和O原子之间的键能减小,CO2分子结构稳定性减弱,即降低CO2分子断裂反应的能垒,最终催化整个电化学还原过程[7]。图3给出了在元素周期表中可用于制作电化学还原CO2催化剂的核心元素的分布。
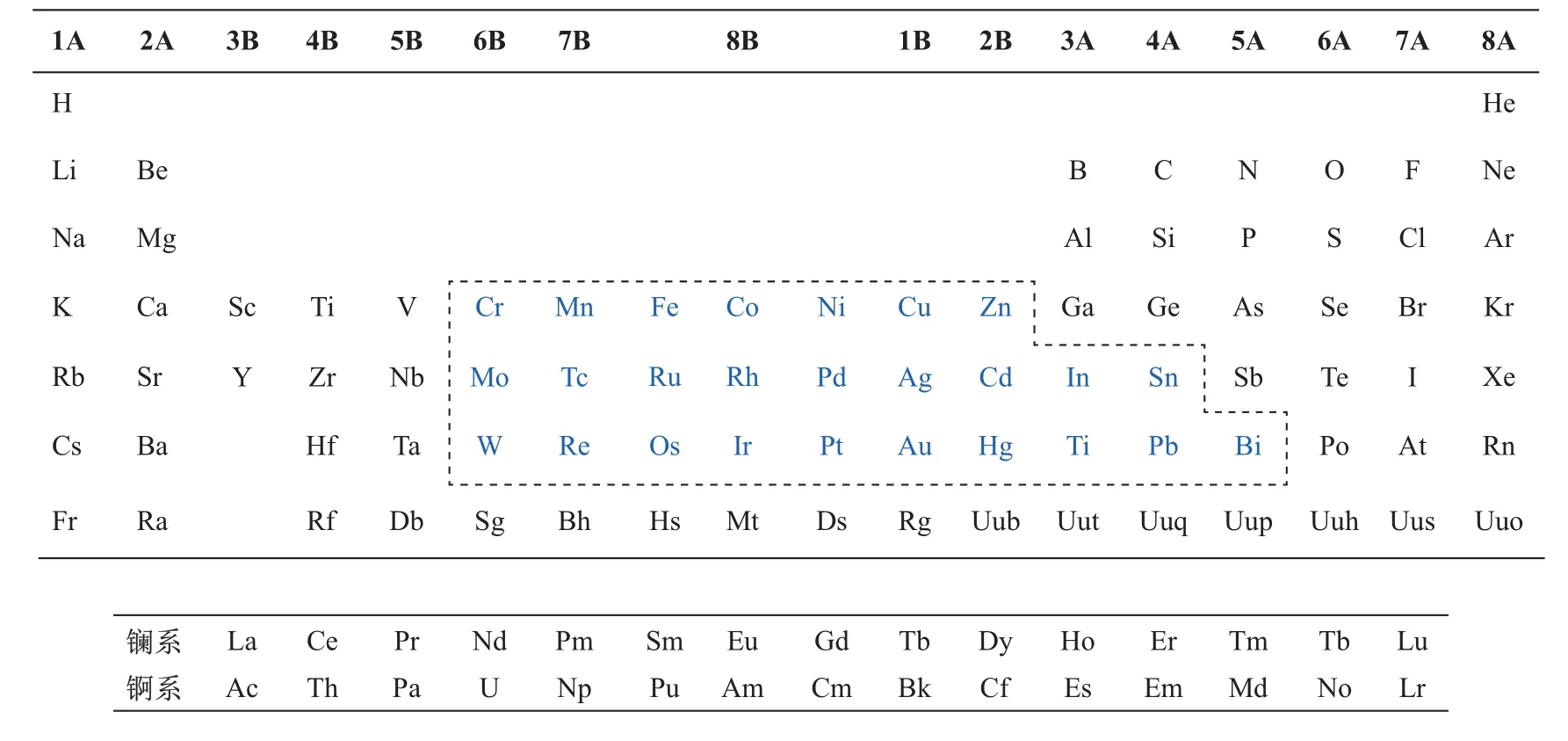
图3 可用来制作电化学还原CO2催化剂的金属元素
目前,被开发的CO2电化学还原催化剂大致可分为4类:①金属单质和金属氧化物催化剂;②合金催化剂;③有机金属络合物催化剂;④其他新型催化剂。
2.1.1 金属单质和氧化物催化剂
金属单质和氧化物催化剂,主要是由金属单质和/或金属氧化物构成,很多时候被附着在电极支持体(supporting)上使用。该类催化剂制备简单,导电性强。此类催化剂的性能受制备条件和方法以及其在电极表面上的形貌影响较大,因此通过制备方法及其电极结构调控可以提高催化活性、稳定性及选择性。此类催化剂是CO2电化学还原研究领域研究和应用最广泛的一类。电极制作使用不同金属材料,则产物、转化率和电流效率也不相同。基于催化性能和经济等方面考虑,常用的元素有铜(Cu)、锡(Sn)和锌(Zn)等。
Cu是少数可以抑制析氢反应的金属之一,被广泛地用作电化学CO2还原催化剂。用Cu单质作催化剂时得到的产物,除了CH4、C2H4、CO、HCOOH等低碳碳氢化合物以外,还出现过含有6个碳原子的高碳化合物[8-9]。生产这些产物的法拉第效率,受温度、电解质浓度、施加电压、溶液酸度甚至电极材料纯度的影响。例如:使用纯度高达99.999%的Cu作为阴极在CO2饱和的0.5 mol/L KHCO3电解质中还原CO2时,Hori等人发现,升高温度(从0到40℃),CH4的法拉第效率会从65%降到接近0%,而C2H4的法拉第效率增幅则达到了20%。他们还发现,当施加电压为-1.2 V(vs. NHE)或者更正时,得到的主要产物是CO;当施加电压为-1.2 V(vs. NHE)或者更负时,还原产生的CO就会和H+离子结合生成CH4、C2H4等碳氢化合物,CO的法拉第效率就会降低[10]。
金属Sn同样以无毒、价格低廉、高选择性等优点在CO2电化学还原中得到了广泛研究。据报道,在水溶液中,Sn电极是CO2电化学还原生产甲酸最具活性的电极。Sn的化学形态对甲酸的选择性有影响,已有多种形貌的Sn单质,如多孔锡和锡金属线等[11-12],被探索用于CO2电化学还原制备甲酸。相比之下,在非水溶液中,用Sn电极得到的主要产物是CO和少量的甲酸、草酸等[13-14]。也有最新研究报道,Sn金属的CO2电还原活性是因为Sn金属表面有Sn氧化物。如果去除Sn的氧化物,单质Sn就显示不出明显的电催化活性[15]。
在早期电化学还原CO2的研究中,Pb、Zn、Hg和Cd等金属元素由于有很高的析氢电位,也被尝试用作电极材料,并展现出不同的催化活性和产物选择性。如在0.1 mol/L KHCO3水体系中,用Zn、Cd和Hg阴极还原CO2生产甲酸和CO,法拉第效率分别是20%、39%和94%,而CO的法拉第效率分别是39.6%、14.4%和0.0%[16]。用Zn单质作电极材料时,CO2电化学还原产物主要是CO。原因可以推断是,CO2在电化学还原的过程中,先形成中间体,此中间体可以吸附在Zn电极表面,继续转化为CO(反应式(2))。由于Zn金属对CO的吸附能力很差,CO一经形成,便倾向于脱离Zn电极表面,成为主要还原产物。如果电极对CO吸附能力较强,CO可能会继续被还原下去,得到其他还原产物。此外,金属Pb、Hg和Cd的毒性很大,已经不被用作电极和催化剂材料。
2.1.2 合金催化剂
每种单质金属都有各自的电化学氧化还原特性,用它们制备合金材料,金属元素比例会影响产物的法拉第效率和电流密度。表2比较了单质Cu和Cu-Au合金在0.5 mol/L KHCO3水溶液中催化CO2还原的产物(醇类和甲酸)及法拉第效率。实验的Cu-Au合金被电沉积在纳米级多孔Cu膜(nanoporous Cu film,NCF)上。可以看出,Cu-Au合金和单质Cu还原CO2产物的法拉第效率明显不同[17]。

表2 单质Cu和Cu-Au合金的电催化CO2还原产物和法拉第效率[17]
通过不断调整合金的比例,寻找出性能最好的合金催化剂,就可能得到性能好于元素单质的催化剂。比如,当利用Sn-Pb合金作电极材料电化学还原CO2产生甲酸时,2 h电解的平均电流密度和法拉第效率分别达到了45.7 mA•cm-2和79.8%,明显高于单一的Sn或Pb金属的相应指标[18]。
最近,有研究报道,具有核壳结构的催化剂对CO2电化学还原有良好的催化作用。图4显示一种核壳结构,内心是Ag3Sn,外壳是SnOx的Ag-Sn双金属催化剂。这种新型结构的催化剂,在-0.8 V (vs. RHE)电势下电催化还原CO2生成甲酸,选择性高达80%[19]。

图4 Ag-Sn双金属催化剂核壳结构[19]
2.1.3 有机金属络合物催化剂
除了金属单质及其合金材料,金属络合物也一直被尝试用作CO2电还原催化剂。图3中标识出的金属元素,大多数可以用作络合物催化剂的核心金属原子,其中过渡金属,特别是贵金属元素最常见。图5给出了几个有代表性且可以和金属形成有机金属络合物催化剂的含氮有机配体,其中氮位是配位齿,可以是四齿、三齿、二齿或者单齿,比如卟啉(porphyrin)、酞菁(phthalocyanine)、三吡啶(terpyridine)、二吡啶(2,2’-bipyridine)以及吡啶(pyridine)。实际上这些配体通过某个位置上置入官能团或者元素置换,还衍生出了更多结构上相似的配体。形成的络合物与配体对应络合物相比,电催化性能也将有一定区别[5]。使用有机金属络合物催化剂得到的CO2还原产物主要是CO[20-24]。

图5 几种有代表性的有机配体
2.1.4 新型催化剂
MOF是指金属有机框架(metal-organic frameworks),是具有高比表面的新型催化剂。通过对这种催化剂结构的调整可优化催化性能。这类催化剂是将有催化活性的催化剂单元,通过原子层沉积方法进行合成。方法类似于砌墙,将催化剂一层一层地连接起来。这种CO2电还原催化剂的还原产物通常是CO,具有施加的电压低、法拉第效率高、工作寿命相对较长等优点[25-26]。Kornienko等人[26]曾利用钴卟啉MOF(Al2(OH)2TCPP-Co)作催化剂,选择性地把CO2催化还原成CO,选择性超过76%,而且催化活性可以保持约7 h。结构和催化过程如图6所示,A是催化剂活性单元,B是形成的MOF结构,C是整催化过程。

图6 MOF的结构和催化过程[26]
近年来出现了一种以微生物作为阴极催化剂对CO2进行还原的电化学技术。在这种技术中,混合菌群直接在电极上转化为氢气获得电子。利用获得的电子,将CO2分别转化为CH4和CH3COOH。生物阴极群落构成包括醋酸杆菌属、甲烷杆菌属和甲烷微粒菌属等功能微生物[27]。
除了含有金属的催化剂可以用来电化学还原CO2以外,一些非金属电极/催化剂也有良好的电催化性能。例如:导电聚合物电极(conducting polymer electrodes)、芳香族胺催化剂(aromatic amine catalysts)、自由基阴离子催化剂(radical anion catalysts)等。以导电聚合物为例,Koleli 等人[28]在甲醇中用聚苯胺(polyaniline)电极电化学还原CO2,产生CH3COOH和HCOOH,法拉第效率分别是78%和12%。Aydin等人[29]发现,聚吡咯(polypyrrole)电极在甲醇中高压下也能很好地催化还原CO2,对HCHO、HCOOH和CH3COOH的最大的法拉第效率分别是1.9%、40.5%、62.2%。
2.2 电解质
在电化学还原CO2过程中,除了电极材料以外,电解质也会对还原产物有影响。目前,电化学还原 CO2体系的电解质主要分为水溶液体系和非水溶性体系两大类。非水溶性介质的研究方向主要有甲醇(CH3OH)等有机溶剂和离子液体。其中离子液体有良好的导电性,对CO2的溶解能力良好,因此目前受到了广泛的关注。在水溶液中电化学还原CO2可在室温和常压下进行,通过选择不同电极和电极电势来改变产物,调控反应速率和选择性,因此对电化学CO2还原有着更好的利用价值。
在水溶液中电化学还原CO2,法拉第效率受电解质中阳离子的影响。Murata和Hori[30]在测试了几种0.1 mol/L MHCO3溶液(M=Li、Na、K和Cs)后发现,Na+、K+和Cs+对还原CO2有促进作用。此外,他们还发现C2H4的生成效率与阳离子的半径大小有关,顺序是Li+> Na+> K+> Cs+。Kyriacou和Anagnostopoulos[31]也发现了同样的规律。在用Fe(0)TPP作催化剂,二甲基甲酰胺(DMF)和四烷基铵(TAA)盐作电解质,电化学还原CO2时,将Mg2+离子加入溶液,他们发现CO2还原速率显著提高,催化剂稳定性也被改善,同时生成CO的法拉第效率超过94%。
非水溶液体系的使用可以增加CO2的溶解度和抑制氢析出,从而提高电流效率。非水体系应用最多的就是有机溶剂,如乙腈、N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)等。因非水体系有机溶液毒性大、电流密度低等缺点,后来人们开始利用离子液体作电解质。离子液体又被称为室温熔融盐,是一种全部由正负离子组成的液体,在室温附近很宽的温度范围内均为液态[32]。离子液体因具有稳定性好、蒸气压小、毒性小等优点,最近引起了广泛的关注。将离子液体用于电化学还原CO2时,由于离子液体能够很好地溶解CO2,可以增加电化学转化的速率。离子液体也存在一些不足之处:①合成工艺复杂,产生废水;②生产成本较高;③稳定性及循环再生利用问题有待解决。
2.3 反应器
电解池的设计直接关系到CO2电还原反应的优化,实验人员一般都会根据自己的需求来设计电解池。目前,在实验室中使用的CO2电化学还原反应装置主要是如图7所示的H型电解池。其特点是制作过程相对容易、操作简单。在实验过程中,CO2气体先通过阴极室,使阴极的电解质溶液中的CO2始终处于饱和状态,以促进与催化剂表面的充分接触。但一般CO2在水溶液中的溶解度低,为了解决这一问题,研究人员常使用气体扩散电极(gas diffusion electrode)。它是一种多孔的复合电极,可以加快CO2气体向电极的扩散速度,使得CO2在这种多孔电极上充分反应;同时还可以抑制析氢反应,提高法拉第效率[33]。Wang等人[34]发现,Sn的气体扩散电极在0.5 mol/L KHCO3溶液中可以选择性地把CO2催化还原成HCOOH(HCOO-),法拉第效率高达73%。

图7 实验用电解池构造实例图[35]
在实际运行中,更要选择稳定性相对高的阴极材料,根据具体的情况设计合适的反应器。到目前为止,CO2电化学还原技术虽然还没有实现大规模的工业应用,但已经报道出了一些接近工业应用的反应装置。图8所示是一个大型反应系统。纯CO2或者CO2/N2混合物与0.45 mol/L KHCO3的阴极电解液混合后,从阴极一端进入阴极室,1 mol/L KOH的阳极电解液向上通过阳极室,在反应器中进行CO2的电化学还原。图9是反应器部分的局部放大。

图8 反应系统图[36]

图9 反应装置图[36]
3 问题和挑战
CO2电化学还原技术在达到实用化和工业化规模之前,仍然有很多关键问题亟需解决。首先,催化剂活性低。在电化学还原CO2时,需要更高地提高电势来推动反应进行,因而带来更多的氢析出。其次,产物选择性差。目前有些催化剂得到的产物常是混合物[37-39]。再者,催化剂稳定性低。在文献中报道的催化剂的稳定性都在十数小时之内。在电化学还原CO2的过程中,金属电极有时会逐渐地被还原的中间体所覆盖,堵塞催化剂的活性位点,导致催化剂的快速失活[36]。另外,在施加高槽电压的情况下,电解质溶液容易被分解。最后,反应器的放大是实现该技术成功的必要步骤。尽管有些科技工程专家已经做了一些尝试,但目前还不够成熟,而且催化剂不耐用,易失活。因此,在反应器方面,我们要优化系统;同时也要开发耐用的催化剂[40]。
(2017年6月14日收稿)
[1] 贺玉龙, 戴本林. 大气中CO2的源与汇及其含量增加对环境的影响[J]. 工业安全与环保, 2010, 36: 25-27.
[2] LIM R J, XIE M S, SK M A, et al. A review on the electrochemical reduction of CO2in fuel cells, metal electrodes and molecular catalysts [J]. Catalysis Today, 2014, 233: 169-180.
[3] 张芳. 当前能源形势及解决能源问题的对策[J]. 科技传播, 2013, 2: 49-50.
[4] 江怀友, 沈平平, 罗金玲, 等. 世界二氧化碳埋存技术现状与展望[J].中国能源, 2010, 32: 28-32.
[5] QIAO J L, LIU Y Y, HONG F, et al. A review of catalysts for the electroreduction of carbon dioxide to produce low-carbon fuels [J]. Chemical Society Reviews, 2014, 43: 631-675.
[6] BARD A J, PARSONS R, JORDAN J. Standard potentials in aqueous solution [M]. New York: M. Dekker, 1985.
[7] CHAPLIN R P S, WRAGG A A. Effects of process conditions and electrode material on reaction pathways for carbon dioxide electroreduction with particular reference to formate formation [J]. Journal of Applied Electrochemistry, 2003, 33: 1107-1123.
[8] SHIBATA H, MOULIJN J A, MUL G. Enabling electrocatalytic Fischer-Tropsch synthesis from carbon dioxide over copper-based electrodes [J]. Catal Lett, 2008, 123: 186-192.
[9] WANG X Y, LIU S Q, HUANG K L, et al. Fixation of CO2by electrocatalytic reduction to synthesis of dimethyl carbonate in ionic liquid using effective silver-coated nanoporous copper composites [J]. Chinese Chemical Letters, 2010, 21: 987-990.
[10] 欧利辉, 陈胜利. CO2在Cu表面还原成碳氢化合物的DFT计算研究[J]. 电化学, 2011, 17(2): 155-160.
[11] ZHAO Y, WANG C Y, WALLACE G G. Tin nanoparticles decorated copper oxide nanowires for selective electrochemical reduction of aqueous CO2to CO [J]. Journal of Materials Chemistry A 4, 2016, 27: 10710-10718.
[12] LU W X, ZHOU J, KONG F Y, et al. Porous tin-based film deposited on copper foil for electrochemical reduction of carbon dioxide to formate [J]. International Journal of Hydrogen Energy, 2016, 41: 1585-1591.
[13] JITARU M, LOWY D A, TOMA M, et al. Electrochemical reduction of carbon dioxide on flat metallic cathodes [J]. Journal of Applied Electrochemistry, 1997, 27: 875-889.
[14] MACHUNDA R L, JU H, LEE J. Electrocatalytic reduction of CO2gas at Sn based gas diffusion electrode [J]. Curr Appl Phys, 2011, 11: 986-988.
[15] ZHANG R, LV W, LEI L. Role of the oxide layer on Sn electrode in electrochemical reduction of CO2to formate [J]. Applied Surface Science, 2015, 356: 24-29.
[16] NODA H, IKEDA S, ODA Y, et al. Electrochemical reduction of carbon dioxide at various metal electrodes in aqueous potassium hydrogen carbonate solution [J]. Bull Chem Soc Jpn, 1990, 63: 2459-2462.
[17] JIA F, YU X, ZHANG L. Enhanced selectivity for the electrochemical reduction of CO2to alcohols in aqueous solution with nanostructured Cu-Au alloy as catalyst [J]. J Power Sources, 2014, 252: 85-89.
[18] CHOI S Y, JEONG S K, KIM H J, et al. Electrochemical reduction of carbon dioxide to formate on tin-lead alloys [J]. ACS Sustain Chem Eng, 2016, 4: 1311-1318.
[19] LUC W, COLLINS C, WANG S W, et al. Ag-Sn bimetallic catalystwith a core-shell structure for CO2reduction [J]. J Am Chem Soc, 2017, 139: 1885-1893.
[20] MORLANES N, TAKANABE K, RODIONOV V. Simultaneous reduction of CO2and splitting of H2O by a single immobilized cobalt phthalocyanine electrocatalyst [J]. ACS Catalysis, 2016, 6: 3092-3095.
[21] LIYANAGE N P, DULANEY H A, HUCKABA A J, et al. Electrocatalytic reduction of CO2to CO with re-pyridyl-NHCs: proton source influence on rates and product selectivities [J]. Inorganic Chemistry, 2016, 55: 6085-6094.
[22] JOHNSON B A, MAJI S, AGARWALA H, et al. Activating a low overpotential CO2reduction mechanism by a strategic ligand modification on a ruthenium polypyridyl catalyst [J]. Angew Chem Int Edit, 2016, 55: 1825-1829. doi: 10.1002/anie.201508490
[23] AMBRE R B, DANIEL Q, FAN T, et al. Molecular engineering for efficient and selective iron porphyrin catalysts for electrochemical reduction of CO2to CO [J]. Chem Commun, 2016, 52: 14478-14481.
[24] NGO K T, MCKINNON M, MAHANTI B, et al. Turning on the protonation-first pathway for electrocatalytic CO2reduction by manganese bipyridyl tricarbonyl complexes [J]. J Am Chem Soc, 2017, 139: 2604-2618.
[25] LEUNG K, NIELSEN I M B, SAI N, et al. Cobalt-porphyrin catalyzed electrochemical reduction of carbon dioxide in water. 2. mechanism from first principles [J]. Journal of Physical Chemistry A, 2010, 114: 10174-10184.
[26] KORNIENKO N, ZHAO Y B, KILEY C S, et al. Metal-organic frameworks for electrocatalytic reduction of carbon dioxide [J]. J Am Chem Soc, 2015, 137: 14129-14135.
[27] 蒋永, 苏敏, 张尧, 等. 生物电化学系统还原二氧化碳同时合成甲烷和乙酸[J]. 应用与环境生物学报, 2013, 19: 833-837.
[28] KOLELI F, ROPKE T, HAMANN C H. The reduction of CO2on polyaniline electrode in a membrane cell [J]. Synthetic Metals, 2004, 140: 65-68.
[29] AYDIN R, KOLELI F. Electrocatalytic conversion of CO2on a polypyrrole electrode under high pressure in methanol [J]. Synthetic Metals, 2004, 144: 75-80.
[30] MURATA A, HORI Y. Electrochemical reduction of CO2to CO at Ni electrodes modified with Cd [J]. Chemistry Letters, 1991, 20: 181-184.
[31] KYRIACOU G Z, ANAGNOSTOPOULOS A K. Influence CO2partial pressure and the supporting electrolyte cation on the product distribution in CO2electroreduction [J]. Journal of Applied Electrochemistry, 1993, 23: 483-486.
[32] 蒋平平, 李晓婷, 冷炎, 等. 离子液体制备及其化工应用进展[J]. 化工进展, 2014, 33: 2815-2828.
[33] KOBAYASHI T, TAKAHASHI H. Novel CO2electrochemical reduction to methanol for H-2 storage [J]. Energ Fuel, 2004, 18: 285-286.
[34] WANG Q, DONG H, YU H. Fabrication of a novel tin gas diffusion electrode for electrochemical reduction of carbon dioxide to formic acid [J]. RSC Adv, 2014, 4: 59970-59976.
[35] BONIN J, MAURIN A, ROBERT M. Molecular catalysis of the electrochemical and photochemical reduction of CO2with Fe and Co metal based complexes. Recent advances [J]. Coordin Chem Rev, 2017, 334: 184-198.
[36] LI H, OLOMAN C. Development of a continuous reactor for the electro-reduction of carbon dioxide to formate —Part 1: Process variables [J]. Journal of Applied Electrochemistry, 2006, 36: 1105-1115.
[37] LI H, OLOMAN C. The electro-reduction of carbon dioxide in a continuous reactor [J]. Journal of Applied Electrochemistry, 2005, 35: 955-965.
[38] OLOMAN C, LI H. Electrochemical processing of carbon dioxide [J]. ChemSusChem, 2008, 1: 385-391.
[39] AGARWAL A S, ZHAI Y M, HILL D, et al. The electrochemical reduction of carbon dioxide to formate/formic acid: engineering and economic feasibility [J]. ChemSusChem, 2011, 4: 1301-1310.
[40] ZHOU A H, HE D L, XIE N X, et al. Electrochemical quartz crystal microbalance probing the electro-formed and electro-reduced products on a copper electrode in aqueous solutions containing NaHCO3and Na2CO3[J]. Electrochim Acta, 2000, 45: 3943-3950.
(编辑:沈美芳)
An overview of electrochemical reduction of carbon dioxide
ZHANG Qi①, XU Wutao①, LIU Yuyu①②, ZHANG Jiujun①②
①College of Sciences, Shanghai University, Shanghai 200444, China; ②Institute of Sustainable Energy, Shanghai University, Shanghai 200444, China
Over the past decades, electrochemical reduction of CO2(ERC) has
widespread attentions due to its ability to store renewable energy from solar, wind, tidal and so on as well as abandoned electricity energy nuclear/hydroelectricity power plants in the forms of low-carbon fuels and valuable chemicals. This technology can promote energy storage and the utilization of waste (gas). It is considered to be a green and promising CO2disposal method. When using different catalysts, electrolytes and reactor design for ERC, the products and system energy efficiency obtained would be different. Here, we give a brief overview of the ERC fundamentals and the current state of this technology.
ERC, catalyst, electrolyte, reactor
10.3969/j.issn.0253-9608.2017.04.002
†通信作者,E-mail: liuyuyu@shu.edu.cn
††加拿大工程院院士,研究方向:电化学、电催化、光电化学、电化学能源储存与转换
