亚硝酰氢对冠心病心力衰竭大鼠心肌线粒体功能的影响
2017-09-07郭彦青徐继尧王日军王敬萍
郭彦青 徐继尧 王日军 王敬萍
基础研究
亚硝酰氢对冠心病心力衰竭大鼠心肌线粒体功能的影响
郭彦青 徐继尧 王日军 王敬萍
目的 探讨亚硝酰氢对心肌梗死后心力衰竭大鼠心肌线粒体Na+,K+-ATP酶、Ca2+-ATP酶及线粒体呼吸链复合体Ⅰ、Ⅳ活性的影响。方法 结扎大鼠前降支制作心肌梗死后心力衰竭模型,35只Wistar大鼠随机分为假手术组、心力衰竭模型组、亚硝酰氢组。分别给予各组大鼠皮下注射0.9%生理盐水2 ml或亚硝酰氢供体0.1 mg/100 g,4周后差速离心法提取线粒体,测量其Na+、K+-ATP酶及Ca2+-ATP酶活性;应用紫外分光光度法测定缺血再灌注后心肌线粒体呼吸链复合体Ⅰ、Ⅳ的活性。结果 与模型组相比,亚硝酰氢组大鼠线粒体Na+,K+-ATP酶[(42.64±4.13)U/mgprot比(37.99±3.25)U/mgprot]、Ca2+-ATP酶[(32.44±3.13)U/mgprot比(27.91±4.25)U/mgprot]活性及线粒体呼吸链复合体Ⅰ、Ⅳ活性[(0.554±0.052)ukat/g比(0.413±0.060)ukat/g、(0.058±0.005)ukat/g比(0.051±0.004)ukat/g]明显增加。结论 亚硝酰氢改善心力衰竭大鼠心功能的作用通过增加线粒体Na+,K+-ATP酶和Ca2+-ATP酶活性,以及线粒体呼吸链复合体Ⅰ、Ⅳ活性而实现。
亚硝酰氢; Na+,K+-ATP酶; Ca2+-ATP酶; 呼吸链
近年来多项研究[1,2]证实,心力衰竭中存在能量代谢障碍。线粒体是心脏能量产生的场所,其功能障碍在心衰的发生发展中起着重要的作用。因此,通过改善心衰时心肌细胞线粒体功能进而改善能量供应,为治疗心衰提供了新的思路。最新研究表明[3,4],亚硝酰氢(nitroxyl hydrogen,HNO)可以使心力衰竭时心肌收缩力增强,同时改善心肌舒张功能。我们的前期研究结果[5]表明,亚硝酰氢能改善冠心病心力衰竭大鼠心脏功能,但其具体作用机制是否与改善线粒体功能相关,目前鲜见报道。本研究采用HNO干预心力衰竭大鼠,探讨HNO对心力衰竭大鼠线粒体Na+,K+-ATP酶和Ca2+-ATP酶活性,以及线粒体呼吸链复合体Ⅰ、Ⅳ活性的影响,从能量代谢角度了解其具体作用机制。
1 材料与方法
1.1 实验动物与试剂 清洁级近交系Wistar大鼠,雄性,10周龄,体重200~250 g,北京市实验动物中心提供,实验期间以常规鼠饲料喂养,自由摄食、饮水,动物房温度维持在(22±3)℃,相对湿度为(50±20)%。Angeli′s salt(AS,一种经典的亚硝酰氢供体)购自美国Cayman公司。线粒体Na+,K+-ATP酶和Ca2+-ATP酶活性测定试剂盒购于南京建成生物公司。线粒体呼吸链复合体酶Ⅰ、Ⅳ活性检测试剂盒购自上海杰美公司。
1.2 心力衰竭模型制作 大鼠称重后以1%戊巴比妥钠40 mg/kg腹腔麻醉,备皮,仰卧固定,行气管插管,连接动物呼吸机(潮气量10 ml/kg,呼吸频率80次/min,吸呼比1∶1),监测心电图。常规强力碘消毒,于胸骨左侧第3、4肋间开一横切口,暴露心脏,由左心耳下方2~3 mm结扎左冠状动脉前降支。结扎即刻心电监护显示肢导R波振幅明显升高,随后Ⅰ、Ⅱ、Ⅲ、aVL、aVF和V3导联ST段弓背向上抬高>0.2 mV,并呈动态演变过程。1周时复查心电图可见病理性Q波为心肌梗死模型制作成功。心肌梗死4周后做超声心动图检测示LVEF≤45%为心力衰竭模型成功标志[6]。
1.3 分组及给药 35只Wistar大鼠,分为假手术组8只,施行假手术而不进行药物干预,常规饲养;其余27只大鼠制作心肌梗死模型,心肌梗死4周后心力衰竭模型制作成功16只,随机分为2组:心力衰竭模型对照组8只,给予生理盐水2 ml皮下注射,亚硝酰氢组8只,给予AS以0.1 mg/100 g皮下注射,分别干预4周。
1.4 实验方法
1.4.1 心肌线粒体的提取 利用差速离心的方法提取心肌线粒体。取各组大鼠心室肌组织,剪碎,置于7 ml 0.3 mol/L蔗糖、10 mmol/L咪唑(pH 7.4,4℃)溶液中,使用电动玻璃匀浆器进行研磨,组织匀浆液在4℃条件下使用低温超速离心机 800 g,离心10 min,弃沉淀,取上清液再次离心,4℃,10 000 g,离心20 min,得到少量沉淀,再用洗液(25 mmol/L蔗糖、75 mmol/L甘露糖,50 μmol/L EGTA、0.1 mol/L KCl,pH 7.4,4℃)洗1遍,再次10 000 g离心20 min,沉淀物即为心肌线粒体。上清用于提取肌浆网。20 mmol/L HEPES,0.1 mmol/L KCl(pH 6.8,25℃)溶解沉淀。线粒体蛋白含量用Folin-酚法(Lowry法)测定。
1.4.2 线粒体Na+,K+-ATP酶和Ca2+-ATP酶的测定 采用分光光度法测定心肌线粒体Na+,K+-ATP酶和Ca2+-ATP酶的活性,超微量ATP酶试剂盒购于南京建成生物公司。用岛津UV-2450紫外/可见分光光度计检测其吸光度值(A),结果用U/mgprot表示。
1.4.3 心肌线粒体呼吸链复合体酶Ⅰ、Ⅳ活性的检测 按照上海杰美基因医药科技有限公司试剂盒说明书测定,用分光光度法分别在340 nm(复合体酶Ⅰ)和550 nm(复合体酶Ⅳ)处测定。心肌线粒体呼吸链复合体酶Ⅰ比活性=[(△A样品-△A背景)×样品稀释倍数]/[0.1(样品质量,mg)×6.22]/线粒体蛋白浓度。心肌线粒体呼吸链复合体酶Ⅳ比活性=[(△A样品-△A背景)×样品稀释倍数]/[0.1(样品质量,mg)×21.84]/线粒体蛋白浓度。以牛血清白蛋白为标准,应用Folin-酚法测定各组线粒体蛋白浓度。
1.5 统计学方法 采用SPSS 18.0统计软件进行分析。计量资料以±s表示,多样本均数比较采用单因素方差分析,组间比较方差齐时采用q检验,方差不齐时采用Tamhane检验。P<0.05认为差异有统计学意义。
2 结果
2.1 各组大鼠心肌线粒体Na+,K+-ATP酶活性比较 用药前与假手术组比较,模型组及HNO组大鼠Na+,K+-ATP酶活性明显降低(P<0.01),模型组、HNO组两组之间未见统计学差异。用药后,与模型组比较,HNO组Na+,K+-ATP酶活性明显增加(P<0.05)。见表1。
2.2 各组大鼠线粒体Ca2+-ATP酶活性比较 用药前与假手术组比较,模型组及HNO组大鼠Ca2+-ATP酶活性明显降低(P<0.01),模型组、HNO组两组之间比较未见统计学差异。用药后与模型组比较,HNO组Ca2+-ATP酶活性明显增加(P<0.05)。见表2。
表1 各组大鼠心肌线粒体Na+,K+-ATP酶活性比较(±s)

表1 各组大鼠心肌线粒体Na+,K+-ATP酶活性比较(±s)
注:与假手术组比较,aP<0.01;与心衰模型组比较,bP<0.05
组别 例数 Na+,K+-ATP酶(U/mgprot)用药前 用药后假手术组 8 54.62±6.40 53.92±5.16模型组 8 38.03±4.13a 37.99±3.25aHNO组 8 37.26±3.43a 42.64±4.13ab
表2 各组大鼠心肌线粒体Ca2+-ATP酶活性比较(±s)

表2 各组大鼠心肌线粒体Ca2+-ATP酶活性比较(±s)
注:与假手术组比较,aP<0.01;与心衰模型组比较,bP<0.05
组别 例数 Ca2+-ATP酶(U/mgprot)用药前 用药后假手术组 8 47.88±4.43 47.92±4.14模型组 8 28.13±2.13a 27.91±4.25aHNO组 8 27.96±3.01a 32.44±3.13ab
2.3 各组大鼠线粒体呼吸链复合体酶CI、CIV活性比较 与假手术组比较,模型组及HNO组大鼠CI、CIV活性明显下降(P<0.01);与模型组相比,HNO组CI、CIV活性有所增加(P<0.05)。见表3。
表3 各组大鼠心肌线粒体呼吸链复合体酶CI、CIV活性比较(±s)
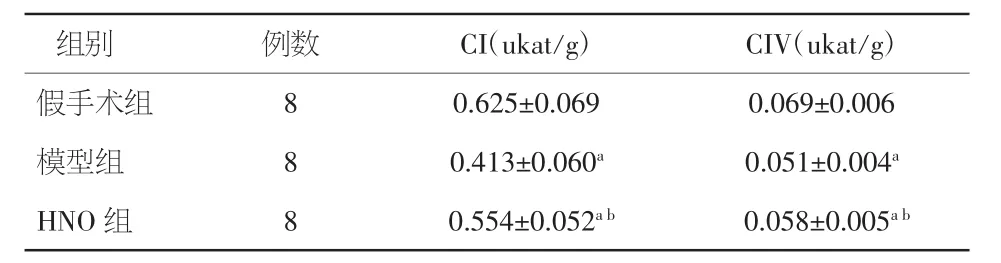
表3 各组大鼠心肌线粒体呼吸链复合体酶CI、CIV活性比较(±s)
注:与假手术组比较,aP<0.01;与心衰模型组比较,bP<0.05
组别 例数假手术组 8 0.625±0.069 0.069±0.006模型组 8 0.413±0.060a 0.051±0.004aHNO组 8 0.554±0.052ab 0.058±0.005abCI(ukat/g) CIV(ukat/g)
3 讨论
心力衰竭目前仍是威胁全世界人类健康的主要疾病之一[7-9]。心脏是高耗氧器官,心肌组织唯一能够直接利用的能量形式是ATP,心肌细胞必须不断合成ATP才能维持正常的泵功能和细胞活力。ATP产生主要是通过线粒体的呼吸链氧化磷酸化途径实现的,故线粒体内膜/外膜及基质上酶复合物的含量及活性在能量代谢过程中起着极其重要的作用。多项实验[9-11]表明,心肌线粒体功能障碍在心室重构和能量代谢失衡中起重要作用。研究心衰线粒体上主要酶活性的变化对于改善能量代谢的机制十分必要。我们前期实验[5]表明,HNO可使心力衰竭大鼠LVEF明显提高,LVDD、LVSD、NTProBNP及心率显著下降,对心力衰竭起到了有益的治疗作用,但其具体的作用机制是否与改善线粒体功能相关尚不明确。为此,我们在前期研究的基础上进一步探讨了亚硝酰氢对心力衰竭大鼠心肌线粒体功能的影响。
本实验结果显示,与假手术组相比,模型组大鼠心肌线粒体Na+,K+-ATP酶、Ca2+-ATP酶及呼吸链复合体酶Ⅰ、Ⅳ的活性显著下降,差异有统计学意义,这也进一步说明线粒体的功能障碍对心衰的发生发展有着重要的促进作用[12]。Na+,K+-ATP酶和Ca2+-ATP酶都是P型ATP酶(P-type ATPase),广泛存在于线粒体膜上,可通过水解ATP来维持膜内外离子平衡,在物质运送、能量转换及信息传递方面具有重要作用。呼吸链复合体酶Ⅰ、Ⅳ在能量代谢中起着非常重要的作用,其活性变化可直接或间接反映线粒体呼吸功能的变化[13]。本研究结果表明,与假手术组相比,模型组大鼠心肌线粒体Na+,K+-ATP酶、Ca2+-ATP酶及呼吸链复合体酶Ⅰ、Ⅳ活性明显下降,心衰大鼠心肌细胞对钙离子的处理能力降低,说明大鼠心力衰竭后出现能量代谢障碍,心功能下降;而给予HNO干预4周后,大鼠心肌线粒体Na+,K+-ATP酶、Ca2+-ATP酶及呼吸链复合体酶Ⅰ、Ⅳ活性较模型组明显增加,线粒体功能改善后其心功能亦有所改善,心力衰竭也得到一定程度的缓解,说明HNO供体AS可以改善冠心病心力衰竭大鼠的线粒体功能进而改善心脏功能。线粒体Na+,K+-ATP酶和Ca2+-ATP酶位于线粒体内膜中,可维持线粒体膜电化学梯度,是线粒体结构、功能变化的灵敏指标。由于Ca2+-ATP酶是心肌细胞内回收钙离子,使细胞质中钙离子迅速减低发挥心脏舒张功能的主要蛋白,所以我们推断AS可以通过增加肌浆网Ca2+-ATP酶的活性使其对钙离子转运能力增强,从而改善心脏的收缩、舒张功能。
可见,HNO可以增加衰竭心脏心肌细胞线粒体Na+,K+-ATP酶、Ca2+-ATP酶及呼吸链复合体酶Ⅰ、Ⅳ的表达,促进钙离子重吸收,增加肌浆网内钙离子储存量,使细胞质中的钙离子迅速减少,改善心脏收缩、舒张功能,这也许是HNO改善心力衰竭大鼠心脏功能的一种分子机制。本研究证实HNO可通过改善线粒体膜上主要酶活性而改善心脏功能,为治疗心力衰竭、延缓心衰进展提供了新的思路。
[1]Song R,Zhu S,Zhang H,et al.ATPase may play a critical role in disturbance of energy metabolism in congestive heart failurerats.Int J Clin Exp Med,2014,7:3654-3658.
[2]Kuai Q,Wang C,Wang Y,et al.Energy metabolism regulated by HDAC inhibitor attenuates cardiac injury in hemorrhagic rat model.Sci Rep,2016,6:38219.
[3]O′Malley M,Fong H,Sánchez ME,et al.Inhalation of phosphine gas following a fire associated with fumigation of processed pistachio nuts.Agromedicine,2013,18:151-173.
[4]Peshin SS,Srivastava A,Halder N,et al.Pesticide poisoning trend analysis of 13 years:a retrospective study based on telephone calls at the National Poisons Information Centre,All India Institute of Medical Sciences.New Delhi J Forensic Leg Med,2014,22:57-61.
[5]郭彦青,张东凤,徐继尧,等.亚硝酰氢对心力衰竭大鼠心脏功能及肌浆网钙泵蛋白表达的影响.中国医药,2016,12:1774-1778.
[6]WANG XF,QU XQ,Zhang TT,et al.Testosterone suppresses ventricular remodeling and improves left ventricular function in rats following myocardial infarction.Exp Ther Med,2015,9:1283-1291.
[7]Savic-Radojevic A,Pljesa-Ercegovac M,Matic M,et al.Novel Biomarkers of Heart Failure.Adv Clin Chem,2017,79:93-152.
[8]Denfeld QE,Winters-Stone K,Mudd JO,et al.Frequency of and Significance of Physical Frailty in Patients With Heart Failure.Am J Cardiol,2017,9149:30045-30050.
[9]Brown DA,Perry JB,Allen ME,et al.Expert consensus document:Mitochondrial function as a therapeutic target in heart failure.Nat Rev Cardiol,2016.[Epub ahead of print].
[10]Bayeva M,Gheorghiade M,Ardehali H.Mitochondria as a therapeutic target in heart failure.J Am Coll Cardiol,2013,61:599-610.
[11]Sabbah HN.Targeting mitochondrial dysfunction in the treatment of heart failure.Expert Rev Cardiovasc Ther,2016,14:1305-1313.
[12]Knowlton AA,Chen L,Malik ZA.Heart failure and mitochondrial dysfunction:the role of mitochondrial fission/fusion abnormalities and new therapeutic strategies.J Cardiovasc Pharmacol,2014,63:196-206.
[13]Penna C,Perrelli MG,Pagliaro P.Mitochondrial pathways,permeability transition pore, and redox signaling in cardioprotection: therapeutic implications. Antioxid Redox Signal,2013,18:556-599.
Effect of nitroxyl hydrogen on myocardial mitochondrial function in rats with heart failure of coronary heart disease
GUO Yan-qing,XU Ji-yao,WANG Ri-jun,et al.Department of Cardiology,Cardiovascular Hospital of Shanxi Province,Taiyuan 030024,China Corresponding author:WANG Jing-ping,E-mail:azgyq@sohu.com
ObjectiveTo investigate the effects of nitroxyl hydrogen on activity of Na+,K+-ATP enzyme and Ca2+-ATP enzyme and mitochondrial respiratory chain complexⅠ andⅣ in rats with heart failure after myocardial infarction.MethodsRats heart failure model was made by ligated left coronary artery anterior descending branch.35 Wistar rats were randomly divided into 3 groups including sham-operated group,heart failure group,treated with hydrogen nitrosyl group.The rats were given subcutaneous injection of 0.9%2 ml saline or nitrosyl hydrogen donor 0.1 mg/100 g for 4 weeks.The activity of Na+,K+-ATP enzyme and Ca2+-ATP enzyme and mitochondrial respiratory chain complexⅠ andⅣ was measured by using ultraviolet spectrophotometry after centrifugation of mitochondria.ResultsThe activity of Na+,K+-ATP enzyme[(37.99±3.25)U/mgprot vs(42.64±4.13)U/mgprot]and Ca2+-ATP enzyme[(27.91±4.25)U/mgprot vs(32.44±3.13)U/mgprot]and mitochondrial respiratory chain complexⅠ andⅣ[(0.413±0.060)ukat/g vs(0.554±0.052)ukat/g,(0.051±0.004)ukat/g vs(0.058± 0.005)ukat/g]in HNO group was increased significantly compared with the model group.ConclusionHNO improves cardiac function of heart failure rats by increasing mitochondrial activity of Na+,K+-ATP enzyme and Ca2+-ATP enzyme and mitochondrial respiratory chain complexⅠ andⅣ.
HNO; Na+,K+-ATP enzyme; Ca2+-ATP enzyme; Respiratory chain
10.3969/j.issn.1672-5301.2017.08.024
Q95-33;R541.4
A
1672-5301(2017)08-0760-04
2017-02-21)
山西省应用基础研究项目(面上青年基金项目)(项目编号:201601D021156)
030024 山西省太原市,山西省心血管病医院心内科
王敬萍,E-mail:azgyq@sohu.com
