索拉非尼对肝癌细胞中PD-L1表达的影响及机制
2017-08-31刘林森龙文汀张悦刘树旺刘利平
刘林森,龙文汀,张悦,刘树旺,刘利平
(1深圳市人民医院·暨南大学第二临床医学院,广东深圳 518020;2北京大学深圳医院)
索拉非尼对肝癌细胞中PD-L1表达的影响及机制
刘林森1,龙文汀2,张悦1,刘树旺1,刘利平1
(1深圳市人民医院·暨南大学第二临床医学院,广东深圳 518020;2北京大学深圳医院)
目的 探讨索拉非尼对肝癌细胞中程序性死亡分子配体1(PD-L1)表达的影响及可能的机制。方法 分别将0、2.5、5、10 μmol /L 索拉菲尼培养液作用于肝癌细胞株HepG2,Real-time PCR和Western blotting法检测不同浓度索拉菲尼处理后HepG2细胞中PD-L1和缺氧诱导因子1α(HIF-1α)的表达水平。分别用pEGFP-N1-HIF-1α(pEGFP-N1-HIF-1α组)、shRNA-HIF-1α(shRNA-HIF-1α组)和对照质粒pEGFP-N1、shRNA-control(pEGFP-N1组、shRNA-control组)转染HepG2细胞,检测各组HIF-1α、PD-L1 mRNA及蛋白的表达。结果 索拉菲尼干预后,HepG2细胞中PD-L1和HIF-1α mRNA及蛋白的表达下调,呈浓度依赖性(P均<0.05)。与pEGFP-N1组比较,pEGFP-N1-HIF-1α组PD-L1、HIF-1α mRNA及蛋白表达水平升高(P均<0.01);与shRNA-control组比较,shRNA-HIF-1α组PD-L1、HIF-1α mRNA及蛋白表达水平降低(P均<0.01)。结论 索拉非尼可通过抑制HIF-1α信号通路抑制肝癌细胞中PD-L1的表达。
肝肿瘤;索拉非尼;程序性死亡分子配体1;缺氧诱导因子1α
肝癌是我国常见的恶性肿瘤,起病隐匿,多数患者确诊时已是晚期[1]。晚期肝癌的治疗方法非常有限,索拉非尼是目前治疗晚期肝癌的主要药物之一,其能够同时抑制肝癌细胞增殖和肿瘤血管生长,延长了晚期肝癌患者的生存时间[2,3]。最近有文献报道,索拉非尼还可以增强CD8+T细胞的免疫功能,减少程序性死亡分子受体 1(PD-1)阳性的CD8+T细胞的比例和减少免疫抑制细胞Treg细胞及骨髓来源的抑制性细胞的数量,从而逆转肝癌组织的局部免疫抑制状态[4,5]。程序性死亡分子配体1(PD-L1)是PD-1的配体,通过与T 淋巴细胞表面的PD-1蛋白结合,抑制T淋巴细胞的增殖与活化,导致了肿瘤免疫失活和免疫逃逸[6]。PD-L1在肝癌组织中高表达,与患者预后呈负相关[7,8]。我们前期研究显示,索拉非尼可抑制缺氧诱导因子1α(HIF-1α)的表达[9],有文献报道,HIF-1α可以上调PD-L1的表达[10,11]。2016年6月~2017年2月,本研究探讨了索拉非尼对肝癌细胞PD-L1表达的影响及机制。现报告如下。
1 材料与方法
1.1 材料 肝癌细胞HepG2购自中国细胞库典藏细胞中心,采用含10%胎牛血清(FBS)的DMEM培养液,置于37 ℃二氧化碳培养箱中培养;脂质体转染试剂lipofectamine 2000为美国Life Technologies公司产品,DMEM、FBS购于Hyclone公司,PCR 引物由Invitrogen公司合成。鼠抗人HIF-1α单克隆抗体购于Santa Cruz 公司。HIF-1α过表达质粒pEGFP-N1-HIF-1α、HIF-1α干扰质粒shRNA-HIF-1α和对照质粒购自上海吉凯基因化学技术有限公司。索拉非尼购于LC Labortories公司。Cocl2购于Sigma公司。
1.2 细胞处理 将HepG2细胞种植于6孔板中,经24 h 贴壁后,分别加入含0、2.5、5、10 μmol/L索拉菲尼的培养液,同时加入100 μmol/L Cocl2作用24 h,收获细胞,提取RNA和总蛋白。分别用pEGFP-N1-HIF-1α(pEGFP-N1-HIF-1α组)、shRNA-HIF-1α(shRNA-HIF-1α组)和对照质粒pEGFP-N1、shRNA-control(pEGFP-N1组、shRNA-control组)转染HepG2细胞,按照说明书步骤操作,48 h后收获细胞提取RNA和总蛋白。
1.3 HepG2细胞中PD-L1和HIF-1α mRNA的表达 采用Real-time PCR法。测RNA的浓度和纯度后取1 μg mRNA逆转录成cDNA,10倍稀释后使用。HIF-1α引物序列:上游:5′-ACTTCTGGATGCTGGTGATTTG-3′,下游:5′-GCTTCGCTGTGTGTTTTGTTCT-3′。PD-L1引物序列:上游:5′-CATTTGCTGAACGCCCCATA-3′,下游:5′-CTGCTTGTCCAGATGACTTCG-3′。内参照β-actin引物序列:上游:5′-AGAGGGAAATCGTGCGTGAC-3′,下游:5′-CAATAGTGATGACCTGGCCGT-3′。总反应体积为20 μL:sybrGreen Mix 10 μL,cDNA模板2 μL,上游引物(10 μmol/L) 0.8 μL,下游引物(10 μmol/L)0.8 μL,去离子水6.4 μL。反应条件:95 ℃变性1 min,40次循环内95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸30 s,最后72 ℃延伸10 min。重复3次。反应结束时在ABI 7 000软件系统中分别调整基线和阈值,计算出各反应孔的Ct值。Ct值代表基因的拷贝数,ΔΔCt=(目的基因Ct-内参基因Ct)/(阴性对照Ct-内参基因Ct),基因表达的变化倍率=2-ΔΔCt。
1.4 HepG2细胞中HIF-1α和PD-L1蛋白表达的检测 采用Western blotting法。蛋白定量后分别经10%的聚丙烯酰胺凝胶电泳转移至硝酸纤维素膜上。加入鼠抗人HIF-1α单克隆抗体1∶250稀释;鼠抗人PD-L1单克隆抗体1∶500稀释;鼠抗人β-actin单克隆抗体1∶2 000稀释。加入HRP标记的兔抗鼠二抗,1∶2 000稀释。ECL显色,计算机扫描蛋白质条带并作灰度分析。以β-actin作内参照, 分别用PD-L1/β-actin、HIF-1α/β-actin代表PD-L1、HIF-1α的相对表达水平,每个样本重复3次。

2 结果
2.1 不同浓度索拉非尼作用后HepG2细胞PD-L1和HIF-1α表达的变化 0、2.5、5、10 μmol/L索拉非尼处理后,HepG2细胞PD-L1 mRNA相对表达量分别为1.00±0.01、0.68±0.02、0.45±0.02、0.25±0.01,HIF-1α mRNA相对表达量分别为1.00±0.03、0.97±0.04、0.95±0.03、0.91±0.06;PD-L1 蛋白相对表达量分别为1.00±0.03、0.41±0.05、0.26±0.04、0.16±0.03,HIF-1α 蛋白相对表达量分别为1.00±0.02、0.69±0.06、0.24±0.05、0.13±0.02。HepG2细胞经过2.5、5、10 μmol/L索拉非尼处理后,无论mRNA水平还是蛋白水平,PD-L1、HIF-1α表达均降低(P均<0.01),不同浓度间各指标比较,P均<0.01,索拉非尼导致二者水平降低且呈浓度依赖性(P<0.01)。
2.2 各组HIF-1α、PD-L1表达的比较 见表1。
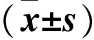
表1 各组HIF-1α、PD-L1表达的比较
注:与pEGFP-N1组比较,*P<0.01;与shRNA-control组比较,#P<0.01。
3 讨论
索拉非尼是一种口服的多种激酶抑制剂,一方面,抑制包括C-Raf、B-Raf 在内的丝/苏氨酸蛋白激酶活性,阻碍Raf/MEK/ERK通路的信号传导,诱导肿瘤细胞凋亡;另一方面,抑制多种与新生血管生成和肿瘤发展相关的受体酪氨酸激酶活性,包括与促血管生成相关的VEGFR-2 、VEGFR-3和 PDGFR-β,与肿瘤生成相关的c-kit和Flt-3等,阻断肿瘤新生血管生成,间接抑制肿瘤细胞生长[2,3]。除此之外,文献报道,索拉非尼还可以逆转肝癌的免疫抑制状态[4,5]。
免疫抑制和免疫逃逸是肿瘤发生、发展的主要原因[6]。研究发现,免疫抑制与免疫逃逸和肿瘤细胞PD-L1的过表达密切相关。肿瘤细胞可通过其表面的PD-L1与免疫细胞T细胞表面的PD-1结合,传导抑制性信号,使得T细胞不能识别肿瘤细胞和向肿瘤细胞发出攻击信号,导致了肿瘤细胞的免疫逃逸[6]。多种肿瘤组织中PD-L1高表达的患者预后较差,较易出现复发和转移[7~9]。因此阻断PD-L1或下调PD-L1的表达有可能恢复T细胞对肿瘤的杀伤功能,抑制肿瘤复发和转移。目前PD-L1抗体在临床抗肿瘤治疗中也获得了较好的疗效。
研究发现,肿瘤细胞的PD-L1过表达和缺氧微环境密切相关。缺氧条件下,PD-L1可在HIF-1α的诱导下上调其在肿瘤细胞、巨噬细胞、骨髓来源的抑制性细胞及树突状细胞中的表达,其作用非常迅速且具有一定的选择性,其在肿瘤区域中的表达相对外周淋巴器官(脾脏) 有明显差异[10,11]。当使用HIF-1α信号通路阻断剂时,肿瘤细胞表面的PD-L1表达下降,肿瘤细胞对CTL 细胞介导的溶解作用的耐受性下降,进一步提示了HIF-1α在由PD-L1介导的免疫抑制和免疫逃逸中的关键作用[12]。
我们前期研究发现索拉非尼可通过阻断mTOR/p70S6K/4E-BP1和ERK信号通路阻断HIF-1α的表达[9]。本研究结果显示,索拉菲尼干预后,HepG2细胞中PD-L1和HIF-1α的表达下调,呈浓度依赖性。上调HIF-1α的表达后PD-L1的表达上调,干扰HIF-1α的表达后PD-L1的表达下调。提示索拉非尼可通过抑制HIF-1α信号通路抑制PD-L1蛋白及基因的表达,且呈浓度依赖性。索拉非尼可能一定程度上恢复了T细胞对肝癌细胞的免疫杀伤作用,这可能是其有效治疗肝癌又一新的作用机制。本研究观察都是基于细胞水平,尚需通过动物实验和体内实验进一步验证。
[1] Grandhi MS, Kim AK, Ronnekleiv-Kelly SM, et al. Hepatocellular carcinoma: from diagnosis to treatment[J]. Surg Oncol, 2016,25(2):74-85.
[2] Keating GM. Sorafenib: review in hepatocellular carcinoma[J]. Target Oncol, 2017,12(2):243-253.
[3] Mazzoccoli G, Miele L, Oben J, et al. Biology, epidemiology, clinical aspects of hepatocellular carcinoma and the role of sorafenib[J]. Curr Drug Targets, 2016,17(7):783-789.
[4] Chuang HY, Chang YF, Liu RS, et al. Serial low doses of sorafenib enhance therapeutic efficacy of adoptive T cell therapy in a murine model by improving tumor microenvironment[J]. PLoS One, 2014,9(10):e109992.
[5] Chen ML, Yan BS, Lu WC, et al. Sorafenib relieves cell-intrinsic and cell-extrinsic inhibitions of effector T cells in tumor microenvironment to augment antitumor immunity[J]. Int J Cancer, 2014,134(2):319-331.
[6] Iwai Y, Hamanishi J, Chamoto K, et al. Cancer immunotherapies targeting the PD-1 signaling pathway[J]. J Biomed Sci, 2017,24(1):26.
[7] Calderaro J, Rousseau B, Amaddeo G, et al. Programmed death ligand 1 expression in hepatocellular carcinoma: relationship with clinical and pathological features[J]. Hepatology, 2016,64(6):2038-2046.
[8] Jung HI, Jeong D, Ji S, et al. Overexpression of PD-L1 and PD-L2 is associated with poor prognosis in patients with hepatocellular carcinoma[J]. Cancer Res Treat, 2017,49(1):246-254.
[9] Liu LP, Ho RL, Chen GG, et al. Sorafenib inhibits hypoxia-inducible factor-1α synthesis: implications for antiangiogenic activity in hepatocellular carcinoma[J]. Clin Cancer Res, 2012,18(20):5662-5671.
[10] Noman MZ, Desantis G, Janji B, et al. PD-L1 is a novel direct target of HIF-1α, and its blockade under hypoxia enhanced MDSC-mediated T cell activation[J]. J Exp Med, 2014,211(5):781-790.
[11] Koh J, Jang JY, Keam B, et al. EML4-ALK enhances programmed cell death-ligand 1 expression in pulmonary adenocarcinoma via hypoxia-inducible factor (HIF)-1α and STAT3[J]. Oncoimmunology, 2015,5(3):e1108514.
[12] Fontugne J, Augustin J, Pujals A, et al. PD-L1 expression in perihilar and intrahepatic cholangiocarcinoma[J]. Oncotarget, 2017,8(15):24644-24651.
Effect of sorafenib on expression of PD-L1 in hepatocellular carcinoma cells
LIULinsen1,LONGWenting,ZHANGYue,LIUShuwang,LIULiping
(ShenzhenPeople'sHospital,Shenzhen518020,China)
Objective To investigate the effect of sorafenib on the expression of programmed cell death ligand 1(PD-L1) in the hepatocellular carcinoma cells and the underlying mechanism. Methods Real-time PCR and Western blotting was applied to detect the mRNA and protein expression levels of PD-L1 and hypoxia-inducible factor-1α (HIF-1α) in HepG2 cells treated with 0, 2.5, 5, 10 μmol/L sorafenib, respectively. HepG2 cells were transfected with pEGFP-N1-HIF-1α (pEGFP-N1-HIF-1α group), shRNA-HIF-1α (shRNA-HIF-1α group) and the control plasmids including pEGFP-N1 and shRNA-control (pEGFP-N1 group, shRNA-control group), and then the mRNA and protein expression levels of HIF-1α and PD-L1 were detected. Results The mRNA and protein expression levels of PD-L1 and HIF-1α in HepG2 cells were down-regulated after sorafenib intervention in a dose-dependent manner (bothP<0.05). Compared with the pEGFP-N1 group, the mRNA and protein expression levels of PD-L1 and HIF-1α increased in the pEGFP-N1-HIF-1α group (bothP<0.01). Meanwhile, compared with the shRNA-control group, the mRNA and protein expression levels of PD-L1 and HIF-1α significantly decreased in the shRNA-HIF-1α group (bothP<0.01).Conclusions Sorafenib can inhibit the expression of PD-L1 in liver cancer cells through inhibiting HIF-1α signaling pathway.
liver neoplasms; sorafenib; programmed cell death ligand 1; hypoxia-inducible factor-1α
国家自然科学基金青年基金项目(81402041);深圳市科技创新项目(JCYJ20160422170206664,JCYJ20150403101028198)。
刘林森(1982-),男,硕士,主要研究方向为肝癌的基础与临床。E-mail: 38284540@qq.com
刘利平(1982-),男,副主任医师,主要研究方向为肝癌的基础和临床。E-mail: leoliping@aliyun.com
10.3969/j.issn.1002-266X.2017.29.002
R735.7
A
1002-266X(2017)29-0005-03
2017-04-08)
