参附注射液30 106例上市后临床安全性医院集中监测
2017-08-30王志飞喻锦扬谢雁鸣��
王志飞 喻锦扬 谢雁鸣 ��


[摘要]该文报告了参附注射液的安全性主动监测。监测采用前瞻性、多中心、大样本、登记注册式医院集中监测模式,并设置了严格的三级质控和防漏报机制。监测于2012年2月—2015年6月在28家二级和三级医院登记患者30 106例,发现ADE 114例,经三级判定明确ADR 23例,ADR发生率为0076%,为罕见水平,95% CI(0045%,0108%)。ADR的主要表现为皮疹、瘙痒、注射部位不适、恶心、呕吐、腹痛、头晕、胸闷、心悸、寒战、发热和呼吸困难,未监测到严重ADR。过敏史、给药途径、剂量、溶媒、给药浓度、合并用药可能会影响参附注射液ADR的发生。
[关键词]登记注册; 医院集中监测; 参附注射液; ADR特征; 影响因素; ADR发生率
Clinical safety imtensive hospital monitoring on Shenfu injection with 30 106 cases
WANG Zhifei1, YU Jinyang2, XIE Yanming1*
(1Institute of Basic Research in Clinical Medicine, China Academy of Chinese Medical Sciences, Beijing 100700, China;
2 Center for ADR Monitoring of Guangdong, Guangzhou 510080, China)
[Abstract]This paper is to report the implementation and results of safety monitoring of Shenfu injection Prospective, multicenter, large sample, registrytype centralized hospital monitoring mode was used, and the threelevel quality control and antiomissive mechanisms were used strictly In the monitoring was carried out in 28 hospitals and lasted for 4 years 30 106 patients were registered; ADE occurred in 114 patients, and ADR was identified in 23 patients with an incidence rate of 0076% for ADR [95% confidence interval (0045%,0108%), which was in a rare level The main ADRs included rash, pruritus, discomfort at the site of the infusion, nausea, vomiting, abdominal pain, dizziness, chest tightness, heart palpitations, chills, fever and dyspnea No severe ADRs were found in the monitoring This paper also fund that history of allergy, methods of administration, dosage, solvent, concentration, and combined medication may affect the incidence of ADR in the use of Shenfu injection
[Key words]registration; centralized hospital monitoring; Shenfu injection; ADR; influence factors; the incidence rate of ADR
参附注射液(国药准字号Z20043116)是中医回阳救逆古方参附汤经分离提取,灭菌制成,由红参和附子组成,作为治疗心衰、休克、心肌梗塞及肿瘤放疗、化疗用药,均取得良好疗效[1]。参附注射液前期已开展了药学、药理、毒理等研究[25],并完成了文献、医院信息系统数据和国家不良反应监测中心自发呈报系统数据的分析[612]。然而,要想全面把握参附注射液的临床安全性还须有针对性地开展安全性主动监测,一方面可以明确ADR发生率,另一方面也可使以上各个来源的证据通过安全性主动监测联系起来,相互呼应,呈现出较明确的统一指向。基于上述认识设计并实施了参附注射液安全性主动监测,现报告如下。
1资料与方法
11监测目的
明确参附注射液ADR发生率,包括已知ADR发生率、新的ADR发生率、各ADR症状的发生率和各细分人群的ADR发生率等;明确参附注射液ADR临床特征;探讨参附注射液ADR发生的影响因素;掌握参附注射液的临床用药情况。
12监测设计
设计类型为前瞻性登记注册式医院集中监测,监测人群为监测医院监测期内使用参附注射液的患者。根据国际通行的3例原则,按照中药注射剂ADR发生率约001%的水平计算,监测样本量为3万例。结合文献报道的ADR发生时间,从用药开始即密切观察30 min,30 min以后采取医护人员定期检查的方法或由病人主动汇报的方法观察。
主要监测指标:参附注射液用药患者在住院期间的ADE和ADR,包括住院期间出现的死亡和疾病异常加重,医师、护师、药师上报的ADE和实验室检查指标变化。评价标准:根据国家食品药品监督管理總局药品安全监管司、国家药品不良反应监测中心2005年9月发布的《药品不良反应报告和监测工作手册》推荐的关联性评价来确定ADE与药品的关系。
13质量控制与数据管理
131三级质控一级检查为各监测中心内部核查,设定专职质控负责人,所有调查表均进行核查和验收;二级监查由牵头单位负责,制定监查计划,按照既定监查频率或有因监查;三级稽查是课题组对一级单位、牵头单位的全面质控,旨在发现和解决项目共性问题。
132偏倚控制制订防漏报机制,根据各监测中心实际情况建立监测流程并通过专家委员会论证;监测数据与医院信息系统数据复核,保证监测人群无漏报;通过专人负责、多重巡检最大程度减少ADR漏报。
133数据管理采用纸质监测表填写,在线数据采集系统双人独立录入,机器逻辑校验,人工核查、清理,并对疾病、药物和ADR编码。西医诊断数据编码采用《国际疾病分类标准编码》(ICD10);中医诊断(疾病和证候)采用中华人民共和国国家标准“中医病证分类与代码”(GB/T 156571995);西药数据编码采用世界卫生组织药物统计方法整合中心发布的“药物的解剖学、治疗学及化学分类法”(anatomical therapeutic chemical,ATC);中药数据编码采用中华人民共和国国家标准“全国主要产品分类与代码”(GB/T 763512002);ADR数据编码采用世界卫生组织不良反应术语集(the WHO adverse reaction terminology,WHOART)。
14统计分析
采用SAS 92统计软件进行描述性分析。正态分布计量资料描述均数、标准差、最小值、最大值,偏态分布计量资料描述中位数、上四分位数和下四分位数、最小值、最大值,分类资料描述频数及百分比;按泊松分布计算ADE/ADR发生率,并统计其95%CI。应用R软件进行影响因素分析,包括基于DMwR程序包进行SMOTE抽样、基于grpreg程序包建立Group LASSO分析模型、基于glinternet程序包进行强分层带交互效应的变量选择。
15伦理与国际注册
监测方案通过了中国中医科学院中医临床基础医学研究所伦理委员会,伦理批号2012NO96;方案在wwwclinicaltrialsgov上进行注册,注册号NCT01612633。
2结果
21一般情况
监测从2012年2月启动,到2015年6月结束。全国8个省市、28家医院加入本次监测。其中西医院21家,中医院7家;三级甲等医院24家,三级乙等医院1家,二级甲等医院3家;华东地区5家,华南地区14家,西南地区4家,华北地区4家,东北地区1家。
22ADR发生情况
221ADR发生率登记病例30 106例,共有114例发生了ADE,其中23例为ADR(表1),总体ADR发生率为0076%。根据“国际医学科学组织委员会”(CIOMS)推荐的5级标准(SFDA发布的《药品不良反应报告和监测工作手册》引用,判定为)罕见ADR。按泊松分布估计参附注射液ADR发生率的95%CI(0045%,0108%)(表2)。
222ADR表现23例ADR中,出现皮疹、瘙痒9例(3913%),注射部位不适(如疼痛、发红、酸痛等)4例(1739%),恶心、呕吐、腹痛3例(1304%),头晕4例(1739%),胸闷、心悸4例(1739%),寒战、发热3例(1304%),呼吸困难1例(435%)。23例ADR中,有6例新的ADR,症状主要表现为胸闷、胸口疼痛、注射部位疼痛、寒战、发热(表2)。
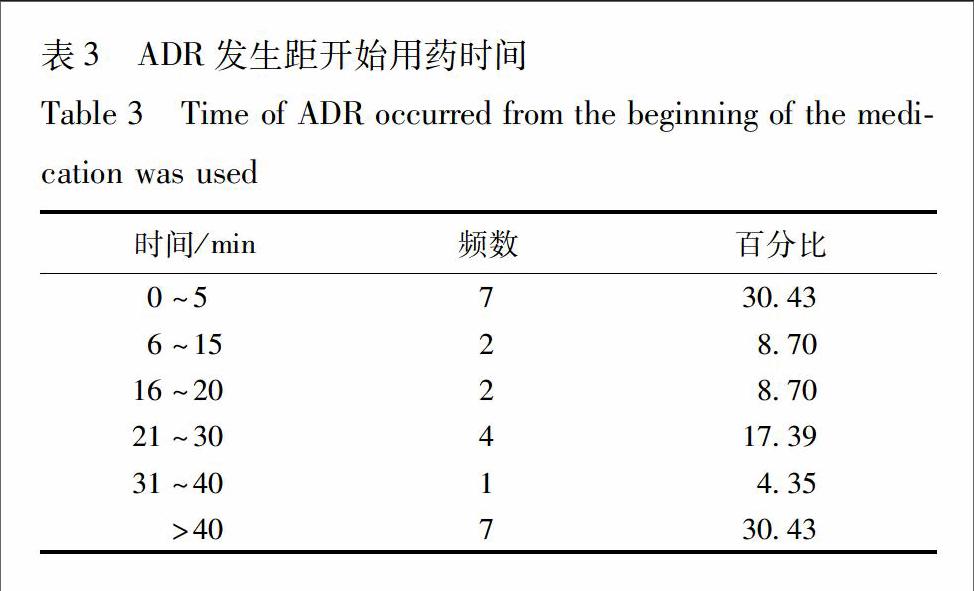
223ADR发生距离用药开始的时间23例ADR中发生于30 min以内占6522%(表3)。
224ADR的处理及转归ADR发生后给予停药、减药处理和(或)使用药物对症处理,也有病例给予外敷等处理。其中停药处理15例,减药处理4例,未停药或减药4例,2例未给予任何处理,1例给予冷热湿敷,1例换药处理,11例采用了药物对症处理,处理ADR的药品有美托洛尔、非那根、盐酸异丙嗪、葡萄糖、生理盐水、葡萄糖酸钙、托烷司琼、氯雷他定片、地塞米松针、苯海拉明针、西替利嗪分散片、安痛定。ADR转归分为痊愈、好转、未好转、不详、死亡。本次监测中,转归为痊愈的有12例,好转的有11例。
225停药或减量后ADR是否减轻停药或减量后的结果分为减轻、未减轻、不明、未停药或未减量。23例ADR中,停药或减量后ADR减轻的22例,未停药仅减量后ADR减轻的1例。
226再次使用后是否出现ADR再次使用后的结果分为出现ADR、未出现ADR、不明、未再次使用。本监测的23例ADR中,再次使用后出现ADR的1例、未出现ADR的1例、不明的0例、未再次使用的21例。
23ADR影响因素
231ADR发生率的比较从ADR的发生来看,中医院ADR发生率(0180%)比西医院(0040%)高,二级医院ADR发生率(0134%)比三级医院(0070%)高,女性ADR发生率(0115%)比男性(0039%)高,有过敏史人群ADR发生率(0308%)比无过敏史人群(0069%)高,静脉推注ADR发生率(0209%)比静脉滴注(0072%)高,非常规剂量ADR发生率(0167%)比常规剂量(0073%)高,溶媒为5%葡萄糖氯化钠注射液ADR发生率(0587%)比09%氯化钠注射液(0106%)和5%葡萄糖注射液(0039%)高,使用非说明书溶媒(0119%)比使用说明书溶媒(0038%) ADR发生率高,溶媒剂量100 mL的患者(0177%)比溶媒剂量为250 mL的患者ADR发生率(0063%)高,高浓度用药ADR发生率(0142%)比常规浓度(0063%)高。
232列联分析19~45岁有过敏史的患者ADR发生率较高;5%葡萄糖氯化钠注射液与氟尿嘧啶注射液合并用藥时ADR发生率较高;不使用溶媒的情况下合并拉唑类药物ADR发生率较高(监测发现有参附注射液不使用溶媒直接注射的情况)。
233Group LASSO模型分析患者有过敏史且使用09%氯化钠注射液为溶媒的时候发生ADR可能性大;用药天数5 d以上,并且合并头孢类药物时发生ADR可能性大;高浓度且合并拉唑类药物时发生ADR的可能性大;年龄19~45岁或用药天数7 d及以上且有呼吸道炎症时发生ADR可能性较大;采用较高浓度给药,年龄46~65岁时发生ADR可能性较大;年龄19~45岁且用药天数7 d及以上者发生ADR可能性较大;溶媒为5%葡萄糖注射液且浓度较高时发生ADR可能性大;溶媒为10%葡萄糖注射液且用药天数7 d以上发生ADR可能性大;溶媒同时使用5%葡萄糖注射液和09%氯化钠注射液时发生ADR可能性大。
3讨论
31医院集中监测的适用性
本次监测采用了医院集中监测的模式,医院集中监测是指在一定的时间、一定的范围内对某一医院或某一地区内所发生的ADR 及药物利用详细记录,以探讨ADR的发生规律[13]。本次监测仅观察住院患者的用药和ADR发生情况,也不对患者出院后的用药及ADR发生情况进行随访,因此无法观察到门诊、院外用药和远期的安全性问题。但是从参附注射液的特点来看,医院集中监测的模式是适宜的。参附注射液在临床主要作为治疗心衰、休克、心肌梗死及肿瘤放疗、化疗的辅助用药,主要在病房使用,较少用于门诊及作为院外用药。研究也发现,参附注射液1次滴注50~200 mL后,指标成分的半衰期t1/2:苯甲酰新乌头碱(BMA)为412~577 h,附子灵(FN)为155~215 h,人参皂苷Rg1为038~053 h,人参皂苷Rb1为6811~7336 h,人参皂苷Rc为8191~9301 h,可见药物代谢较快[14]。因此,医院集中监测用于参附注射液的安全性主动监测是适宜的。
32ADR表现
本次监测到的参附注射液ADR表现为皮疹、瘙痒、注射部位不适(如疼痛、发红、酸痛等)、恶心、呕吐、腹痛、头晕、胸闷、心悸、寒战、发热、呼吸困难。新发ADR主要表现为胸闷、胸口疼痛、注射部位疼痛、寒战、发热。这与文献研究结果不符。参附注射液的ADR文献提示其ADR主要为口舌干燥、咽痛(256%),面部潮红、发热/烦热(226%),头痛/头胀(111%),心悸/心动过速/心动过缓(146%),血压升高(35%),胃肠炎/腹部不适/恶心呕吐(55%),局部疼痛(5%),失眠(25%),皮疹(5%),出汗(25%),血压下降(1%),肝功能异常(05%),电解质紊乱(05%)[6]。本次监测中皮疹、瘙痒占比高达3913%,为最主要的ADR表现;而在文献报道中皮疹占比仅5%。
分析这一问题产生的原因,认为与不同的监测模式相关。本次监测是前瞻性、多中心的医院集中监测,参与中心多、人数多、时间长,监测更多地偏于规范化和流程化,虽然能最大程度减少漏报和瞒报,但对于较轻的、一过性的、非典型的ADE则较难发现;文献的个案报道是医护人员自发的临床观察,虽然覆盖面不广,但观察更加细致。因此中药的上市后安全性研究应兼顾多个来源的证据,注重多源证据的整合[15]。
33采用SMOTE+ Group LASSO方法分析ADR影响因素
中药的安全性主动监测,监测人群数量庞大但发现的ADR例数较少,形成严重的不平衡数据,导致多种统计方法的不适用。本文探索采用SMOTE+Group LASSO的方法解决这一问题。
SMOTE抽样方法通过将小子类扩增,大子类缩小以达到平衡的目的。在使用SMOTE抽样方法解决了数据不平衡的问题后,直接运用Logistic回归分析是可行的,但在自变量为分类变量或连续变量离散化的情况下,通常需要设置哑变量来进行分析,在原始变量被处理为多个哑变量并建模后,可以得到每个哑变量各自的beta系数估计值以及該估计值是否为0的检验,实际中通常会出现某原始变量的多个哑变量的beta系数估计值不能全部通过检验的情况。这就会给最终原始变量的解释带来困难。
该问题可以通过Group LASSO方法解决[16]。LASSO是一种变量选择方法,通过给变量系数加罚,使不重要的变量系数为0,从而删除该变量。为避免建模后出现多个哑变量中部分变量被选出而其他变量未被选出,本次分析使用了Group LASSO将由原变量拆分的多个哑变量集合为一个组,并保证这种情况下对应的一组变量都可以同时被选入或者不被选入模型。
基于SMOTE+Group LASSO筛选并分析影响因素的方法是针对严重不平衡数据的一次探索,虽得到一定结果,但其是否适用尚需进一步的研究。
34ADE/ADR发生率被低估的可能性分析
主动监测是药品上市后安全性研究的重要方法,但仍具有一定的局限性。本次监测遵循可疑即报的原则,并设置了严格的质量控制和偏倚控制,但ADE/ADR的发生率仍有可能被低估。ADE/ADR只有被识别才有可能被上报,但有些ADE/ADR为一过性的表现,当患者没有向医生报告时,往往被忽视;有些ADE/ADR表现较轻,可能会被忽略或被解释为疾病的自然进程。
另外,本监测考察了实验室指标的变化,但是由于属非干预性观察,大多数患者仅进行了一次检查,而且检查的内容也各不相同,这样从实验室指标变化的角度来分析ADE/ADR就存在一定局限性,也可能导致ADE/ADR的发生率被低估。
然而,医院集中监测对于严重ADR则一般不会漏报。而从临床意义、患者权益和品种发展来看,严重ADR的发现无疑更具现实意义。本次监测未发现严重ADR,说明药物的严重ADR发生率较低,后期应继续开展全生命周期的安全性监测。
4结论
参附注射液总体ADR发生率为0076%,属罕见ADR;按泊松分布估计其95%CI(0045%~0108%)。
参附注射液ADR表现为皮疹、瘙痒9例(3913%),注射部位不适(如疼痛、发红、酸痛等)4例(1739%),恶心、呕吐、腹痛3例(1304%),头晕4例(1739%),胸闷、心悸4例(1739%),寒战、发热3例(1304%),呼吸困难1例(435%)。新发ADR 6例,主要表现为胸闷、胸口疼痛、注射部位疼痛、寒战、发热。
对ADR发生的影响因素开展的探索性研究获得线索,提示过敏史、给药途径、剂量、溶媒、给药浓度、合并用药可能都会影响ADR的发生。建议临床使用参附注射液要严格遵循说明书要求,避免使用非说明书溶媒或不使用溶媒直接注射,避免高剂量高浓度静脉推注,避免有过敏史人群使用。然而由于ADR病例较少,混杂因素较多,关于影响因素的结论具有较大局限性。
[参考文献]
[1]李勤,李秉芝,刘宏 参附注射液的药理作用及临床应用[J]. 医学综述,2008,14(8):1247
[2]王颖,龙敏,余晓琴,等 参附注射液中特殊色谱成分的分析[J] 中国药房,2008,19(27):2114
[3]刘唯芬 红参和参附注射液HPLC指纹图谱研究[D]沈阳: 沈阳药科大学,2006
[4]高小恒,陈达艳,刘效栓,等 参附注射液药理作用研究进展[J] 实用中医药杂志,2013,29(11):972
[5]张淑华,黄秀华,欧真蓉,等 参附注射液与12种药物配伍的急性毒性试验研究[J] 中国中医急症,2005,14(8):768
[6]付莹坤,谢雁鸣 参附注射液临床应用及其不良反应文献分析[J] 中国中药杂志,2012,37(18):2796
[7]胡晶,符子艺,谢雁鸣,等 参附注射液治疗感染性休克的系统评价[J] 中国中药杂志,2013,38(18):3209
[8]白洋,杨薇,刘峘,等 734例参附注射液疑似过敏反应影响因素分析[J] 中成药,2016,38(3):505
[9]杨靖,赵若琪,谢雁鸣,等 基于HIS真实世界的参附注射液临床实效研究[J] 中国中药杂志,2012,37(18):2730
[10]杨靖,谢雁鸣,李霖,等 基于医院信息系统的参附注射液治疗危重症临床用药特点分析[J] 中医杂志,2014,55(12):1059
[11]杨靖,李霖,谢雁鸣,等 參附注射液治疗冠心病临床用药方案实效研究[J] 中国中药杂志,2013,38(18):3099
[12]彭时雨,杨薇,谢雁鸣,等 基于25704例电子医疗病历的参附注射液临床常用药物组合方案探索研究[J] 中国中药杂志,2015,40(12):2435
[13]谢雁鸣,廖星,赵玉斌,等 中药上市后安全性医院集中监测技术规范(征求意见稿)[J] 中国中药杂志,2013,38(18):2919
[14]Zhang Yuqiao,Tian Dali,Huang Yuyou,et alPharmacokinetic evaluation of Shenfu Injection in beagle dogs after intravenous drip administration[J] Acta Pharmaceutica Sinica B, 2016,6(6):584
[15]王志飞,田大力,张雯,等 参附注射液药品风险控制研究思路及实践[J] 中国中药杂志,2014,39(18):3641
[16]丁毅涛 稀疏Group Lasso高维统计分析[D]西安: 西北大学,2013
[责任编辑张燕]
