Cajal间质细胞在急性胆囊炎中的分布
2017-08-29黄振鹏余保平
邱 虎, 黄振鹏, 罗 曼, 余保平
武汉大学人民医院消化内科 消化系统疾病湖北省重点实验室,湖北 武汉 430000
Cajal间质细胞在急性胆囊炎中的分布
邱 虎, 黄振鹏, 罗 曼, 余保平
武汉大学人民医院消化内科 消化系统疾病湖北省重点实验室,湖北 武汉 430000
目的 研究胆囊各部位Cajal间质细胞(interstitial cells of Cajal, ICCs)在急性胆囊炎中的分布。方法 健康成年豚鼠30只,随机分为正常组、胆总管结扎24 h和48 h组,通过胆总管结扎方法构建急性胆囊炎模型,收集每组胆囊HE染色、免疫荧光染色观察胆囊炎症程度和ICCs分布情况。结果 正常组胆囊组织未见炎性改变,胆总管结扎24 h组可见炎症较轻,胆总管结扎48 h组可见明显炎性改变。炎症逐渐加重时,ICCs数量逐渐减少,差异具有统计学意义(P<0.001);各组胆囊ICCs的数量从胆囊底部到胆囊颈部逐渐增加,但随炎症程度发展数量均有减少,差异具有统计学意义(P<0.05)。结论 发生急性胆囊炎时,胆囊各部位ICCs减少,这可能是导致胆囊动力学障碍重要原因之一。
Cajal间质细胞;胆囊;急性胆囊炎
急性胆囊炎是消化内科临床中常见的疾病,Cajal间质细胞(interstitial cells of Cajal, ICCs)是消化道的起搏细胞,具有神经传递的功能,因此ICCs的异常与消化道动力性疾病的发病机制有着密不可分的关系[1-2]。胆囊平滑肌中也存在ICCs,且对胆囊的自发节律性电活动和自动节律性收缩活动具有调控作用[3]。研究报道急性胆囊炎引起胆道平滑肌受损,将会导致胆囊动力性收缩障碍,但当发生急性炎症时,胆囊中ICCs分布尚不清楚[4]。本研究通过研究急性胆囊炎时胆囊中ICCs分布,从而间接证明胆囊ICCs对胆囊动力学影响具有重要意义。
1 材料与方法
1.1 实验动物及分组 30只健康成年豚鼠购自武汉生物研究所,体质量250~350 g,雌雄不限[动物许可证号SCXK(鄂)2012-0013]。随机均分为3组,正常组、胆总管结扎24 h组(BDL-24 h组)、胆总管结扎48 h组(BDL-48 h组),并置于标准动物饲养条件下饲养。实验经过武汉大学人民医院伦理委员会审批(批准号:10190A)。
1.2 急性胆囊炎模型的构建 腹腔内注射浓度百分比5%水合氯醛溶液麻醉,腹部备皮,剑突下1 cm左右沿腹中线切口,游离胆总管,在十二指肠入口处结扎胆总管,随后逐层缝合。豚鼠清醒后,移至笼内,可给予进食和喂水。分别在12 h、24 h两个时间点处死对应的实验组收集胆囊组织,4%多聚甲醛固定[5]。
1.3 溶液与试剂 豚鼠抗c-kit抗体为eBiosicence c-kit(CD-117),购自美国eBiosicence公司,浓缩型正常山羊血清、荧光(Cy3)标记羊抗兔IgG购自武汉博士德生物工程有限公司。
1.4 HE染色 取各组胆囊组织,4%多聚甲醛固定,石蜡包埋、切片5 μm厚,行苏木素-伊红(HE)染色,光镜下观察各组胆囊病理学改变。
1.5 免疫荧光检测c-kit阳性细胞 切片依次放入二甲苯Ⅰ→二甲苯Ⅱ→无水乙醇Ⅰ→无水乙醇Ⅱ→95%酒精→90%酒精→80%酒精→70%酒精;采用微波抗原修复10 min;滴加稀释好的正常山羊血清,室温封闭30 min后弃去;滴加稀释好的一抗(稀释比例1∶50),4 ℃湿盒中孵育过夜;PBST冲洗切片3次,每次3 min;吸水纸擦干切片后滴加稀释好的荧光二抗(稀释比例1∶100),湿盒中37 ℃孵育1 h,PBST冲洗切片4次,每次3 min;滴加DAPI避光孵育5 min,对标本进行染核,PBST冲洗切片4次,每次5 min,洗去多余的DAPI;用吸水纸擦干切片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
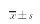
2 结果
2.1 HE染色 经HE染色后,光镜下可见正常组胆囊组织各层结构基本完整,未见充血及炎性细胞浸润,BDL-24 h组胆囊组织可见轻微充血、水肿及少量炎性细胞浸润;BDL-48 h组胆囊组织可见明显充血、水肿及大量炎性细胞浸润,并伴有部分黏膜上皮脱落(见图1)。
图1 胆囊组织HE染色(200×) A:正常组;B:BDL-24 h组;C:BDL-48 h组Fig 1 Gallbladder tissue HE staining(200×) A: normal group; B: BDL-24 hours group; C: BDL-48 hours group
2.2 ICCs免疫荧光染色 在豚鼠急性胆囊炎模型中,正常组ICCs多呈纺锤状或星形,伴有两个或多个突起,表达于肌层和黏膜层,呈网络状分布。与正常组相比, BDL-24 h组、BDL-48 h组ICCs的形态发生变化,ICCs突起消失。数量上,随炎症发展,胆囊ICCs逐渐减少,正常组、BDL-24 h组、BDL-48 h组的数量分别为61.6667±2.08167、54.0000±1.73205、38.3333±1.52753,差异有显著统计学意义(F=131.690,P=0.000)。对胆囊底、体和颈三个不同部位分别研究中,发现胆囊ICCs的数量从胆囊底到胆囊颈明显逐渐增加,但随炎症程度发展,胆囊ICCs的数量均有减少,正常组胆囊颈、胆囊体、胆囊底Cajal间质细胞数量分别为70.0000±2.00000、60.6667±3.78594、53.6667±4.04145,差异有统计学意义(F=17.433,P=0.003);DBL-24 h组胆囊颈、胆囊体、胆囊底ICCs数量分别为60.3333±2.51661、55.0000±1.00000、46.6667±3.51188,差异有统计学意义(F=21.712,P=0.002);DBL-48 h组胆囊颈、胆囊体、胆囊底ICCs数量分别为50.3333±1.52753、39.0000±1.00000、25.6667±3.05505,差异有显著统计学意义(F=108.316,P=0.000)(见图2~4)。
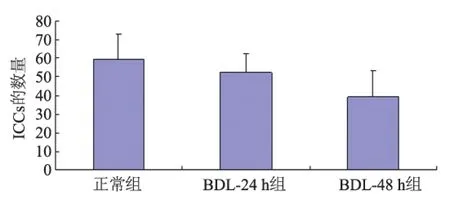
图2 急性胆囊炎各组胆囊ICCs的数量变化Fig 2 The quantity changes of ICCs in acute cholecystitis

图3 急性胆囊炎胆囊不同部位胆囊ICCs的数量变化
Fig 3 The quantity changes of ICCs in different parts of acute cholecystitis
3 讨论
急性胆囊炎是急诊中常见的疾病,其诊断对临床医师仍然是一个挑战。急性胆囊炎的发病机制尚未完全阐明,目前考虑主要由于胆管梗阻、化学性刺激和细菌感染等引起,其中胆管梗阻是引起急性胆囊炎最重要的因素,在发达国家中,10%~15%的成年人会受胆结石的影响[6]。当胆管发生梗阻时,局部的组织和黏膜将会出现缺血及水肿,且胆汁发生淤积和浓缩会引起一系列的炎症反应,使得胆囊黏膜上皮分泌更多的黏液,胆汁排除障碍,造成胆囊腔内压力升高,进而加重胆囊壁的缺血和水肿,最终导致胆道平滑肌收缩能力减弱是急性胆囊炎发生、发展的一个重要过程。胆总管结扎术可以构造出急性胆囊炎动物模型,本研究HE染色标本中,光镜下见正常组胆囊组织各层结构基本完整,未见充血及炎性细胞浸润,随着炎症发展,胆囊组织可见轻微充血、水肿及少量炎性细胞浸润,并伴有部分黏膜上皮脱落,与其他学者研究[7-8]结果一致。

图4 急性胆囊炎不同部位Cajal间质细胞分布Fig 4 The distribution of ICCs in different parts of acute cholecystitis
ICCs参与胃肠道自发的节律性电活动,是胃肠道的起搏细胞;并且ICCs能够介导神经冲动的传递,与平滑肌细胞存在许多缝隙连接,是肠神经调控平滑肌的媒介,因此ICCs对胃肠道的动力性功能起着决定性的作用[9]。ICCs主要存在胃肠道的环形肌层与纵行肌层之间,与肌间神经丛相邻。目前研究也证实,在胆囊和肝外胆管的平滑肌层也同样存在大量的ICCs,且其功能与胃肠道肌间ICCs类似,同样在泌尿生殖系统中也有发现ICCs,自发的节律性电活动也发生在此类组织中,因此认为ICCs可能调控胆管系统的自发节律性电活动和介导神经冲动的传递[10]。ICCs可被c-kit免疫反应蛋白标记,在光镜下观察发现其在胃肠道中呈网络状分布,形状呈星形或纺锤形,核大,为圆形及卵圆形,一般有两个或多个突起,彼此相互连接及与平滑肌细胞缝隙连接形成网络结构[11]。但不同物种、不同器官及不同组织均有自己独特的特征,可能与各自所处的微环境相关,包括神经分布、物理因素、化学因素和与平滑肌细胞的空间位置关系等。值得注意的是,根据ICCs在胆道系统所处的位置,ICCs的外观形态和数量将会发生变化。本实验结果显示,ICCs主要分布在胆囊平滑肌层,在正常组、BDL-24 h组及BDL-48 h组中,ICCs的密度和数量从胆囊底部到胆囊颈部是逐渐增加的,尤其是在胆囊颈部。有研究也显示,ICCs分布在胆囊、胆囊管及肝总管的平滑肌层,随着平滑肌层的增厚,ICCs的密度和数量逐渐增加;从胆总管的上部到胆总管的下部,ICCs的数量是逐渐增加的,尤其是在Oddi括约肌[10]。由此可见,胆囊、胆总管可能与ICCs协同控制胆汁的储存与释放。
大量临床研究已经证实ICCs具有调控胃肠道动力的功能,且ICCs的数量减少与胃肠道动力障碍密切相关,因此为胃肠道动力相关性障碍疾病提供了全新的理论解释。姚涛等[12]研究报道,在糖尿病胃轻瘫患者中,ICCs在胃体及胃窦的分布稀疏,数量减少,ICCs数量的减少可能是糖尿病胃轻瘫的重要发病机制。吴本升等[13]研究发现,在慢传输型便秘的大鼠模型中,c-kit的阳性表达水平明显低于正常组,使用促动力药物治疗组的c-kit阳性表达水平有所升高,但仍低于正常组,说明通过促进ICCs的再生与修复,增加肠道动力,从而实现通便的作用。Oddi括约肌功能障碍常常导致慢性胆道疼痛和复发性胰腺炎,但其致病机制尚未明确,其收缩功能认为是受神经、激素及局部因素控制。胆总管下端及壶腹部ICCs数量及密度的增加也被认为是控制Oddi括约肌收缩功能的重要因素,且参与Oddi括约肌功能障碍疾病的发生、发展过程。胆囊的收缩功能与胆总管密不可分,因此有理由认为ICCs也参与胆囊的收缩功能。本实验结果也显示在各组中,胆囊ICCs的数量从胆囊底到胆囊颈明显逐渐增加,说明ICCs可能直接参与胆囊收缩的生理过程。随着胆囊炎症程度的加重,胆囊ICCs的数量也逐渐减少,说明胆囊ICCs是炎症侵袭时最先受损细胞之一,与其他研究[14]发现相似。
综上可见,急性胆囊炎的发病,将会引起胆囊ICCs的受损,导致胆囊ICCs的形态和数量发生变化,使得胆囊平滑肌的收缩功能发生障碍。因此,我们有必要进一步研究胆囊ICCs的分布和功能与急性胆囊炎及胆囊收缩功能障碍之间的关系。
[1]Faussone-Pellegrini MS, Thaneberg L. Guide to the identification of interstitial cells of Cajal [J]. Microsc Res Tech, 1999, 47(4): 248-266.
[2]Rich A, Miller SM, Gibbons SJ, et al. Local presentation of steel factor increases expression of c-kit immunoreactive insterstitial cells of Cajal in culture [J]. Am J Physiol Gastrointest Liver Physiol, 2003, 284(2): 313-320.
[3]李湘楚, 肖勇, 余保平, 等. 胆道梗阻对胆囊动力及Cajal间质细胞形态的影响[J].中华消化杂志, 2011, 31(6): 396-400. Li XC, Xiao Y, Yu BP, et al. The effect of biliary obstruction on gallbladder motility and morphology of interstitial cells of Cajal [J]. Chin J Dig, 2011, 2011, 31(6): 396-400.
[4]Ziessman HA. Acute cholecystitis, biliary obstruction,and biliary leakage [J]. Semin Nucl Med, 2003, 33(4): 279-296.
[5]Myers SI, Bartula LL, Colvin MP, et al. Bile duct ligation induced acute inflammation up-regulates cyclooxygenase-2 content and PGE2 release in guinea pig gallbladder smooth muscle cell cultures [J]. Prostaglandins Leukot Essent Fatty Acids, 2005, 72(5): 327-333.
[6]Ansaloni L, Pisano M, Coccolini F, et al. 2016 WSES guidelines on acute calculous cholecystitis [J]. World J Emerg Surg, 2016, 11: 25.
[7]张丽, 余保平, 杨斌, 等. 硫化氢/胱硫醚-γ-裂解酶在胆管梗阻致急性胆囊炎中的表达[J]. 胃肠病学和肝病学杂志, 2014, 23(2): 230-233. Zhang L, Yu BP, Yang B, et al. Expression of hydrogen sulfide/cystathionine-γ-lyase in acute acalculous cholecystisis induced by bile duct ligation [J]. Chin J Gastroenterol Hepatol, 2014, 23(2): 230-233.
[8]Soylu S, Aydin C, Bagcivan I, et al. Effects of NO/L-arginine pathway on gallbladder contractility in bile duct ligated guinea pigs [J]. J Surg Res, 2009, 155(1): 70-76.
[9]潘慧斌, 陆建峰, 汪瑶, 等. Cajal间质细胞与胃肠道动力性疾病的相关性研究进展[J]. 医学综述, 2014, 20(15): 2702-2705. Pan HB, Lu JF, Wang Y, et al. Research progress in correlation between interstitial cells of Cajal and gastrointestinal motility disorders [J]. Medical Recapitulate, 2014, 20(15): 2702-2705.
[10]Yue H, Feng , Bin Y, et al. Distribution of the interstitial Cajal-like cells in the gallbladder and extrahepatic biliary duct of the guinea-pig [J]. Acta Histochemica, 2009, 111(2): 157-165.
[11]翁超, 袁琴, 范莹. Cajal间质细胞的研究进展[J].世界华人消化杂志, 2012, 20 (20): 1848-1852. Weng C, Yuan Q, Fan Y. Progress in research of interstitial cells of Cajal [J]. World Journal of Gastroenterology, 2012, 20(20): 1848-1852.
[12]姚涛, 袁秀珠. Cajal间质细胞介导的糖尿病大鼠胃离体平滑肌条收缩功能的研究[J].临床消化病杂志, 2011, 23 (3): 156-159. Yao T, Yuan XZ. Function of the gastric smooth muscles contraction induced by interstitial Cajal cell in diabetic rats [J]. Chinese Journal of Clinical Gastroenterology, 2011, 23(3): 156-159.
[13]吴本升, 周锦勇, 王海丹, 等. 养阴润肠方对慢性传输型便秘模型大鼠Cajal间质细胞影响[J]. 辽宁中医药大学学报, 2014, 16(2): 25-28. Wu BS, Zhou JY, Wang HD, et al. Effects of Yangyin runchang prescription on interstitial cells of Cajal of rats with slow transit constipation [J]. Journal of Liaoning University of TCM, 2014, 16(2): 25-28.
[14]Der T, Bercik P, Donnelly G, et al. Interstitial cells of Cajal and inflammation-induced motor dysfunction in the mouse small intestine [J]. Gastroenterology, 2000, 119(6): 1509-1599.
(责任编辑:马 军)
The distribution of the interstitial cells of Cajal in acute cholecystisis
QIU Hu, HUANG Zhenpeng, LUO Man, YU Baoping
1.Department of Gastroenterology, Hubei Key Laboratory of Digestive System Disease, Renmin Hospital of Wuhan University, Wuhan 430000, China
Objective To study the distribution of the interstitial cells of Cajal (ICCs) in gallbladder in acute cholecystisis. Methods Thirty adult guinea pigs were randomly divided into 3 groups, including normal group, bile duct ligation for 24 hours group and bile duct ligation for 48 hours group. Guinea pigs within acute cholecystisis model were induced by common bile duct ligation. Gallbladder spicemen were collected from all groups. HE staining and immunofluorescence were used to observe the degree of gallbladder inflammation and the distribution of ICCs. Results Gallbladder spicemen with HE staining in each group, there was no obvious inflammation in normal group. Compared with normal group, bile duct ligation for 24 hours group were in mild inflammation, bile duct ligation for 48 hours group were in significant inflammation. The number of ICCs was decreased when inflammation gradually increased, the difference was statistically significant (P<0.001). The number of ICCs in each groups gallbladder tissue was increased from the bottom of gallbladder to the neck, but with the development of the change of inflammation, the number of ICCs were all reduced,the difference was statistically significant (P<0.05). Conclusion The number of ICCs in all parts of gallbladder in acute cholecystisis are decreased, which maybe one of the most important causes on the disorder of gallbladder dynamics.
Interstitial cells of Cajal; Gallbladder; Acute cholecystisis
10.3969/j.issn.1006-5709.2017.07.023
国家自然科学基金(81170351)
邱虎,硕士,研究方向:胃肠道动力疾病的基础与临床。E-maill:qiuhu1027@163.com
余保平,博士,教授,研究方向:胃肠道动力疾病的基础与临床。E-maill:yubp62@163.com
R575.6
A
1006-5709(2017)07-0805-04
2016-09-09
