超声内镜诊断胃黏膜早期病变浸润深度的准确性分析
2017-08-29张海涵蒋建霞
张海涵, 蒋建霞
南京医科大学第一附属医院消化内科,江苏 南京 210029
超声内镜诊断胃黏膜早期病变浸润深度的准确性分析
张海涵, 蒋建霞
南京医科大学第一附属医院消化内科,江苏 南京 210029
目的 探讨超声内镜(endoscopic ultrasonography,EUS)诊断胃黏膜早期病变浸润深度的准确性。方法 回顾性分析2013年1月-2015年12月在南京医科大学第一附属医院消化内镜中心诊断为胃黏膜高级别上皮内瘤变(high-grade intraepithelial neoplasia,HGIN)的100例患者的EUS资料,包括内镜下病变部位、大小、个数、侵犯层次、黏膜外观等。并与其术后病理进行比较,分析EUS对判断病变浸润深度的准确性及其影响因素。结果 100例活检诊断为胃HGIN患者中,超声示黏膜层57例,黏膜下层43例。内镜切除(endoscopic resection,ER)术后,黏膜层88例,黏膜下层12例;19例术后病理升级为早期胃癌(early gastric cancer, EGC)。活检诊断HGIN准确率为81.0%(81/100)。EUS诊断胃黏膜病变浸润深度的准确性为65.0%(65/100),其中,低估率和过判率分别为2.0%(2/100)和33.0%(33/100)。EUS判断黏膜层病变的敏感性和特异性分别为62.5%(55/88)和83.3%(10/12)。对于黏膜下层及凹陷型病变层次的判断,EUS更易误诊(P<0.05)。结论 EUS是判断胃黏膜早期病变浸润深度的有效方法。但对于黏膜下层及凹陷型病变,EUS判断的准确性相对较低。
胃黏膜高级别上皮内瘤变;早期胃癌;超声内镜;浸润深度;病理
胃黏膜高级别上皮内瘤变(high-grade intraepithelial neoplasia, HGIN)是胃癌的一种癌前病变,因其癌变风险高,治疗上首选内镜切除(endoscopic resection, ER)[1]。早期胃癌(early gastric cancer, EGC)及HGIN预后较好,内镜或手术切除后5年生存率95%以上[2]。因此防治胃癌的关键在于早期诊治。超声内镜(endoscopic ultrasonography, EUS)既可直视消化道腔内形态,又可通过实时超声扫描,区分胃壁的各层结构,判断病灶的回声、起源、大小、边界范围、生长方式等,这对早期肿瘤的诊断及治疗有着重要意义[3]。本研究回顾性分析100例行EUS检查的胃黏膜HGIN患者,比较超声及病理结果,探讨EUS对胃黏膜早期病变浸润层次判断的准确性,分析其相关影响因素。
1 资料与方法
1.1 一般资料 收集南京医科大学第一附属医院消化内镜中心在2013年1月-2015年12月经胃镜及活检病理诊断为胃黏膜HGIN的患者临床资料,将其中先后行EUS评估及ER治疗且资料完整的患者纳入本研究。最终纳入100例患者,男69例,女31例,平均年龄(62.44±9.67)岁(34~86岁)。通过对比EUS及术后病理结果,评价EUS对胃黏膜早期病变诊断及浸润层次判断的准确性,利用统计学方法,分析其可能的影响因素。
1.2 EUS检查方法 EUS检查采用日本Olympus微探头UM2R(频率12 MHz)、UM3R(频率20 MHz)。胃镜选用日本Olympus GIF-Q240Z胃镜、Olympus GIF-H260胃镜。超声下正常胃壁的5个层次回声清楚:由内向外依次为上皮和黏膜层(呈高回声)、黏膜肌层(呈低回声)、黏膜下层(呈高回声)、固有肌层(呈低回声)、浆膜层(呈高回声)[4]。根据EUS下病变累及到胃壁的最外层次来评估胃黏膜早期病变的浸润深度。病变的超声下表现可为低回声浸润、层次增厚或不清、有中断或消失等。其中黏膜层病变的超声图像表现为黏膜层及黏膜肌层增厚,黏膜下层连续完整;黏膜下层病变的超声表现为第1~3层结构增厚、层次模糊或消失中断,黏膜下层变薄,固有肌层保持完整。
1.3 ER方式 治疗采用日本Olympus GIF-Q240Z胃镜、OlympusGIF-H260胃镜、Hook刀(Olympus KD- 620LR)、IT刀(Olympus KD-611L)、德国Erbe APC探头(VIO 300D)。ER方法主要包括内镜下黏膜切除术(EMR)和内镜黏膜下剥离术(ESD)两种。术前对患者常规行EUS、CT检查,以判断病变深度及范围,排除淋巴结及远处转移。评估患者全身状况,排除麻醉和内镜治疗禁忌证,签署治疗同意书。EMR主要适用于直径<20 mm的胃部浅表肿瘤诊断和治疗,操作步骤包括:黏膜下注射-圈套器完整套切-创面处理。ESD是在EMR基础上发展起来,可以切除直径>20 mm的较大病灶,主要步骤包括:病灶周围标记-黏膜下注射-环形切开黏膜-黏膜下剥离-切除病灶-创面处理。如有创面出血时,需及时用热钳、氩气刀或钛夹止血,确保创面止血良好,无活动性出血。
1.4 病理诊断 ER术后将标本固定于平板上,观察、测量标本大小、外观情况。拍照后将标本浸入甲醛液固定。将组织以2 mm为间隔连续切片,依次放入包埋盒,组织脱水、浸蜡、石蜡包埋。最后,病理医师评估肿瘤情况,包括病变大小、组织学类型、浸润深度、水平和垂直切缘、是否存在淋巴结侵犯及是否达到完全切除。诊断病变浸润深度根据维也纳分类系统[5]。
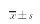
2 结果
2.1 患者的基本临床特征 100例患者术前活检病理均诊断为胃黏膜HGIN。EUS层次:黏膜层病变者共57例(57.0%),黏膜下层病变共43例(43.0%);病变平均直径为(2.12±1.35) cm;病变主要位于胃下1/3部,共57例(57.0%);外观形态上,隆起型病变最多,共45例(45.0%);伴溃疡形成的病变57例(57.0%);有红斑者共41例(41.0%);表面粗糙者共39例(39.0%)。ER术后病理诊断为HGIN共81例(81.0%),EGC 19例(19.0%);病理层次:黏膜层共88例(88.0%),黏膜下层共12例(12.0%)(见表1)。
表1 100例患者的基本临床特征
Tab 1 The basic clinical features of 100 patients
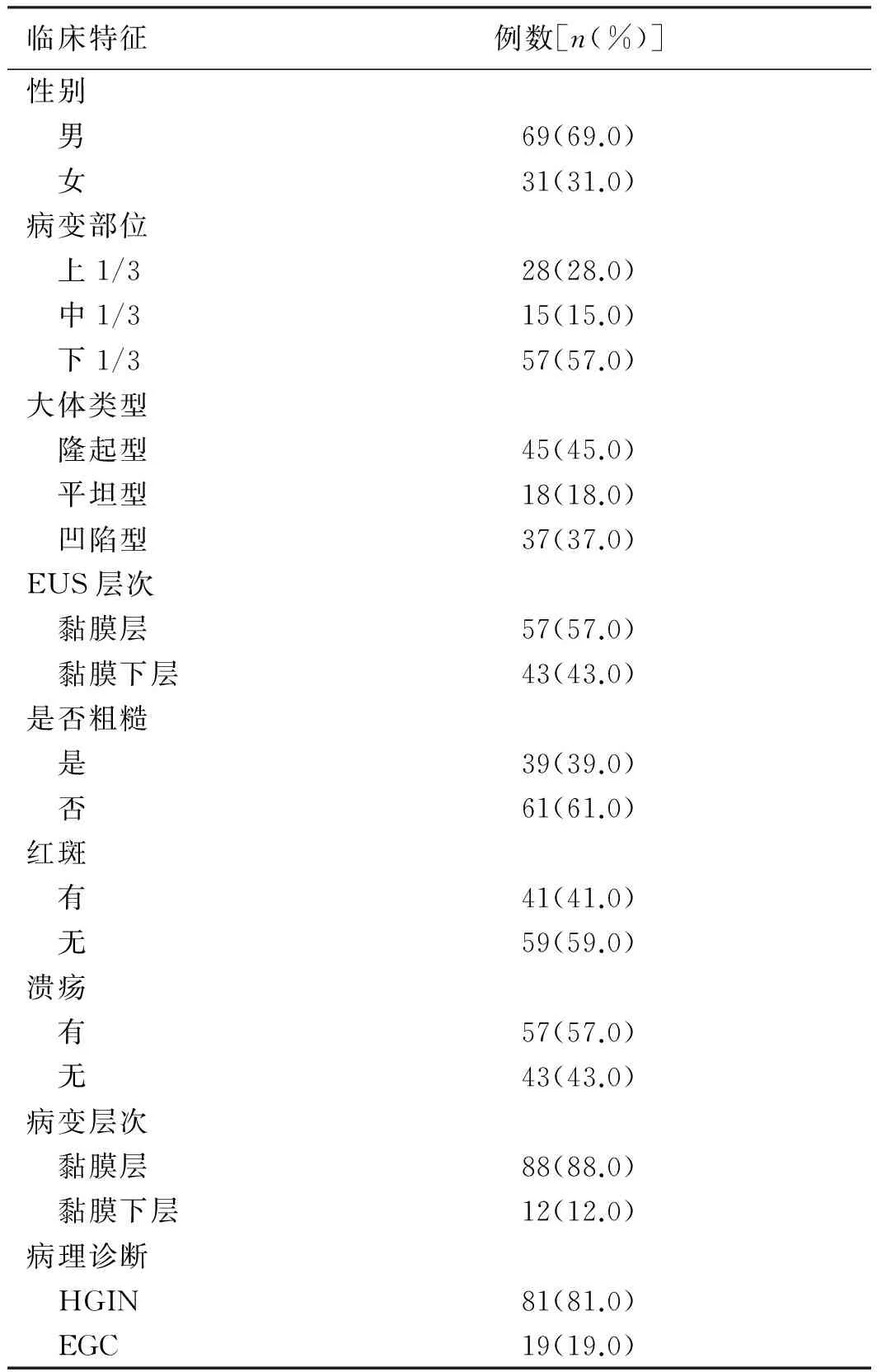
临床特征例数[n(%)]性别 男69(69.0) 女31(31.0)病变部位 上1/328(28.0) 中1/315(15.0) 下1/357(57.0)大体类型 隆起型45(45.0) 平坦型18(18.0) 凹陷型37(37.0)EUS层次 黏膜层57(57.0) 黏膜下层43(43.0)是否粗糙 是39(39.0) 否61(61.0)红斑 有41(41.0) 无59(59.0)溃疡 有57(57.0) 无43(43.0)病变层次 黏膜层88(88.0) 黏膜下层12(12.0)病理诊断 HGIN81(81.0) EGC19(19.0)
2.2 EUS判断胃黏膜病变层次的准确性、敏感性和特异性 本研究纳入的100例活检诊断为胃HGIN的患者中,ER术后有19例经病理诊断升级为EGC,活检病理对诊断胃黏膜HGIN的准确性为81.0%(81/100)。超声层次与ER术后病理层次一致者共65例,余35例前后层次不一致者中,其中有2例超声提示黏膜层病变,而术后病理示黏膜下层侵犯;有33例术前EUS提示黏膜下层病变,而术后病理局限于黏膜层。因此,EUS判断胃黏膜早期病变浸润层次的准确性为65.0%(65/100),其中低估率和过判率分别为2.0%(2/100)和33.0%(33/100)。EUS判断黏膜层病变层次的敏感性和特异性分别为62.5%(55/88)和83.3%(10/12);阳性预测值和阴性预测值分别为96.5%(55/57)和23.3%(10/43)。黏膜内病变的敏感性和特异性分别为62.5%(55/88)、83.3%(10/12)。
表2 影响EUS准确判断胃黏膜早期病变层次的危险因素分析[例数(%)]
Tab 2 Risk factors for the accuracy of EUS in evaluation of invasion depth in early gastric neoplasia [n(%)]
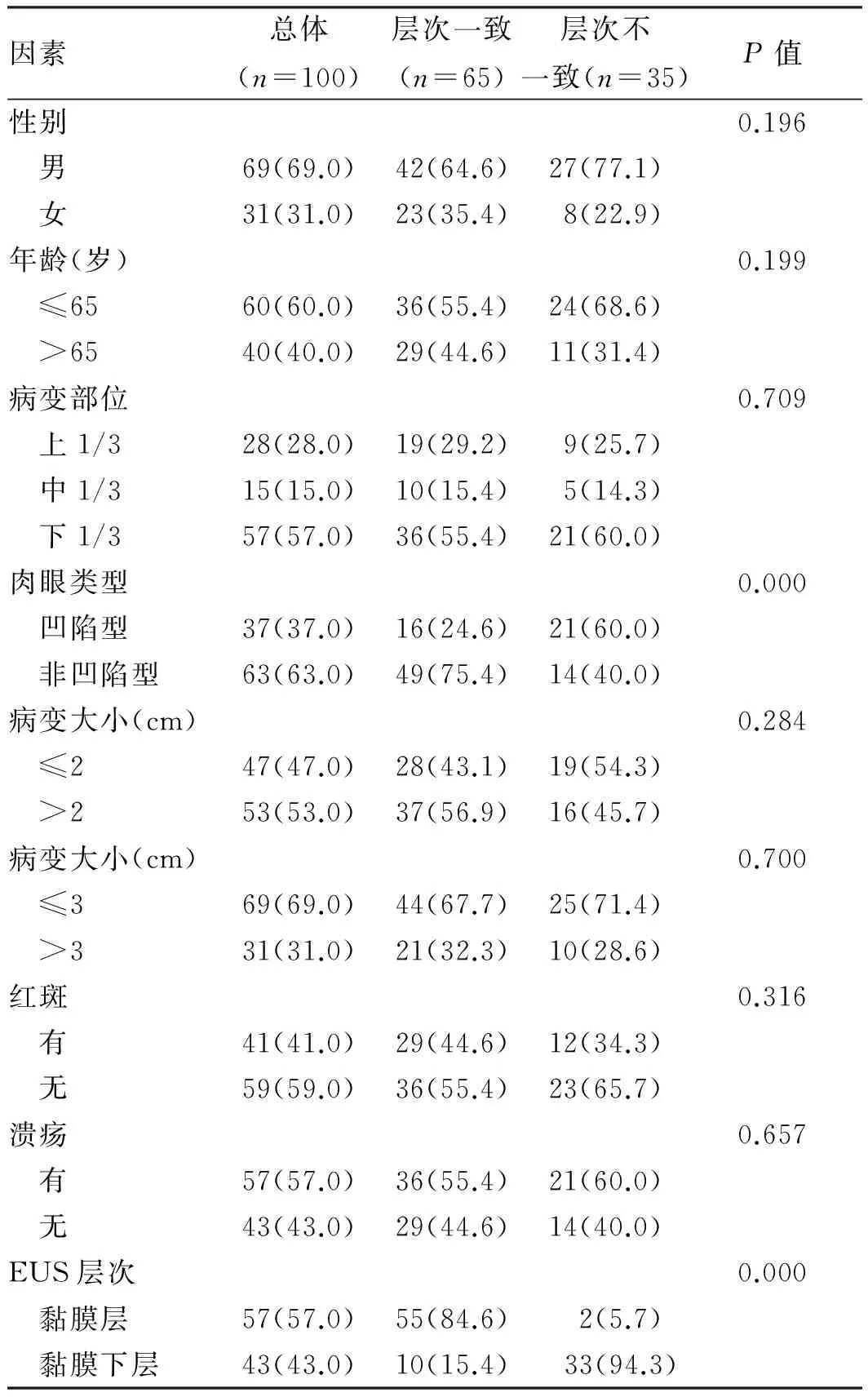
因素总体(n=100)层次一致(n=65)层次不一致(n=35)P值性别0.196 男69(69.0)42(64.6)27(77.1) 女31(31.0)23(35.4)8(22.9)年龄(岁)0.199 ≤6560(60.0)36(55.4)24(68.6) >6540(40.0)29(44.6)11(31.4)病变部位0.709 上1/328(28.0)19(29.2)9(25.7) 中1/315(15.0)10(15.4)5(14.3) 下1/357(57.0)36(55.4)21(60.0)肉眼类型0.000 凹陷型37(37.0)16(24.6)21(60.0) 非凹陷型63(63.0)49(75.4)14(40.0)病变大小(cm)0.284 ≤247(47.0)28(43.1)19(54.3) >253(53.0)37(56.9)16(45.7)病变大小(cm)0.700 ≤369(69.0)44(67.7)25(71.4) >331(31.0)21(32.3)10(28.6)红斑0.316 有41(41.0)29(44.6)12(34.3) 无59(59.0)36(55.4)23(65.7)溃疡0.657 有57(57.0)36(55.4)21(60.0) 无43(43.0)29(44.6)14(40.0)EUS层次0.000 黏膜层57(57.0)55(84.6)2(5.7) 黏膜下层43(43.0)10(15.4) 33(94.3)
2.3 影响EUS判断胃黏膜早期病变层次准确性的危险因素分析 黏膜层病变的57例患者中,仅2例是黏膜下层浸润;黏膜下层病变的43例患者中,33例为黏膜层病变。EUS对黏膜内和黏膜下层病变判断的准确率分别为96.5%(55/57)和23.3%(10/43),差异有统计学意义(P<0.05,见表2)。37例凹陷型病变的患者中,有21例(56.8%)EUS层次与病理层次不一致;而63例非凹陷型病变的患者中,仅14例(22.2%)前后层次不一致,差异有统计学意义(P<0.05)。因此,对于凹陷型及黏膜下层病变,EUS判断病变层次的准确性更低(P<0.05)。
3 讨论
2000年WHO新分类标准则首次引入胃黏膜上皮内瘤变(gastric intraepithelial neoplasia, GIN)这一概念[6]。GIN包括低级别上皮内瘤变(low-grade intraepithelial neoplasia, LGIN)和HGIN,是胃癌的一种癌前病变。HGIN是指异型细胞占据上皮全层,但未突破基底膜。根据Vienna分类标准[7],HGIN、原位癌、可疑侵袭性肿瘤及黏膜内癌被统一归类于第4类非侵袭性高级别瘤变。胃黏膜HGIN的癌变率高,且在组织学方面与黏膜内癌较难区分,因此治疗上以积极的手术切除或内镜切除作为首选[8]。EGC是指癌组织浸润仅限于黏膜层及黏膜下层者,无论有无淋巴结转移。治疗上根据病变浸润深度、病变大小、有无淋巴结转移等具体情况,选择内镜治疗或手术切除治疗[9]。内镜治疗可达到与外科手术相似的治疗效果,且具有手术时间短、并发症少、住院时间短、生活质量高等优势[10]。治疗前需完善EUS、CT等检查,进一步评估病变。
EUS作为评估胃癌分期的重要方法之一,它利用不同组织间的回声差异区分胃壁的不同层次,从而准确地区分病变、评估病变大小及浸润深度。Mandai等[11]的研究显示,EUS对肿瘤侵犯深度的判断准确性高于常规CT扫描或MRI。Yanai等[12]研究显示,EUS评估早期胃癌浸润深度的准确性为64.8%,超声对病变层次的低估和过判比例分别为7.4%和24.1%。本研究显示,EUS诊断胃黏膜早期病变浸润层次准确性、低估率和过判率分别为65.0%、2.0%和33.0%。误判的34例患者中,有32例(94.1%)为过判,而低估的比例相对较低。EUS对病变深度的过判可能是因为超声检查前活检造成黏膜破损、炎症细胞浸润或局部修复形成纤维化,从而引起黏膜下层超声下回声的改变。另外,De Angelis等[13]研究发现,病变黏膜下层丰富的血管可在超声下形成伪影,从而影响EUS对病变深度的判断。染色内镜、放大内镜、窄带成像技术(NBI)等新型内镜技术的应用,不仅可以提高早期胃癌及癌前病变诊断的敏感性和特异性[14],且有助于我们判断病变的范围[15]。NBI可以获得对比效果突出的不同黏膜层次内毛细血管和细微腺体形态图像,达到窥镜下对黏膜组织形态进行强调的染色效果,从而更有效地进行靶向活检,提高标本的阳性率,减少过度活检[16]。另外,在夹取活检后适当应用抑酸药及胃黏膜保护剂从而促进黏膜修复,以及适当延长活检与超声检查的时间间隔等,均可能减少因此种原因造成的误判。
常规频率下,EUS可将胃壁区分为5个层次,其中第2层(黏膜肌层)和第3层(黏膜下层)较难区分。本研究中,EUS诊断胃黏膜层病变的敏感性、特异性分别为62.5%和83.3%。Mocellin等[17]的Meta分析显示EUS判断黏膜层病变的敏感度、特异度分别为0.83(95%CI: 0.76~0.89)和0.79(95%CI: 0.65~0.88)。高频率超声小探头因可将胃壁细分为7~13层结构,能更好地区分黏膜肌层和黏膜下层[18]。Mandai等[11]的研究显示,在15 MHz时黏膜肌层的区分率仅为15%~20%,而30 MHz下可提高至87%,黏膜内癌诊断的准确率提高至90%。本研究结果显示,对于凹陷型及黏膜下层病变,EUS判断病变层次更易发生误诊。凹陷型、溃疡型和未分化的胃癌其EUS分期准确性较低[19]。另外,肿瘤的部位、大小也影响超声评估的准确性,EUS对于诊断胃中1/3部及直径>3 cm的肿瘤浸润层次的准确性更高[20]。
尽管活检病理是临床诊断胃黏膜HGIN的主要方法,但活检病理诊断与ER病理有时会存在差异[21]。本研究结果显示,活检病理诊断为HGIN的100例患者中,19例患者术后病理升级为EGC,即活检病理诊断HGIN准确率为81.0%。术后比例升级的19例患者中有15例术前EUS显示黏膜下层浸润。因此,对于超声显示为黏膜下层病变的HGIN患者,应警惕合并癌变的可能性,这对判断患者的远期预后有重要意义。
综上所述,EUS是判断胃黏膜早期病变浸润深度的有效方法。胃癌内镜治疗前的超声评估至关重要。基于本研究对比EUS与内镜治疗术后病理结果,对于黏膜下层及凹陷型病变,EUS判断病变层次的准确性相对较低。
[1]Rugge M, Capelle LG, Fassan M. Individual risk stratification of gastric cancer: evolving concepts and their impact on clinical practice [J]. Best Pract Res Clin Gastroenterol, 2014, 28(6): 1043-1053.
[2]Suzuki H, Oda I, Abe S, et al. High rate of 5-year survival among patients with early gastric cancer undergoing curative endoscopic submucosal dissection [J]. Gastric Cancer, 2016, 19(1): 198-205.
[3]Guo J, Liu Z, Sun S, et al. Endosonography-assisted diagnosis and therapy of gastrointestinal submucosal tumors [J]. Endosc Ultrasound, 2013, 2(3): 125-133.
[4]金震东, 李兆申. 消化超声内镜学[M]. 第2版. 北京: 科学出版社, 2011: 1-30.
[5]Dixon MF. Gastrointestinal epithelial neoplasia: Vienna revisited [J]. Gut, 2002, 51(1): 130-131.
[6]Yakirevich E, Resnick MB. Pathology of gastric cancer and its precursor lesions [J]. Gastroenterol Clin North Am, 2013, 42(2): 261-284.
[7]Stolte M. The new “Vienna Classification” for epithelial neoplasia of the gastrointestinal tract. Pros or cons?[J]. Pathologe, 2001, 22(1): 4-12.
[8]廖专, 孙涛, 吴浩, 等. 中国早期胃癌筛查及内镜诊治共识意见(2014年4月·长沙)[J]. 胃肠病学, 2014, 19(7): 408-427.
[9]Kato M. Diagnosis and therapies for gastric non-invasive neoplasia [J]. World J Gastroenterol, 2015, 21(44): 12513-12518.
[10]Zhao S, Zhang X, Wang J, et al. Endoscopic resection versus surgery for early gastric cancer and precancerous lesions: a meta-analysis [J]. Springerplus, 2016, 5(1): 678.
[11]Mandai K, Yasuda K. Accuracy of endoscopic ultrasonography for determining the treatment method for early gastric cancer [J]. Gastroenterol Res Pract, 2012, 2012: 245390.
[12]Yanai H, Matsumoto Y, Harada T, et al. Endoscopic ultrasonography and endoscopy for staging depth of invasion in early gastric cancer: a pilot study [J]. Gastrointest Endosc, 1997, 46(3): 212-216.
[13]De Angelis C, Pellicano R, Manfrè SF, et al. Endoscopic ultrasound in the 2013 preoperative evaluation of gastric cancer [J]. Minerva Gastroenterol Dietol, 2013, 59(1): 1-12.
[14]Horiuchi Y, Fujisaki J, Yamamoto N, et al. Accuracy of diagnostic demarcation of undifferentiated-type early gastric cancer for magnifying endoscopy with narrow-band imaging: surgical cases [J]. Surg Endosc, 2017, 31(4): 1906-1913.
[15]Nagahama T, Yao K, Maki S, et al. Usefulness of magnifying endoscopy with narrow-band imaging for determining the horizontal extent of early gastric cancer when there is an unclear margin by chromoendoscopy [J]. Gastrointest Endosc, 2011, 74(6): 1259-1267.
[16]Kodashima S, Fujishiro M. Novel image-enhanced endoscopy with i-scan technology [J]. World J Gastroenterol, 2010, 16(9): 1043-1049.
[17]Mocellin S, Marchet A, Nitti D. EUS for the staging of gastric cancer: a meta-analysis [J]. Gastrointest Endosc, 2011, 73(6): 1122-1134.
[18]诸琦. 超声内镜[M]. 上海: 上海科技教育出版社, 2009: 1-20.
[19]Kim GH, Park DY, Kida M, et al. Accuracy of high-frequency catheter-based endoscopic ultrasonography according to the indications for endoscopic treatment of early gastric cancer [J]. J Gastroenterol Hepatol, 2010, 25(3): 506-511.
[20]Razavi SM, Khodadost M, Sohrabi M, et al. Accuracy of endoscopic ultrasonography for determination of tumor invasion depth in gastric cancer [J]. Asian Pac J Cancer Prev, 2015, 16(8): 3141-3145.
[21]Kato M. Diagnosis and therapies for gastric non-invasive neoplasia [J]. World J Gastroenterol, 2015, 21(44): 12513-12518.
(责任编辑:陈香宇)
The accuracy of endoscopic ultrasonography in evaluation of invasion depth in early gastric neoplasia
ZHANG Haihan, JIANG Jianxia
Department of Gastroenterology, the First Affiliated Hospital of Nanjing Medical University, Nanjing 210029, China
Objective To investigate the accuracy of endoscopic ultrasonography (EUS) for determining the depth of early stage of gastric neoplasia. Methods The clinical datas of 100 patients who were diagnosed as high-grade intraepithelial neoplasia (HGIN) from Jan. 2013 to Dec. 2015 in the endoscopy center, including the lesion size, location, depth, appearance were analyzed retrospectively. Compared with the EUS results, postoperative pathological results for the lesion infiltration depth, and the risk factors for the inconsistence were analyzed. Results Among the 100 HGIN patients, 57 patients were with mucosal invasion and 43 submucosal invasion according to EUS assessment. After endoscopic resection (ER), 88 were with mucosal invasion and 12 submucosal invasion. A total of 19 patients had their postoperative pathology upgraded to early gastric cancer (EGC). The diagnosis accuracy rate of endoscopic biopsy for HGIN was 81.0% (81/100). The overall accuracy of EUS assessment for the depth of tumor invasion was 65.0% (65/100), the rate of underestimation and overestimation was seen in 2 (2.0%) and 33 (33.0%) , respectively. For mucosa lesions, the sensitivity and specificity of EUS was 62.5% (55/88) and 83.3% (10/12), respectively. The accuracy of EUS decreased especially for depressed lesions and lesions with submucosal invasion (P<0.05). Conclusion EUS is an effective method to diagnose the infiltration depth of gastric neoplasia. For depressed and submucosal lesions, the accuracy of EUS was relatively low.
Gastric high-grade intraepithelial neoplasia; Early gastric cancer; Endoscopic ultrasonography; Invasion depth; Histopathology
10.3969/j.issn.1006-5709.2017.07.018
江苏省六大人才高峰课题基金(2015-WSN-028)
张海涵,在读硕士研究生,研究方向:消化道早癌的诊治。E-mail: sea-snake@163.com
蒋建霞,医学博士,副教授,主任医生,硕士研究生导师,研究方向:消化道早癌的诊治及幽门螺杆菌感染。E-mail: jjxcasey@aliyun.com
R573
A
1006-5709(2017)07-0782-04
2017-03-07
