替芬泰对HepG2细胞的线粒体毒性
2017-08-29胡金芳邸志权张宗鹏申秀萍
冯 玥,霍 璇,胡金芳,邸志权,张宗鹏,申秀萍
(天津药物研究院新药评价有限公司,天津300301)
替芬泰对HepG2细胞的线粒体毒性
冯 玥,霍 璇,胡金芳,邸志权,张宗鹏,申秀萍
(天津药物研究院新药评价有限公司,天津300301)
目的采用HepG2细胞来评价首次合成的马蹄金素衍生物替芬泰在抗乙肝病毒的同时对肝细胞的线粒体毒性,为临床试验剂量设计和合理用药提供参考。方法测定替芬泰对HepG2细胞增殖的抑制率,对培养上清液乳酸含量、细胞活性氧含量、线粒体膜电位变化及线粒体呼吸链复合物酶Ⅰ~Ⅳ活性的影响,综合评价替芬泰的线粒体毒性。结果替芬泰对HepG2细胞增殖的半数抑制浓度为359 μmol·L-1。与对照组比较,替芬泰400 μmol·L-1(196 mg·L-1)时明显降低HepG2细胞的线粒体膜电位,明显增加细胞活性氧含量,升高乳酸生成水平,降低线粒体呼吸链复合物酶Ⅰ、Ⅱ、Ⅲ的活性,具有明显的线粒体毒性。与拉米夫定、阿德福韦酯比较,同为100 μmol·L-1的替芬泰对上述指标均无影响。结论替芬泰的线粒体毒性安全范围较大,实验结果对临床试验剂量设计和临床用药具有一定的指导意义。
替芬泰;线粒体毒性;线粒体膜电位;活性氧;线粒体呼吸链复合物酶;乳酸
乙肝病毒(hepatitis B virus, HBV)是迄今所有已知可感染人体并具有独立复制能力的双链DNA病毒中最小且最有效的病毒,仅含3.2 kb,属于嗜肝DNA病毒科[1]。HBV可引发急、慢性肝炎,慢性乙肝是当前最严重的健康问题之一,可发展为肝硬化乃至肝癌。全球每年约有100万人死于乙肝病毒感染的相关疾病,占疾病死因的第九位。目前用于治疗乙肝的药物主要以拉米夫定为代表的核苷类药物和以干扰素α为代表的生物类免疫调节剂,但这些药物都存在副作用大、容易产生耐药、停药易发生“反跳”等缺陷,因此,寻找和开发新的抗乙肝病毒药物具有重要的意义。
替芬泰为苗药马蹄金中分离而成的二肽衍生物,具有较强的抗HBV的活性,作为抗乙肝新药具有全新化学骨架,可直接干扰乙肝病毒DNA合成,在乙肝病毒表面合成抗原,具有多靶点抗乙肝病毒、生物利用度高、不需长期持续用药的特点。药物毒性研究是药物研究的重要组成部分,药物导致的不良反应是许多药物临床前研发、临床试验失败,甚至上市后撤市的主要原因[2]。近年来,越来越多的研究表明,线粒体损伤是许多药物毒性作用的重要特征,并提示线粒体可能是药物毒性作用的重要靶标。事实上,线粒体毒性已经成为多种药物研发失败或临床应用受限的重要因素,已有多个候选药物因存在严重的线粒体毒性而被迫中止研发。线粒体毒性主要是由于线粒体膜受到破坏、呼吸链被抑制、线粒体DNA的损失等引起能量代谢障碍,进而导致线粒体功能障碍及细胞损伤[3]。用于抗乙肝病毒的核苷类似物是导致线粒体毒性的常见药物之一。这类化合物与宿主细胞的DNA聚合酶γ有一定的亲和力,是该类药物对正常的机体组织细胞产生不良反应的主要原因[4],可引起中毒性肾损伤、肝脂肪变性和乳酸血症等不良反应,严重者可致乳酸中毒和胰腺炎等[5-6]。抗乙肝新药替芬泰主要靶器官是肝脏,本文采用肝脏毒性评价中最常用的、具有人类肝细胞的多种代谢酶活力和其他特征的肝癌细胞系HepG2细胞,来评价替芬泰在抗乙肝病毒的同时对肝细胞的线粒体毒性,为临床试验剂量设计和合理用药提供参考。
1 材料
1.1细胞人肝癌细胞株(HepG2)由天津中医药大学惠赠,用含10%胎牛血清的DMEM培养基,于37℃、5% CO2培养箱中培养。
1.2药品与试剂替芬泰由贵州省中国科学院天然产物化学重点实验室合成提供,分子式为C29H35N3O4,批号20110302。拉米夫定片(葛兰素史克,批号12060111);阿德福韦酯片(天津药物研究院药业有限责任公司,批号120656)。二甲基亚砜(DMSO,Solarbio,批号302A035);DMEM(Gibco,批号8113049);胎牛血清(FBS,Hyclone,批号NWCO389);0.25%胰酶(Gibco,批号1128331);PBS缓冲液(Gibco,批号8112156);青链霉素混合液(100×,Solarbio,批号20120626);MTT(Sigma,批号M2128);乳酸含量测定试剂盒(南京建成生物工程研究所,批号20120912);活性氧(reactive oxygen species, ROS)检测试剂盒(北京普利莱基因技术有限公司,批号C1300);罗丹明123(Sigma,批号MKBC2653V);线粒体呼吸链复合物酶Ⅰ、Ⅱ、Ⅲ、Ⅳ活性定量检测试剂盒(上海杰美基因医药科技有限公司,批号135897573)。
1.3仪器CO2培养箱(MCO-18AIC,三洋电机国际贸易有限公司);Varioskan Flash酶标仪(Thermo Scientific);MLS-3750高压蒸汽灭菌锅(日本三洋电子有限公司);超净工作台(天津市拉贝尔实验设备有限公司);KA-1000离心机(飞鸽公司);TS100荧光倒置显微镜(日本NIKON公司);FASCAriaTM流式细胞仪(BD公司);PL203型电子天平(梅特勒托利多仪器上海有限公司)。
2 方法
2.1替芬泰对HepG2细胞增殖的影响及IC50测定取处于对数生长期的HepG2细胞,以2.5×107·L-1的密度接种于96孔板中,于5% CO2、 37℃培养箱中培养24 h后,加入含不同浓度替芬泰的培养液,使其终浓度分别为0、50、100、200、300、400、600 μmol·L-1,替芬泰先用DMSO溶解,后用DMEM培养液稀释至终浓度,各加药组DMSO终浓度均为0.1%,对照组为含0.1% DMSO的DMEM,确保与加药各组形成阴性对照,同时设空白组,即无细胞孔,每组6个复孔,放入培养箱中培养24 h后移去药物,每孔避光加入5 g·L-1的MTT 20 μL,10% FBS的DMEM 180 μL,孵育4 h后吸掉上清,每孔加入150 μL的DMSO,室温下震荡10 min,492 nm处测OD值。抑制率/%=(对照组吸光值-加药组吸光值)/(对照组吸光值-空白组吸光值)×100%。
2.2替芬泰对HepG2细胞线粒体膜电位(mitochondrialmembranepotential,MMP)的影响取处于对数生长期的HepG2细胞,接种于直径为6 cm的培养皿中,于5% CO2、37℃培养箱中培养24 h后,加入含不同浓度替芬泰的培养液,使其终浓度分别为0、100、200、400 μmol·L-1,同时设阳性对照组拉米夫定100 μmol·L-1及阿德福韦酯100 μmol·L-1,每组3个复皿,各组药物的溶解与稀释同上。药物作用24 h后移去药物,换为正常的含血清培养基培养5 d,每2 d换液1次,于d 6各组细胞PBS冲洗后,用0.25%胰酶消化收集,无血清DMEM重悬,加入1 g·L-1的罗丹明,使其终浓度为10 mg·L-1,在37℃下平衡30 min,收集细胞,用PBS离心洗涤2次,1 500 r·min-1离心10 min,除去没有结合的染料,重悬细胞,用流式细胞仪测各组荧光强度,细胞膜电位的大小用其平均荧光强度表示。
2.3替芬泰对HepG2细胞内ROS含量的影响细胞的前处理方法同“2.2”项,药物作用24 h后移去药物,换为正常的含血清培养基培养5 d,每2 d换液1次,于d 6用PBS冲洗后,0.25%胰酶消化收集重悬,加入终浓度为10 μmol·L-1的DCFH-DA,37℃孵育15~20 min,每隔3~5 min混匀1次,使探针和细胞充分作用,并设置不染色的细胞作为阴性细胞对照。用PBS洗涤细胞2次,去除未进入细胞内的DCFH-DA,收获各组细胞,上流式细胞仪检测ROS。
2.4替芬泰对HepG2细胞乳酸产生水平的影响细胞的前处理方法同“2.2”项,于加药后d 6收集各组细胞培养液上清,用乳酸含量测定试剂盒,采用比色法测定乳酸含量;同时对细胞进行消化,采用台盼蓝拒染法,对活/死细胞进行计数,将结果换算成每106个细胞的乳酸含量,比较不同药物浓度条件下细胞的乳酸生成水平。
2.5替芬泰对HepG2细胞线粒体呼吸链复合物酶活性的影响取处于对数生长期的HepG2细胞,以5×108·L-1的密度接种于底面积为75 cm2的培养瓶中,于5% CO2、37℃培养箱中培养24 h后,加入含不同浓度替芬泰的DMEM培养液,使其终浓度分别为0、100、200、400 μmol·L-1,同时设阳性对照组拉米夫定100 μmol·L-1及阿德福韦酯100 μmol·L-1,每组3个复瓶,药物作用24 h后移去药物,换为正常的含血清DMEM培养5 d,每2 d换液1次,于d 6各组细胞PBS冲洗后,0.25%胰酶消化收集,用线粒体提取试剂盒破裂细胞,考马斯亮蓝测定总蛋白,调整各组样品蛋白量后,用线粒体呼吸链复合物酶活性测定试剂盒测定呼吸链复合物酶Ⅰ、Ⅱ、Ⅲ、Ⅳ的活性。

3 结果
3.1替芬泰对HepG2细胞增殖的影响及IC50测定Tab 1结果显示,随着替芬泰浓度的增大,OD值递减,说明存活细胞数递减,药物毒性增大,当替芬泰浓度为400、600 μmol·L-1时,抑制率分别为68.9%、90.4%,通过拟合曲线计算出替芬泰对HepG2细胞增殖的半数抑制浓度IC50值为359 μmol·L-1。
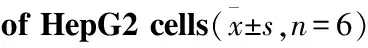
Tab 1 Effect of bentysrepinine on proliferation
*P<0.05,**P<0.01vscontrol group(0 μmol·L-1)
3.2替芬泰对HepG2细胞MMP的影响Tab 2结果显示,与对照组比较,替芬泰浓度为100、200 μmol·L-1时平均荧光强度基本无变化,浓度为400 μmol·L-1时,平均荧光强度明显降低,即MMP明显减小。与拉米夫定、阿德福韦酯比较,同为100 μmol·L-1的替芬泰对MMP的影响较小。

Tab 2 Effect of bentysrepinine on MMP
*P<0.05vscontrol group
3.3替芬泰对HepG2细胞ROS含量的影响Tab 3结果显示,与对照组比较,替芬泰浓度为100、200 μmol·L-1时平均荧光强度基本无变化,浓度为400 μmol·L-1时,平均荧光强度明显升高,即ROS明显增加。与拉米夫定、阿德福韦酯比较,同为100 μmol·L-1的替芬泰对ROS的影响与拉米夫定相当,较阿德福韦酯小。
3.4替芬泰对HepG2细胞乳酸产生水平的影响Tab 4结果显示,与对照组比较,替芬泰浓度为100、200 μmol·L-1时对培养液上清乳酸含量基本无影响,当浓度为400 μmol·L-1时乳酸含量明显升高。拉米夫定、阿德福韦酯均可明显增加乳酸含量,与两者比较,同为100 μmol·L-1的替芬泰对乳酸含量基本无影响。

Tab 3 Effect of bentysrepinine onROS of HepG2 cells(±s,n=3)
*P<0.05vscontrol group

Tab 4 Effect of bentysrepinine on lactic acidcontent of HepG2 cells(±s,n=3)
*P<0.05vscontrol group
3.5替芬泰对HepG2细胞线粒体呼吸链复合物酶活性的影响Tab 5结果显示,与对照组比较,替芬泰浓度为100、200 μmol·L-1时,对线粒体呼吸链复合物酶Ⅰ~Ⅳ均基本无影响,浓度为400 μmol·L-1时,明显降低复合物酶Ⅰ、Ⅱ、Ⅲ的活性,降低复合物酶Ⅳ的活性但差异无统计学意义,可见替芬泰对HepG2细胞线粒体呼吸链复合物酶活性的影响主要集中在复合物酶Ⅰ,随着浓度的增加,进而对其他复合物酶产生影响。与拉米夫定、阿德福韦酯比较,同为100 μmol·L-1的替芬泰对复合物酶活性基本无影响。
4 讨论
中草药是我国治疗乙肝的特色所在,在抗病毒、免疫调节、抗肝纤维化和恢复肝功能方面均取得了一定成效。本项目从民间用于主治急、慢性肝炎、胆囊炎等症的苗族药马蹄金中发现具有抗乙肝病毒活性的化合物——马蹄金素N-[N-苯甲酰基-L-酪氨酰基]-L-苯丙氨醇。通过精心的科学设计,相继合成了马蹄金素的一系列衍生物(600余个),以拉米夫定为阳性对照药物,经抗HBV实验筛选结果表明,其中一个衍生物替芬泰具有较强的抗HBV的活性[7]。以此为候选药物进行体内、外抗HBV实验的深入研究,发现其体内、外均有抗HBV作用,重复性好,具有良好的量效关系和时效关系,停药后不易反弹,对核苷类似物耐药病毒株有效[8]。同时进行了一般药理学试验,急毒[9]、长毒试验,遗传毒性试验,生殖毒性试验及药代动力学试验,并没有发现其对心、肝、肾等大器官的副作用,是替芬泰在安全性上最大的优势,这对于长期服药的乙型肝炎病人,特别是乙型肝炎肾功能异常的病人又多了一种服药选择,有很好的应用前景。

Tab 5 Effect of bentysrepinine on activity of mitochondrial respiratory chain complex enzymes of HepG2 cells(±s,n=3)
*P<0.05,**P<0.01vscontrol group. Unit of enzyme activity: nmol cytochrome C·min-1·mg-1
大量研究表明,线粒体对调控细胞生长、增殖、分化和死亡等生命活动起重要作用。线粒体功能损伤会导致生物能量代谢失常、ATP合成下降、钙稳态失衡、自由基生成增多,从而诱发细胞凋亡。因肝毒性、心脏毒或肾脏毒而被撤市或研发终止的药物,线粒体毒性为主要的毒性机制[10]。线粒体是内源性活性氧ROS产生与代谢的主要场所,一方面ROS参与正常的各种代谢活动,另一方面即使ROS产生的多一些,也会被ROS清除剂清除,维持一定的动态平衡[11],而当各种因素导致ROS生成过量时,ROS极易攻击线粒体,尤其是线粒体DNA[12]。当线粒体DNA受损时,又会引发过量ROS生成,导致ATP合成水平下降[13]。ROS的生成极大依赖线粒体膜电位MMP,MMP的变化可以反映出线粒体受损的程度,并被认为是细胞凋亡的早期事件[14]。MMP降低可引起胞内游离钙离子浓度升高,影响胞内钙稳态,加重细胞氧化应激,导致线粒体功能紊乱[15]。
本实验采用HepG2细胞对替芬泰的线粒体毒性进行体外评价,根据替芬泰对HepG2细胞增殖的IC50,设计实验剂量分别为100、200、400 μmol·L-1,其中400 μmol·L-1相当于猴口服替芬泰30 mg·kg-1(相当于猴临床等效剂量的7.81倍)90 d后血清Cmax的240倍。结果显示,200 μmol·L-1的替芬泰(相当于猴口服替芬泰30 mg·kg-190 d后血清Cmax的120倍)对HepG2细胞未见明显的线粒体毒性,与拉米夫定及阿德福韦酯相比需要更高浓度才对线粒体产生影响,表明替芬泰的线粒体毒性安全范围较大,实验结果对临床试验剂量设计和临床用药具有一定的指导意义。
[1] 赫晓林,黄建炜,许瑞安,等.HBV病毒复制机制及慢性乙型肝炎药物靶点[J].中国药理学通报,2015,31(2):152-6.
[1] He X L, Huang J W, Xu R A, et al. Hepatitis B virus replication mechanisms and drug targets of chronic hepatitis B[J].ChinPharmacolBull, 2015,31(2): 152-6.
[2] 胡倩倩,时丽丽,谭初兵,等.核苷类似物线粒体毒性机制及临床表现[J].中国药理学与毒理学杂志,2013,27(5):885-8.
[2] Hu Q Q, Shi L L, Tan C B, et al. Mitochondrial toxicity mechanism of nucleoside analogues and its clinical manifestations[J].ChinJPharmacolToxicol, 2013,27(5):885-8.
[3] 周一凡,刘春晓. 线粒体功能异常引起的疾病研究进展[J]. 辽宁医学院学报,2010,31(4):370-2.
[3] Zhou Y F, Liu C X.Research advances in diseases caused by mitochondrial dysfunction[J].JLiaoningMedUniv,2010,31(4):370-2.
[4] Birkus G, Hitchcock M J, Cihlar T.Assessment of mitochondrial toxicity in human cells treated with tenofovir: comparison with other nucleoside reverse transcriptase inhibitors[J].AntimicrobAgentsChemother, 2002,46(3): 716-23.
[5] Mazzucco C E, Hamatake R K, Colonno R J, et al.Entecavir for treatment of hepatitis B virus displays noinvitromitochondrial toxicity or DNA polymerase gamma inhibition[J].AntimicrobAgentsChemother, 2008,52(2): 598-605.
[6] Telegdy L. Treatment of hepatitis B[J].OrvHetil, 2004,145(45): 2293-6.
[7] Fan H, Li R, Gu Y, et al. Quantitation of bentysrepinine(Y101) in rat plasrna by liquid chromatography tandem mass spectrometry: application to pharmacokinetic study[J].JChromatogrBAnalytTechnolBiomedLifeSci, 2012:103-9.
[8] 王盼丽,黄正明. 替芬泰(Y101)抗肝炎的研究进展[C]//中国医药教育协会第三届三次理事大会暨学术年会论文专辑. 重庆:中国医药教育协会,2013:154-9.
[8] Wang P L, Huang Z M. The research progress of bentysrepinine(Y101) on anti-hepatitis[C]//The third session of the third council and academic papers album of China Medicine Education Association. Chongqing: China Medicine Education Association, 2013:154-9.
[9] 刘青川,黄正明. 苯丙氨酸二肽类化合物Y101的急性毒性研究[C]//中国医药教育协会第三届三次理事大会暨学术年会论文专辑. 重庆:中国医药教育协会,2013:215-7.
[9] Liu Q C, Huang Z M. Acute toxicity study of phenylalanine dipeptide compounds Y101[C]//The third session of the third council and academic papers album of China Medicine Education Association. Chongqing: China Medicine Education Association, 2013:215-7.
[10]富 欣,潘晓靓,李 华,等. 体外评价马兜铃酸对HepG2细胞线粒体功能的影响[J].世界临床药物,2015,36(4):236-42.
[10]Fu X, Pan X L, Li H, et al.Invitroassessment of mitochondrial dysfunction of Aristolochic acid on HepG2 cells[J].WorldClinDrugs, 2015,36(4):236-42.
[11]杨亚萍,汪亚帷,李梦佳,等.DSF-Cu通过影响线粒体功能和细胞骨架诱导鼻咽癌CNE-2Z细胞凋亡[J].中国药理学通报,2016,32(9):1208-17.
[11]Yang Y P, Wang Y W, Li M J, et al. DSF-Cu induces apoptosis of human nasopharyngeal carcinoma CNE-2Z cells by affecting function of mitochondria and cytoskeleton[J].ChinPharmacolBull, 2016,32(9):1208-17.
[12]Cortassa S, O′rourke B, Aon M A.Redox-optimized ROS balance and the relationship between mitochondrial respiration and ROS[J].BiochimBiophysActa, 2014,1837(2): 287-95.
[13]Kaim G, Dimroth P.ATP synthesis by F-type ATP synthase is obligatorily dependent on the transmembrane voltage[J].EMBOJ, 1999,18(15): 4118-27.
[14]任艳青,田宇柔,李 琛,等. 京尼平苷及其体内代谢产物京尼平对HepG2细胞毒性的比较及机制研究[J].中国药理学通报,2016,32(12):1755-61.
[14]Ren Y Q, Tian Y R, Li C, et al. Cytotoxic effect of geniposideand its metabolite genipin on HepG2 cells and mechanism[J].ChinPharmacolBull, 2016,32(12): 1755-61.
[15]Mazars C, Thuleau P, Lamotte O, et al. Cross-talk between ROS and calcium in regulation of nuclear activities[J].MolPlant, 2010,3(4): 706-18.
ThemitochondrialtoxicityofbentysrepinineonHepG2cells
FENG Yue, HUO Xuan, HU Jin-fang, DI Zhi-quan, ZHANG Zong-peng, SHEN Xiu-ping
(TianjinInstituteofPharmaceuticalResearchNewDrugEvaluationCo.,Ltd.,Tianjin300301)
AimTo provide references for clinical trials dose and rational drug use by evaluating mitochondrial toxicity of bentysrepinine on HepG2 cells.MethodsMitochondrial toxicity of bentysrepinine on HepG2 cells was cmomprehensively evaluated by measuring proliferation inhibition rate, lactic acid content in culture supernatant, reactive oxygen species(ROS) content, mitochondrial membrane potential (MMP) variation and the activity of mitochondrial respiratory chain complex enzymes Ⅰ to Ⅳ.ResultsThe half inhibitory concentration of bentysrepinine of HepG2 cells was 359 μmol·L-1. Compared with the control group, bentysrepinine could reduce the MMP, raise the level of lactic acid, increase the content of ROS and lower the activity of mitochondrial respiratory chain complex enzymes Ⅰ to Ⅲ with the concentration of 400 μmol·L-1(196 mg·L-1), showing an obvious mitochondrial toxicity. Compared with lamivudine and adefovir dipivoxil, bentysrepinine exerted no influence on indexes above with the same concentration 100 μmol·L-1.ConclusionsBentysrepinine shows an obvious mitochondrial toxicity on HepG2 cells with the concentration of 400 μmol·L-1. This mitochondrial toxicity is not presented with the concentration of 200 μmol·L-1. It shows that the safety range of bentysrepinine about mitochondrial toxicity is relatively wide. The test plays a guiding role in clinical trial dose design as well as clinical treatment.
bentysrepinine; mitochondrial toxicity; MMP; ROS; mitochondrial respiratory chain complex enzymes; lactic acid
时间:2017-8-20 16:47 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170820.1647.026.html
2017-06-15,
2017-07-12
国家科技重大专项课题(No 2015ZX09501004-002-003)
冯 玥(1986-),女,硕士,助理研究员,研究方向:药理学、毒理学,通讯作者,E-mail: fengy8@tjipr.com; 申秀萍(1964-),女,本科,研究员,研究方向:药理、毒理,通讯作者,Email:shenxp@tjipr.com
10.3969/j.issn.1001-1978.2017.09.013
A
:1001-1978(2017)09-1248-05
R322.47;R329.24;R512.62;R916.4;R977.6
