己烯雌酚对人类高位和低位隐睾睾丸引带细胞的影响
2017-08-22王冰洁周君梅李玲玲陈方
王冰洁,周君梅,李玲玲,陈方
己烯雌酚对人类高位和低位隐睾睾丸引带细胞的影响
王冰洁,周君梅,李玲玲,陈方
目的研究外源性雌激素己烯雌酚(DES)在体外对高位和低位隐睾患儿睾丸引带细胞的影响。
方法以麻醉下未降睾丸的位置位于内环口以上的腹腔型隐睾为高位组,已出内环口但未出外环口的腹股沟管型隐睾为低位组,分别收集高、低位隐睾患儿术中的废弃引带,经IV 型胶原酶消化后原代培养、比较其形态和细胞骨架的差别;将两组细胞分别培养于溶剂对照组(DMSO)和 DES 浓度梯度为 0.01、0.1、1 及 10 μg/ml 的培养基内 24 h。以鬼笔环肽标记法示 DES 作用前后细胞的形态学改变;CCK-8 法检测其增殖能力的变化;荧光定量 PCR 法检测RXFP2 基因相对表达量的差异。
结果人类高位和低位隐睾睾丸引带细胞大部分为成纤维细胞样,其中低位组的细胞可自发融合成多核肌管样细胞。高浓度 DES(10 μg/ml)可抑制人类高、低位隐睾的睾丸引带细胞的增殖、改变细胞的光镜特征和微丝骨架,但是其对两组细胞的影响没有统计学差异。高浓度 DES 上调两组细胞 RXFP2 的表达水平。
结论人类高、低位隐睾的睾丸引带细胞具有不同的形态特征;高浓度外源性雌激素可改变高位和低位隐睾的睾丸引带细胞骨架、抑制细胞的增殖活力并上调人类引带 RXFP2 基因的表达。
隐睾; 睾丸引带细胞; 己烯雌酚
www.cmbp.net.cn 中国医药生物技术, 2017, 12(4):310-316
隐睾中高位隐睾约占 10%[1],临床发现,未降睾丸位置越高,其发育越差[2],且手术并发症发生率越高[3],但隐睾未降睾丸位置高低不一的原因目前尚未阐明。人类睾丸引带发育异常是隐睾发生的重要因素之一[4-5]。睾丸引带主要由细胞外基质及间充质细胞(主要包括成纤维细胞、少量平滑肌细胞及骨骼肌细胞)构成[6]。已有学者发现人类高位隐睾及低位隐睾睾丸引带的细胞基质成分中总胶原成分存在差异[7],提示引带组织的发育和功能在人类高、低位隐睾中不尽相同。目前动物研究已发现外源性雌激素己烯雌酚(DES)可改变小鼠睾丸引带细胞的微丝骨架并抑制其增殖[8],其对人类睾丸引带的影响尚未见报道。DES 是否通过影响睾丸引带,继而影响到睾丸的下降和停留位置尚有待研究。
基于以上原因,本实验拟首先对人类高位及低位隐睾睾丸引带进行原代细胞培养、观察其形态差异,在此基础上进一步研究外源性 DES 对两组细胞的作用及其差异,探寻其与高、低位隐睾发生的关系,以期为隐睾的防治提供借鉴。
1 材料与方法
1.1 材料
1.1.1 标本来源 人类睾丸引带组织来源于上海市儿童医院泌尿外科的隐睾患儿,患儿术前均明确诊断为隐睾,未伴发其他泌尿生殖系统畸形,且未接受内分泌治疗及其他促进睾丸下降的治疗。根据麻醉后未降睾丸的位置分为 2 组,麻醉下未降睾丸的位置位于内环口以上的腹腔型隐睾为高位组,出内环口但未出外环口的为低位组。本研究已通过医院伦理委员会的批准(编号:2016R009-F01),标本采集已征得患儿家长的知情同意。
1.1.2 实验材料 DMEM 基础培养基、青链霉素、L-谷氨酰胺、非必需氨基酸、胎牛血清、IV 型胶原酶、胰酶均购自美国 Gibco 公司;二甲基亚砜(DMSO)、DES 购自美国 Sigma 公司;Trizol 试剂购自美国 Invitrogen 公司;反转录试剂盒购自日本 Takara 公司;实时荧光定量 PCR 试剂盒购自瑞士 Roche 公司;引物设计及合成由上海生工生物工程公司承担;鬼笔环肽及 CCK-8 试剂盒购自上海翊圣生物科技有限公司;倒置相差显微镜及荧光显微镜购自德国 Leica 公司;生物安全柜购自新加坡 Esco 公司;二氧化碳培养箱及红光/紫外分光光度计购自美国 Thermo 公司;酶标仪购自德国BMG Labtech 公司;台式高速冷冻离心机购自德国Eppendorf 公司。
1.2 方法
1.2.1 睾丸引带细胞的培养 手术切取睾丸引带组织后立即放入完全培养基(DMEM 基础培养基中添加 10% 胎牛血清、1% 青链霉素、L-谷氨酰胺及非必需氨基酸)并密封于冰上,低温运送至生物安全柜操作。取出组织用 IV 型胶原酶(1 mg/ml)37 ℃ 水浴消化 1 h 后,1000 r/min 离心 4 min,弃上清,加入完全培养基重悬,吹打洗涤,再次1000 r/min 离心 4 min,弃上清。细胞沉淀加入完全培养基,吹匀后接种于 4 孔板中,置于 5% CO2、37 ℃ 饱和湿度孵育箱中静置培养。48~72 h 换液1 次,待细胞生长达 90% 融合后进行传代。
1.2.2 实验分组 分别培养高位及低位隐睾的第3 代睾丸引带细胞用于细胞实验,高位组及低位组细胞各分为 6 组:正常对照组以完全培养基培养;溶剂对照组在完全培养基中加入 0.1% DMSO;其余 4 组分别以含 DES 终浓度为 0.01、0.1、1 及10 μg/ml 的完全培养基培养。各组细胞于 5% CO2、37 ℃ 条件下培养 24 h 用于实验。
1.2.3 免疫细胞化学染色 分别取高、低位隐睾的睾丸引带细胞爬片,PBS 洗 3 次,每次 5 min;加入 4% 多聚甲醛室温固定 30 min;PBS 洗涤3 次,每次 5 min;加入鬼笔环肽避光孵育 30 min,然后 PBS 洗涤 3 次,DAPI 复染核后封片,荧光显微镜观察。
1.2.4 CCK-8 法检测细胞增殖与活力 取对数生长期的两组隐睾睾丸引带细胞,将其接种于 96 孔板,2 × 104个细胞/孔。按 1.2.2 分组,诱导 24 h 后分别加入 CCK-8,避光置于 37 ℃ 培养箱中孵育2 h,检测每孔 450 nm 波长下的吸光度(A),计算细胞活力。
细胞活力(%)=(A实验组–A空白组)/(A对照组–A空白组)× 100%
1.2.5 细胞总 RNA 抽提及 RT-PCR 取对数生长期的高位及低位隐睾的睾丸引带细胞,Trizol 法抽提总 RNA,经反转录后进行荧光定量 PCR 检测:①增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)基因表达水平,引物正向序列5' TCTGAGGGCTTCGACACCTA 3',反向序列5' CGCG TTATCTTCGGCCCTTA 3';②松弛素/胰岛素样家族肽受体 2(RXFP2)基因表达水平,引物正向序列 5' ACTCAACTGGGTGGATTTGGA 3',反向序列 5' TGTCTTCTCTGGAACAAAACCAA 3';③内参基因为甘油醛-3-磷酸脱氢酶(GAPDH),其正向序列 5' GCACCGTCAAGGCTGAGAAC 3',反向序列 5' TGGTGAAGACGCCAGTGGA 3'。实验中所用引物浓度均为 10 μmol/L,扩增条件为:95 ℃ 预变性 10 min;95 ℃ 变性 10 s,60 ℃ 退火 30 s,72 ℃ 延伸 30 s,40 个循环。
1.3 统计学处理
应用 SPSS 23.0 统计软件进行统计分析,数据均以±s表示,高位及低位组组间比较采用独立样本t检验;高、低位组内各浓度组之间比较采用单因素方差分析,P< 0.05 即认为差异有显著性。
2 结果
本实验高位组招募 7 例患儿,低位组招募22 例患儿分别进行睾丸引带原代细胞培养,其中高位组成功培养出 5 例,低位组成功培养出 16 例;两组各取 3 例进行引带细胞 DES 刺激实验。
2.1 DES 作用下隐睾睾丸引带细胞的光镜特征
研究发现,高位组引带细胞光镜下细胞形态为成纤维样细胞,胞体呈梭型或不规则多边形,胞质有突起,胞核圆(图 1A);高位组引带细胞在溶剂对照组及低浓度 DES(0.01、0.1 和 1 μg/ml)作用下未见明显形态改变;而在高浓度 DES(10 μg/ml)作用下,细胞开始从盖玻片表面脱离,死亡明显增多,存活细胞胞体皱缩(图 1B);低位隐睾睾丸引带细胞的培养过程中发现原代培养部分细胞自发出现细胞融合现象,表现为多核肌管样细胞,胞体大而长,多个胞核并排于胞质中(图 1C 白色箭头);低位溶剂对照组及低浓度 DES(0.01、0.1 和1 μg/ml)作用下未见明显形态改变;低位组细胞在高浓度 DES(10 μg/ml)作用下发生了类似高位组的变化(图 1D)。
2.2 己烯雌酚可改变人类高、低位隐睾睾丸引带细胞的微丝骨架
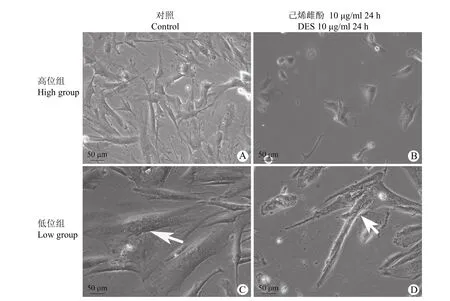
图1 DES 对高、低位隐睾睾丸引带细胞形态的影响(白色箭头示多核细胞)Figure 1 Effects of DES on morphology of cryptorchidism testis gubernaculum cell in high and low position (White arrows show multinucleated cells)

图2 鬼笔环肽标记的 DES 对高、低位隐睾睾丸引带细胞骨架的影响(白色箭头示多核细胞)Figure 2 Effects of DES on cytoskeleton of cryptorchidism testis gubernaculum cell in high and low position (White arrows show multinucleated cells)
鬼笔环肽标记的肌动蛋白丝(F-actin)荧光染色显示,高位隐睾引带细胞微丝骨架(绿色)清晰,肌动蛋白分布均匀(图 2A);高位组引带细胞在溶剂对照组及低浓度 DES(0.01、0.1 和 1 μg/ml)作用下未见明显细胞骨架改变;而在高浓度 DES(10 μg/ml)作用后,镜下观察可见死细胞增多,存活细胞肌动蛋白纤维排列紊乱,细胞骨架重塑(图 2B);低位组隐睾引带细胞骨架清晰,肌动蛋白骨架舒展且分布均匀,多个细胞核(蓝色)位于一个细胞内(图 2C 白色箭头);低位组引带细胞在溶剂对照组及低浓度 DES(0.01、0.1 和1 μg/ml)作用下未见明显形态改变;而在高浓度DES(10 μg/ml)作用后,镜下观察低位引带细胞骨架也发生与高位组类似重塑改变(图 2D)。
2.3 己烯雌酚可抑制人类高、低位隐睾睾丸引带细胞的增殖并上调 RXFP2 表达量
高、低位溶剂对照组与正常对照组相比没有显著性差异,高位组 DES 作用 24 h 后的细胞增殖活力数值分别为(98.47 ± 6.58)%、(99.68 ±3.48)%、(99.42 ± 3.20)%、(98.41 ± 2.11)%、(72.07± 5.71)%,但是只有高浓度 DES(10 μg/ml)与对照组相比存在统计学差异(P= 0.0005);低位组DES 的细胞增殖活力数值分别为(95.44 ± 3.97)%、(96.53 ± 3.01)%、(91.15 ± 8.59)%、(83.16 ±6.11)%、(67.77 ± 3.01)%,也呈现下降的趋势,但只有 10 μg/ml 浓度组与对照组存在统计学差异(P= 0.038)(图 3A)。为此,我们分别检测了高、低位组细胞在高浓度 DES 组的 PCNA 表达量,发现高浓度 DES 组处理后两组细胞的 PCNA均下降(P= 0.002,图 3B),差异均有统计学意义;而在高浓度 DES 处理后高、低位引带细胞的 INSL3 受体 RXFP2 表达量均呈现上升趋势(图 3C);但 DES 对高、低位两组的细胞增殖的抑制影响、PCNA 及 RXFP2 的表达水平改变均没有显著性差异。

图3 DES 对高、低位隐睾睾丸引带细胞增殖活力及相关基因表达量影响(*P< 0.05,**P< 0.01)(A:DES 作用 24 h 后高、低位隐睾睾丸引带细胞增殖力变化;B:10 μg/ml DES 作用 24 h 后高、低位隐睾睾丸引带细胞 PCNA 相对表达量的变化;C:10 μg/ml DES 作用 24 h 后高、低位隐睾睾丸引带细胞 RXFP2 相对表达量的变化)Figure 3 Effects of DES on proliferation vitality and related gene expression of cryptorchidism testis gubernaculum cell in high and low position (*P< 0.05,**P< 0.01) (A: The change of cell proliferation vitality after exposure to DES for 24 h in the high and low group; B: The change of PCNA relative expression after exposure to DES 10 μg/ml for 24 h in the two groups; C: The change of RXFP2 relative expression after exposure to DES 10 μg/ml for 24 h in the two groups)
3 讨论
隐睾睾丸位置高低与睾丸发育和手术效果密切相关[1,9],目前针对高、低位隐睾的研究多集中于手术方式的改良,而高位和低位隐睾的发病机制有何差异仍有待研究,睾丸引带异常是引起隐睾的重要病因,其与高、低位隐睾发生的关系有待研究。
我院儿童专科医院特色生物样本库的建立为隐睾等先天性疾病的研究提供了实验平台[10]。隐睾是出生后才可明确诊断的以临床症状命名的疾病,在胚胎期尚无法推测其出生后睾丸能下降的最终位置,且人类胚胎睾丸引带采集涉及备受争议的伦理问题,故本研究采集的标本系隐睾形成后的引带而不是形成过程中的引带。Robbins 等[11]在大鼠的胚胎睾丸引带中培养出长条的多核肌管细胞,提示正常胚胎睾丸引带应具有向肌细胞分化的潜能。本研究发现,人类低位隐睾睾丸引带原代培养的部分细胞在体外可自发融合成多核肌管样细胞,考虑到原代细胞培养存在一定细胞损耗,因而并非所有低位隐睾引带均可培养出肌管细胞。这与 Robbins 等对大鼠胚胎睾丸引带-提睾肌复合体原代培养出的间充质细胞融合成多核肌管细胞的现象相一致。而在人类高位睾丸引带原代培养的细胞均未观察到多核肌管细胞形成。以上结果提示,人类隐睾睾丸引带在发育过程中具有肌肉样细胞的成分差异,该差异可能会影响下降睾丸的最终停留位置,其具体机制仍有待进一步研究。
近年来,越来越多的证据表明,环境因素可影响人类健康[12],其中环境内分泌干扰物质(endocrine-disrupting chemicals,EDCs)与隐睾的发生相关,其代表因子 DES 可通过影响机体内分泌系统进而干扰生殖系统的发育和功能[13],使动物及人类后代隐睾发病率升高[14-15]。动物实验中已经发现 DES 可致小鼠睾丸引带细胞骨架重塑、细胞周边肌动蛋白丝带模糊、应力纤维增加[16-17]。细胞骨架是由细长的蛋白质聚合物纤维形成的网络,肌动蛋白细胞骨架纤维的组装和拆解存在一个动态平衡,其重组的调节对细胞内运输、收缩、运动、分裂和增殖的过程至关重要[18]。DES 对小鼠引带细胞的影响提示其可致 F-actin 发生解聚、形成应力纤维,导致胞质内细胞骨架排列紊乱,继而可能降低细胞的收缩、影响其分裂和增殖。综上所述,DES 可改变小鼠引带细胞骨架形态并影响其增殖功能,但目前尚没有针对其他种属的睾丸引带细胞做相关的研究验证工作,故本研究在睾丸引带动物实验研究的基础上进行 DES 对人类引带细胞的骨架及增殖功能研究。
本研究发现,高浓度 DES(10 μg/ml)影响人类高位和低位隐睾睾丸引带细胞、导致细胞 F-actin骨架重塑、细胞死亡增多,这与之前在小鼠睾丸引带细胞中观察到的结果相似[16-17];此外,随着 DES暴露浓度的增加,仅见高浓度 DES 对高位和低位隐睾睾丸引带细胞的增殖均具有明显抑制作用,且两组细胞在高浓度状态下的 PCNA 表达均显著下调也进一步证实了该现象,而低浓度亚组均未见明显统计学差异。以上结果提示,DES 可能通过浓度依赖的方式改变高、低位隐睾睾丸引带细胞的细胞骨架、影响 F-actin 组装和拆解的动态平衡、继而导致细胞肌动蛋白骨架重塑,由此阻碍了细胞分裂的过程、导致细胞增殖能力的下降和收缩力的改变、继而影响到睾丸引带的发育、导致隐睾的发生。本研究未发现各浓度组的 DES 对高位和低位引带细胞的作用具有明显差异,其原因可能在于 DES对于各个阶段的细胞均具有毒性作用,一旦不同发育阶段的胚胎接触到 DES,即会对该阶段的细胞产生影响,根据受 DES 影响时的不同胎龄而导致不同结果,出生后表现为高位或低位隐睾。
此外,已有研究证实,RXFP2 与引带发育密切相关[19]。目前有学者以小鼠胚胎期宫内暴露于DES 后雄性后代的睾丸引带为研究对象检测RXFP2 的受体表达水平的改变,以期探寻 DES 对睾丸引带作用的内分泌通路。该课题组发现宫内暴露于 DES(50 μg/kg·d)RXFP2 表达水平较对照组升高[20]。此外,李建宏等[21]在体外用 DES(10 μg/ml)刺激小鼠引带原代细胞后,其 RXFP2 表达呈现上调,与胚胎期宫内暴露引带的结果相一致。上述结果均与本实验中人类高、低位引带细胞在体外暴露于 10 μg/ml DES 的激素相关受体基因表达的结果相一致,说明人类高位隐睾睾丸引带细胞在 DES毒染的作用下呈现出与小鼠引带细胞相似的激素受体水平改变,推测 DES 可能是通过 RXFP2 通路影响人类引带细胞的生长,具体机制仍有待进一步研究。
[1]Denes FT, Saito FJ, Silva FA, et al.Laparoscopic diagnosis and treatment of nonpalpable testis.IntBraz J Urol, 2008, 34(3):329-334.
[2]Shono T, Kondo T, Suita S.Differential development of ectopic testes based on their location in rats.J PediatrUrol, 2006, 2(5):464-467.
[3]Vikraman J, Hutson JM, Li R, et al.The undescended testis: Clinicalmanagement and scientific advances.SeminPediatrSurg, 2016,25(4):241-248.
[4]Zhuang LK.Progress in the study of factors regulating the differentiation of gubernaculum testis.Chin J PediatrSurg, 2011,32(1):65-68.(in Chinese)
庄利恺.调节睾丸引带分化的因素研究进展.中华小儿外科杂志,2011, 32(1):65-68.
[5]Favorito LA, Costa SF, Julio-Junior HR, et al.The importance of the gubernaculum in testicular migration during the human fetal period.IntBraz J Urol, 2014, 40(6):722-729.
[6]Costa WS, Sampaio FJ, Favorito LA, et al.Testicular migration:remodeling of connective tissue and muscle cells in human gubernaculum testis.J Urol, 2002, 167(5):2171-2176.
[7]Soito IC, Favorito LA, Costa WS, et al.Extracellular matrix remodeling in the human gubernaculum during fetal testicular descent and in cryptorchidic children.World J Urol, 2011, 29(4):535-540.
[8]Duan S, Zhang X, Jiang X, et al.An insight into insulin-like factor 3 regulate its receptor RXFP2 in mouse gubernaculum testis cells.Int J Clin Exp Pathol, 2015, 8(11):14806-14811.
[9]Kurz D.Current management of undescended testes.Curr Treat Options Pediatr, 2016, 2(1):43-51.
[10]Wang M, Gao ZM, Lyu ZB, et al.Establishment and application of the biobanks with children's hospital features.Chin Med Biotechnol, 2016,11(3):280-284.(in Chinese)
王敏, 高志梅, 吕志宝, 等.儿童专科医院特色生物样本库的建立与应用.中国医药生物技术, 2016, 11(3):280-284.
[11]Robbins AK, Mateson AB, Khandha A, et al.Fetal rat gubernaculum mesenchymal cells adopt myogenic and myofibroblast-like phenotypes.J Urol, 2016, 196(1):270-278.
[12]Shi ML, Zhao ZH.Epigenetic, environment and disease.Chin Med Biotechnol, 2013, 8(5):362-367.(in Chinese)
师明磊, 赵志虎.表观遗传、环境与疾病.中国医药生物技术, 2013,8(5):362-367.
[13]Casals-Casas C, Desvergne B.Endocrine disruptors: from endocrine to metabolic disruption.Annu Rev Physiol, 2011, 73:135-162.
[14]Zhang L, Zheng XM, Zheng H, et al.The effect of diethylstilbestrol on inducing abdominal cryptorchidism and relevant genetic expression in rats.Chin J Prev Med, 2009, 43(5):413-417.(in Chinese)
张林, 郑新民, 郑航, 等.己烯雌酚致大鼠腹腔内隐睾及其对相关基因表达的影响.中华预防医学杂志, 2009, 43(5):413-417.
[15]Palmer JR, Herbst AL, Noller KL, et al.Urogenital abnormalities in men exposed to diethylstilbestrol in utero: a cohort study.Environ Health, 2009, 8:37.
[16]Zhang X, Jiang XW, Li JH, et al.Effects of diethylstilbestrol on F-actin and free Ca2+ in mouse gubernaculum cells in culture.J Environ Health, 2014, 31(2):100-103.(in Chinese)
张镟, 蒋学武, 李建宏, 等.己烯雌酚染毒对小鼠睾丸引带细胞纤维肌动蛋白和游离钙离子浓度的影响.环境与健康杂志, 2014,31(2):100-103.
[17]Zhang X, Li JH, Ma L, et al.Diethylstilbestrol impairs the morphology and function of mouse gubernaculum testis in culture.Cell BiolToxicol, 2012, 28(6):397-407.
[18]Páchniková G, Uldrijan S, Imramovský A, et al.Substituted 2-hydroxy-N-(arylalkyl)benzamide sensitizes cancer cells to metabolic stress by disrupting actin cytoskeleton and inhibiting autophagic flux.Toxicol In Vitro, 2016, 37:70-78.
[19]Ferlin A, Simonato M, Bartoloni L, et al.The INSL3-LGR8/GREAT ligand-receptor pair in human cryptorchidism.J Clin Endocrinol Metab, 2003, 88(9):4273-4279.
[20]Du YS.Effect of diethylstilbestrol on expressions of AR, ERα, Acta1 and PCNA mRNA in gubernaculum testis tissues.Shantou:Shantou University, 2009.(in Chinese)
杜源生.己烯雌酚对小鼠睾丸引带组织中AR、ERα、Actal和PCNA mRNA表达的影响.汕头: 汕头大学, 2009.
[21]Li JH, Duan SX, Qi YW, et al.Effect of different concentrations of diethylstilbestrol and insulin—like factor 3 on expressions of leucine rich repeat containing G protein coupled receptor 8 mRNA and protein in gubernaculum testis cells in vitro.J Appl Clin Pediatr, 2011,26(11):830-832.(in Chinese)
李建宏, 段守兴, 祁艳卫, 等.己烯雌酚和胰岛素样因子 3对睾丸引带细胞中富含亮氨酸的G蛋白耦联受体8 mRNA和蛋白表达水平的影响.实用儿科临床杂志, 2011, 26(11):830-832.
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(4):310-316
组织生物样本库标准化培训将在青岛举办
2017年 9月 7 – 9日,“标准化理论与国家标准制修订培训班、生物样本库岗前培训和生物样本库质量达标检查培训”将在青岛举办。本次培训班由中国医药生物技术协会组织生物样本库分会、全国医药生物样本标准化技术委员会和中国生物样本库联盟主办。
中国医药生物技术协会组织生物样本库分会于 2009年,经卫生部、民政部批复成立,分会秉承“珍惜样本、执行标准、充分应用、维护产权”的宗旨,充分发挥行业规范、学术交流、教育培训、国际交流、科研服务的主要职能。自成立以来,组织举办九届中国生物样本库标准化建立与应用研讨会、四届中国生物样本库院长高峰论坛,与国家 863 分子分型项目组、癌症基因组共同编写了《中国生物样本库与数据库建立指南》,编译《ISBER 最佳实践 2012》,制定《中国医药生物技术协会生物样本库标准(试行)》,为我国近 100 家医院提供培训,为全国数十家医院提供质量控制。同时,全国生物样本标准化技术委员会于 2015年 6月经国家标准化管理委员会批复成立。
会务组联系电话:021-51320288-5307。联系人:徐艳萍。
The effect of diethylstilbestrol on high and low gubernaculums cells from cryptorchid patients
WANG Bing-jie, ZHOU Jun-mei, LI Ling-ling, CHEN Fang
ObjectiveTo explore the effect of diethylstilbestrol (DES) between the primary cells cultured from gubernaculum testis of cryptorchid patients whose undescend testis located in high position and low position.
MethodsThe gubernaculum testis were collected from cryptorchid patients during orchidopexy.Two groups named high group and low group were divided depending on the position of undescended testis after anesthesia.The position which was higher than the inner ring or between the inner ring and the outer ring was named the high group or the low group, respectively.The primary cells were cultured through type IV collagenase digestion and their morphology and cytoskeleton differences were compared.Then we cultured cells of the two groups in solvent control group (DMSO) and DES concentration gradient of 0.01, 0.1, 1 and 10 μg/ml and compared them with the control group respectively.Meanwhile the morphology, cell proliferation changes and the relative expression level of gene RXFP2 were detected.
ResultsHuman gubernaculum testis cells were mostly fibroblast-like and no difference was found between them in cytoskeleton.The morphology of high group cells did not change significantly while some low group cells spontaneously fused into multinucleated myotubes during culture.Additionally, high concentration of DES (10 μg/ml) changed the morphology and microfilament cytoskeleton of human cryptorchidism gubernaculum testis cells and inhibited their proliferation in both groups, but there was no statistical differences in the effects on the cells of two groups.The expression of RXFP2 was up-regulated by high concentration of DES at high concentration (10 μg/ml) in both groups.Meanwhile the expression level of PCNA was significantly lower in the DES group than that in the control group in both high and low groups.
ConclusionHigh concentration exogenous estrogen can remodel the microfilament cytoskeleton of human cryptorchidism gubernaculum cells and inhibits their proliferation in both groups, but no significant difference is found between the two groups.DES of high concentration (10 μg/ml) up-regulates the expression level of human RXFP2 gene.
Cryptorchidism; Gubernaculum testis cells; Diethylstilbestrol
ZHOU Jun-mei, Email: junmei_zhou@139.com
10.3969/j.issn.1673-713X.2017.04.004
国家自然科学基金(81270742、81370700、81470911);上海交通大学医工交叉研究基金(YG2016MS32)
200040 上海交通大学附属儿童医院/上海市儿童医院泌尿外科(王冰洁、陈方),中心实验室(周君梅、李玲玲)
周君梅,Email:junmei_zhou@139.com
2017-03-23
Author Affiliation:Department of Urology (WANG Bing-jie, CHEN Fang), Central Laboratory (ZHOU Jun-mei, LI Ling-ling),Shanghai Children’s hospital, Shanghai Jiaotong University, Shanghai 200040, China
