BBC3基因表达与肺鳞状细胞癌预后的相关性及其分子机制研究
2017-08-16沈学远胡煜琳
李 超,沈学远,胡煜琳
(1.重庆医科大学附属永川医院胸心外科,重庆 402160;2.重庆医科大学附属永川医院肾病风湿科,重庆 402160;3.重庆市荣昌区人民医院内科 402160)
BBC3基因表达与肺鳞状细胞癌预后的相关性及其分子机制研究
李 超1,沈学远1,胡煜琳2,3△
(1.重庆医科大学附属永川医院胸心外科,重庆 402160;2.重庆医科大学附属永川医院肾病风湿科,重庆 402160;3.重庆市荣昌区人民医院内科 402160)
目的 验证BCL2绑定组件3(BBC3)基因表达与肺鳞状细胞癌(LUSC)术后生存时间的相关性,探究其分子机制。方法 利用实时荧光定量PCR(qRT-PCR)技术检测BBC3基因在39例LUSC患者肿瘤组织标本内的表达,并对患者进行随访,收集临床生存资料。使用Kaplan-Meier法结合log rank检验进行生存分析,使用COX比例风险模型进行多因素生存分析。在NCI-H226细胞系内过表达BBC3基因,利用噻唑蓝(MTT)法及流式细胞术检测其表达对细胞增殖及凋亡的影响。结果 BBC3的表达与肿瘤是否转移(r=0.556,P=0.023)、肿瘤大小(r=0.532,P=0.042)、T分期(r=0.551,P=0.021)及TNM分期(r=0.524,P=0.047)明显相关。Kaplan-Meier法结合log rank检验发现BBC3表达与患者生存时间明显相关,BBC3高表达者生存时间明显高于BBC3低表达者(χ2=7.542,P=0.006)。COX比例风险模型分析发现,肿瘤是否转移、肿瘤T分期、TNM分期及BBC3表达均独立且明显影响患者的生存时间(P<0.05)。重组BBC3质粒组凋亡细胞比例明显高于对照组与空载质粒组,差异均有统计学意义(P<0.05)。结论 BBC3基因表达可抑制肿瘤细胞增殖、促进凋亡,与LUSC预后具有明显相关性,可能作为判别LUSC术后生存预测的的潜在辅助性分子标志物。
BBC3;肺;肿瘤,鳞状细胞;预后;细胞增殖;细胞凋亡;生物学标记
肺癌是当今世界对人类健康与生命危害最大的恶性肿瘤之一,肺癌因其早期不易被发现并且对化疗和放疗常产生耐药,故病死率高[1]。其中肺鳞状细胞癌(lung squamous cell carcinoma,LUSC)占所有非小细胞肺癌(non-small cell lung cancers,NSCLC)的80%以上,是最常见的肺癌类型。目前,LUSC发生、发展的分子机制研究已有大量的积累,但由于缺少准确的预后分子标志物或指标,患者的5年生存率仍然处于非常低的水平[2-3]。生物芯片、高通量测序及蛋白质谱等高通量生物技术的迅速发展,为快速有效地寻找LUSC的早期预后分子标志物提供了新的视角与方向[1,4-8]。目前,已有部分研究通过高通量技术,发现了一些潜在的分子标志物,例如:表皮生长因子受体(EGFR)[9]、核苷酸剪切修复复合体(ERCC1)的5′核酸内切酶[10]、原癌基因Kirsten-Rous肉瘤病毒(K-ras)[11]、核糖核苷酸还原酶的调节亚基(RRM1)[12]。但又陆续有研究发现,这些标志物的预测准确性及与LUSC的功能相关性都有限,且缺少多中心、大样本研究的验证[13-14]。因此,在本课题组的前期工作中,利用公共数据库中收集得到的大量LUSC组织标本表达谱数据及临床生存资料数据,结合生物信息学分析发现了5个潜在的LUSC预后相关的基因。其中BCL2绑定组件3(BCL2 binding component 3,BBC3)还未有研究发现其与LUSC的关系[15]。本研究中收集39例患者LUSC组织标本及相关的临床生存资料,并检测BBC3基因的表达情况,进一步验证BBC3基因与LUSC预后的相关性。同时,研究BBC3基因与癌细胞增殖与凋亡的分子机制,评估其作为LUSC预后分子诊断标志物的潜力。
1 资料与方法
1.1 一般资料 LUSC组织标本均取自重庆医科大学附属永川医院2010-2012年手术切除的LUSC组织,患者共39例,男28例,女11例;年龄34~72岁;有吸烟史者26例,无吸烟史者13例;22例肿瘤发生转移,17例未转移;肿瘤大于或等于3 cm者21例,<3 cm 者18例;T分期0期20例,Ⅰ期8例,Ⅱ期11例;TNM分期Ⅰ期13例,Ⅱ期12例,Ⅲ期14例;癌胚抗原(CEA)水平高22例,正常17例;术后10例行化疗,29例未行化疗。所有标本均在离体后30 min内液氮速冻,并于-80 ℃冰箱保存。术后跟踪随访患者至2015年6月,记录死亡时间与病例,每3个月随访1次,每次详细记录患者的一般体征及相关检查结果,以手术时间为生存起始时间,以随访结束时间为终止时间,随访时间均大于3年,对于非肿瘤原因导致的死亡视为“存活”,随访截止时有20人死亡。
1.2 方法
1.2.1 细胞培养与基因过表达试验 人肺癌NCI-H226细胞购自中国科学院细胞库(货号:TCHu235)。常规培养,接种至6孔板,待细胞生长平铺约60%~80%,按照lipofectamine 2000TM试剂盒(美国Invitrogen公司)说明书进行转染,经检测无突变的重组质粒加入量为4 μg/L,转染细胞后加入100 mL/L胎牛血清1640培养液(上海远慕生物科技有限公司),于37 ℃、5%CO2条件下培养细胞48 h,挑取单克隆集落逐步扩增后传代培养,以200 μg/mL G418维持。试验设3个组,分别为无转染空白细胞对照(NCI-H226)组,空载质粒转染细胞对照(NCI-H226-pcDNA3.1)组及重组BBC3质粒试验(NCI-H226-pcDNA3.1-BBC3)组。利用蛋白质印迹法(Western blotting)检测BBC3基因的表达。
1.2.2 实时荧光定量PCR(qRT-PCR) 利用TRIZol试剂盒(美国Invitrogen公司)提取细胞总RNA,具体步骤参考试剂盒说明。采用SYBR Green法检测BBC3基因的表达。采用10.00 μL ABI体系,包括单链cDNA 1.00 μL,SYBR Green Real-time PCR Master Mix 5.00 μL,上游引物和下游引物各0.45 μL(1 μmol/L),再加去离子水3.10 μL。采用ABI Stepone qRT-PCR仪检测。PCR循环参数:95 ℃ 60 s,95 ℃ 15 s,60 ℃ 15 s,72 ℃ 35 s,共40个循环。以β-actin基因作为内参照进行PCR,用计算机软件(StepOneTMSoftware v3.0)分析各反应的荧光强度得出反应的循环阈值(cycle threshold,Ct)。使用比较Ct值法计算目的基因的相对表达水平。引物信息见表1。
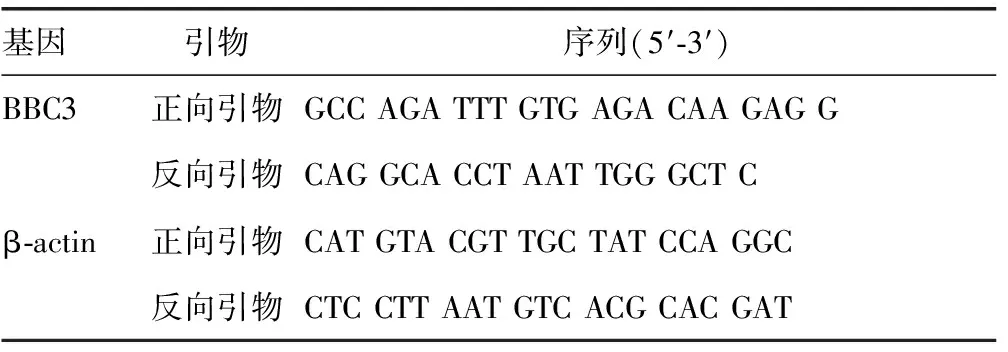
表1 PCR引物
1.2.3 Western blotting 收集细胞,加入细胞裂解液,提取总蛋白。采用二喹啉甲酸(BCA)法进行蛋白定量。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后将蛋白转至聚偏氟乙烯(PVDF)膜,在5%牛血清清蛋白(BSA)溶液中室温孵育1 h以封闭膜上的非特异结合。Tris缓冲生理盐水/吐温(TBS/T)洗膜3次,每次5 min。封闭过的膜加入一级抗体(CST,货号:4976,1∶1 000稀释)4 ℃过夜,抗原抗体结合。TBS/T洗膜3次,每次5 min。加入辣根过氧化物酶(HRP)标记的二级抗体(CST,货号:7467,1∶3 000稀释)以结合一级抗体及HRP标记的抗生物素抗体以结合分子量标准,室温孵育膜1 h。TBS/T洗膜3次,每次5 min。加入化学发光底物发光,用凝胶成像系统(美国Chemilumines-cenceimaging system)扫描图像,Image J分析软件将图片上每个特异条带灰度数值化,统计BBC3蛋白与β-actin吸光度(A)值比值。
1.2.4 噻唑蓝(MTT)比色法 收集对数期细胞,调整细胞悬液浓度约5×104/mL,接种于96孔板,每孔加入100 μL,培养箱中培养至细胞单层铺满孔底。共设置3组:对照组,空载质粒组,重组BBC3质粒组,每组设3个复孔。培养24 h后,倒置显微镜下观察。每孔加入20 μL MTT溶液(5 mg/mL,即0.5% MTT),继续培养4 h,2 000 r/min离心96孔板,利用虹吸原理弃去培养液。每孔加入150 μL二甲基亚砜,置摇床上振荡10 min。在酶标仪490 nm波长处测量各孔A值。
1.2.5 流式细胞术 3组细胞(对照组、质粒组、重组BBC3质粒组)取对数生长期细胞以1×105/孔接种于96孔板中,每孔2 mL体系,待细胞贴壁后换液。3组均设3个复孔,继续培养24 h后,消化收集细胞(包括上清中的细胞),磷酸盐缓冲液(PBS)洗涤2遍,弃去上清液,加入5 μL磷脂结合蛋白V(Annexin V)和1 μL碘化丙啶(PI)做标记,避光15 min,再加入1×Buffer 400 μL,上机检测。
1.3 统计学处理 采用SPSS17.0统计软件进行统计分析,使用Sperman等级相关分析BBC3基因表达与各临床指标间的相关性,使用Kaplan-Meier法进行生存分析,使用log rank检验分析单因素预后显著性,使用COX比例风险模型进行多因素生存分析。采用Students′t检验计算不同组间的差异。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 BBC3基因表达与临床资料及LUSC预后的相关性 BBC3的表达与肿瘤是否转移(r=0.556,P=0.023)、肿瘤大小(r=0.532,P=0.042)、T分期(r=0.551,P=0.021)及TNM分期(r=0.524,P=0.047)明显相关,与年龄(r=0.231,P=0.467)、性别(r=0.215,P=0.632)、吸烟史(r=0.313,P=0.197)、CEA水平(r=0.322,P=0.124)、术后是否化疗(r=0.304,P=0.226)无明显相关性,见表2。以39份组织标本BBC3基因表达水平的中位数为界,分为BBC3高表达者(17例)与BBC3低表达者(22例)。使用Kaplan-Meier法绘制LUSC患者的生存曲线,见图1;同时利用log rank检验分析BBC3表达与生存时间的相关性,结果显示二者明显相关,其中BBC3高表达者生存时间明显高于BBC3低表达者,差异有统计学意义(χ2=7.542,P=0.006)。
2.2 多因素分析生存时间的影响因素 本研究使用COX比例风险模型对可能影响患者生存时间的多种临床资料进行多因素分析,结果发现,肿瘤是否转移、肿瘤T分期、TNM分期及BBC3表达均独立且明显影响患者的生存时间,见表3。
2.3 BBC3对细胞增殖的影响 Western blotting检测3组细胞中BBC3基因表达情况见图2A。重组BBC3质粒组中BBC3表达明显升高(P<0.05),而对照组与空载质粒组比较,差异无统计学意义(P>005),BBC3基因的过表达试验有效。采用MTT法检测BBC3表达对细胞增殖能力的影响,结果发现,与对照组相比,空载质粒组细胞存活率为108%,重组BBC3质粒组降低到74%;重组BBC3质粒组与对照组及空载质粒组比较,差异均有统计学意义(P<0.05),见图2B。
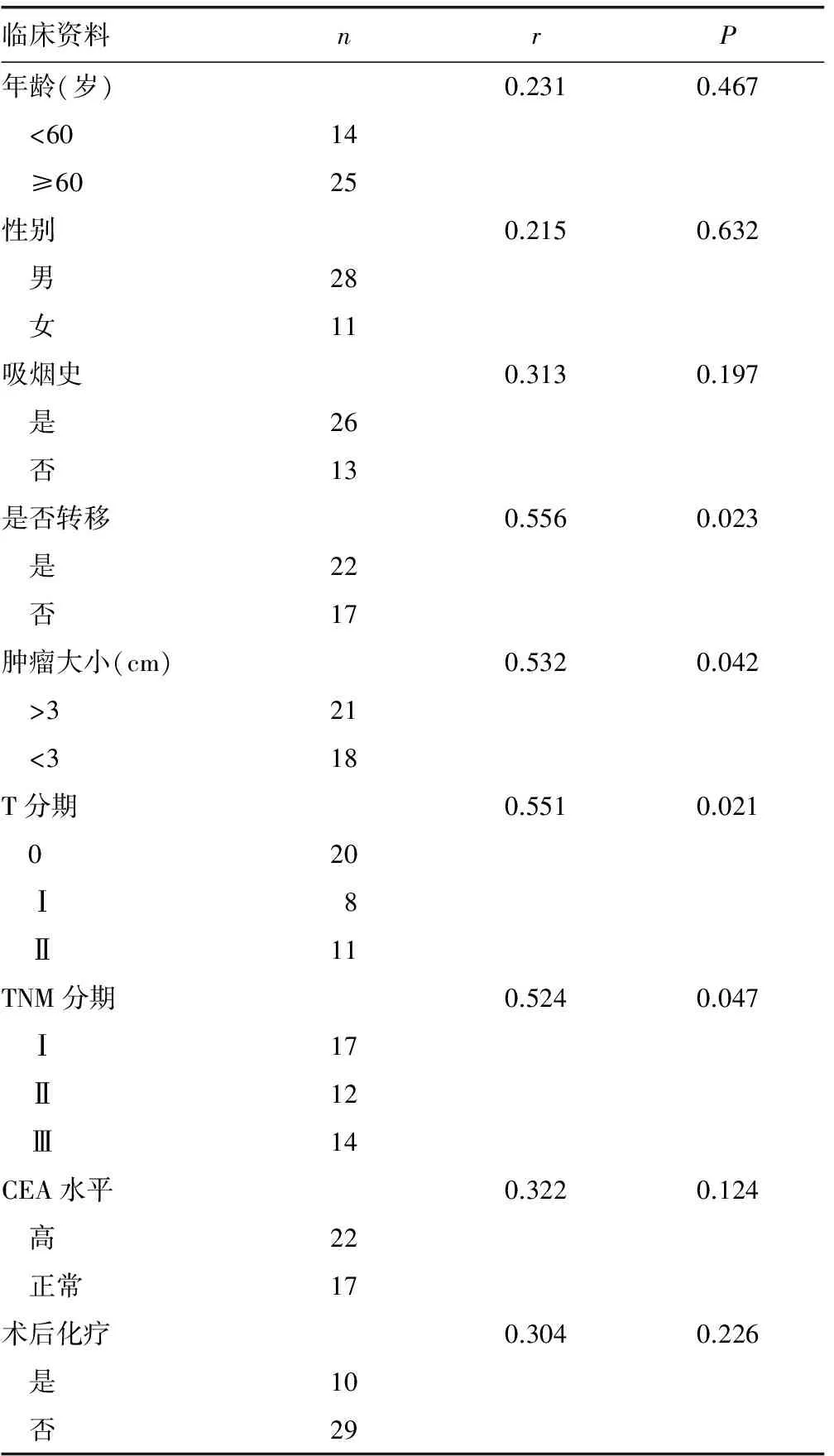
表2 患者临床资料与BBC3表达相关性
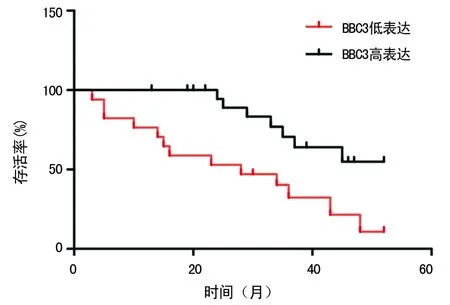
图1 BBC3高表达与低表达患者的生存曲线
2.4 BBC3对细胞凋亡的影响 利用流式细胞术检测3组细胞的凋亡,对照组、空载质粒组、重组BBC3质粒组细胞的凋亡率分别为(51.28±6.23)%、(54.34±5.46)%及(75.08±6.24)%,其中重组BBC3质粒组凋亡细胞比例明显高于其他两组,差异均有统计学意义(P<0.05);而对照组与空载质粒组比较,差异无统计学意义(P>0.05),见图3、表4。
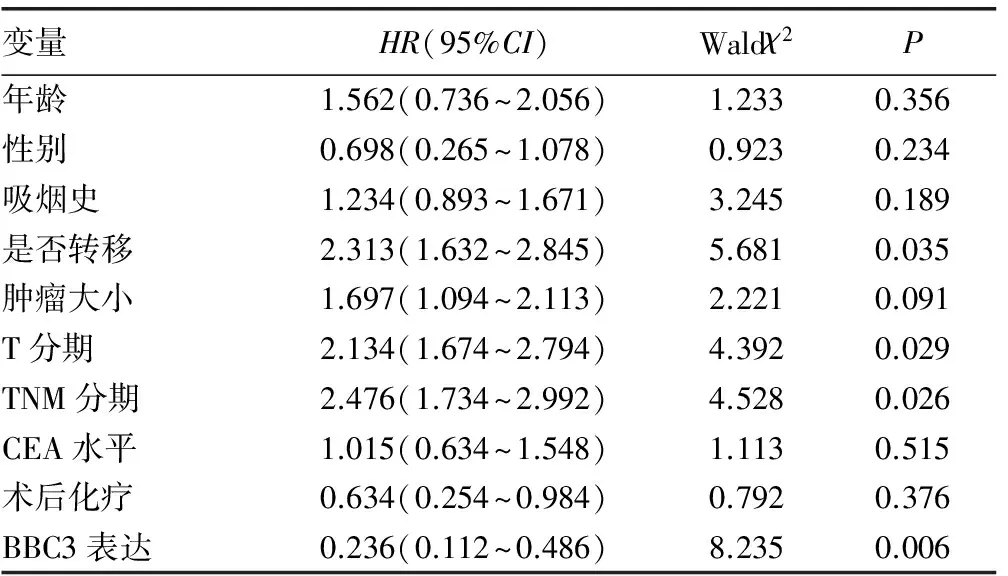
表3 影响生存时间的多因素分析
HR:风险比

A:Western blotting检测3组细胞内BBC3表达;B:MTT法检测3组细胞的增殖能力;*:P<0.05,与空载质粒组比较
图2 3组细胞内BBC3的表达及细胞增殖能力

图3 流式细胞术检测3组细胞凋亡
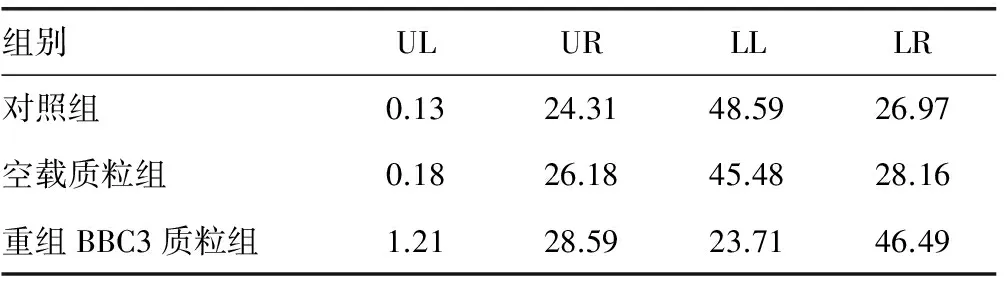
组别ULURLLLR对照组0.1324.3148.5926.97空载质粒组0.1826.1845.4828.16重组BBC3质粒组1.2128.5923.7146.49
UL:左上角(单核细胞);LL:左下角(活细胞);UR:右上角(坏死及末期凋亡细胞);LR:右下角(早期凋亡细胞)
3 讨 论
传统利用高通量技术筛选肿瘤标志物的技术手段,往往只单纯地分析所有基因的表达情况(转录组学研究),筛选出在不同组间表达存在明显差异的基因。而后再扩大样本量检测某些候选标志基因的表达,进一步验证其分型的准确性和稳定性。而区别于传统的高通量技术筛选肿瘤标志物的方式,在本课题组的前期工作中,不仅仅考虑基因在不同组间的表达差异情况(Cox生存分析),同时,还进一步整合了基因间的调控关系信息(TF调控基因集)、基因与其他分子间的调控关系信息(miRNA靶向基因集)及基因本身的生物学功能信息(GO功能数据集)。最终利用基因表达信息(转录组)结合以上3种其他层面的分子信息综合分析筛选,最后得到更具有生物学代表性的候选分子标志物,其中包括了BBC3[15]。而本研究即通过收集LUSC患者组织标本,针对前期工作得到的BBC3基因进行进一步的试验验证,然后利用Kaplan-Meier法及Cox比例风险分析发现,BBC3基因的表达确实与LUSC患者的临床生存时间明显相关。
为了进一步探究BBC3基因在肿瘤预后中可能的分子机制,本研究进一步对BBC3在NCI-226细胞内进行过表达试验,然后检测BBC3的表达对细胞增殖及凋亡能力的影响,结果发现,BBC3的高表达可以抑制细胞的增殖并促进细胞凋亡。由此认为,在LUSC的发展过程中,BBC3基因参与细胞凋亡通路,是影响LUSC生存时间的关键机制。同时,BBC3基因本身也是一个经典的促凋亡蛋白,属于Bcl2蛋白家族成员,可与其他Bcl2蛋白家族成员结合并诱导线粒体功能紊乱,同时激活(Caspase)凋亡途径[16]。另还有研究发现,其在细胞自噬过程中也起到重要作用[17]。因BBC3在凋亡过程中的重要作用,有研究认为其可能成为肿瘤治疗的一个关键性靶点蛋白。目前已有研究证明,BBC3与胰腺导管腺癌预后明显相关,其在生存时间长的患者肿瘤组织内明显高表达[18]。但目前尚缺乏研究证明其与LUSC发生、发展相关。而本研究发现BBC3基因的表达确实与LUSC患者的临床生存时间呈明显负相关。笔者认为其分子机制可能是,BBC3在LUSC组织中高表达,可促进肿瘤细胞的凋亡,有效降低术后LUSC肿瘤的复发能力。因此,笔者认为BBC3的表达高低可以作为LUSC预后的分子标志物,并可与其他预后相关的临床资料相联合对LUSC的预后进行判断。
但是,受限于目前临床样本量,BBC3在临床预后上的诊断价值还需要更大样本及更长随访时间的研究。同时,笔者认为疾病分子标志物的真正确立,不仅需要在统计学上证明其疾病分类的准确性和稳定性,还需要通过进一步的试验探究其在疾病发生过程中的具体机制,从生物学上证明其切实有效,且可作为疾病的分子标志物用于临床检验。因此,针对BBC3基因在LUSC组织中的具体分子机制研究,尤其是参与的上下游基因调控通路,将是本课题组下一步的重点工作。
[1]Tan X,Qin W,Zhang L,et al.A 5-microRNA signature for lung squamous cell carcinoma diagnosis and hsa-miR-31 for prognosis[J].Clin Cancer Res,2011,17(21):6802-6811.
[2]Tanoue LT,Detterbeck FC.New TNM classification for non-small-cell lung cancer[J].Expert Rev Anticancer Ther,2009,9(4):413-423.
[3]Boyle P,Ferlay J.Cancer incidence and mortality in Europe,2004[J].Ann Oncol,2005,16(3):481-488.
[4]Gao W,Shen H,Liu L,et al.MiR-21 overexpression in human primary squamous cell lung carcinoma is associated with poor patient prognosis[J].J Cancer Res Clin Oncol,2011,137(4):557-566.
[5]Mcdoniels-Silvers AL,Nimri CF,Stoner GD,et al.Differential gene expression in human lung adenocarcinomas and squamous cell carcinomas[J].Clin Cancer Res,2002,8(4):1127-1138.
[6]Hu Z,Wang J,Yao T,et al.Identification of novel mutations of TP53,ALK and RET gene in metastatic thymic squamous cell carcinoma and its therapeutic implication[J].Lung Cancer,2013,81(1):27-31.
[7]Carvalho RH,Hou J,Haberle V,et al.Genomewide DNA methylation analysis identifies novel methylated genes in Non-Small-Cell lung carcinomas[J].J Thorac Oncol,2013,8(5):562-573.
[8]Carvalho RH,Haberle V,Hou J,et al.Genome-wide DNA methylation profiling of non-small cell lung carcinomas[J].Epigenetics Chromatin,2012,5(1):9.
[9]Meert AP,Martin B,Delmotte P,et al.The role of EGF-R expression on patient survival in lung cancer:a systematic review with meta-analysis[J].Eur Respir J,2002,20(4):975-981.
[10]Lord RV,Brabender J,Gandara D,et al.Low ERCC1 expression correlates with prolonged survival after cisplatin plus gemcitabine chemotherapy in non-small cell lung cancer[J].Clin Cancer Res,2002,8(7):2286-2291.
[11]Johnson ML,Sima CS,Chaft J,et al.Association of KRAS and EGFR mutations with survival in patients with advanced lung adenocarcinomas[J].Cancer,2013,119(2):356-362.
[12]Simon GR,Schell MJ,Begum M,et al.Preliminary indication of survival benefit from ERCC1 and RRM1-tailored chemotherapy in patients with advanced nonsmall cell lung cancer:evidence from an individual patient analysis[J].Cancer,2012,118(9):2525-2531.
[13]Brattström D,Wester K,Bergqvist M,et al.HER-2,EGFR,COX-2 expression status correlated to microvessel density and survival in resected non-smallb celllung cancer[J].Acta Oncol,2004,43(1):80-86.
[14]Onn A,Correa AM,Gilcrease M,et al.Synchronous overexpression of epidermal growth factor receptor and HER2-neu protein is a predictor of poor outcome in patients with stage Ⅰ non-small cell lung cancer[J].Clin Cancer Res,2004,10(1 pt 1):136-143.
[15]Li C,Ran M,Hu YL,et al.Identifying molecular biomarker for the lung squamous cell carcinoma by integrating multifactorial data[J].Curr Bioinform,2015,10(1):106-111.
[16]Follis AV,Chipuk JE,Fisher JC,et al.PUMA binding induces partial unfolding within BCL-xL to disrupt p53 binding and promote apoptosis[J].Nat Chem Biol,2013,9(3):163-168.
[17]Thorburn J,Andrysik Z,Staskiewicz LA,et al.Autophagy controls the kinetics and extent of mitochondrial apoptosis by regulating PUMA levels[J].Cell Rep,2014,7(1):45-52.
[18]Du QH,Zhang KJ,Jiao XL,et al.Prognostic significance of PUMA in pancreatic ductal adenocarcinoma[J].J Int Med Res,2012,40(6):2066-2072.
Study on the relationship between BBC3 expression and prognosis of patients with squamous cell lung neoplasms and its mechanism*
LiChao1,ShenXueyuan1,HuYulin2,3△
(1.DepartmentofCardiothoracicSurgery,YongchuanHospital,ChongqingMedicalUniversity,Chongqing402160,China;2.DepartmentofNephropathyandRheumatism,YongchuanHospital,ChongqingMedicalUniversity,Chongqing402160,China;3.DepartmentofInternalMedicine,RongchangDistrictPeople′sHospital,Chongqing402160,China)
Objective To explore the correlation between BCL2 binding component 3 (BBC3) expression and postoperative survival time of lung squamous cell carcinoma (LUSC),and investigate its molecular mechanism.Methods The expression of BBC3 in 39 patients was detected by using qRT-PCR assay.Meanwhile,clinical data of all patients were collected by follow-up visit.Then,the survival analysis was performed by using Kaplan-Meier and log rank tests.Moreover,multiple factors analysis was performed using COX proportional hazard model.At last,BBC3 was over-expressed in NCI-H226 cell lines,then detected the effects of BBC3 expression on cell proliferation and apoptosis by using MTT assay and flow cytometry.Results BBC3 expression were significantly correlated with the tumor metastasis (r=0.556,P=0.023),tumor size (r=0.532,P=0.042),T staging (r=0.551,P=0.021) and TNM staging (r=0.524,P=0.047).Meanwhile,the results of Kaplan-Meier and log rank tests found that BBC3 expression was significantly correlated with survival time of patients with LUSC,and the length of survival time in patients with high BBC3 expression was longer than that in patients with low BBC3 expression (χ2=7.542,P=0.006).The COX proportional hazard model indicated that tumor metastasis,T staging,TNM staging and BBC3 expression were independent factors which significantly affected survival time.Moreover,the proportion of apoptotic cells in the recombinant plasmid BBCs group was higher than that in the empty plasmid group and control group (P<0.05).Conclusion BBC3 expression could suppress the proliferation of tumor cells and promote apoptosis,and are significantly correlated with survival time of patients,so which may be assistant biomarkers for prognosis of LUSC.
BBC3;lung;neoplasms,squamous cell;prognosis;cell proliferation;apoptosis;biological markers
��·临床研究
10.3969/j.issn.1671-8348.2017.19.012
重庆市科委一般项目(cstc2016jcyjA0343);重庆市卫生局科研面上项目(2015MSXM058);重庆市永川区自然科学基金(Ycstc,2015nc5004);重庆医科大学附属永川医院院内课题(YJZQN201529,YJSCI201504 )。 作者简介:李超(1980-),主治医师,硕士,主要从事胸部肿瘤的基础与临床研究。△
E-mail:lcr808@126.com。
R734.2
A
1671-8348(2017)19-2631-04
2017-03-01
2017-05-05)
