基于大鼠血清差异蛋白质组学小白杏杏仁油免疫调节作用研究
2017-08-07田洪磊颜海燕谈思维毛晓英
田洪磊 詹 萍 颜海燕 谈思维,2 毛晓英
(石河子大学食品学院1,石河子 832000) (杭州职业病防治院2,杭州 310006)
基于大鼠血清差异蛋白质组学小白杏杏仁油免疫调节作用研究
田洪磊1詹 萍1颜海燕1谈思维1,2毛晓英1
(石河子大学食品学院1,石河子 832000) (杭州职业病防治院2,杭州 310006)
采用iTRAQ标记及高效液相色谱-电喷雾串联质谱(LC-ESI-MS/MS)技术对小白杏杏仁油干预试验大鼠血清差异表达蛋白进行定量鉴定,并通过表达模式及代谢通路聚类对鉴定获得的差异蛋白进行生化代谢途径和信号转导途径分析。结果表明,小白杏杏仁油可能通过调节血清中结合珠蛋白(HP)、角蛋白(KRT10、KRT42)、微管蛋白α-8链(TUBA8)、免疫球蛋白重(k)链VⅢ区(VH26、MOPC63)、α-1-抗蛋白酶(SERPINA1)及T-激肽原(KNG1)等蛋白的表达水平,作用于金黄色葡萄球菌感染、吞噬体、致病性大肠杆菌感染、原发性免疫缺陷、补体和凝血级联5条先天性免疫通路而展现其免疫调节作用。
小白杏杏仁油 蛋白质组学 免疫调节 代谢通路
现代分析技术与蛋白质组学相结合的方法可为天然产物生物学功能评价提供有力借鉴,其中串联质谱或多维液相色谱联用技术与同位素标记相对和绝对定量(iTRAQ)技术融合手段已成为蛋白质定性和定量研究的主要工具,该技术可对血清、细胞裂解液等绝大多数复杂样本进行相对和绝对定量研究[1]。与双向电泳(2-DE)、差异凝胶电泳(DIGE)及同位素亲和标签(ICAT)等传统蛋白质组学中常用的蛋白分离鉴定技术相比,虽然相关方法结合质谱联用亦可实现微量蛋白的分析鉴定,然而在精确定量差异蛋白方面存在缺陷[2],iTRAQ技术对8种以内的不同蛋白质样品中个体蛋白氨基及侧链氨基酸进行分别标记,可实现差异蛋白(P<0.05)的准确分析。血清作为机体疾病表征或功能物质干预作用的标志物直接载体,依托实验动物或志愿人群血清样本资源,通过血清蛋白质组学进行疾病发生机制及中药或功能食品生物学功能研究引起了国内外相关研究领域的关注[3-4],将现代蛋白质组学分析技术与生物信息统计方法相结合可实现天然产物生物学功能的深入解析。
本研究建立免疫力低下大鼠模型,通过空白对照组(BS)、模型组(MC)、模型小白杏杏仁油样品组(SF)实施免疫调节作用研究的基础上,采用iTRAQ标记及高效液相色谱-电喷雾串联质谱(LC-ESI-MS/MS)技术对差异表达蛋白进行定量鉴定,并通过表达模式聚类(EPC)及代谢通路(Pathway)等分析对鉴定获得的差异蛋白进行功能诠释,确定其参与的最主要生化代谢途径和信号转导途径,通过共性差异蛋白作用通路及机制解析再次验证小白杏杏仁油的抗氧化与免疫调节效果,并推测其他生物学功能。
1 材料与方法
1.1 材料与设备
小白杏杏仁油:石河子大学农产品加工与贮藏重点实验室自制;四乙基溴化铵(TEAB) :美国应用生物系统公司(ABI);胰蛋白酶(250 U/mg) :Promega公司;低分子量标准蛋白(97、66、43、31、20、14 KDa):美国Sigma公司;其他试剂(均为分析纯):国药集团化学试剂有限公司。
5430R冷冻离心机:德国Eppendorf公司;VCX130超声波细胞破碎仪:美国Sonics公司;iMark酶标仪:美国Bio-Rad公司;LC-2AD纳升流速高效液相色谱在线检测仪、LC-20AB高效液相色谱脱机检测仪:日本岛津公司;Triple TOF 5600质谱仪:美国AB SCIEX公司。
1.2 试验方法
1.2.1 操作流程
操作流程图见1。
图1 试验操作流程
1.2.2 免疫动物模型建立与血清采集
实验大鼠由新疆医科大学第一附属医院动物实验中心提供(动物生产许可证号:SCXY(新)2011-0004),动物饲养在新疆医科大学第一附属医院动物实验中心动物饲养房(许可证号:SYXK(新)2010-0003) 内进行。采用环磷酰胺诱导的方法建立免疫力低下大鼠模型,具体方法参见文献[5]。将实验大鼠随机分成3组(正常大鼠空白对照组BS、大鼠模型对照组MC及大鼠模型样品喂养组SF),其中样品喂养组每日按5 mL/100g灌胃,其他2组按相同体积生理盐水灌胃对照,喂养28 d后采集检测样本。采用心脏取血—抗凝储存的方法制备各组血浆样品,在0 ℃条件下离心分离(3 000 r/min) 10 min,获得待检血清。
1.2.3 大鼠血清样本的制备
称取适量各组血清样品,加入500 μL蛋白裂解液对蛋白进行溶解,然后分别添加浓度为1 mmol/L的PMSF溶液及2 mmol/L的EDTA溶液,旋涡反应5 min后添加浓度为10 mmol/L的DTT溶液,超声处理15 min混匀后,经过25 000×g离心分离20 min后取上清液;在56 ℃条件下将制备上清液中加入终浓度为10 mmol/L的DTT溶液处理1 h,还原打开二硫键,而后加入终浓度为55 mmol/L的IAM溶液,暗室静置45 min进行半胱氨酸的烷基化封闭,进而加入适量冷丙酮在-20 ℃条件下静置2 h,随后经过25 000×g离心分离20min丢弃上清液,将沉淀物在200 μL的TEAB(0.5 mol/L)中超声溶解15 min,离心(25 000×g)分离20 min后取上清液,用于后期定量分析。采用ProteoMiner蛋白富集试剂盒法去除高丰度蛋白,蛋白质浓度测量方法参见文献[6]。
1.2.4 大鼠血清样本的酶解
配制12%的十二烷基硫酸钠聚丙烯酰胺凝胶,各血清蛋白样品分别与2×上样缓冲液混合,95 ℃条件下加热5 min。设置每个样品上样量为30 μg,Marker上样量为10 μg,120 V稳压电泳120 min,电泳结束后通过考马斯亮蓝染液染色2 h,并经脱色液脱色3~5次,每次脱色时间为30 min;各样品精确取出100 μg蛋白,设置适宜的酶解体系(蛋白:酶=2∶1),在37 ℃条件下加入胰蛋白酶酶解4 h,后期再次按照预设比例补加胰蛋白酶1次,37 ℃条件下继续酶解8 h。
1.2.5 iTRAQ标记及SCX分离
将胰蛋白酶消化后的体系分别用真空离心泵抽干肽段,并用0.5 mol/L的TEAB对制备肽段进行复溶。按照实验手册和相关报道进行不同肽段样本的iTRAQ标记[7-8],模型组(MC)、模型小白杏杏仁油样品组(SF) 及空白对照组(BS)酶解肽段分别采用115、117及119 iTRAQ标签进行标记,室温培养2 h后将标记后的各肽段样品进行等量混合。
采用LC-20AB液相系统对样品进行分离。分离柱选用SCX分离柱(Ultremex SCX,4.6×250 mm);洗脱条件如下:首先用4 mL buffer A (25%乙腈中NaH2PO4浓度为25 mmol/L,pH=2.7)将标记后抽干的混合肽段进行复溶,以1 mL/min的速率进行入柱梯度洗脱,再次采用buffer A洗脱10 min,然后循序混入5%~35%的buffer B (25%乙腈中NaH2PO4浓度为25 mmol/L,KCl浓度为1 mol/L,pH=2.7) 进而洗脱11 min,最终循序混入35%~80%的buffer B洗脱1 min,在214 nm吸光度条件下对整个洗脱过程进行监测,经过筛选可获得12个组分,各组分分别用StrataX除盐柱进行除盐处理,冷冻抽干备用。
1.2.6 基于高分辨率阱质谱仪 (LTQ Orbitrap HCD) 的LC-ESI-MS/MS分析
采用buffer A (2% 乙腈,0.1% 蚁酸) 将抽干备用的各组分分别复溶至0.5 μg/μL,20 000×g离心10 min去除不溶物质,通过LC-20AD纳升液相色谱仪进行分析。
分析条件:C18反相柱 (进样部分:200 μm内径×2 cm长度,洗提分离部分:75 μm内径×10 cm长度)对各上样 (10 μL,约5 μg) 组分实施反相分离。分离程序依次为:15 μL/min流速进样4 min,采用洗涤梯度为2%~35% 的buffer B (98%乙腈,0.1%蚁酸) 以400 nL/min流速梯度洗涤44 min,相同设置洗涤梯度为35%~80% 进行线性洗提2 min,最终依次采用80% 的buffer B与buffer A分别洗柱4、1 min。
液相分离的肽段样本进入高分辨率阱质谱仪进行检测,结合高能量碰撞裂解模式对肽段进行筛选。离子源电压设置为1.5 kV进行离子阱信号检测,对离子阱内控制聚集量约为1×104个离子进行扫描(质荷比范围为350~2 000 u) 鉴定。
1.2.7 数据库选择与检索
基于蛋白质质谱属性选择合适数据库,若检测样本来源于已测序生物,即直接选择该物种数据库;若为非测序生物样本,则选择与待测样本最为相近的物种蛋白质组数据库,试验大鼠血清来源于已测序大鼠物种,选择IPI.RAT.v3.87 (39 925 sequences)作为本研究数据库,并结合蛋白质鉴定标准软件Mascot2.3.02进行数据库检索。
2 结果与分析
2.1 血清样本蛋白质电泳胶图
正常大鼠空白对照组、大鼠模型对照组及大鼠模型样品喂养组血清样本蛋白质电泳胶图见图2。
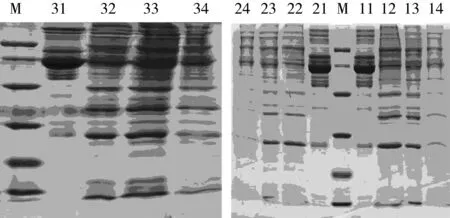
注:聚丙烯酰胺浓度12%;Marker(M):97、66、43、31、20和14 KDa,装载量12 μg;每个样品上样量30 μg;11~14分别为去除高丰度蛋白前的MC试验组、及其去除高丰度蛋白后的E1、E2、E3储备样;21~24分别为去除高丰度蛋白前的SF试验组、及其去除高丰度蛋白后的E1、E2、E3储备样;31~34分别为去除高丰度蛋白前的BS试验组、及其去除高丰度蛋白后的E1、E2、E3储备样。图2 血清样本蛋白质电泳胶图
2.2 肽段匹配误差评估
通过提高肽段母离子质量检测的精确度能大幅度减少假阳性鉴定结果出现的概率,虽然通过LTQ-Orbitrap-Velos质谱仪所获得的一级、二级质谱的质量精确度均小于3×10-6,但是为了防止鉴定结果遗漏等问题的出现,将数据库检索策略的肽段误差控制在±10×10-6以内,通过图3显示的所有匹配肽段的相对分子量真实值与理论值之间的误差分布情况分析,谱图匹配质量误差符合研究要求。
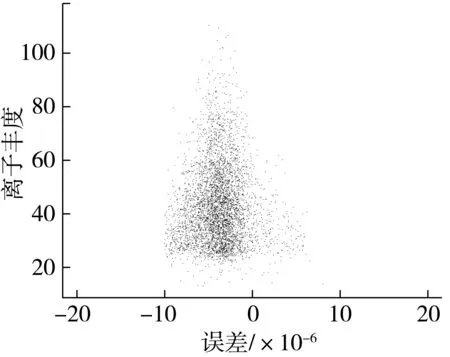
注:纵坐标表示肽段匹配偏差在一定范围内的mascot 离子丰度(数量);横坐标表示匹配到的肽段的检测值和理论值之间的误差。图3 谱图匹配质量误差分布情况
2.3 对照组血清差异表达蛋白鉴定
在对各组血清样本的低丰度蛋白进行同位素标记、强阳离子交换色谱柱及反相色谱柱分离的基础上,通过LC-ESI-MS/MS分析共检测到1 651个肽段,根据不同iTRAQ标签组分的相对丰度实施对照组各肽段的相对定量,其定量结果采用其中一组相对于另一组的比值表示。在此基础上,利用所得肽段进行蛋白质数据库检索与分析,获得系列蛋白质丰度比不同的差异蛋白,对于丰度比接近于1的同一蛋白可视为此种蛋白在两两对比的两组间没有显著变化,当蛋白质的丰度比(即差异倍数)达到1.2倍以上时,且经统计检验P<0.05,该蛋白可视为不同样品对照组的差异蛋白质,依照此方案分析共得到251个差异蛋白质。通过免疫力低下模型组(MC)、模型小白杏杏仁油样品组(SF)及空白对照喂养组(BS)3组试验组中血清差异蛋白的两两比对,并对以上不同对照组所得的差异蛋白进行初步统计分析,发现相关生物功能蛋白均产生了较为明显的差异,复杂血清蛋白体系多样性改变的同时,存在共性变化的差异蛋白,其中3组对比组(MC/SF、MC/BS及SF/BS)中均有差异的共有14个差异蛋白(表1、图4),共同差异蛋白的筛选与统计为后期Pathway及表达模式聚类分析等提供了先决条件,亦可为小白杏杏仁油免疫功能明晰提供充实的数据库。
共性差异蛋白比较值对照分析看出,在对试验大鼠进行免疫力低下模型处理后,相对于基础喂养空白对照组,相关功能蛋白表达出现下调趋势,或由于机体应激状态的产生,导致结合珠蛋白(HP)、角蛋白(KRT)及免疫球蛋白重链V-Ⅲ区(VH26)等免疫力低下诱导急性期时相反应蛋白的明显上调;在小白杏杏仁油对照干预作用条件下,相关共性差异蛋白指标均出现不同程度的调整。
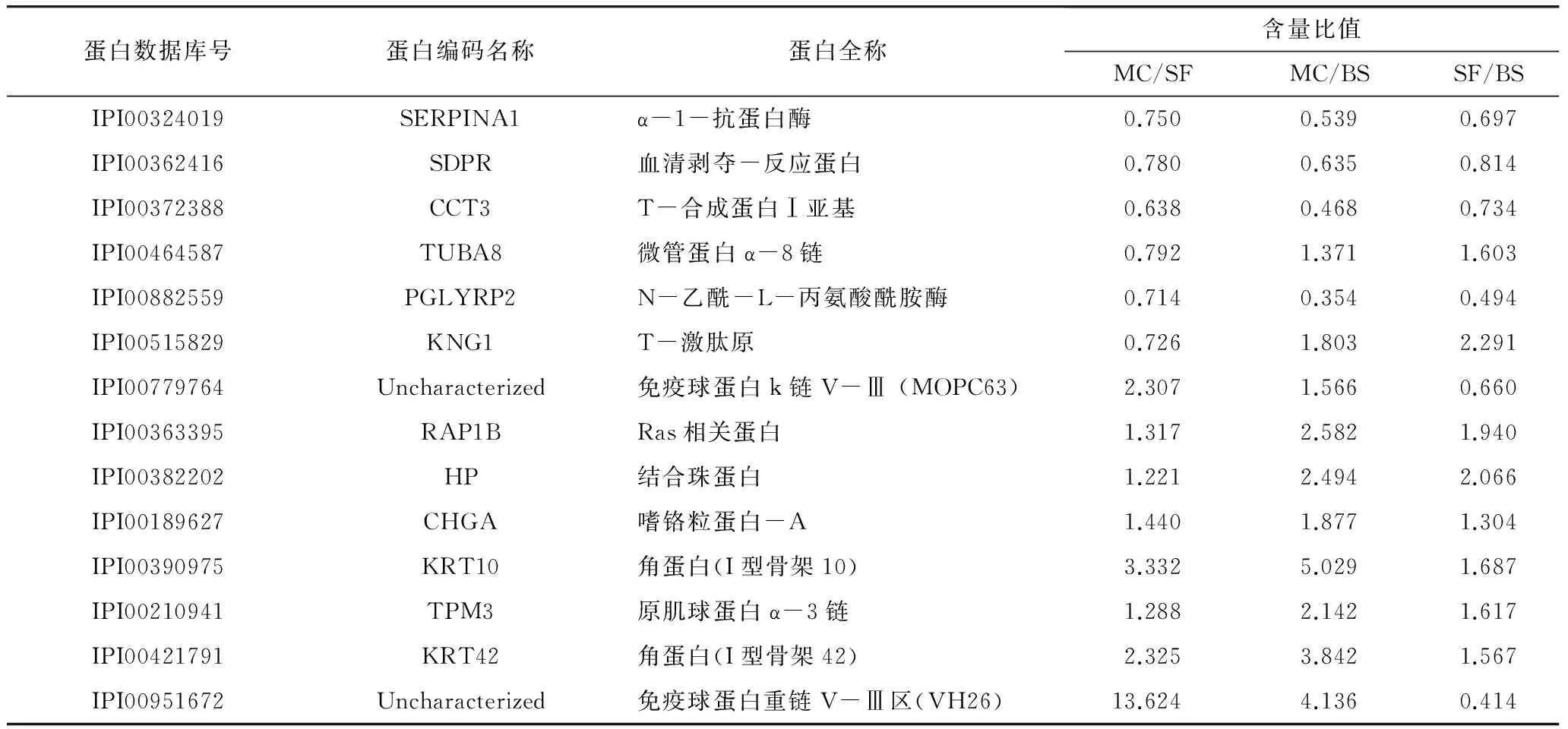
表1 各对照组中共性差异蛋白种类及其比值
注:BS为正常大鼠空白对照组,MC为大鼠模型对照组,SF为大鼠模型样品喂养组。
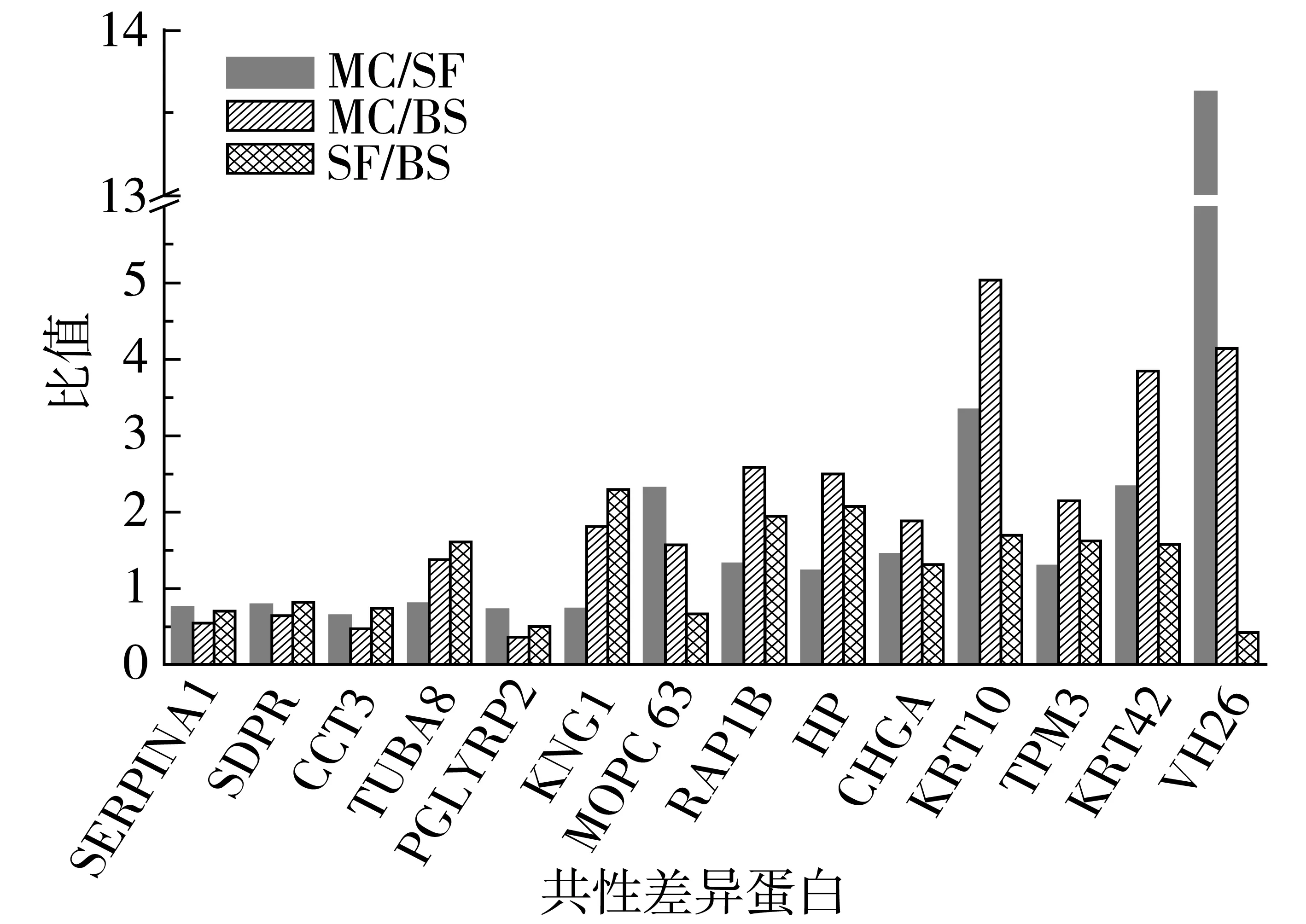
注:共性差异表达蛋白采用国际通用的蛋白编码名称表示。图4 各比较组共性差异表达蛋白
2.4 对照组血清差异表达蛋白Pathway富集分析
为了深入解析小白杏杏仁油对实验大鼠的生物学功能,本研究采用KEGG Pathway数据库对所获得的14种共性差异蛋白进行参与生化代谢途径及信号转导途径分析,预期通过Pathway富集,明晰其主导作用机制或协同作用效果。
通过KEGG Pathway数据库进行共性差异蛋白pathway检索,获得了V-Ⅲ区(VH26)、角蛋白(KRT10、KRT42)、结合珠蛋白(HP)、Ras相关蛋白(RAP1B)、原肌球蛋白α-3链(TPM3)、α-1-抗蛋白酶(SERPINA1)、微管蛋白α-8链(TUBA8)及T-激肽原(KNG1)、免疫球蛋白k链V-Ⅲ区(MOPC63)10种蛋白的相关作用通路,通路分析表明小白杏杏仁油对金黄色葡萄球菌感染通路、吞噬体通路、致病性大肠杆菌感染通路、原发性免疫缺陷通路、补体和凝血级联5条先天性免疫通路作用最为频繁(各通路包含共性差异蛋白数N>3),其他4种共性差异蛋白尚未有确定的作用通路。
结合比较组共性差异表达蛋白比较值分析,可能由于模型处理所造成的机体应激状态,以及后期相关炎症反应、易感染等现象的发生发展,免疫球蛋白重链V-III区(VH26)、I型角蛋白(KRT I)、结合珠蛋白(HP)、Ras相关蛋白(RAP1B)、原肌球蛋白α-3链(TPM3)等相关急性期时相反应蛋白在MC试验组血液中的表达明显增高,通过小白杏杏仁油平行干预作用后,相关急性期时相反应蛋白表达或免疫炎症诱导重链突变区重排现象在SF试验组中显著下降,可以说明小白杏杏仁油对相关微生物感染及原发性免疫缺陷等通路具有一定的抑制与调控作用,但是与BS对照组相比,大部分相关差异蛋白表达水平仍略显偏高。本次研究所涉及血清RAP1B蛋白在MC组中表达相对较高,但通过其在SF组中下调的表现可以预测小白杏杏仁油对机体应激状态逆转的辅助作用;同样,平行对照组中原肌球蛋白α-3链(TPM3)的差异性表达亦引起了广大学者的普遍关注,研究发现粥样动脉硬化[9]、毒性视网膜损伤[10]等病理现象都伴随着TPM3表达水平的提升,通过目前相关研究成果推断,在被动免疫力低下大鼠模型(MC)构建后是否由于类似继发性疾病的产生,而导致MC组血清TPM3的特异性表达,继而可能基于小白杏杏仁油的干预作用趋于下调[11-12]。同时还发现可能由于小白杏杏仁油的干预而激发了α-1-抗蛋白酶(SERPINA1)、微管蛋白α-8链(TUBA8)及T-激肽原(KNG1)等差异蛋白的表达,从而辅助调控了与其相关的补体和凝血级联等富集通路。共性差异蛋白的获得与表达途径解析为功能脂质体生物学功能构效关系深入研究奠定基础。
3 结论
小白杏杏仁油免疫调控作用与血清蛋白表达中金黄色葡萄球菌感染、吞噬体、致病性大肠杆菌感染、原发性免疫缺陷、补体和凝血级联5条先天性免疫通路具有紧密相关性。
小白杏杏仁油可能通过调控血清免疫球蛋白重(k)链V-III区(VH26 、MOPC63)、结合珠蛋白(HP)、角蛋白(KRT10、KRT42)、微管蛋白α-8链(TUBA8)、α-1-抗蛋白酶(SERPINA1)及T-激肽原(KNG1)等共性差异蛋白,而展现其免疫调控作用。
[1]谢秀枝, 王欣, 刘丽华, 等. iTRAQ 技术及其在蛋白质组学中的应用[J]. 中国生物化学与分子生物学报, 2011, 27(7): 616-621 Xie Xiuzhi, Wang Xin, Liu Lihua, et al. ITRAQ technology and its application in proteomics[J]. Chinese Journal of Biochemistry and Molecular Biology, 2011, 27(7): 616-621
[2]Manavalan A, Adav S S, Sze S K. iTRAQ-based quantitative secretome analysis of phanerochaete chrysosporium[J]. Journal of Proteomics, 2011, 75(2): 642-654
[3]Huang Z L, Wang H L, Huang H L, et al.iTRAQ-based proteomic profiling of human serum reveals down-regulation of platelet basic protein and apolipoprotein B100 in patients with hematotoxicity induced by chronic occupational benzene exposure[J]. Toxicology, 2012, 291(1-3): 56-64
[4]Huang Y P, Zhang X Y, Jiang W, et al. Discovery of serum biomarkers implicated in the onset and progression of serous ovarian cancer in a rat model using iTRAQ technique[J]. European Journal of Obstetrics & Gynecology and Reproductive Biology, 2012, 165(1): 96-103
[5]田洪磊, 张灏, 田丰伟. 小白杏杏仁油免疫调节及对S180肉瘤抑制作用研究[J]. 中国粮油学报, 2013, 28(2):55-59 Tian Honglei, Zhang Hao, Tian Fengwei. Study on the immunoregulatory activities and the inhibition effect on S180sarcom of Xiao-bai apricot almond oil[J]. Journal of the Chinese Cereals and Oils Association, 2013, 28(2): 55-59
[6]Carlsson N, Borde A, Wölfel S, et al.Quantification of protein concentration by the Bradford method in the presence of pharmaceutical polymers[J]. Analytical Biochemistry, 2011, 411(1): 116-121
[7]Link A J, Labaer J(编). 曾明, 等(译). 冷泉港蛋白质组学实验手册[M]. 北京: 化学工业出版社, 2012: 56-170 Link A J, Labaer J (editors). Zeng Ming, et al (translators). Proteomics a cold spring harbor laboratory course manual[M]. Beijing: Chemical Industry Press, 2012: 56-170
[8]Qiao J J, Wang J X, Chen L, et al. Quantitative iTRAQ LC-MS/MS proteomics reveals metabolic responses to biofuel ethanol in cyanobacterial synechocystis sp.PCC6803 [J]. Journal of Proteome Research, 2012, 11(11): 5286-5300
[9]Mochizuki H, Nakamura K, Sato H, et al. Multiplex PCR and genescan analysis to detect immunoglobulin heavy chain gene rearrangement in feline B-cell neoplasms[J].Veterinary Immunology and Immunopathology, 2011, 143(1-2): 38-45[10]Kang J H, Ryu H S, Kim H T, et al. Proteomic analysis of human macrophages exposed to hypochlorite-oxidized low-density lipoprotein[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2009, 1794(3): 446-458[11]Chen J M, Zhu G Y, Xia W T, et al. Proteomic analysis of rat retina after methanol intoxication[J]. Toxicology, 2012, 293(1-3): 89-96
[12]Kelly E, Greene C M, Carroll T P, et al.Alpha-1 antitrypsin deficiency[J]. Respiratory Medicine CME, 2011, 4(1):1-8.
Immune Regulatory Activities of Small White Apricot Almond
Oil by Differentially Expressed Proteomics-Based Approach
Tian Honglei1Zhan Ping1Yan Haiyan1Tan Siwei1,2Mao Xiaoying1
(College of Food Science, Shihezi University1, Shihezi 832000)
(Hangzhou Hospital for the Prevention and Treatment of Occupational Diseases2, Hangzhou 310006)
Differentially expressed proteins of serum were quantitatively identified through iTRAQ labeling and high performance liquid chromatography-electrospray ionization tandem mass spectrometry (LC-ESI-MS/MS). The biochemical metabolic and signal transduction pathways of the differentially expressed proteins identified were conducted with expression pattern and metabolic pathway analysis. The results showed that small white apricot almond oil could demonstrate the immune regulatory activities with 5 innate immune pathways, including interactions with staphylococcus aureus infection, phagosome, pathogenic E. coli infection, primary immunodeficiency, complement and blood coagulation. The proteins expression levels, such as haptoglobin protein (HP), keratin (KRT10, KRT42), tubulin α-8 chain (TUBA8), V-III section of immunoglobulin heavy(k) chain (VH26,MOPC63), α-1-antiprotease (SERPINA1) and T-prokinin (KNG1), were closely related those innate immune pathways.
small white apricot almond oil (WAAO), proteomics, immunomodulatory, pathway
国家自然科学基金(31000766、31260374)
2015-07-05
田洪磊,男,1979年出生,副教授,食品科学
詹萍,女,1981年出生,副教授,食品风味化学、食品营养学 颜海燕,女,1974年出生,高级实验师,食品营养学
R151.1
A
1003-0174(2017)02-0062-06
