高粱不同溶剂提取物的抗氧化活性及抗细胞氧化应激作用
2017-08-07申迎宾程李琳齐雅静钱海峰齐希光
申迎宾 张 晖 程李琳 齐雅静 王 立 钱海峰 齐希光
(江南大学食品科学与技术国家重点实验室;江南大学食品学院,无锡 214122)
高粱不同溶剂提取物的抗氧化活性及抗细胞氧化应激作用
申迎宾 张 晖 程李琳 齐雅静 王 立 钱海峰 齐希光
(江南大学食品科学与技术国家重点实验室;江南大学食品学院,无锡 214122)
以红高粱为原料,采用测定清除DPPH·和ABTS+·能力、总抗氧化能力3种方法比较了不同提取溶剂提取物的抗氧化活性,测定了总酚含量,并分析了总酚含量与抗氧化方法的相关性。并研究了高粱多酚对细胞氧化应激的影响。结果表明,60%乙醇提取物中总酚含量最高,达到315.45 mg GAE/100 g DW。DPPH·清除能力达到89.88%,ABTS+·清除能力达到89.9%,总抗氧化能力为15.93 mmol TEAC/100 g DW,其中ABTS+·与总酚的相关系数最高,为0.80 (P=0.193>0.05),但是不显著。高粱多酚质量浓度为2 mg/mL时,对H2O2诱导小鼠肝细胞产生MDA抑制率最高,为72.96%。在质量浓度为300 μg/mL时,使得PC12细胞的存活率达到94.11%。由此可见,红高粱具有很强的体外抗氧化能力,并对细胞的氧化应激具有保护作用。
抗氧化活性 红高粱 DPPH· ABTS+· PC12 MTT
大量的流行病学研究表明,长期食用全谷物食品可以降低患心血管疾病[1]、2型糖尿病[2-3]、某些癌症[4](结肠癌)等慢性疾病[5]的风险。这可能是因为谷物多酚通过抗氧化活性改善机体的氧化还原平衡状态[6],并进一步影响慢性病的进程。但是,随着人们生活水平的提高,所食米面越来越精,越来越讲究口感,这导致谷物加工时大部分的多酚组分被去除,影响了人们的健康。多酚是谷物中十分重要的一类倍受关注的抗氧化活性成分,多存在于谷物的麸皮中,近年的全谷物概念提出并受到重视后,人们开始关注整粒谷物的营养和功能,多酚是其发挥抗氧化功能的主要物质基础。
高粱是世界第五大粮食作物[7],在我国东北、华北地区分布广泛,栽培面积和产量均居世界前列,高粱的外种皮中含有大量的多酚类化合物[8],包括酚酸、黄酮类化合物和原花青素等,这些多酚化合物具有很强的抗氧化活性。国外已经有研究对高粱中的多酚成分及其抗氧化活性进行报道[9-11],但是主要集中在不同高粱品种间的比较,而不同溶剂对高粱多酚及其抗氧化活性的影响研究较少,张海晖等[12]虽然研究了70%乙醇、70%甲醇和70%的丙酮对高粱、甜高粱的多酚含量及抗氧化活性影响,认为70%乙醇更有利于多酚化合物的提取,但是没有比较其他溶剂(纯水和含中浓度水平的有机溶剂)对高粱多酚及抗氧化活性的影响,也没有从细胞水平上分析高粱多酚的抗氧化应激作用。从细胞水平上来评价抗氧化活性是目前较为前沿的抗氧化活性评价方法,它可以反映抗氧化剂的吸收、代谢、分布的变化情况。与化学模型的分析法相比,更能准确反映生理特性;与动物实验法相比,周期更短、测定程序更简单。所以采用细胞水平上评价抗氧化活性的方法既可以反映抗氧化剂的生物活性,又可以节约成本,也减少了对动物的伤害。因此本试验以高粱整籽粒为研究对象,采用测定清除DPPH·和ABTS+·、总抗氧化能力3种体外化学抗氧化体系,考察不同的提取溶剂提取物(水、60%乙醇、60%甲醇、60%丙酮)的抗氧化活性。同时研究60%乙醇提取物对H2O2诱导小鼠肝细胞产生MDA抑制作用,分析60%乙醇提取物对H2O2诱导的PC12细胞氧化应激的保护作用。从体外化学模型和细胞的角度分析了高粱的抗氧化活性,为开发高粱中的多酚成分提供参考。
1 材料与方法
1.1 材料与仪器
红高粱:市售,产地:东北,粉碎过60目筛备用。
福林试剂:上海荔达生物科技有限公司; DPPH、ABTS、Trolox:Sigma 公司; DEME培养基:美国Gibco公司;MDA检测试剂盒、蛋白质测定试剂盒:南京建成生物技术研究所;MTT检测试剂盒:碧云天生物技术有限公司。PC12细胞:江南大学细胞实验室;FRAP试剂: 0.1 mol/L醋酸缓冲液(pH 3.6):10 mmol/L TPTZ (溶于40 mmol/L盐酸): 20 mmol/L三氯化铁=10∶1∶1。
摇摆式DFY-500高速中药粉碎机:浙江温岭市林大机械有限公司;酶标仪SH-1000Lab:江南大学国家食品企业质量安全检测技术示范中心;722N型可见分光光度计:上海精密科学仪器有限公司;L550离心机:湖南湘仪实验室仪器开发有限公司。
1.2 试验方法
样品处理:准确称量1 g红高粱粉末,10 mL相应各提取溶剂(水、60%乙醇、60%甲醇、60%丙酮),超声波辅助提取30 min,60 ℃下提取3 h,连续2次,定容25 mL容量瓶,质量浓度为40 mg全谷物/mL,4 ℃保存,待测。
样品制备:取10 g红高粱粉末,100 mL 60%乙醇溶液,超声波辅助提取30 min,60 ℃下提取3 h,连续2次,合并提取液,旋蒸至无醇味,冷冻干燥,-20 ℃保存,待测。
1.2.1 总酚的测定
总酚含量的测定采用福林酚法[13],检测波长为765 nm,取0.5 mL不同溶剂的高粱提取物,加入0.5 mL福林酚试剂和2 mL 15%的碳酸钠溶液,充分混合,定容10 mL摇匀,室温下反应 60 min,以不加碳酸钠溶液的反应液为空白,在特征吸收波长处, 测吸光度值,记录数据,根据没食子酸标准曲线,计算样品总酚的相对含量。以mg GAE/100 g DW计算。
1.2.2 DPPH自由基的测定
[14-15]并做一定修改,准确称取7.88 mg DPPH·,用无水乙醇溶解,定容于100 mL 容量瓶中,摇匀,配制浓度为2 ×10-4mol/L 的溶液,保存于冰箱中,备用。向4 mL 2×10-4mol/L DPPH自由基溶液中加入0.5 mL高粱多酚提取液样品,摇匀于室温下放置30 min,于517 nm下测定其吸光值AS;同时测定4 mL 2×10-4mo1/L DPPH自由基溶于0.5 mL 60%乙醇混合液的吸光值AC,根据以下公式计算样品对DPPH自由基的抑制率。
式中:AS为加样品液时DPPH自由基溶液的吸光值;AC为未加品液时DPPH自由基溶液的吸光值。
1.2.3 ABTS阳离子自由基的测定
根据参考文献[16]并做相应修改,取4.9 mL ABTS阳离子自由基溶液与0.1 mL样品混合,反应10 min,测定吸光度,空白为0.1 mL甲醇。按照下列公司计算。
式中:A0为未加样品的ABTS阳离子自由基溶液的吸光值;A为样品与ABTS阳离子自由基溶液反应后的吸光值。
1.2.4 总抗氧化能力测定
取4 mL FRAP试剂与0.1 mL样品,反应10 min在593 nm下测吸光值。以不同浓度梯度的Trolox溶液为标样作标准曲线,抗氧化能力用TEAC (trolox equivalent antioxidant capacity)表示,空白为0.1 mL 60%乙醇,得到吸光值(Y)与Trolox 含量(x)之间的回归方程。
1.2.5 抑制双氧水诱导小鼠肝细胞产生MDA试验
参照参考文献[17],略做调整。选取体重18~25 g的雄性昆明种小鼠1只,迅速分离肝组织,用冷生理盐水洗净后称重,冰浴下匀浆,制成体积分数0.5%的悬浮液。取部分肝悬液用考马斯亮蓝试剂盒测定蛋白质含量。试验分组为空白对照(不加H2O2),模型组(加H2O2)和高粱多酚样品干涉组(加样品+加H2O2)。各试验组分别取700 μL的肝匀浆,在样品干涉组分别加入不同浓度的高粱多酚样品350 μL。在空白对照和模型组,加入700 μL的肝匀浆,混匀,37 ℃水浴15 min后,在空白对照组中加入700 μL生理盐水,而在模型组中加入350 μL生理盐水,然后除空白组,其余组加入350 μL 400 mmol/L的H2O2启动反应,混匀,继续水浴45 min后,在冰浴条件下,终止反应10 min,然后4 ℃下3 500 r/min离心10 min,取上清液500 μL分装,用于测定各组MDA含量。
MDA含量(nmol/mg)=
1.2.6 MTT法测定PC12细胞的活力
PC12细胞[18]接种于DEME培养液中,于37 ℃、5%CO2培养箱中培养至对数生长期,取出,离心(1 000 r/min, 3 min),去除上清,细胞培养液稀释为3.6×104个/mL, 96孔培养板每孔加100 μL,分组为:正常细胞组、模型细胞组(200 μmol/L H2O2)、阿魏酸细胞组(200 μmol/L H2O2+0.1 mmol/L)、低浓度干涉组(200 μmol/L H2O2+75 μg/mL)、中浓度干涉组(200 μmol/L H2O2+150 μg/mL)、高浓度干涉组(200 μmol/L H2O2+100 μg/mL)。
接种细化孵育24 h后,除正常对照组外,其余各组吸弃原培养液,加入含有相应浓度样品浓度培养液100 μL,继续孵育24 h后,吸弃培养液,加入100 μL 含200 μmol/L的H2O2培养液,于37 ℃培养2 h,除去培养基,加入MTT,4 h后,除去MTT,加入150 μL的DMSO,振荡混匀15 min,上酶标仪检测细胞活力。
1.3 数据处理与分析
采用微软办公软件Office 2003、SPSS17.0软件处理数据,所有试验均做3个重复。
2 结果与讨论
2.1 总酚含量
不同提取溶剂对红高粱总酚的影响如图1所示,其中60%乙醇提取物中总酚含量最高,达到315.45mg/100 g DW, 高粱的水提取物中总酚含量较低。同时,水、60%甲醇和60%丙酮的提取效果没有显著差异,可见不同的提取溶剂对高粱中总酚含量有一定的影响,60%乙醇较其他溶剂效果好。又由于乙醇价格低廉,毒副作用小,所以在提取高粱多酚时选择乙醇作为提取溶剂更为合适。

图1 不同提取溶剂对红高粱总酚的影响
2.2 DPPH自由基清除率
红高粱不同溶剂提取物的DPPH·的清除能力见图2。结果表明:60%的乙醇、60%的甲醇、60%的丙酮均较水提取物清除能DPPH·的能力强,且均比1 mmol/L Trolox的阳性对照清除DPPH·的能力强。60%乙醇提取物清除自由基的能力是最强的,达到了89.88%。同时,60%甲醇和60%丙酮较水提取物的DPPH·清除能力强。由此可见溶剂对DPPH·的清除能力影响较大,选择合适的提取溶剂很重要,60%的乙醇是理想的提取溶剂。与以往研究类似,都表明高粱具有很强的清除自由基的能力[19]。
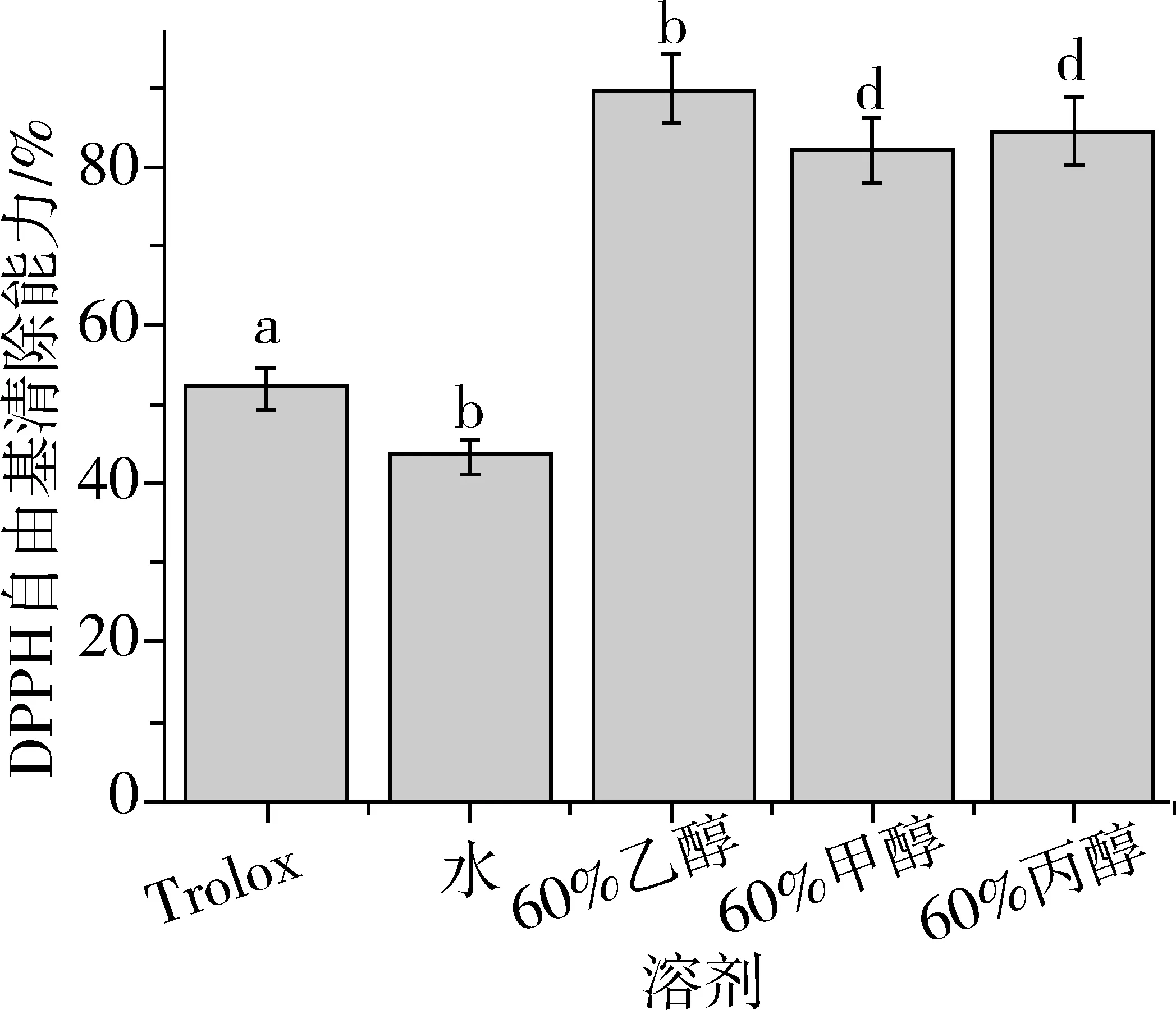
图2 不同提取溶剂对DPPH·清除率的影响
2.3 ABTS自由基清除率
高粱不同提取溶剂提取物的ABTS+·清除能力见图3,可知,水提取物、60%的乙醇、60%的甲醇、60%的丙酮提取物均较1 mmol/L的Trolox阳性对照强。同时,60%的乙醇提取物的ABTS+·清除能力最强达到了89.9%,同时,水、60%甲醇、60%丙酮提取物的ABTS+·清除能力差异不显著。由此可见,溶剂对ABTS+·的清除能力影响不大,而60%乙醇提取物具有最强的ABTS+·清除能力。

图3 不同提取溶剂对ABTS+·清除率的影响
2.4 FRAP测定总抗氧化能力
高粱不同溶剂提取物总抗氧化能力如图4所示,可见,60%的乙醇、60%的甲醇、60%的丙酮提取物均比水提取物的总抗氧化能力强,且三者相比无显著差异,但均比水提取的总抗氧化能力强。60%乙醇提取物的总抗氧化能力达到15.93 mmol TEAC/100 g DW。因此,结合上述选择溶剂的情况,选择60%乙醇作为提取溶剂较合适。

图4 不同提取溶剂对总抗氧化能力的影响
2.5 相关性分析
总多酚与DPPH·清除能力的相关系数为0.62,为正相关,但是未到达显著水平(P=0.38>0.05),与总抗氧化能力的相关性为0.632(P=0.368>0.05),这说明还有其他种类的抗氧化成分存在。总多酚与ABTS阳离清除能力的相关系数最高,为0.80(P=0.193>0.05),ABTS阳离子自由基清除能力与总酚含量密切相关, 但是没有达到显著水平,不具有统计学意义。这与以往研究谷物多酚与抗氧化方法间的相关性具有一致性[20-21], 结果表明,虽然高粱中富含多酚成分,但是提取物中总酚含量与抗氧化活性均未达到显著水平,一方面,可能是试验误差造成的,另一方面,也间接表明可能存在其他抗氧化成分影响高粱提取物的抗氧化活性。
2.6 抑制H2O2诱导小鼠肝细胞产生MDA试验
机体的体内的酶系统会产生氧自由基[22],这些自由基能攻击生物膜中的多不饱和脂肪酸而引发脂质过氧化作用,并伴有脂质过氧化物如MDA生成,进而引起细胞代谢及功能障碍甚至死亡[23]。因此常以MDA的含量来反应脂质过氧化的程度。
如表1所示,模型组的MDA含量比正常组显著增加,若加入红高粱提取物MDA的生成量明显减少,且成一定的剂量关系,说明红高粱提取物有抑制H2O2诱导的脂质氧化作用。高浓度的红高粱提取物的抑制率最高为72.96%。这也表明高粱多酚具有抗细胞氧化应激的作用。

表1 红高粱对H2O2诱导的肝细胞产生MDA生成的影响
注:数字旁字母不同,代表组间有显著差异(P<0.05)。
2.7 红高粱对H2O2诱导的PC12细胞氧化应激的保护作用
随着人们生活质量的改善,饮食引起的氧化应激损伤和抗氧化保护作用的理论受到普遍重视,长期膳食高脂肪、高能量的食品容易造成体内的氧化应激,引起多种慢性病如高血压、动脉硬化、糖尿病等。摄入一定的抗氧化剂有助于缓解这一状况。目前研究氧化应激的模型较多,其中PC12细胞是研究药物对细胞氧化应激的常用细胞,多个文献都有报道[24-25]。由表2知,PC12细胞经过H2O2处理后,模型组细胞存活率下降至(59.18±1.21)%,0.1 mmol/L的阿魏酸和低中高浓度的高粱总提取物能够提高H2O2诱导的PC12细胞存活率,而高浓度的红高粱总提取物(300 μg/mL)能够大大提高细胞的存活率(94.11%),较阿魏酸阳性组效果明显(81.81%)。这表明高粱多酚对H2O2诱导的PC12细胞氧化应激具有保护作用。

表2 红高粱对H2O2诱导的PC12细胞氧化应激的保护作用
3 结论
60%乙醇提取物中总酚含量最高,达到315.45 mg/100 g DW,DPPH·清除能力达到89.88%,ABTS+·清除能力达到89.9%,总抗氧化能力为15.93 mmol TEAC/100 g DW,均较其他溶剂提取的效果好。
清除ABTS+·能力与总酚的相关系数最高,为0.80 (P=0.193>0.05),但是没有达到显著水平,不具有统计学意义。
高质量浓度(2 mg/mL)的红高粱提取物对H2O2诱导小鼠肝细胞产生MDA抑制率最高,为72.96%。
红高粱总提取物为300 μg/mL时,能够大大提高细胞的存活率,达到94.11%。
参考文献
[1]Montonen J, Boeing H, Fritsche A, et al. Consumption of red meat and whole-grain bread in relation to biomarkers of obesity, inflammation, glucose metabolism and oxidative stress[J]. European Journal of Nutrition, 2013,52(1):337-345
[2]Hur I Y,Reicks M. Relationship between whole-grain intake, chronic disease risk indicators, and weight status among adolescents in the national health and nutrition examination survey, 1999-2004[J]. Journal of the Academy of Nutrition and Dietetics, 2012,112(1):46-55
[3]Priebe M G, Van Binsbergen J J, De Vos R , et al. Whole-grain foods for the prevention of type 2 diabetes mellitus[J]. Journal of Diabetes, 2009,1(3):138-139
[4]Nimptsch K, Kenfield S, Jensen M K, et al. Dietary glycemic index, glycemic load, insulin index, fiber and whole-grain intake in relation to risk of prostate cancer[J]. Cancer Causes & Control, 2011,22(1):51-61
[5]Magnanti S M, Fernandes J, Hirshberg S E, et al. Whole grain intake and coronary heart disease risk in young adults[J]. Faseb Journal, 2011,25:339-347
[6]Sosa V, Moline T, Somoza R, et al. Oxidative stress and cancer: An overview[J]. Ageing Research Reviews, 2013,12(1):376-390
[7]Svensson L, Sekwati-Monang B, Lutz D L, et al. Phenolic acids and flavonoids in nonfermented and fermented redSorghum(SorghumbicolorL. Moench)[J]. Journal of Agricultural and Food Chemistry, 2010,58(16):9214-9220
[8]Dykes L, Rooney L W, Waniska R D, et al. Phenolic compounds and antioxidant activity of sorghum grains of varying genotypes[J]. Journal of Agricultural and Food Chemistry, 2005,53(17):6813-6818
[9]Vargas-Solorzano J W, Piler Carvalho C W, Takeiti C Y, et al. Physicochemical properties of expanded extrudates from colored sorghum genotypes[J]. Food Research International, 2014,55:37-44
[10]Dykes L, Rooney W L,Rooney L W. Evaluation of phenolics and antioxidant activity of black sorghum hybrids[J]. Journal of Cereal Science, 2013,58(2):278-283
[11]Kil H Y, Seong E S, Ghimire B K, et al. Antioxidant and antimicrobial activities of crude sorghum extract[J]. Food Chemistry, 2009,115(4):1234-1239
[12]Schifitto G, Yiannoutsos C T, Ernst T, et al. Selegiline and oxidative stress in HIV-associated cognitive impairment[J]. Neurology, 2009,73(23):1975-1981
[13]Zhang R F, Zeng Q S, Deng Y Y, et al. Phenolic profiles and antioxidant activity of litchi pulp of different cultivars cultivated in southern China[J]. Food Chemistry, 2013,136(3-4):1169-1176
[14]Fernandez-Orozco R, Roca M, Gandul-Rojas B, et al. DPPH-scavenging capacity of chloroplastic pigments and phenolic compounds of olive fruits (cv.Arbequina) during ripening[J]. Journal of Food Composition and Analysis, 2011,24(6):858-864
[15]段江莲, 刁文睿, 李为琴, 等. 高粱籽粒乙醇提取物的体外抗氧化及抑菌活性[J]. 中国粮油学报, 2013(11):13-17 Duan J L, Diao W R, Li W Q, et al. In vitro antioxidant and antimicrobial activities of ethanol extracts from sorghum grains [J]. Journal of the Chinese Cereals and Oils Association, 2013(11):13-17
[16]Lahouar L, El A A, Ghrairi F, et al. Phytochemical content and antioxidant properties of diverse varieties of whole barley (HordeumvulgareL.) grown in Tunisia[J]. Food Chemistry, 2014,145:578-583
[17]马晓佩. 黑米饮料及其抗氧化活性的研究[D].无锡:江南大学, 2008 Ma X P. Study and antioxidant activities of black rice beverage [D]. Wuxi:Jiangnan University,2008
[18]Jang Y J, Kang N J, Lee K W, et al. Protective effects of red wine flavonols on 4-hydroxynonenal-induced apoptosis in PC12 cells[J]. Annals of the New York Academy of Sciences, 2009,1171: 170-175
[19]刘禹, 段江莲, 李为琴,等. 高粱米不同溶剂提取物的抗氧化活性研究[J]. 中国粮油学报, 2013(6):36-39 Liu Y, Duan J L, Li W Q, et al. Study on antioxidant activity of different solvent extracts from sorghum[J]. Journal of the Chinese Cereals and Oils Association, 2013(6):36-39[20]Choi Y, Jeong H S, Lee J. Antioxidant activity of methanolic extracts from some grains consumed in Korea[J]. Food Chemistry, 2007,103(1):130-138
[21]Deng G F, Xu X R, Guo Y J, et al. Determination of antioxidant property and their lipophilic and hydrophilic phenolic contents in cereal grains[J]. Journal of Functional Foods, 2012,4(4):906-914
[22]Bandeira S D, Da Fonseca L J S, Guedes G D, et al. Oxidative stress as an underlying contributor in the development of chronic complications inDiabetesMellitus[J]. International Journal of Molecular Sciences, 2013,14(2):3265-3284[23]Al-Yahya M, Mothana R, Al-Said M, et al. Attenuation of CCl4-induced oxidative stress and hepatonephrotoxicity by Saudi Sidr Honey in rats[J]. Evidence-Based Complementary and Alternative Medicine, 2013
[24]Hwang S L, Yen G C. Neuroprotective effects of the citrus flavanones against H2O2-induced cytotoxicity in PC12 cells[J]. Journal of Agricultural and Food Chemistry, 2008,56(3):859-864
[25]Zhu K X, Guo X, Guo X N, et al. Protective effects of wheat germ protein isolate hydrolysates (WGPIH) against hydrogen peroxide-induced oxidative stress in PC12 cells[J]. Food Research International, 2013,53(1):297-303.
Antioxidant Activity and Anti-Oxidative Stress of Different Solvent Extracts from Sorghum
Shen Yingbin Zhang Hui Cheng Lilin Qi Yajing Wang Li Qian Haifeng Qi Xiguang
(State Key Laboratory of Food Science and Technology; School of Food Science and Technology, Jiangnan University, Wuxi 214122)
In this paper, antioxidant activity of different extraction solvent extract was measured by DPPH· scavenging , ABTS+· scavenging and total antioxidant activity using red sorghums as raw materials, and total phenolic content was measured, and the correlation was analyzed between the total phenolic content and antioxidant methods. The effects of sorghum polyphenol on oxidative stress in cells were also measured. The results showed that 60% ethanol extract had the highest total phenolic content, reaching 315.45 mg GAE/100 g DW. DPPH· scavenging capacity reached 89.88%. ABTS+· scavenging capacity reached 89.9%. Total antioxidant capacity was 15.93 mmol TEAC/100 g DW. There was the highest correlation coefficient between the scavenging ABTS+· ability and total phenolic content (R=0.80,P=0.193>0.05), but it was not significant. The rate of H2O2-induced inhibition of mouse liver cells to produce MDA reached 72.96% with high concentrations of sorghum polyphenol (2 mg/mL). Meanwhile, the survival rate of PC12 cells was 94.11% with the concentration of 300 μg/mL. Therefore, red sorghum had a strong antioxidant capacity in vitro, and had protective effects against oxidative stress in cell.
antioxidant activity, red sorghum, DPPH·, ABTS+·, PC12, MTT
863计划(2013AA102203-7),国家自然科学基金(31471617),“十二五”国家科技支撑计划(2012BAD 37B08-3)
2015-07-21
申迎宾,男,1981年出生,博士,粮食深加工及资源利用
张晖,女,1967年出生,教授,谷物功能成分
TS21
A
1003-0174(2017)02-0019-06
