胸腔镜肺切除术后持续咳嗽的多因素分析
2017-08-07姜冠潮隋锡朝惠本刚
慕 腾 姜冠潮 李 晓 隋锡朝 惠本刚 王 云 王 俊
(北京大学人民医院胸外科,北京 100044)
·临床论著·
胸腔镜肺切除术后持续咳嗽的多因素分析
慕 腾 姜冠潮 李 晓 隋锡朝 惠本刚 王 云 王 俊**
(北京大学人民医院胸外科,北京 100044)
目的 探讨胸腔镜肺切除术后持续咳嗽(cough after pulmonary resection,CAP)发生的预后因素。 方法 回顾性分析2014年4月~2016年3月我科650例肺癌胸腔镜肺切除术的临床资料,根据术后是否发生持续咳嗽分为CAP组和非CAP组,单因素分析包括性别、年龄、吸烟史、病理类型、纵隔淋巴结转移、手术侧(左侧或右侧)、手术肺叶(上叶或非上叶)、手术方式、淋巴结切除方式、气管树周围淋巴结切除、离断下肺韧带、出院时合并气胸、出院时合并胸水,采用logistic回归进行多因素分析。 结果 术后发生CAP 175例,占26.9%。单因素分析显示,年龄、吸烟史、手术侧、切除肺叶、气管树周围淋巴结切除、出院时合并气胸有统计学差异(P<0.05)。多因素回归分析显示,年龄(OR=0.616,95%CI:0.424~0.895,P=0.011)、吸烟史(OR=0.656,95%CI:0.432~0.997,P=0.048)、手术侧(OR=1.814,95%CI:1.241~2.652,P=0.002)、切除肺叶(OR=1.789,95%CI:1.214~2.636,P=0.003)、气管树周围淋巴结切除(OR=2.730,95%CI:1.126~6.622,P=0.026)是CAP发生的预后因素。 结论 持续咳嗽是胸腔镜肺切除术后的常见并发症之一。年龄<63岁、无吸烟史、右侧手术、上叶手术、有气管树周围淋巴结切除的患者更易发生CAP。
肺癌; 并发症; 肺切除术后持续咳嗽
肺切除术后持续咳嗽(cough after pulmonary resection, CAP)是肺切除术后的常见并发症之一[1],发生率高达25%~50%[2,3]。CAP是指发生于肺切除术后持续时间不小于2周的干咳,胸部X线无明显异常,排除鼻后滴流综合征、支气管哮喘、口服血管紧张素转化酶抑制剂(angiotension converting enzyme inhibitors,ACEI)药物等因素[2]。CAP可加重切口疼痛,增加拔除胸引管后切口漏气风险,严重者可干扰患者交谈或睡眠,加重患者心理负担,影响患者生活质量[3,4]。目前,CAP尚未得到临床足够重视,临床特点和发生原因也尚未明确。CAP的发生可能与支气管牵拉、支气管内缝线暴露[5]、淋巴结清扫、膈肌抬高、胃食管反流[2,6]等因素有关。但既往研究的样本量小,不同研究的结果之间存在矛盾之处。本文回顾性分析2014年4月~2016年3月我院650例肺癌胸腔镜肺切除术的临床资料,探讨CAP发生的预后因素。
1 临床资料与方法
1.1 一般资料
病例选择标准:①2014年4月~2016年3月,接受胸腔镜亚肺叶、肺叶、复合肺叶或全肺切除,伴或不伴纵隔淋巴结切除;②术后病理诊断为原发性肺癌或癌前病变。排除标准:①术前有明确的咳嗽病史;②术前合并可引起咳嗽发作的内科因素(包括呼吸道感染性疾病、过敏性鼻炎、支气管哮喘、慢性阻塞性肺疾病、鼻后滴流综合征、口服ACEI药物等;③失访或其他原因不能明确是否发生持续咳嗽者。
CAP诊断标准:①术前无明显咳嗽病史;②术后咳嗽发生于肺切除术后30 d内;③术后咳嗽持续时间不少于2周;④排除肿瘤复发;⑤排除内科因素所致的咳嗽发作。
检索我科肺癌数据库,共入组650例,男319例,女331例。年龄(59.7±10.9)岁。按照是否满足CAP诊断标准分为CAP组和非CAP组(图1),分别为175、475例。右侧手术383例,上叶手术416例,亚肺叶切除203例。中位纵隔淋巴结切除数为11枚(0~41枚)。术后病理:腺癌544例,鳞癌66例,腺鳞癌7例,小细胞肺癌9例,大细胞肺癌4例,非典型腺瘤样增生11例,类癌7例,小细胞及腺癌混合性癌1例,小细胞及低分化鳞癌混合性癌1例。有吸烟史190例。
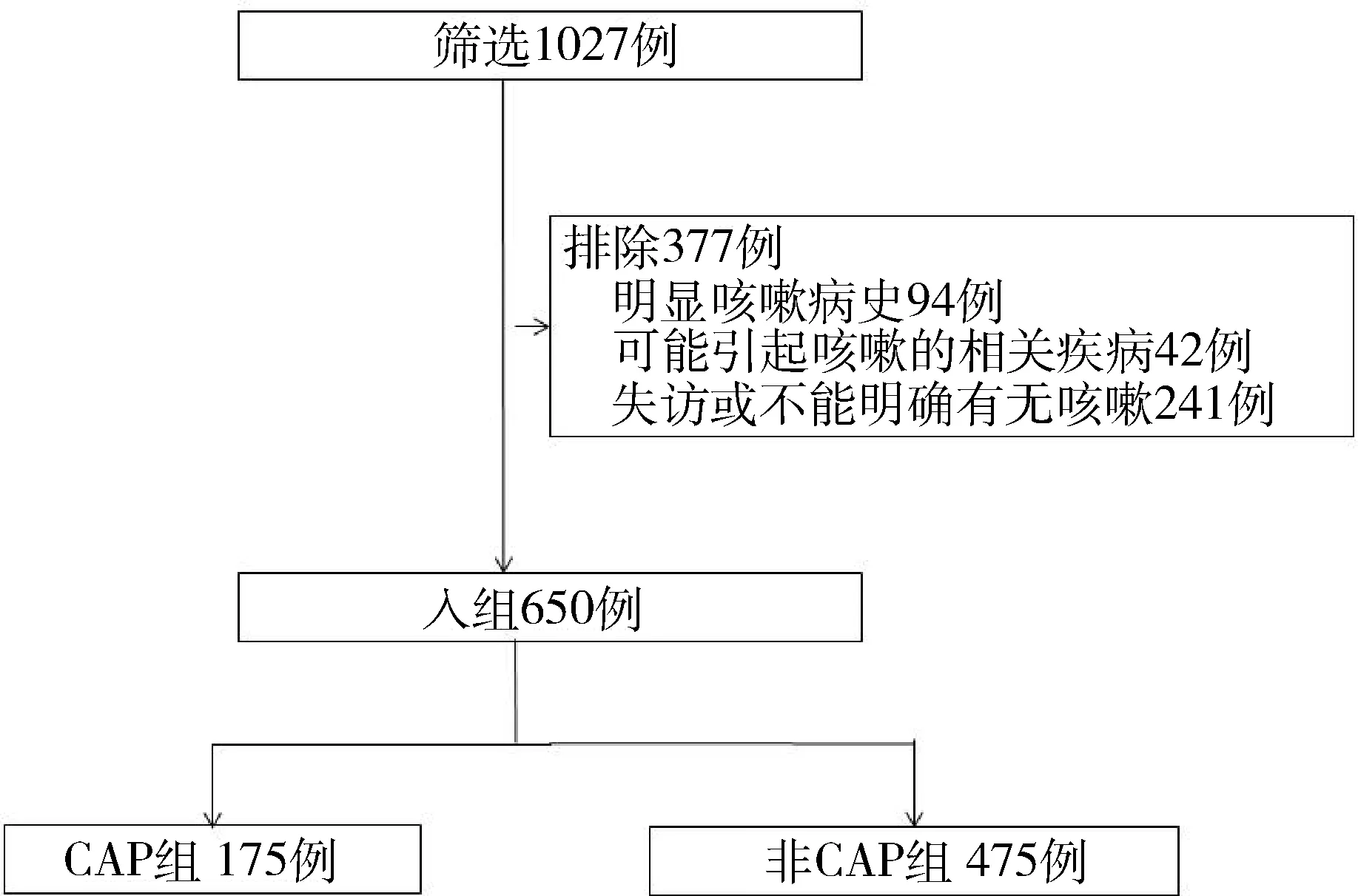
图1 病例入组流程图
1.2 方法
健侧卧位,双腔气管插管全身麻醉,健侧单肺通气。胸腔镜手术采用以 “王氏手法”为核心的手术方法[7]。淋巴结分组采用AJCC标准[8]。纵隔淋巴结清扫和采样采用ACSOG Z0030标准[9]。依据咳嗽感受器的分布特点[10],将分布于气管周围的淋巴结称为气管树周围淋巴结,包括2、4、7组。有上述3组中任何一组淋巴结切除定义为有气管树周围淋巴结切除,无上述3组淋巴结切定义为无气管树周围淋巴结切除。肺楔形切除和肺段切除合称亚肺叶切除。出院时有无胸水或气胸均以出院前最后一次的胸部正侧位X线为依据。
胸腔闭式引流<200 ml/d,咳嗽时无气泡,胸部X线提示肺复张良好,无明显肺炎或肺不张时,可拔除胸腔闭式引流管。
1.3 统计学处理
采用SPSS20.0软件进行统计学分析。用受试者工作特征曲线(ROC曲线)分析年龄对CAP发生的影响,确定Cutoff值并以此将年龄转化为分类变量。首先,对各自变量行χ2检验,然后对单因素分析有统计学差异(P<0.05)的自变量进行多因素logistic回归分析(Forward法),P<0.05差异有统计学意义。
2 结果
CAP开始的中位时间为术后6 d(1~30 d),持续的中位时间180 d(14~720 d)。采用ROC曲线所获得的年龄的Cutoff值为63岁。单因素分析结果显示:年龄、吸烟史、手术侧、手术肺叶、气管树周围淋巴结切除、出院时合并少量气胸差异有统计学意义(P<0.05),见表1。多因素分析显示:年龄、吸烟史、手术侧、手术肺叶、气管树周围淋巴结切除是CAP发生的独立预后因素(P<0.05),气胸并非CAP的独立预后因素(P=0.056)(表2)。
3 讨论
生理状态下,咳嗽是机体的一种重要防御性反射,过度的咳嗽可导致多种并发症,包括乏力、失眠、眩晕、头痛、肌肉痛、声音嘶哑、尿失禁、肋骨骨折、自发性气胸、肺疝等[11,12]。咳嗽反射是咳嗽发生的生理基础。咳嗽感受器接受理化刺激后产生的冲动,沿迷走神经传入纤维上传至脑干、脑桥、大脑皮层,经处理后沿迷走神经、膈神经及脊神经的运动支下传至呼吸肌,支配呼吸肌协调性运动而产生咳嗽[13]。迷走神经C-纤维是最主要的咳嗽感受器,主要分布于喉、气管、隆突及肺内较大支气管,不仅分布于气道的黏膜上皮,而且分布于气道壁内的咳嗽效应器。
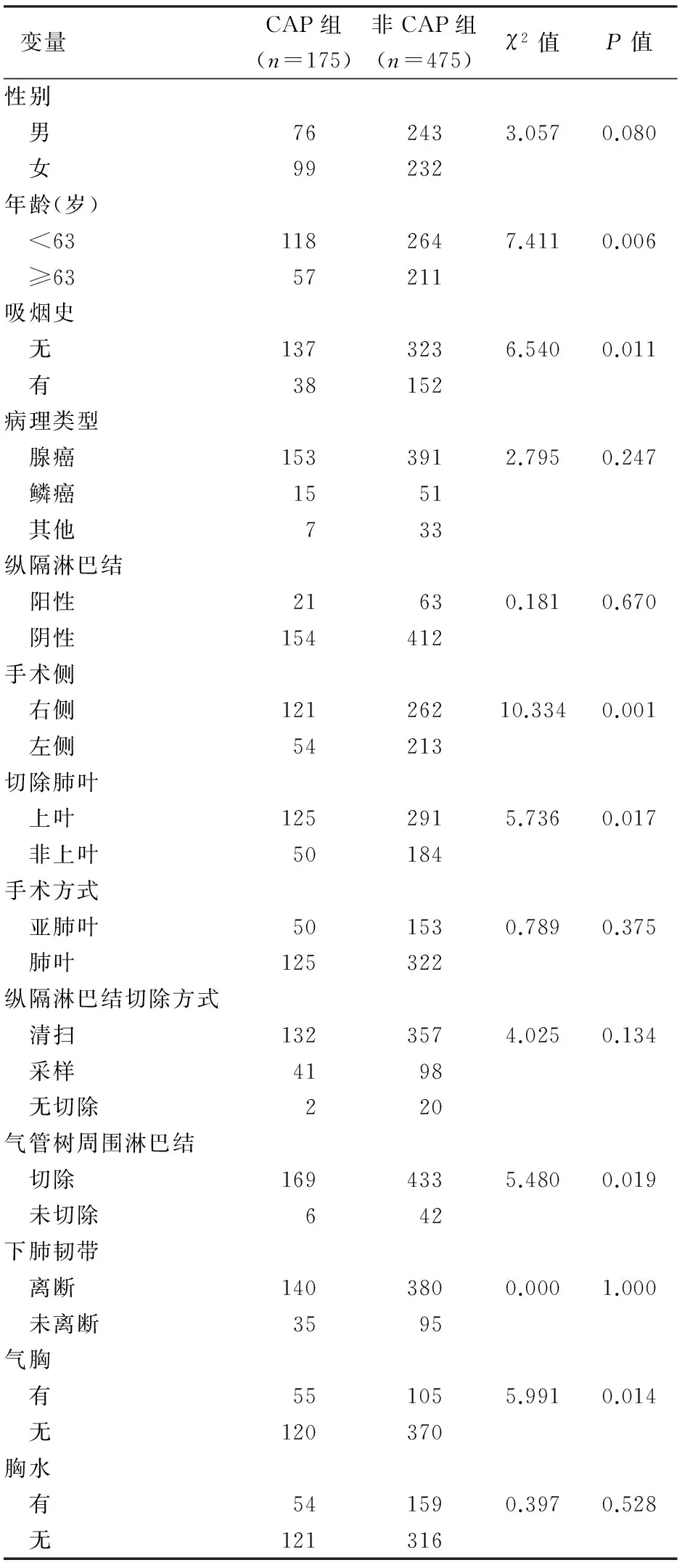
表1 CAP的单因素分析
病理状态的咳嗽可由多种复杂的因素引起,CAP则特指因肺切除术而导致的持续咳嗽。目前,关于CAP的研究仍较少,其定义及诊断尚无统一标准,流行病学特点和临床特征也不明确。Sawabata等[2]2005年首次给出CAP的初步定义,数据结果显示:术后1年内CAP发生率为50%,术后1~5年CAP发生率为18%。Sarna等[3]认为非小细胞肺癌术后长期生存者中咳嗽的患病率约为25%。沿用上述CAP的定义,本研究CAP发生率26.9%(175/650),与既往研究相符。另外,进一步对本组所有CAP的临床特点进行总结后发现:CAP发生的中位时间为术后第6天,持续的中位时间180 d。根据临床经验,CAP多出现于拔除胸腔闭式引流管后,而拔管前的症状多被患者的主动咳嗽所掩盖。本研究咳嗽开始的时间与我中心术后带胸管时间[14]相当(术后6 d vs. 术后6.4 d),与临床经验相符。Miyamoto等[15]的研究显示CAP持续的平均时间为393.2 d。因该研究是一项单臂的治疗性研究,选择的病例可能是较严重病例,且样本量较小,不具有代表性。因此,我们认为180 d的中位持续时间可能更能预测真实情况。上述研究均为回顾性研究,CAP的发生率及持续时间可能因咳嗽症状的好转而被低估。
CAP发生的原因和机制目前尚不明确,纵隔淋巴结切除可能是其中的一个重要因素。Sawabata等[2]的横断面研究推测纵隔淋巴结切除可能是术后持续咳嗽的原因,但数据上并未证实该推测。Huang等[16]认为纵隔淋巴结切除术后气管局部裸露并直接暴露于理化因素的刺激是CAP发生的可能原因。在此假设的基础上,Huang等尝试用自体纵隔脂肪移植填塞气管旁淋巴结清扫后的空腔来预防CAP的发生,并取得一定疗效。本研究结果显示是否切除纵隔淋巴结或纵隔淋巴结的切除方式似乎并不影响术后持续咳嗽的发生(P=0.134),这可能与本组无淋巴结切除的病例数较少有关(n=22)。我们根据迷走神经C-纤维主要分布于气管、隆突及肺内较大支气管内的特点, 对有无气管树周围淋巴结切除进行分析,结果显示无论单因素或多因素均具有统计学意义。因此,气管树周围淋巴结切除是肺切除术后持续咳嗽的独立预后因素。气管树周围淋巴结切除如何引起持续咳嗽,目前尚无相关报道。根据咳嗽感受器、迷走神经分布及手术操作特点,推测可能的机制有:①淋巴结切除过程中损伤了分布于相应区域的迷走神经分支中的咳嗽传入纤维,咳嗽传入纤维在修复过程中敏感性增加;②切除淋巴结过程中损伤气管壁,气管壁损伤和修复过程中释放的致咳因子导致气管壁内咳嗽感受器异常兴奋;③淋巴结切除后,支气管壁受到异常的机械牵拉或直接暴露于各种化学刺激,导致咳嗽反射异常兴奋。
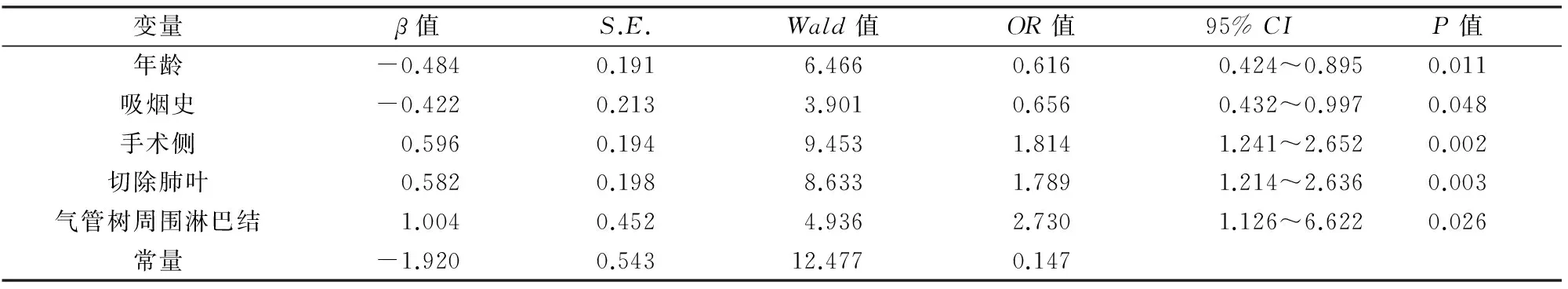
表2 CAP的多因素logistic回归分析
肺切除后继发的解剖和生理改变可能是影响CAP发生的另一个重要因素。肺切除术后患侧肺容量下降,胸膜腔内压力下降,机体通过一系列代偿机制来填充残腔以恢复胸膜腔正常压力,如残肺过度膨胀、同侧膈肌抬高、纵隔向患侧移位等。长期的代偿可进一步导致支气管扭曲、残肺畸形等。这些解剖和生理改变可能导致呼吸过程中气流动力学或气道敏感性变化,从而导致咳嗽。本研究结果显示上叶切除可以增加CAP发生的风险,原因可能是在同等条件下上叶切除较下叶切除后的残腔更大,因此导致的解剖和生理改变更加严重。
既往研究表明,吸烟是慢性咳嗽的重要原因之一[12],本研究的结果似乎与这一结论相悖,即术前吸烟可能是CAP发生的保护性因素。这种现象深层的原因可能为:长期吸烟导致气道咳嗽感受器的敏感性下降[17,18],使咳嗽反射对手术所造成刺激的敏感性减弱,同时随着患者术后的戒烟,术前吸烟者在术后反而更少发生CAP。单因素分析显示气胸与CAP关系的P值为0.014,采用前进法进行多因素分析时,P值的变化趋势如下:纳入手术侧后为0.013,纳入手术叶后为0.030,纳入年龄后为0.037,纳入气管树周围淋巴结后为0.047,纳入吸烟史后为0.056。由上述P值变化可以看出,气胸与CAP的相关性受其他因素影响较大,可能是混杂因素。其中是否上叶切除对气胸的P值影响最大,结合临床经验,上叶体积较大,切除术后残腔较大,更容易因余肺不能完全填充残腔而导致残留气胸。因此,气胸可能是上叶切除导致咳嗽的中间因素之一,并不是独立因素。
与既往研究相比,本研究样本量相对较大,揭示了CAP的部分临床特点,证实了气管树周围淋巴结切除与CAP发生的相关性,具有一定的说服力。诚然,本研究也存在一些不足之处:①单中心回顾性研究,可能存在选择偏倚或信息偏倚;②只对可能影响CAP发生因素进行了探索,而这些因素引起CAP发生的确切机制仍需进一步的研究。
综上所述,持续咳嗽是肺癌肺切除术后的一个常见并发症。年龄<63岁、无吸烟史、右侧手术、上叶手术以及有气管树周围淋巴结切除的肺癌患者更容易发生术后持续咳嗽。
1 龙 浩,林志潮,林勇斌,等.胸腔镜与小切口开胸肺切除术后生活质量的对比性研究.中国微创外科杂志,2008,8(2):137-139.
2 Sawabata N, Maeda H, Takeda S, et al. Persistent cough following pulmonary resection: observational and empiric study of possible causes. Ann Thorac Surg,2005,79(1):289-293.
3 Sarna L, Evangelista L, Tashkin D, et al. Impact of respiratory symptoms and pulmonary function on quality of life of long-term survivors of non-small cell lung cancer. Chest,2004,125(2):439-445.
4 Sawada S, Suehisa H, Yamashita M. Inhalation of corticosteroid and β-agonist for persistent cough following pulmonary resection. Gen Thorac Cardiovasc Surg,2012,60(5):285-288.
5 Shure D. Endobronchial Suture: A foreign body causing chronic cough. Chest,1991,100(5):1193-1196.
6 Sawabata N, Takeda S, Tokunaga T, et al. Acid regurgitation associated with persistent cough after pulmonary resection: an observational study. Cough,2006,2(1):9-16.
7 李 运,王 俊,隋锡朝,等.全胸腔镜肺叶切除手术操作流程及技巧的优化:北京大学人民医院经验.中华胸心血管外科杂志,2010,26(5):300-306.
8 Mountain CF, Dresler CM. Regional lymph node classification for lung cancer staging. Chest,1997,111(6):1718-1723.
9 Darling GE, Allen MS, Decker PA, et al. Randomized trial of mediastinal lymph node sampling versus complete lymphadenectomy during pulmonary resection in the patient with N0 or N1 (less than hilar) non-small cell carcinoma: Results of the American College of Surgery Oncology Group Z0030 Trial. J Thorac Cardiovasc Surg,2011,141(3):662-670.
10 Canning BJ, Chang AB, Bolser DC, et al. Anatomy and neurophysiology of cough. Chest,2014,146(6):1633-1648.
11 Irwin RS, Glomb WB, Chang AB. Habit cough, tic cough, and psychogenic cough in adult and pediatric populations: ACCP evidence-based clinical practice guidelines.Chest,2006,129(1 Suppl):S174-S179.
12 Achilleos A. Evidence-based evaluation and management of chronic cough. Med Clin North Am,2016,100(5):1033-1045.
13 Polverino M, Polverino F, Fasolino M, et al. Anatomy and neuro-pathophysiology of the cough reflex arc. Multidiscip Respir Med, 2012,7(1):1-5.
14 隋锡朝,杨 帆,李 运,等.1131例单中心全胸腔镜肺叶切除治疗非小细胞肺癌的远期疗效.中华胸心血管外科杂志,2015, 31(8):472-476.
15 Miyamoto H, Sakao Y, Sakuraba M, et al. Usefulness of suplatast tosilate for chronic cough following lung cancer surgery. Gen Thorac Cardiovasc Surg,2009,57(9):463-466.
16 Huang J, Luo Q, Tan Q, et al. Evaluation of the surgical fat-filling procedure in the treatment of refractory cough after systematic mediastinal lymphadenectomy in patients with right lung cancer. J Surg Res,2014,187(2):490-495.
17 Sitkauskiene B, Stravinskaite K, Sakalauskas R, et al. Changes in cough reflex sensitivity after cessation and resumption of cigarette smoking. Pulm Pharmacol Ther,2007,20(3):240-243.
18 Millqvist E, Bende M. Capsaicin cough sensitivity is decreased in smokers. Respir Med,2001,95(1):19-21.
(修回日期:2017-02-23)
(责任编辑:李贺琼)
Multivariate Analysis of Cough After Pulmonary Resection by Video-assisted Thoracoscopic Surgery
Mu Teng, Jiang Guanchao, Li Xiao, et al.
Department of Thoracic Surgery, Peking University People’s Hospital, Beijing 100044, China
Wang Jun, E-mail: xiongwai@263.net
Objective To analyze prognostic factors of cough after pulmonary resection (CAP) by video-assisted thoracoscopic surgery(VATS). Methods A retrospective analysis of 650 patients who underwent thoracoscopic pulmonary resection for lung cancer in our hospital between April 2014 and March 2016 was carried out. All those patients were divided into either CAP group or non-CAP group. The univariate analysis included gender, age, smoking history, pathological type, mediastinal lymph nodes metastasis, operation side, operation lobe, operative approaches, extention of mediastinal lymphadenectomy, para-bronchial tree lymph nodes resection, inferior pulmonoary ligaments division, pneumothorax when discharged, and pleural effusion when discharged. The multivariate analysis was also conducted by logistic regression. Results A total of 175 cases (26.9%) were included in the CAP group. The univariate analysis showed that age, smoking history, operation side, operation lobe, para-bronchial tree lymph nodes resection, pneumothorax when discharged had significantly statistical difference between the two groups (P<0.05). The multivariate analysis showed that younger than 63 years old (OR=0.616, 95%CI: 0.424-0.895,P=0.011), smoking history (OR=0.656, 95%CI: 0.432-0.997,P=0.048), operation side (OR=1.814, 95%CI: 1.241-2.652,P=0.002), operation lobe (OR=1.789, 95%CI: 1.214-2.636,P=0.003), and para-bronchial tree lymph nodes resection (OR=2.730, 95%CI: 1.126-6.622,P=0.026) were independent prognostic factors of CAP. Conclusions CAP is a common postoperative complication of pulmonary resection by VATS. There is a significant relationship between CAP and age, smoking history, operation side, operation lobe and para-bronchial tree lymph nodes resection.
Lung cancer; Complication; Cough after pulmonary resection
首都卫生发展科研专项项目(项目编号:首发2014-1-4081)
A
1009-6604(2017)07-0577-04
10.3969/j.issn.1009-6604.2017.07.001
2016-09-06)
**通讯作者,E-mail:xiongwai@263.net
