包覆全氟戊烷的介孔氧化硅微球增效高强度聚焦超声表面消融离体牛肝
2017-08-07丁晓亚邹建中马大钊
丁晓亚,邹建中,王 琦,文 静,马大钊
(重庆医科大学生物医学工程学院 省部共建国家重点实验室培育基地—重庆市超声医学工程重点实验室重庆市生物医学工程学重点实验室 重庆市微无创医学协同创新中心,重庆 400016)
包覆全氟戊烷的介孔氧化硅微球增效高强度聚焦超声表面消融离体牛肝
丁晓亚,邹建中*,王 琦,文 静,马大钊
(重庆医科大学生物医学工程学院 省部共建国家重点实验室培育基地—重庆市超声医学工程重点实验室重庆市生物医学工程学重点实验室 重庆市微无创医学协同创新中心,重庆 400016)
目的 探讨包覆全氟戊烷的介孔氧化硅微球(MSNC-PFP)对HIFU表面消融离体牛肝的影响。方法 根据MSNC-PFP的浓度将50块离体牛肝平均分为5组:对照组(MSNC-PFP浓度为0)、0.25 mg/ml组、0.50 mg/ml组、1.00 mg/ml组、2.00 mg/ml组。超声引导沿消融线路径多点注射增效剂(即MSNC-PFP)。通过HIFU线性扫描,以凝固性坏死束组合成面,6个面组合成体,对体腔内区域不直接消融。观察消融中声像图的改变。以TTC染色肉眼观察坏死范围,HE染色光镜下观察坏死程度。测量各组消融体积并评价消融效果,评价指标包括靶区覆盖指数(CI)、靶外体积指数(EI)、能效因子(EEF)。结果 当MSNC-PFP浓度在1.00 mg/ml以上时,声像上为团状强回声,3~5 min后消退;MSNC-PFP浓度越高,HIFU辐照区域的灰度值改变越大。0.50、1.00、2.00 mg/ml组总消融体积高于对照组,EEF值低于对照组(P均<0.01)。1.00、2.00 mg/ml组的CI及EI值均高于其余各组(P均<0.05)。肉眼观察凝固性坏死区表现为灰白色,未坏死区则表现为红色。光镜下见当MSNC-PFP浓度≥0.50 mg/ml时,形成的凝固性坏死带完整。结论 采用MSNC-PFP可增大HIFU表面消融离体牛肝的消融体积,减低EEF,从而提高辐照效率。
全氟戊烷的介孔氧化硅微球;高强度聚焦超声消融术;离体;牛;肝
由于高强度聚焦超声(high-intensity focused ultrasound, HIFU)消融时间长、投放能量高,引发并发症的风险较大等诸多因素的影响,在肝脏较大肿瘤消融中的应用受到一定限制[1]。HIFU为表面消融方式,即在靶区的周边进行适形消融,形成完整的凝固性坏死带包裹消融区,阻断内部血供使其自然坏死,达到降低消融剂量和缩减消融时间的目的[2]。为形成完整且有足够厚度的坏死带,在消融中形成和促进内部组织的直接坏死[3-4]。本研究利用包覆全氟戊烷的介孔氧化硅微球(permeating perfluoropentane drops-encapsulated mesoporous silica nanocapsules, MSNC-PFP)对HIFU的增效作用[5-6],将增效剂与表面消融方法相结合进行离体牛肝实验,以评价消融效果。
1 材料与方法
1.1实验材料与分组 新鲜离体牛肝,切为 100 mm×100 mm×70 mm的长方块,以真空旋片脱气泵脱气40 min后复温,备用。50块离体牛肝随机分为5组,每组各10块。MSNC-PFP由上海硅酸盐研究所配制,直径200 nm,沸点29℃。
1.2方法 HIFU消融及超声监测均采用海扶刀®JC200型聚焦超声肿瘤治疗系统(重庆海扶医疗科技股份有限公司),治疗头直径220 mm,焦距 140 mm,工作频率1.0 MHz;系统自带灰度测量软件及不规则物体体积测量软件。HIFU消融后,进行肉眼及光镜下组织学观察。
1.2.1 增效剂注射 在超声监测及引导下,选定消融区域。沿HIFU线性消融路径,逐一位点注射MSNC-PFP,位点间距10 mm,每个位点注射剂量为20 μl。对5组离体牛肝其中1组(对照组)MSNC-PFP浓度为0,其余4组注射MSNC-PFP浓度分别为0.25、0.50、1.00、2.00 mg/ml。
1.2.2 消融方法 增效剂注射结束后即刻进行HIFU消融。选定深度为40、35、29、22、14 mm的5个层面,以递减(240、220、200、160、140 W)的功率逐层消融。线性扫描速度为5 mm/s,计划消融范围为 41 mm×41 mm×32 mm,顶层和底层为11条消融线组成的面,相邻两条线间隔4 mm,中间层面以4条线状坏死束组成消融框,消融间隔时间为10 s,相邻层面间隔时间为6 min,以防止持续HIFU辐照造成消融区温度过高而引起大面积热坏死。
1.2.3 消融体积测量及评价指标 HIFU辐照后,沿z轴方向薄层切开靶体,每层厚约3 mm。行TTC染色,肉眼观察剖面凝固性坏死情况。如坏死形态规则,则采用游标卡尺测量并计算各组薄层切开后每一层离体牛肝的消融面积,计算该层面的消融体积:消融体积=消融面积×层厚,各层面消融体积相加获得总消融体积;如发现坏死体积不规则,则采用HIFU消融系统自带的不规则物体体积测量软件进行坏死区域勾画及体积测量,获得总消融体积。计算消融框外体积:消融框外体积=总消融体积-计划消融体积。
评价指标包括:靶区覆盖指数(coverage index, CI)[7],CI=总消融体积/计划消融体积×100%,用于判断总体消融率;靶外体积指数(external volume index, EI)[8],EI=消融框外体积/计划消融体积×100%,用于评价消融的适形性;能效因子(energy efficiency factor, EEF)[9],EEF(J/mm3)=P×T/V,其中P表示声功率(W),T表示治疗时间(s),V表示总消融体积(mm3),用于判断应用增效剂对HIFU消融离体牛肝组织难易程度的影响,EEF越低则越易于消融。
1.2.4 组织学观察 对沿z轴方向薄层(层厚3 mm)切开的离体肝组织分别取辐照区中心及辐照区边界组织切片,HE染色后于光镜下观察坏死程度。
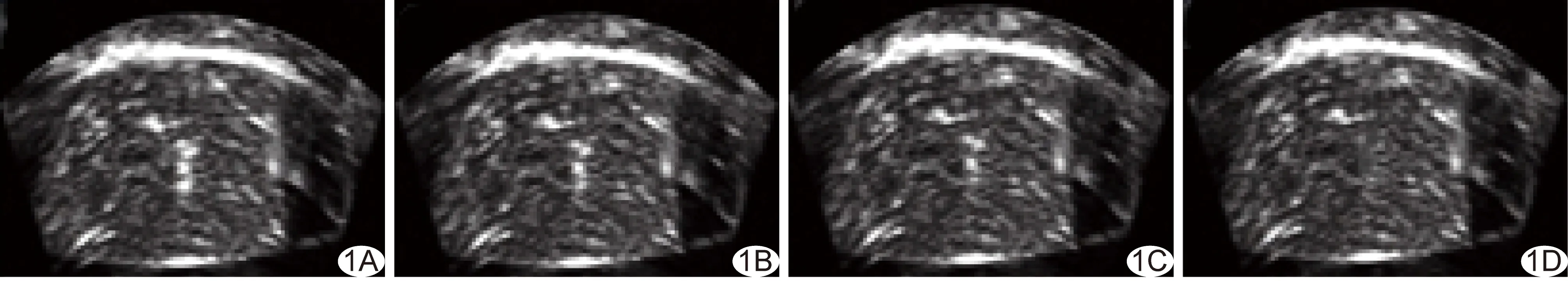
图1 超声引导下多点注射MSNC-PFP声像图 A~D.依次为注射进离体牛肝内即刻(A)、1 min(B)、2 min(C)、3 min(D)超声表现

组别总凝固性坏死体积(cm3)EEF值CI值EI值2.00mg/ml组44.59±1.511.27±0.0374.26±2.1517.25±2.311.00mg/ml组37.39±0.941.64±0.0965.88±1.3612.62±2.670.50mg/ml组32.59±1.312.02±0.0860.55±1.815.08±1.260.25mg/ml组29.73±0.442.28±0.0557.98±2.53-1.26±2.73对照组28.41±0.892.56±0.0857.11±1.59-2.86±0.37F值103.48240.9967.4187.10P值<0.001<0.001<0.001<0.001
2 结果
2.1声像图表现 新鲜离体牛肝脱气后为均匀等回声,当MSNC-PFP浓度在1.00 mg/ml以上时,表现为强回声团,3~5 min回声消退,见图1。HIFU线性消融时,焦点处出现条状强回声带,MSNC-PFP浓度越高,灰度值变化越大,见图2。

图2 不同浓度MSNC-PFP对HIFU表面消融模式中灰度值的影响
2.2消融体积及评价指标比较 各组总消融体积、CI、EI及EEF值见表1。表面消融模式下,以浓度为0.50、1.00、2.00 mg/ml的MSNC-PFP协同HIFU
线性扫描,可增大凝固性坏死体积,减小所需的EEF值,0.50、1.00、2.00 mg/ml组与对照组间总消融体积、EEF值差异均有统计学意义(P均<0.01)。MSNC-PFP浓度0.25 mg/ml组的EEF值与对照组比较,差异无统计学意义(P>0.05)。MSNC-PFP浓度1.00、2.00 mg/ml组,其CI及EI值均高于其余各组,组间两两比较差异均有统计学意义(P均<0.05)。
2.3肉眼观察 各组均可见凝固性坏死带(图3),凝固性坏死区为灰白色,未坏死区牛肝则表现为红色。对照组及MSNC-PFP浓度0.25 mg/ml组的凝固性坏死带融合较差,其余各组凝固性坏死带均融合,坏死带间无组织残留。MSNC-PFP浓度1.00 mg/ml组及2.00 mg/ml组可见内部未消融区及框外热损伤,牛肝失去正常的红色,其中以2.00 mg/ml组热损伤最为严重。
2.4镜下观察 各组消融区凝固性坏死均表现为细胞形态消失,核溶解,呈碎片状红染物;对照组、MSNC-PFP浓度0.25 mg/ml组及0.50 mg/ml组消融区与周边组织分界清晰(图4A),对照组及 0.25 mg/ml组未融合凝固性坏死带间细胞连续性消失,染色质边集,部分核固缩、溶解(图4B), 0.50 mg/ml组凝固性坏死带连续。MSNC-PFP浓度 1.00 mg/ml组及2.00 mg/ml组消融区边界分界不清,周边未消融区组织受热损伤,细胞核固缩,细胞溶解,胞内可见空泡(图4C)。

图3 大体标本 A~E.分别为对照组(A)、MSNC-PFP浓度0.25 mg/ml组(B)、0.50 mg/ml组(C)、1.00 mg/ml组(D)、2.00 mg/ml组(E)牛肝组织顶层凝固性坏死带; F~J.分别为对照组(F)、MSNC-PFP浓度0.25 mg/ml组(G)、0.50 mg/ml组(H)、1.00 mg/ml组(I)、2.00 mg/ml组(J)中间层面凝固性坏死框

图4 HE染色组织学检查(HE,×200) A.0.50 mg/ml组凝固性坏死带与周边分界清晰; B.对照组凝固性坏死带间可见残留细胞; C.2.00 mg/ml组内部未消融区组织热损伤,细胞核固缩、溶解,细胞内出现空泡
3 讨论
目前可用于HIFU增效的纳米材料主要为有机、无机及有机无机杂化体系。有机材料主要通过脂质体、微乳液、高分子材料等包覆液态氟碳化合物制成纳米乳剂,在HIFU激发下产生微泡,可提高HIFU热消融肿瘤的体积[10]。但有机材料稳定性差,HIFU辐照中结构易塌陷,难以实现持续增效的效果[11]。无机材料主要以介孔氧化硅为载体,其稳定性好,以真空装载液态氟碳类化合物,在HIFU焦点区形成稳定的气泡以进行超声诊疗[12]。本实验将MSNC-PFP多点注射入消融区域,发现浓度达1.00 mg/ml以上时,超声回声增强,可持续3~5 min,弥散的MSNC-PFP仍具有增效HIFU消融的效果,辐照区出现明显的回声信号,提示介孔硅类HIFU增效剂在长时间的辐照过程中响应时间更长。
本实验发现MSNC-PFP的浓度可影响HIFU表面消融结果,浓度越高,凝固性坏死体积越大、坏死越彻底,辐照区周边热损伤越严重。分析其原因可能为:①MSNC-PFP浓度越高,对声吸收能力越强,在总能量相同的HIFU辐照下,可产生更强的生物学效应;②MSNC-PFP增强了HIFU的热效应[13];③消融线的先后排列可引起热扩散和声学特性的改变,有助于声能沉积。本实验中,为避免持续辐照产生的持续温度升高,在消融中给予层间隔6 min的散热时间以控制消融结果,发现对照组形成的凝固性坏死带融合欠佳,而给予增效剂的各组其融合较完整,可形成完整的凝固性坏死带。分析原因为增效剂改变组织固有声学性质后,可产生更强的热效应,促进线性坏死带的融合,最终形成完整的壳式坏死带包裹内部未消融区,从而提高HIFU表面消融的有效性。
HIFU表面消融的关键是形成完整且有足够厚度的凝固性坏死带,促进肿瘤内部的自然消亡转归。消融层间隔时间是影响消融效果的主要因素:如间隔时间过短,消融中累积的热会向内部未消融区和外周扩散,造成损伤形态不规则,降低安全性。因此本实验采用6 min作为安全的间隔时间,降低功率后,可见对照组及0.25 mg/ml组的凝固性坏死带分界清晰,内部未消融区组织结构完好,提高MSNC-PFP浓度后,凝固性坏死带连续,与周边组织分界不清,内部未辐照区组织出现热损伤,核固缩,部分溶解消失,胞内出现空泡等。肝脏是富含血供的脏器,HIFU能量沉积较困难,如消融区贯穿血管,血流直接带走大部分热量,难以形成凝固性坏死。因此,为确保该模式的有效性,对血供丰富、能量较难沉积的消融靶区仍需使用增效剂以达到消融效果。
本实验通过多点注射MSNC-PFP的方式探讨其浓度对HIFU表面消融的影响。但离体组织中增效剂的分散较局限,而活体中增效剂分布范围更复杂,还有待进一步探讨。
[1] Yu T, Luo J. Adverse events of extracorporeal ultrasound-guided high intensity focused ultrasound therapy. Plos One, 2010,6(12):2053-2056.
[2] 卜锐,邹建中,银丽,等.应用高强度聚焦超声表面层三维消融模式消融离体牛肝组织.中国介入影像与治疗学,2012,9(12):881-884.
[3] Bu R, Yin L, Yang H, et al. Tissue ablation accelerated by peripheral scanning mode with high-intensity focused ultrasound: A study on isolated porcine liver perfusion. Ultrasound Med Biol, 2013,39(8):1410-1419.
[4] 银丽,邹建中,伍烽,等.高强度聚焦超声壳式辐照的不同线间隔时间对离体牛肝组织的影响.中国介入影像与治疗学,2012,9(10):748-751.
[5] 易良波,王琦,王智彪,等.对比观察SonoVue与包裹全氟戊烷的介孔二氧化硅纳米微球在蛋清体模中的高强度聚焦超声增效作用.中国介入影像与治疗学,2014,11(2):103-106.
[6] Chen Y, Chen HR, Shi JL. Construction of homogenous/heterogeneous hollow mesoporous silica nanostructures by silica-etching chemistry: Principles, synthesis, and applications. Acc Chem Res, 2013,47(1):125-137.
[7] Puri A. Leibel and Phillips textbook of radiation oncology. 3rd ed. Int J Radiat Oncol Biol Physic, 2011,79(4):1276.
[8] Liu HL, Lin WL, Chen YY. A fast and conformal heating scheme for producing large thermal lesions using a 2D ultrasound phased array. Int J Hyperthermia, 2007,23(1):69-82.
[9] 李发琪,杜永洪,王智彪,等.HIFU体外块“切除”动物肝脏、肾脏和肌肉的剂量研究.中国超声医学杂志,2005,21(4):252-255.
[10] Zhou Y, Wang Z, Chen Y, et al. Microbubbles from gas-generating perfluorohexane nanoemulsions for targeted temperature-sensitive ultrasonography and synergistic HIFU ablation of tumors. Adv Mater, 2013,25(30):4123.
[11] 王志刚,冉海涛,郑元义,等.超声分子影像学.北京:科学出版社,2016:596-600.
[12] Wang X, Chen H, Zheng Y, et al. Au-nanoparticle coated mesoporous silica nanocapsule-based multifunctional platform for ultrasound mediated imaging, cytoclasis and tumor ablation. Biomaterials, 2013,34(8):2057-2068.
[13] 钱祖文.高强聚焦超声(HIFU)加热活体组织中的温度分布.应用声学,2010,29(4):269-272.
Permeating perfluoropentane drops-encapsulated mesoporous silica nanocapsules collaborative high-intensity focused ultrasound surface ablation of bovine liver in vitro
DINGXiaoya,ZOUJianzhong*,WANGQi,WENJing,MADazhao
(StateKeyLaboratoryofUltrasoundEngineeringinMedicineCo-FoundedbyChongqingandtheMinistryofScienceandTechnology,ChongqingKeyLaboratoryofUltrasoundinMedicalandBiomedicalEngineering,ChongqingCollaborativeInnovationCenterforMinimally-InvasiveandNoninvasiveMedicine,CollegeofBiomedicalEngineering,ChongqingMedicalUniversity,Chongqing400016,China)
Objective To discusse the influence of permeating perfluoropentane drops-encapsulated mesoporous silica nanocapsules (MSNC-PFP) on HIFU surface ablation in vitro bovine liver. Methods Fifity bovine-liver tissues were divided into 5 groups: Control group, 0.25 mg/ml group, 0.50 mg/ml group, 1.00 mg/ml group, 2.00 mg/ml group according to the concentration of MSNC-PFP. The synergistic agent was injected along the ablation line path under the guiding of ultrasound. The surface ablation model was structured by 6 coagulation necrosis side by using HIFU linear scanning, inner region without melting, and the ultrasonographic changes were observed in the melt area. The coagulation necrosis range was assessed by TTC staining, and necrosis degree was observed by HE staining. The coagulation necrosis volume was measured, the coverage index (CI), external volume index (EI), energy efficiency factor (EEF) were used to evaluate the ablation effect in each group. Results The MSNC-PFP more than 1.00 mg/ml was shown as strong echo in ultrasonic image, fade after 3—5 min. The grey value was changed in HIFU ablation area related to the concentration of MSNC-PFP. The total ablation volume of 0.50 mg/ml group, 1.00 mg/ml group, 2.00 mg/ml group were more than control group, the EEF was lower than that of the control group (allP<0.01). The CI and EI of 1.00 mg/ml group and 2.00 mg/ml group were higher than those of the other group (allP<0.01). The coagulation necrosis became complete when the concentration of MSNC-PFP above 0.50 mg/ml. Conclusion MSNC-PFP can increase the volume of coagulation necrosis, decrease the EEF and increase the efficiency of HIFU surface ablation of bovine liver in vitro.
Perfluoropentane drops-encapsulated mesoporous silica nanocapsules; High-intensity focused ultrasound ablation; In vitro; Bovine; Liver
国家自然科学基金(11574039、11274404)、国家重点基础研究发展计划(973计划)项目(2011CB707900)、国家重大科学仪器设备研制专项(2013YQ03062906)、重庆市研究生科研创新项目(CYS14106)。
丁晓亚(1991—),男,重庆人,在读硕士。研究方向:超声医学。E-mail: 569629602@qq.com
邹建中,重庆医科大学生物医学工程学院 省部共建国家重点实验室培育基地—重庆市超声医学工程重点实验室 重庆市生物医学工程学重点实验室 重庆市微无创医学协同创新中心,400016。E-mail: zoujzh@cqmu.edu.cn
2016-11-29
2017-04-20
R-332; R445.1
A
1672-8475(2017)07-0439-05
10.13929/j.1672-8475.201611033