襄阳大头菜腌制液膜醭细菌群落结构研究
2017-07-31郭壮沈馨董蕴吴竞凌霞胡事成赵慧君
郭壮,沈馨,董蕴,吴竞,凌霞,胡事成,赵慧君*
(1.湖北文理学院化学工程与食品科学学院鄂西北传统发酵食品研究所,湖北襄阳441053;2.襄阳市食品药品检验所,湖北襄阳441021;3.襄阳孔明菜有限公司,湖北襄阳441000)
襄阳大头菜腌制液膜醭细菌群落结构研究
郭壮1,沈馨1,董蕴1,吴竞2,凌霞2,胡事成3,赵慧君1*
(1.湖北文理学院化学工程与食品科学学院鄂西北传统发酵食品研究所,湖北襄阳441053;2.襄阳市食品药品检验所,湖北襄阳441021;3.襄阳孔明菜有限公司,湖北襄阳441000)
使用Miseq高通量测序技术对3个襄阳大头菜腌制液膜醭样品的细菌微生物群落结构进行了解析。在门水平上,变形菌门(Proteobacteria)和硬壁菌门(Firmicutes)平均含量分别为62.12%和34.13%。在属水平上,相对含量>1.0%的细菌属分别为盐单胞菌(Halomonas)、色盐杆菌属(Chromohalobacter)、海杆菌属(Marinobacter)、盐厌氧菌属(Halanaerobium)、四联球菌(Tetragenococcus)和碱杆菌属(Alkalibacillus),其相对含量为26.31%、16.49%、8.13%、24.87%、6.13%和1.16%。在操作分类单元水平(OTU)上,发现14个平均相对含量>1.0%的核心OTU,其中OTU4083(隶属于盐厌氧菌属)、OTU4400(隶属于色盐杆菌属)和OTU846(隶属于盐单胞菌属)的累计平均相对含量为39.50%。由此可见,襄阳大头菜膜醭中的细菌微生物主要由隶属于变形菌门和硬壁菌门的6个属构成,且膜醭共有大量的核心细菌菌群。
襄阳大头菜;膜醭;细菌;多样性
作为我国四大腌菜之一的襄阳大头菜,在长达18个月的腌制过程中,因腌制池表面常形成一层白色的膜醭,导致其品质会明显下降甚至失去经济价值,严重损害了种植户和企业的经济收益,且类似问题在泡菜[1]和葡萄酒[2]等行业中亦较为普遍。膜醭具体表现为在发酵基质的表面形成一层成片或成碎花状的白膜,其实质是一种黏附在生物或非生物材料表面由微生物群体和包裹菌体基质组成的聚合物[3]。
近年来,国内外研究人员围绕发酵食品中膜醭微生物群体的物种组成这一科学问题开展了多项卓有成效的研究。目前普遍认为发酵食品基质表面形成的膜醭是由高需氧的酵母引起的[4]。除真菌外,有学者指出细菌对膜醭的形成亦有贡献,其中枯草芽孢杆菌作为模式微生物被大量研究[5]。TRISTEZZA M等[2]研究发现,分离自葡萄酒中的乳酸菌、醋酸菌在特定的条件下均能形成膜醭。蒋云露等[6]对泡菜膜醭形成过程中膜醭和盐卤中的细菌群落构成和动态变化进行了分析,发现膜醭形成的前、中、后期细菌种类差异较大,前期以革兰氏阳性为主,后期以革兰氏阴性为主。何鹏辉等[7]对泡菜膜醭中细菌进行了分离,研究发现枯草芽胞杆菌(Bacillus subtilis)、弗罗因德(氏)枸橼酸杆菌(Citrobacter freundii)、科氏葡萄球菌科氏亚种(Staphylococcus cohniisubsp.cohnii)、居幼虫普罗威登斯菌(Providencia vermicola)、克雷伯氏菌(Klebsiellasp.)和阴沟肠杆菌(Enterobacter cloacae)等均与膜醭的形成有关。敖晓琳等[8]亦从泡菜水中分离了导致膜醭形成的微生物,其中3株细菌被鉴定为枯草芽胞杆菌(Bacillus subtilis)、1株被鉴定为高地芽孢杆菌(Bacillus altitudinis)。上述研究的开展为明确是何种微生物导致了襄阳大头菜腌制过程中膜醭的形成提供了借鉴。但上述研究多数以纯培养技术为主要研究手段,且在选择分离培养基时存在一定的随意性,因而在研究膜醭中微生物群体的物种组成方面显示出较大的片面性和局限性。
本实验以表面长膜醭的大头菜腌制液为研究对象,采用Miseq高通量测序技术,以细菌16S rRNA为测序靶点,结合生物信息学手段对膜醭的细菌群落结构进行了揭示,以期为后续采取有效措施杜绝大头菜腌制过程中膜醭的形成提供借鉴。
1 材料与方法
1.1 材料与试剂
样品(长膜醭的大头菜腌制液和膜醭):湖北省襄阳孔明菜有限公司。
脱氧核糖核苷酸(deoxy-ribonucleoside triphosphate,dNTP)Mix、5×TransStartTM、FastPfu Buffer和FastPfu Fly DNA Polymerase:北京全式金生物技术有限公司;QIAGEN DNeasy mericon Food Kit:德国QIAGEN公司。
1.2 仪器与设备
Miseq高通量测序平台:美国Illumina公司;2100芯片生物分析仪:美国Agilent公司;5810R台式高速冷冻离心机:德国Eppendorf公司;ND-2000C微量紫外分光光度计:美国NanoDrop公司;DYY-12电泳仪:北京六一仪器厂;Vetiri梯度基因扩增仪:美国AB公司;UVPCDS8000凝胶成像分析系统:美国BIO-RAD公司。
1.3 试验方法
1.3.1 样品的采集
从腌制缸中采集长膜醭的大头菜腌制液和膜醭,使用组织捣碎机将其搅拌均匀后装入无菌采样管中,冷链运送回实验室并进行脱氧核糖核酸(deoxyribonucleic acid,DNA)提取。
1.3.2 DNA提取
使用QIAGEN DNeasy mericon Food Kit试剂盒按照说明书步骤对样品宏基因组DNA进行提取,从浓度和纯度对DNA质量进行检测,符合要求的DNA保存在-20℃条件下备用。
1.3.3 细菌16S rRNA扩增
聚合酶链式反应(polymerase chain reaction,PCR)扩增体系为:4 μL 5×PCR缓冲液,2 μL 2.5 mmol/L dNTPs Mix,0.8μL5μmol/L正向引物,0.8μL5μmol/L反向引物,0.4μL 5 U/μL DNA聚合酶,10 ng DNA模板,体系用ddH2O补充至20μL。细菌16SrRNA正向引物为338F(5'-ACTCCTACGG GAGGCAGCA-3'),反向引物为806R(5'-GGACTACHVG GGTWTCTAAT-3'),在正向引物中加入7个核苷酸标签(barcode)
扩增条件为:95℃预变性3 min;95℃变性30 s,55℃退火30s,72℃延伸45 s,30个循环;72℃延伸10 min。
1.3.4 样品平衡及Miseq高通量测序
经1%琼脂糖凝胶电泳检验合格的扩增产物稀释至100 nmol/L,混合均匀后寄往上海美吉生物医药科技有限公司,使用Miseq平台进行高通量测序。
1.3.5 序列的拼接及质控
首先根据成对序列之间的重叠关系,将双端序列数据拼接成一条序列,继而根据barcode将所有序列划分到各个样品并对序列方向进行校正,最后切掉序列barcode和引物。在拼接过程中,若重叠区的碱基数<10 bp或最大错配比率>0.2,barcode碱基错配或引物碱基错配数>2 bp,或切掉barcode和引物后碱基数<50 bp则将序列予以剔除。
1.3.6 生物信息学分析
质控后的序列使用QIIME(v1.7.0)分析平台[9]进行物种和多样性分析,主要的处理流程为:
①使用PyNAST[10]校准排齐序列,在序列100%相似性下进行UCLUST[11]归并,建立无重复的16S rRNA全长序列集;
②在序列97%相似度下进行操作分类单元(operational taxonomic units,OTU)划分;
③对OTU代表性序列进行同源性比对,整合RDP(ribosomaldatabase project,Release 11.5)[12]和Greengenes(Release 13.8)[13]两个数据库的比对结果,确定每个OTU最终的分类学地位;
④使用FastTree软件[14]绘制基于OTU代表性序列的系统发育进化树,随后计算样品的α多样性。
1.3.7 核酸登录号
本研究中所有序列数据已提交至MG-RAST数据库,ID号为mgp79756。
2 结果与分析
2.1 序列丰富度和多样性分析
3个腌制液膜醭样品16S rRNA测序情况及各分类地位数量如表1所示。
由表1可知,通过Miseq高通量测序,本研究采集的3个样品共产生了105 382条高质量16S rRNA序列,平均每个样品产生35 127条。经过100%序列鉴定聚类分析后,本研究共得到48 025条代表性序列,根据序列的97%相似性进行操作分类单元划分后,共得到6 016个OTU,每个样品平均2 566个OTU。以测序量为自变量,以发现物种数和香农多样性指数为因变量,使用Origin8.6软件(OriginLab,MA,USA)进行稀疏曲线和香农多样性指数曲线绘制,其结果如图1所示。
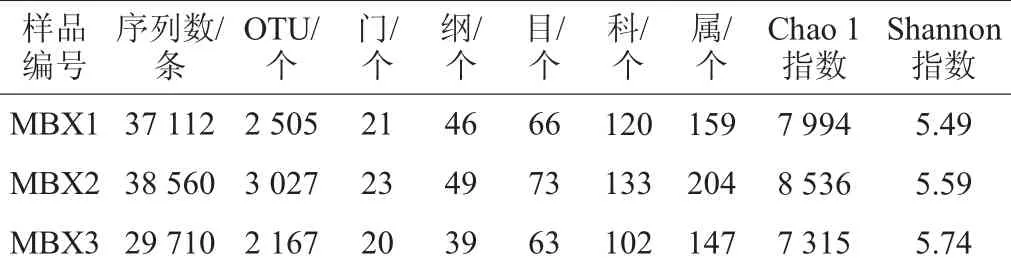
表1 样品16S rRNA测序情况及各分类地位数量Table 1 16S rRNA sequencing conditions and classifications at different taxonomical levels
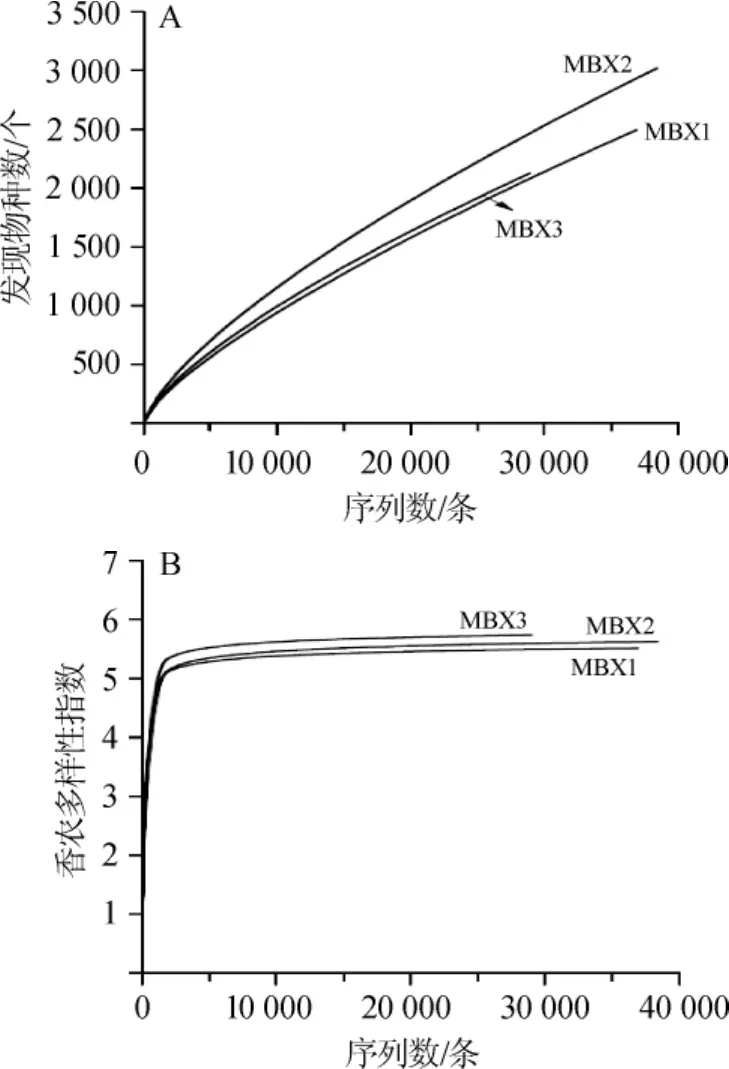
图1 稀疏性曲线(A)和香农多样性指数(B)Fig.1 Rarefaction curve(A)and Shannon diversity index(B)
由图1(A)可知,随着测序深度的增加,发现物种的数量继续增加且没有达到平衡状态,说明随着测序量的增加可能会有新的种系型被发现。由图1(B)可知,随着测序深度的增加,香农多样性指数曲线已基本达到平衡状态,说明在此测序水平下,样品中细菌的多样性已能充分展现。由此可见,本研究产出的序列已经能全面捕获样品中细菌微生物的多样性,因而是满足后续分子生物学分析的。
2.2 基于不同分类地位核心菌群相对含量的分析
本研究使用SILVA数据库对OTU代表性序列进行了同源性比对,所有的序列鉴定为24个门,57个纲,81个目,153个科和268个属,其中有13.25%的序列不能鉴定到属水平。3个大头菜膜醭样品中平均相对含量>1.0%的细菌门分别为变形菌门(Proteobacteria)、硬壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),其相对含量分别为62.12%、34.13%和1.12%。如果某一细菌属在3个样品中的平均相对含量>1.0%,则将其定义为优势细菌属。襄阳大头菜腌制液膜醭中优势细菌属相对含量的比较分析如图2所示。
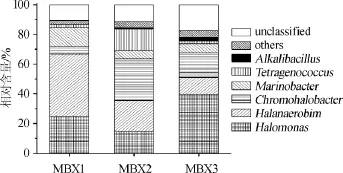
图2 襄阳大头菜腌制液膜醭中优势细菌属相对含量的比较分析Fig.2 Comparative analysis on the relative content of the dominant bacterial genera in biomembrane of Xiangyang mustard root brine
由图2可知,3个大头菜腌制液膜醭样品中优势细菌属分别为隶属于变形菌门(Proteobacteria)的盐单胞菌属(Halomonas)、色盐杆菌属(Chromohalobacter)和海杆菌属(Marinobacter),其相对含量为26.31%、16.49%和8.13%;隶属于硬壁菌门(Firmicutes)的盐厌氧菌属(Halanaerobium)、四联球菌属(Tetragenococcus)和碱杆菌属(Alkalibacillus),其相对含量为24.87%、6.13%和1.16%。由此可见,襄阳大头菜腌制液膜醭中的细菌主要由隶属于变形菌门和硬壁菌门的6个属构成,其累计相对含量为83.10%。张奶英等[15]指出盐单胞菌属(Halomonas)为叶用芥菜腌制过程中的主要优势菌,且色盐杆菌属(Chromohalobacter)在整个腌制过程中均有检出;尹礼国等[16]指出海杆菌属(Marinobacter)为盐渍青菜发酵初期的优势菌;有学者指出盐单胞菌属(Halomonas)、色盐杆菌属(Chromohalobacter)和海杆菌属(Marinobacter)为四川泡菜中的优势菌[17],上述研究结论与本研究相同。除此之外,盐厌氧菌属(Halanaerobium)具有嗜盐和产氢的特性[18],常用于含盐废水的厌氧处理[19]。四联球菌属(Tetragenococcus)隶属于肠球菌科(Enterococcaceae),是一种中度嗜盐的乳酸菌,多分布于酱类制品中[20]。作为一种中度嗜盐嗜碱菌,碱杆菌属(Alkalibacillus)常分布于高盐度的土壤中[21]。
如果某一个菌属在3个样品中均存在,则本研究将其定义为核心菌属。本研究共发现87个核心细菌属,且上述6个相对含量>1.0%的细菌属均为核心属,襄阳大头菜腌制液膜醭中相对含量>1.0%的核心细菌属相关性如图3所示。
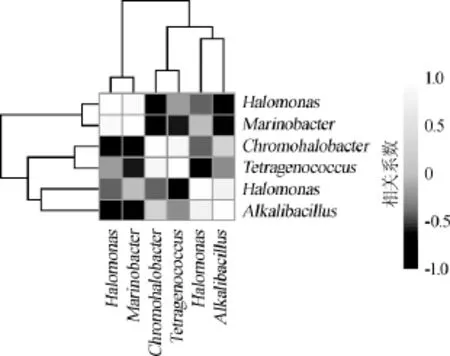
图3 平均相对含量>1.0%的核心细菌属相关性Fig.3 Correlation among the core bacterial genera with relative abundance of more than 1.0%
由图3可知,6个相对含量>1.0%的细菌属之间相关性均不显著(P>0.05)。进一步统计了OTU在3个样品中出现的次数,其结果如图4所示。
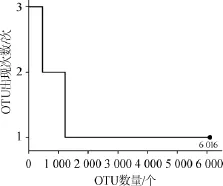
图4OTU在襄阳大头菜腌制液膜醭样品中出现次数统计Fig.4 Occurrence frequency of OTU as a function of their prevalence in biomembrane of Xiangyang mustard root brine
由图4可知,3个襄阳大头菜腌制液膜醭样品共产生6 016个细菌OTU,其中在3个样品中仅出现1次和2次的OUT为4794和761个,占OTU总数的79.69%和12.65%,所包含序列数为6280条和5903条,占所有质控后合格序列数的5.96%和5.60%。采用VENNY2.1在线软件(http://bioinfogp. cnb.csic.es/tools/venny/index.html),基于OTU水平进行Venn图绘制,其结果如图5所示。
由图5可知,3个襄阳大头菜膜醭样品中共发现461个细菌的核心OTU,仅占OTU总数的7.66%,但其包含93 199条序列,占所有质控后合格序列数的88.44%。此外,由上述分析可知,4 794个仅出现1次的OTU,其包含6 280条序列,平均每个OTU仅有1.31条序列,本研究共产生105 382条高质量16S rRNA序列,则每个仅出现1次的OTU其包含序列数占总序列数的0.001 2%,由此可见,虽然有的样品中含有一些较为独特的OTU,但其相对含量较低,因而大头菜腌制液膜醭样品共有大量的核心细菌菌群。本研究发现的461个核心OTU中相对含量>1.0%的OTU在3个样品中相对含量如图6所示。
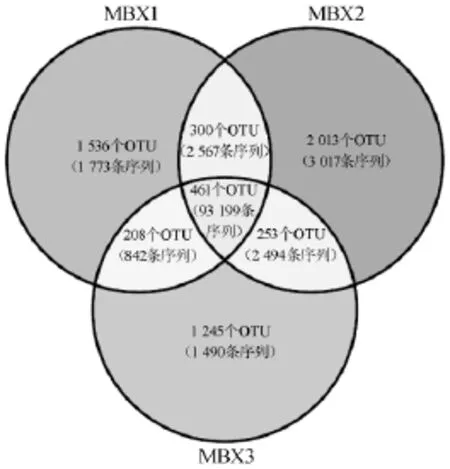
图5 基于OTU水平的Venn图Fig.5 Venn diagram based on OTU level
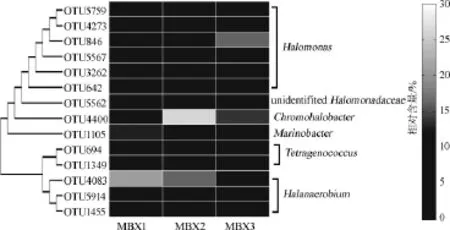
图6 相对含量>1.0%的核心OTU在各襄阳大头菜腌制液膜醭样品中相对含量Fig.6 The relative contents of core OTU with relative abundance of more than 1.0%in biomembrane of Xiangyang mustard root brine
由图6可知,14个核心OTU中,6个隶属于盐单胞菌属(Halomonas)、3个隶属于盐单胞菌属(Halanaerobium)、2个隶属于四联球菌属(Tetragenococcus)、各有1个隶属于海杆菌属(Marinobacter)和色盐杆菌属(Chromohalobacter),1个OTU仅能鉴定到盐单胞菌科(Halomonadaceae)。值得一提的是,在3个样品中平均含量最高的3个核心OTU分别为OTU4083(隶属于盐单胞菌属)、OTU4400(隶属于色盐杆菌属)和OTU846(隶属于盐单胞菌属),其平均含量分别为15.61%、14.58%和9.31%。值得一提的是,核心OTU4083、OTU4400和OTU846在样品MBX1、MBX2和MBX3中的累计相对含量分别为33.13%、45.60%和39.76%,这也进一步证实了襄阳大头菜腌制液膜醭样品共有大量的核心细菌菌群,3个核心OTU的相对含量就占到了细菌类群的1/3左右。本研究进一步对平均相对含量>1.0%的核心OTU之间的相关性进行了分析,其结果如图7所示。
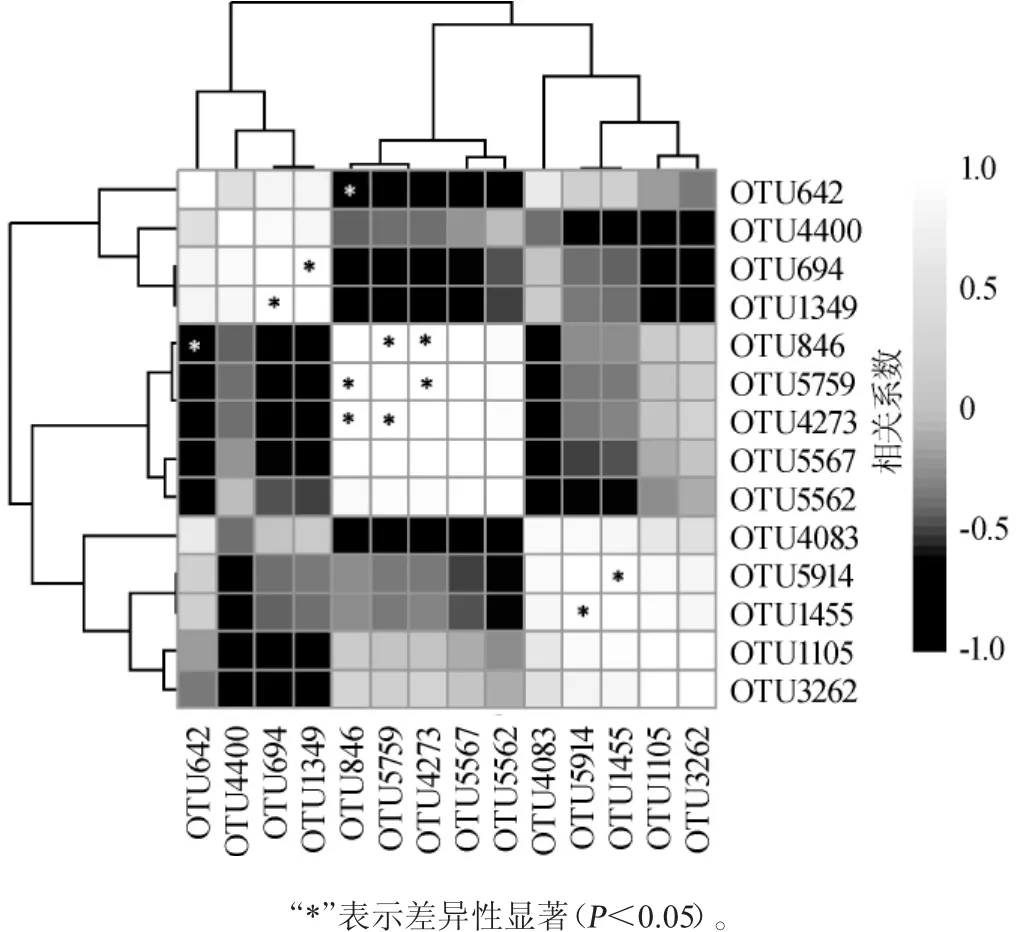
图7 平均相对含量>1.0%的核心OTU相关性Fig.7 Correlation among the core OTU with relative abundance more than 1.0%
由图7可知,OTU846(隶属于盐单胞菌属)与OTU5759(隶属于盐单胞菌属)和OTU4273(隶属于盐单胞菌属)均呈显著正相关(P<0.05),相关系数分别为0.997和0.998,而与OTU642(Halomonas)呈显著负相关(P<0.05),相关系数为-0.999;OTU5759(隶属于盐单胞菌属)与OTU4273(隶属于盐单胞菌属)、OTU694(隶属于四联球菌属)与OTU1349(隶属于四联球菌属)、OTU5914(隶属于盐单胞菌属)与OTU1455(隶属于盐单胞菌属)均呈现显著正相关(P<0.05),相关系数分别为1.000、0.999和1.000。
3 结论
本研究采用宏基因组学策略,使用Miseq高通量测序技术,以细菌16S rRNA为测序靶点,对表面长膜醭的襄阳大头菜腌制液中细菌微生物的多样性进行了揭示。结果发现,襄阳大头菜膜醭中的细菌微生物主要由隶属于变形菌门和硬壁菌门的盐单胞菌属、色盐杆菌属、海杆菌属、盐厌氧菌属、四联球菌属和碱杆菌属的6个细菌属组成,且大头菜腌制液膜醭共有大量的核心细菌菌群。通过本研究的开展,可为因形成膜醭而导致襄阳大头菜产品品质下降这一产业化问题的解决提供理论依据,同时亦可为泡菜和葡萄酒等发酵食品发酵过程中膜醭形成的研究提供参考。
[1]韩珍琼,刘金成,程道梅.泡菜悬浮膜的特性研究及防治措施初探[J].食品工业科技,2011,32(8):232-235.
[2]TRISTEZZA M,LOURENCO A,BARATA A,et al.Susceptibility of wine spoilage yeasts and bacteria in the planktonic state and in biofilms to disinfectants[J].Ann Microbiol,2010,60(3):549-556.
[3]DRESCHER K,NADELL C D,STONE H A,et al.Solutions to the public goods dilemma in bacterial biofilms[J].Curr Biol,2014,24(1):50-55.
[4]VOLLEKOVA A,MALIK F,VOLLEK V,et al.Characterization of yeasts isolated from red wine surface film[J].Folia microbial,1996,41 (4):347-352.
[5]HÖLSCHER T,BARTELS B,LIN Y C,et al.Motility,chemotaxis and aerotaxis contribute to competitiveness during bacterial pellicle biofilm development[J].J Mole Biol,2015,427(23):3695-3708.
[6]蒋云露,杨建涛,何鹏晖,等.传统泡菜腐败过程中膜醭和盐卤的微生物区系分析[J].食品安全质量检测学报,2016,7(1):305-313.
[7]何鹏辉,钱杨,王猛,等.腐败发酵蔬菜中产膜璞细菌的分离鉴定及其生长特性分析[J].食品科学,2017,38(1):1-10.
[8]敖晓琳,蔡义民,夏姣,等.引起泡菜“生花”腐败微生物的分离鉴定[J].食品科学,2013,34(21):204-208.
[9]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nat Meth, 2010,7(5):335-336.
[10]CAPORASO J G,BITTINGER K,BUSHMAN F D,et al.PyNAST:a flexible tool for aligning sequences to a template alignment[J].Bioinformatics,2010,26(2):266-267.
[11]EDGAR R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460-2461.
[12]COLE J R,CHAI B,FARRIS R J,et al.The ribosomal database project (RDP-II):introducing myRDP space and quality controlled public data [J].Nucl Acid Res,2007,35(1):169-172.
[13]DESANTIS T Z,HUGENHOLTZ P,LARSEN N,et al.Greengenes,a chimera-checked 16S rRNA gene database and workbench compatible with ARB[J].Appl Environ Microbial,2006,72(7):5069-5072.
[14]PRICE M N,DEHAL P S,ARKIN A P.Fasttree:computing large minimum evolution trees with profiles instead of a distance matrix[J].Mol Biol Evol,2009,26(7):1641-1650.
[15]张奶英,刘书亮,罗松明,等.叶用芥菜盐渍过程中微生物群落分析[J].食品工业科技,2014,35(13):147-151.
[16]尹礼国,马双艳,李华兰,等.盐渍青菜的细菌菌群结构DGGE分析及产酸细菌分离鉴定[J].食品与发酵工业,2015,41(2):18-23.
[17]佟婷婷.四川泡菜细菌多样性分析及降生物胺菌株筛选[D].无锡:江南大学,2015.
[18]BROWN S D,BEGEMANN M B,MORMILE M R,et al.Complete genome sequence of the haloalkaliphilic,hydrogen-producing bacteriumHalanaerobium hydrogeniformans[J].J Bacteriol,2011,193(14): 3682-3683.
[19]KAPDAN I K,ERTEN B.Anaerobic treatment of saline wastewater by Halanaerobium lacusrosei[J].Process Biochem,2007,42(3):449-453.
[20]SATOMI M,KIMURA B,MIZOI M,et al.Tetragenococcus muriaticus sp.nov.,a new moderately halophilic lactic acid bacterium isolated from fermented squid liver sauce[J].Int J Syst Evol Microb,1997,47(3): 832-836.
[21]TIAN X P,DASTAGER S G,LEE J C,et al.Alkalibacillus halophilus sp.nov.,a new halophilic species isolated from hypersaline soil in Xin-Jiang province,China[J].Syst Appl Microbiol,2007,30(4):268-272.
Diversity of bacterial microflora of biomembrane in Xiangyang mustard root brine
GUO Zhuang1,SHEN Xin1,DONG Yun1,WU Jing2,LING Xia2,HU Shicheng3,ZHAO Huijun1*
(1.Northwest Hubei Research Institute of Traditional Fermented Food,College of Chemical Engineering and Food Science,Hubei University of Arts and Science,Xiangyang 441053,China;2.Xiangyang Institute of Food and Drug Supervision,Xiangyang 441053,China; 3.Xiangyang Kongming Mustard Root Co.,Ltd.,Xiangyang 441000,China)
Three biomembrane samples of Xiangyang mustard root brine were collected and the bacterial microbiota community structure was studied by Miseq high throughput sequencing technology.Results showed that at phyla level,Proteobacteria and Firmicutes were the most dominant,with the relative abundance of 62.12%and 34.13%,respectively.At Genus level,the genus with relative content more than 1.0%wereHalomonas,Chromohalobacter,Marinobacter,Halanaerobium,Tetragenococcus,andAlkalibacillus,with the relative abundance of 26.31%,16.49%,8.13%,24.87%, 6.13%,and 1.16%,respectively.At the operational taxonomic unit(OTU)level,results showed that 14 OTUs were with the relative abundance of more than 1.0%,and the cumulative average relative contents of OTU4083(member ofHalanaerobium),OTU4400(member ofChromohalobacter),and OTU846(member ofHalomonas)was39.50%.The results indicated that the bacterial microbiota of biomembrane in Xiangyang mustard root brine was mainlyconsisted by6 genera,includingProteobacteria and Firmicutes,and biomembrane samplesshared a large number ofcore bacterialmicrobiome. Key words:Xiangyang mustard root;biomembrane;bacterium;diversity
TS264.2
0254-5071(2017)07-0143-05
10.11882/j.issn.0254-5071.2017.07.031
2017-04-03
湖北省食品药品监督管理局科研项目(201601025);襄阳市科技计划研究与开发项目(2016);湖北文理学院食品新型工业化学科群建设项目(2017)
郭壮(1984-),男,副教授,博士,研究方向为食品生物技术。
*通讯作者:赵慧君(1979-),女,讲师,博士,研究方向为食品生物技术。
