乌芪舒筋通络片微生物限度检查方法学研究
2017-07-29陈震尧谢锴标姚伟生
陈震尧+谢锴标+姚伟生
[摘要]目的 建立乌芪舒筋通络片的微生物限度检查方法。方法 根据《中国药典》2015年版第四部“1105、1106、1107”对乌芪舒筋通络片进行微生物限度检查方法学研究。结果 需氧菌总数采用平皿稀释法和薄膜过滤法、霉菌和酵母菌总数采用平皿常规法,回收率均在0.5~2,控制菌采用直接接种法可以检查出大肠埃希菌、沙门菌、耐胆盐革兰阴性菌。结论 需氧菌总数选取平皿稀释法、霉菌和酵母菌总数选取平皿常规法、控制菌选取直接接种法检测,方法可行,操作更简便,适用于乌芪舒筋通络片的微生物限度检查。
[关键词]乌芪舒筋通络片;微生物限度;方法学研究;《中国药典》2015年版
[中图分类号] R286 [文献标识码] A [文章编号] 1674-4721(2017)06(c)-0093-04
[Abstract]Objective To establish a microbial limit test method of Wuqi Shujin Tongluo tablets.Methods Methodology research on microbial limit test of Wuqi Shujin Tongluo tablets was conducted according to the "1105,1106,1107" of Chinese Pharmacopoeia 2015 edition with the fourth part.Results The total number of aerobic bacteria could be tested by plate dilution method and membrane filtration method,the total number of fungus and yeasts could be tested by the plate routine method,and the recovery was between 0.5 and 2,Escherichia coli,Salmonella,Bile salt resistant Gram-negative bacteria could be detected through control bacteria by direct inoculation method.Conclusion The total number of aerobic bacteria can be tested by plate dilution method,the total number of fungus and yeasts can be tested by plate routine method,and the control bacteria can be tested by direct inoculation method,the methods used are feasible,and easier to operate,which are suitable for the microbial limit test of Wuqi Shujin Tongluo tablets.
[Key words]Wuqi Shujin Tongluo Tablets;Microbial limit;Methodology research;Chinese Pharmacopoeia 2015 edition
烏芪舒筋通络片是根据我院省名中医验方制成的纯中药制剂,具有补肝肾,通络止痛的作用,由细辛、制川乌、制草乌、桂枝、牛大力、防己、黑老虎、蜈蚣、走马胎、羚羊角骨、牛膝、黄芪、杜仲、续断、甘草等药味组成[1]。该制剂微生物限度检查法原按《中国药典》2010年版进行方法学验证[2],随着《中国药典》2015年版的实施,新版微生物限度检查方法变化很大,必须重新进行验证。为此,本研究按《中国药典》2015 年版四部“1105、1106、1107”项下方法[3],对该制剂的微生物限度检查方法进行了再次验证研究,制订了新的切实可行的微生物限度检查法,替代了旧标准,并应用于该制剂的日常检验,使该制剂的微生物限度检查法提升到新版《中国药典》的水平。
1 仪器与试药
1.1 仪器
SZX型超净工作台(上海沪南科学仪器联营厂);BHC-1300ⅡA/B3型生物洁净安全柜(苏州净化设备有限公司);YXQWF32-500卧式榘形压力蒸气消毒器(湖南衡阳医疗器械厂);LRH-250A生化培养箱(韶关市泰宏医疗器械有限公司);MJ-160B-Ⅱ霉菌培养箱(上海跃进医疗器械厂);CX31生物显微镜(奥林巴斯);HTY HOMO761匀浆仪(浙江泰林生物技术股份有限公司);JA2003N电子天平(上海精密科学仪器有限公司);JC101型电热鼓风干燥箱(上海成顺仪器仪表有限公司、南通嘉程仪器有限公司合作出品)。
1.2 样品
乌芪舒筋通络片(肇庆市中医院,批号:15050401;15051102;15052401)。
1.3 菌种
实验所用的菌株传代次数不得超过5代[4],并采用适宜的保藏方法保存,确保试验菌株的生物学特性。
金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003]、枯草芽孢杆菌(Bacillus subtilis) [CMCC(B)63501]、铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B)10104]、白色念珠菌(Candida albicans)[CMCC(F)98001]、黑曲霉(Aspergillus niger) [CMCC(F)98003]、大肠埃希菌(Escherichia coli)[CMCC(B)44102]、乙型副伤寒沙门菌(Salmonella paratyphi B)[CMCC(B)50094]。以上菌种均来自于中国食品药品检定研究院。
1.4 培养基
胰酪大豆胨琼脂培养基(批号:3105210)、沙氏葡萄糖琼脂培养基(批号:3105120)、胰酪大豆胨液体培养基(批号:3105305)、沙氏葡萄糖液体培养基(批号:3105054)、麦康凯液体培养基(批号:3105291)、麦康凯琼脂培养基(批号:3105138)、RV沙门增菌液体培养基(批号:3104847)、木糖赖氨酸脱氧胆酸盐琼脂培养基(批号:3104852)、三铁塘琼脂培养基(批号:3105052)、肠道菌增菌液体培养基(批号:3105093)、紫红胆盐葡萄糖琼脂培养基(批号:3104750),均由广东环凯微生物科技有限公司生产,使用前先进行培养基的适用性检查,并且在有效期内使用,培养基的制备按照标示方法进行。
1.5稀释液、冲洗液
pH7.0氯化钠-蛋白胨缓冲液(广东环凯微生物科技有限公司,批号:3105256)、胰酪大豆胨液体培养基(批号:3105305)、0.9%无菌氯化钠溶液(自制)。
2 方法与结果
参照《中国药典》2015年版四部“1105、1106、1107”微生物限度检查法[3]进行验证。
2.1 菌液制备
2.1.1 金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌
取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌的新鲜培养物分别接种至100 ml胰酪大豆胨液体培养基中,30~35℃培养18~24 h;分别取各培养物 1 ml,加 0.9%无菌氯化钠溶液9 ml,按10 倍递增稀释级数制成每毫升含菌数为<100 cfu 的菌悬液[4]。
2.1.2 白色念珠菌
取白色念珠菌的新鲜培养物接种至100 ml沙氏葡萄糖液体培养基中,20~25℃培养2~3 d,取培养物 1 ml,加 0.9%无菌氯化钠溶液9 ml,按10 倍递增稀释级数制备成每毫升含菌数<100 cfu 的菌悬液[4]。
2.1.3黑曲霉
取黑曲霉新鲜培养物接种至沙氏葡萄糖琼脂培养基中,20~25℃培养5~7 d,加入3~5 ml含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液,洗脱孢子。再选用适宜的方法将孢子悬液吸至无菌试管内,用含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液制备成每毫升含菌数<100 cfu 的孢子悬液[4]。
2.2 供试液的制备
取供试品10 g,加胰酪大豆胨液体培养基至100 ml,用匀浆仪打碎,混匀,作为1∶10的供试液。量取1∶10的供试液10 ml,加胰酪大豆胨液体培养基稀释至100 ml,混匀,作1∶100的供试液。
2.3 微生物计数方法适用性试验
2.3.1 平皿常规法
2.3.1.1 试验组 需氧菌总数计数:取1∶10的供试液5份,每份100 ml,分別加入金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉试验菌液适量,振摇均匀,使每毫升供试液含菌量≤100 cfu。取1 ml注入平皿中,平行制备2份,立刻倾注胰酪大豆胨琼脂培养基,凝固,30~35℃中培养≤3 d,计数。
霉菌和酵母菌总数计数:取1∶10的供试液2份,每份100 ml,分别加入白色念珠菌、黑曲霉试验菌液适量,振摇均匀,使每毫升供试液含菌量≤100 cfu。取1 ml注入平皿中,平行制备2份,立刻倾注沙氏葡萄糖琼脂培养基,凝固,20~25℃中培养≤5 d,计数。
2.3.1.2 供试品对照组 取1∶10的供试液,以pH7.0氯化钠-蛋白胨缓冲液代替菌液,同试验组操作。
2.3.1.3 菌液对照组 取胰酪大豆胨液体培养基代替1∶10的供试液,按试验组项下方法操作,加入试验菌液并进行微生物回收试验。
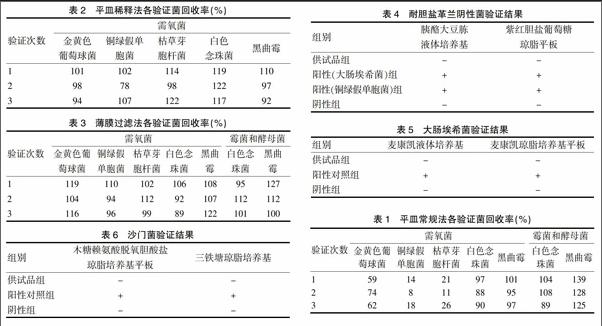
2.3.1.4 计算 各菌株的回收率(R)=(试验组的平均菌落数-供试品对照组的平均菌落数)/菌液组的平均菌落数×100%[5-6],依据《中国药典》2015年版四部规定,比值R应为0.5≤R≤2[7-9](表1)。
2.3.2 平皿稀释法
2.3.2.1 试验组 需氧菌总数计数:取1∶100的供试液5份,每份100 ml,按“2.3.1.1”项下方法操作。
霉菌和酵母菌总数计数:采用平皿常规法R为0.5~2,所以不再进行稀释法研究。
2.3.2.2 供试品对照组 取1∶100的供试液,以pH7.0氯化钠-蛋白胨缓冲液代替菌液同试验组操作。
2.3.2.3 菌液对照组 取胰酪大豆胨液体培养基代替1∶100的供试液,按试验组项下操作方法加入试验菌液并进行微生物回收试验。
2.3.2.4 计算 按“2.3.1.4”项下公式计算,结果见表2。
2.3.3 薄膜过滤法
2.3.3.1试验组 取1∶10供试液10 ml,滤过,取pH7.0氯化钠-蛋白胨缓冲液200 ml,分2次冲洗滤膜,在第2次冲洗中加入相应的菌液适量(含菌量≤100 cfu),滤过,取出滤膜,需氧菌检查将膜贴于胰酪大豆胨琼脂培养基中,在30~35℃下培养,≤3 d,霉菌和酵母菌检查将膜贴于沙氏葡萄糖琼脂培养基中,在20~25℃下培养≤3 d。
2.3.3.2 供试品对照组 取1∶10供试液10 ml,以pH7.0氯化钠-蛋白胨缓冲液代替菌液同试验组操作。
2.3.3.3 菌液对照组 取胰酪大豆胨液体培养基代替1∶10的供试液,按试验组项下操作方法加入试验菌液,同时进行微生物回收试验。
2.3.3.4 计算 按“2.3.1.4”项下公式计算,结果见表3。
由表1~3可知,乌芪舒筋通络片需氧菌总数计数检查采用平皿稀释法、薄膜过滤法,霉菌和酵母菌计数检查采用平皿常规法、薄膜过滤法,R均在0.5~2内,符合《中国药典》2015年版四部微生物学限度检查验证的要求。考虑到实际操作中,平皿常规法、平皿稀释法操作简便,优于操作繁琐的薄膜过滤法,故需氧菌总数计数法可选用培养基稀释法,霉菌和酵母菌总数计数检查选用平皿常规法为最佳方法。
2.4 控制菌适用性试验
2.4.1耐胆盐革兰阴性菌检查验证试验
取1∶10供试液适量,混匀,20~25℃培养2 h,作为预培养供试品。取预培养供试品3份,每份10 ml,分别加入10 ml肠道菌增菌液体培养基,第1份加入1 ml缓冲液作为供试品组,第2份加入1 ml大肠埃希菌(含菌量≤100 cfu/ml)作大肠埃希菌阳性对照组,第3份加入1 ml铜绿假单胞菌(含菌量≤100 cfu/ml)作为铜绿假单胞菌阳性对照组。另取胰酪大豆胨液体培养基10 ml,加入10 ml肠道菌增菌液体培养基及1 ml缓冲液,作为阴性对照组。于30~35℃培养24~48 h,划线接种到紫红胆盐葡萄糖琼脂培养基的平板上,30~35℃下培养18~24 h,观察菌落形态,结果见表4。
2.4.2大肠埃希菌检查验证试验
取1∶10供试液2份,每份10 ml,分别加入到100 ml胰酪大豆胨液体培养基中,第1份加入1 ml缓冲液,混匀,作为供试品组,第2份加入1 ml大肠埃希菌(含菌量≤100 cfu/ml),混匀,作阳性对照组;另取胰酪大豆胨液体培养基110 ml,加入1 ml缓冲液,作为阴性对照组,均于30~35℃中培养18~24 h。
取以上培养物1 ml加入到100 ml麦康凯液体培养基中,在42~44℃下培养24~48 h。然后划线接种于麦康凯琼脂平板上,在30~35℃下培养18~72 h,观察菌落形态,结果见表5。
2.4.3沙门菌检查验证试验
取1∶10供试液2份,每份100 ml,第1份加入1 ml缓冲液,混匀,作为供试品组,第2份加入1 ml沙门菌(含菌量≤100 cfu/ml),混匀,作阳性对照组。另取胰酪大豆胨液体培养基100 ml,加入1 ml缓冲液,作为阴性对照组,在30~35℃下培養18~24 h。然后分别取培养物0.1 ml,接种至10 ml RV沙门增菌液体培养基中,在30~35℃下培养18~24 h,取少量RV沙门增菌液体培养物,划线接种于木糖赖氨酸脱氧胆酸盐琼脂的培养基上,在30~35℃下培养18~48 h,用接种针挑选疑似菌落,进行斜面和高层穿刺接种于三糖铁琼脂培养基上,于30~35℃中培养18~24 h,观察菌落形态,结果见表6。
由表4~6可知,控制菌检查采用直接接种法,即可达到要求。
3讨论
2015年版与2010年版《中国药典》相比[10-11],微生物计数法适用性试验,从对细菌总数作方法适用性检查,变成对需氧菌总数作方法适用性试验,试验菌株3种变为5种;培养基由胰酪大豆胨琼脂替代营养琼脂,用于检查需氧菌,沙氏葡萄糖琼脂培养基代替玫瑰红钠培养基,用于检查霉菌与酵母菌,虽然增加了试验的工作量,但却具有良好的广谱性,提高检出率,方法更灵敏[12]。对控制菌的检查,新版删除了大肠菌群的检查,新增了耐胆盐革兰阴性菌的检查[13],对含有药材粉末的固体口服给药制剂都必须检查沙门菌,提高了对致病菌控制的要求。
乌芪舒筋通络片处方药味中多种成分含有抗菌活性[14-15],由实验可知,对需氧菌具有抑制作用,故需氧菌总数计数检查时采用常规平皿法回收率较低,需选用平皿稀释法或薄膜过滤法。
在实际工作中,匀浆仪打碎样品时,经常出现泡沫,往往对验证结果造成影响,待泡沫消除后再加入菌种,基本能消除由操作引起的影响。
[参考文献]
[1]陈震尧,陈金英,姚伟生,等.乌芪舒筋通络片乌头碱限量检测方法研究[J].中国药房,2015,26(36):5144-5146.
[2]国家药典委员会.中国药典[M].一部.北京:中国医药科技出版社,2010:附录79-88.
[3]国家药典委员会.中国药典[M].四部.北京:中国医药科技出版社,2015:140-151.
[4]刘广文,苑艳飞.养肝解毒丸微生物限度检查法的验证实验[J].中国医药科学,2016,6(13):54-57.
[5]文玉辉,韩珍珍.11种医院制剂微生物限度检查方法验证[J].临床医药实践,2015,24(10):763-765.
[6]柴海毅.浅析微生物计数方法的回收率[J].医药工程设计,2013,34(1):30-31.
[7]陈志禹,夏佳,席时东.八珍丸的中国药典2015年版微生物学检查结果分析与评价[J].药物分析杂志,2016,36(3):418-425.
[8]陈志禹,夏佳,席时东.八珍颗粒《中国药典》2015年版微生物限度检查法的建立及检验结果分析[J].中国卫生检验杂志,2015,25(23):4051-4055.
[9]陈志禹,席时东.中国药典2015年版八珍胶囊和八珍片微生物限度检查与探讨[J].中国现代应用药学,2016,33(5):628-634.
[10]李趣嫦,江艳芳.《中国药典》2010版与2015版微生物限度检查法对四种药物检测结果的比较[J].中国药品标准,2015,16(2):86-90.
[11]景荣先,张国林.2015年版《中国药典》微生物限度检查法洁净环境及计数培养基修订分析探讨[J].中国卫生产业,2015,12(5):184-185.
[12]王洪家.解毒散结颗粒《中国药典》2015年版微生物限度检查方法学验证[J].天津药学,2016,28(4):17-19.
[13]杨晓莉,李辉,马英英,等.《中国药典》2015年版非无菌产品微生物限度检查:控制菌检查法解读与对策[J].中国药师,2016,19(4):748-752.
[14]黄英.清热安宫丸等中成药微生物限度检查方法验证[J].中国药业,2013,22(24):38-40.
[15]刘广桢,张冕,胡文红,等.5种洗剂类医疗机构制剂微生物限度检查方法验证[J].药学研究,2015,34(6):332-334.
(收稿日期:2017-05-16 本文编辑:许俊琴)
