固相萃取-高效液相色谱法测定植物油中苯并(a)芘
2017-07-25范素芳马俊美俞婧王娟刘红冉李强张岩河北省食品检验研究院河北省食品安全重点实验室河北石家庄050004
范素芳,马俊美,俞婧,王娟,刘红冉,李强,张岩(河北省食品检验研究院 河北省食品安全重点实验室,河北 石家庄 050004)
固相萃取-高效液相色谱法测定植物油中苯并(a)芘
范素芳,马俊美,俞婧,王娟,刘红冉,李强,张岩
(河北省食品检验研究院 河北省食品安全重点实验室,河北 石家庄 050004)
本实验建立了基于固相萃取的高效液相色谱法测定植物油中苯并(a)芘含量。样品用正己烷溶解,经Cleanert BAP-3固相萃取小柱净化,采用C18色谱柱分离,以乙腈/水=80/20(V/V)为流动相,经荧光检测器检测。结果表明苯并(a)芘在0. 50 μg /L ~ 50 μg /L浓度范围内线性良好,相关系数为0. 9999,方法检出限为0. 1 μg /kg,样品加标回收率为89.00% ~ 94.46%,RSD为1.0% ~ 2.2%。该方法具有快速、准确、灵敏、简单等特点,可用于植物油中苯并芘的检测。
固相萃取;高效液相色谱法;植物油;苯并(a)芘
苯并(a)芘又称3,4-苯并芘,是由苯环和芘分子结合而成的多环芳烃类化合物[1],具有高度脂溶性[2],并且性质稳定, 不易降解,是常见的高活性间接致癌物的一种,苯并(a)芘具有致畸、致突变作用[3]。植物油是人类食用频率最高的食物之一,在油料作物的种植、加工、运输和烹调的过程中,容易污染苯并(a)芘[4-5],虽然含量通常较低,但其毒性较大,对油脂的营养品质和人体健康都造成的不容忽视损害。因此,许多国家和地区都规定了食用油脂中苯并(a)芘的最大残留限量,欧盟629/2008号文件规定苯并(a)芘的最大残留限量为2μg/kg,我国GB2716-2005《食用植物油卫生标准》中规定为10μg/kg[6]。
近年来,食用植物油中苯并(a)芘超标的食品安全事件时有发生[7-9],引发了政府和公众对食用植物油中苯并(a)芘食用安全问题的强烈关注。目前,植物油中苯并(a)芘含量的检测方法主要有薄层层析法、荧光分光光度法、高效液相色谱法和气相色谱-质谱联用法等[10-15]。其中,薄层层析法和荧光分光光度法操作步骤繁多且灵敏度较低;气质联用技术的分离效果及色谱重现性好,但对仪器要求比较高,不利于推广[16]。高效液相色谱法的分离效果好,灵敏度高,且容易推广,近年来我国制定的标准GB/T22509-2008中也是采用高效液相色谱法,但其存在成本高,耗时长,操作繁琐,重现性差等问题,因此建立一种科学快速且准确可靠的检验方法是十分必要的。
本实验采用Cleanert BAP-3固相萃取柱对植物油进行提取净化,再用高效液相色谱-荧光检测法进行检测,简化了处理步骤,降低了实验成本和有机试剂排放量,实现了植物油中苯并(a)芘的快速精确测定。
1 材料与方法
1.1 仪器与试剂
LC-30AD超高效液相色谱仪(日本SHIMADZU公司) ;12位固相萃取仪(Agilent 公司);IKA Vortex Genius 3旋涡混合器(德国IKA公司);Bond Elut ENV固相萃取柱(500 mg/6 mL,Agilent公司) ;Cleanert BAP-3固相萃取柱(500 mg /6 mL,博纳艾杰尔公司);FLorisil PR(1000 mg/6 mL,北京振翔工贸有限公司) ;C18固相萃取柱、硅胶固相萃取柱、HLB固相萃取柱均购自美国Waters公司。
色谱纯乙腈、正己烷和二氯甲烷(美国Merck 公司) ;苯并(a)芘标准品(纯度99. 3% ,美国Supelco公司)。水为实验室自制的二级水,符合GB/T6682规定。
1.2 色谱条件
色谱柱:Waters ACQUITY UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm,美国Waters公司);流动相:乙腈:水=80:20;流速:0.3 mL/min;进样量:1μL;检测波长:Ex:384 nm,Em:406 nm。
1.3 样品的前处理
1.3.1 试样提取
称取0.5g食用植物油试样(精确到0.001g)于15mL离心管中,加入3mL正己烷,涡旋充分混匀,待净化。
1.3.2 试样净化
将Cleanert BAP-3固相萃取柱用5 mL二氯甲烷,5 mL正己烷活化,将待净化液上样,以2 mL 正己烷润洗样品管,保证完全上样,再用10 mL正己烷淋洗固相萃取柱,最后用5 mL二氯甲烷洗脱,收集洗脱液,于40 ℃下氮气吹干,用1. 00 mL乙腈定容,超声10 s,过0. 22μm有机系微孔滤膜,供液相色谱荧光检测法检测。
2 结果与分析
2.1 固相萃取柱的选择
食用油中的苯并(a)芘的萃取常采用混合溶剂,但由于苯并(a)芘的脂溶性较强导致萃取时提取效率不高;另一种方法是在油脂中加入碱性溶液,经皂化反应除脂后再用溶剂提取,但皂化反应时间长,一般2 h 以上,导致样品检测时间过长。为简化操作,提高检测效率,考虑将植物油样品溶解后,直接进行固相萃取净化。
本实验考察了添加量为10 μg/kg时Bond Elut ENV 、Cleanert BAP-3、FLorisil PR、C18、硅胶和HLB固相萃取柱对苯并芘的保留和净化能力,结果如图1。研究表明Cleanert BAP-3固相萃取柱对样品进行前处理,回收率最高,且干扰较小。Cleanert BAP-3是一种以聚苯乙烯二乙烯苯高聚物为填料的新型固相萃取柱,利用了高聚物苯环和苯并芘之间的π-π作用,能对样品起到很好的净化效果。故选择Cleanert BAP-3固相萃取柱为净化小柱。Cleanert BAP-3柱净化色谱图如图2所示。
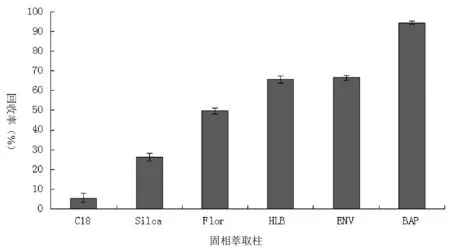
图1 不同固相萃取柱对苯并芘的回收率
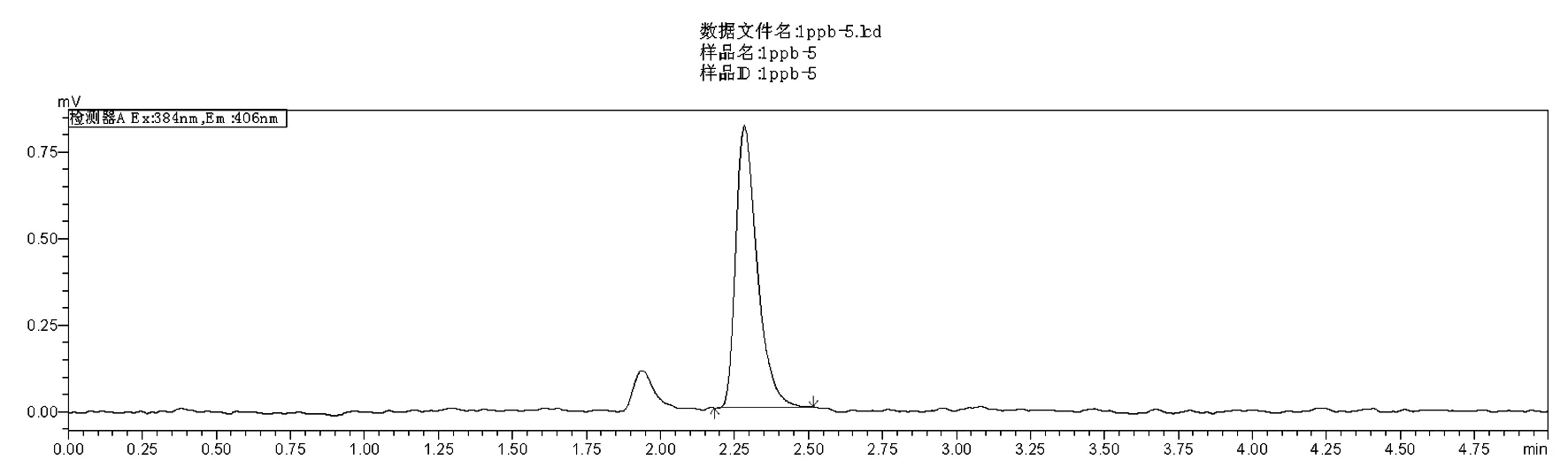
图2 阳性样品的Cleanert BAP-3柱净化色谱图
2.2 称样量的选择
在考察称样量时,通过加标回收率实验确定称样量对回收率的影响。加标量为10 μg/kg,计算称样量分别为0.2 g、0. 5 g、1.0 g、1.5 g、2.0 g时苯并芘的回收率,结果(图3)表明,称样量大于0.5 g时,称样量对回收率有显著影响,称样量提高,回收率降低,原因可能是固相萃取柱的承载量有限,称样量过大,会造成萃取柱过载,从而造成回收率偏低;称样量小于0.5 g时,称样量对回收率影响较小,考虑到适当的增大称样量,可以减少因称量设备精度等造成的误差,故本实验称样量选为0.5 g。
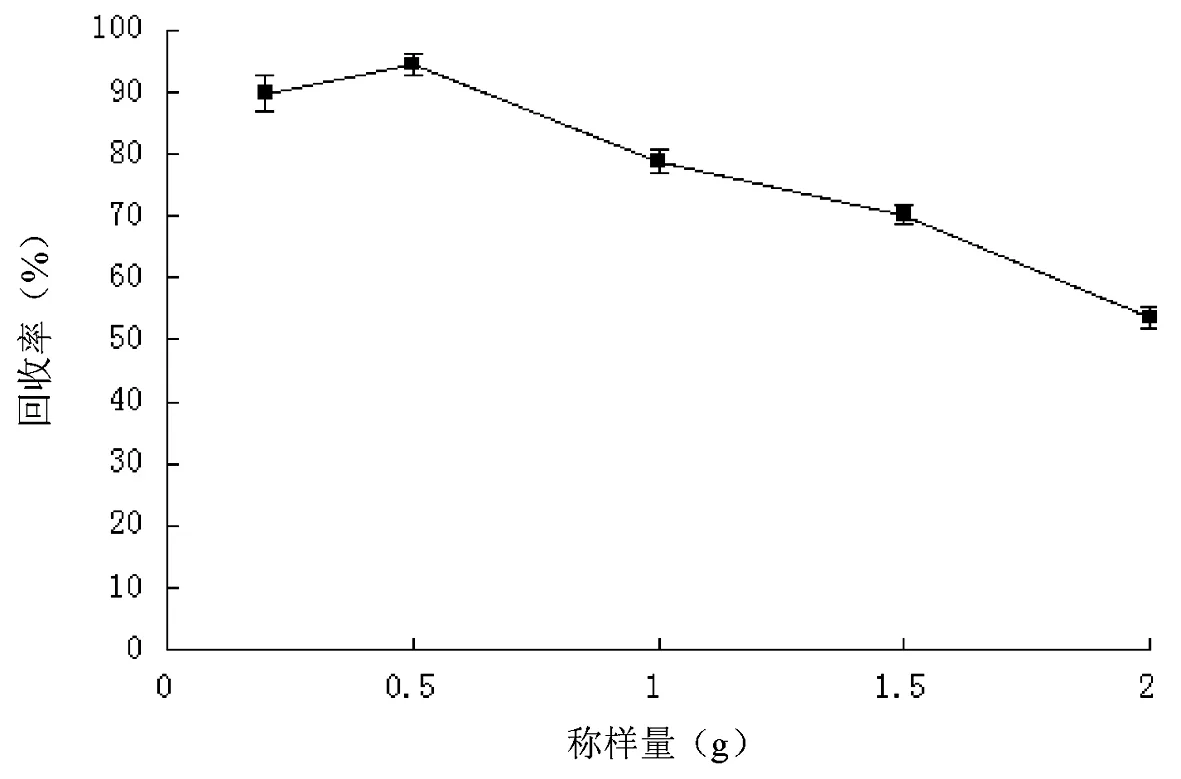
图3 不同称样量对苯并芘的回收率
2.3 标准曲线的绘制和检出限
苯并芘标准品用甲苯溶解后,用乙腈配成10 mg/L储备液,分取储备液再稀释成0. 5、1. 0、5. 0、10. 0、20.0、50.0μg /L,将标准系列溶液在上述色谱条件下进行测定,以浓度为横坐标(X),相应峰面积为纵坐标(Y)进行线性回归 ,苯并芘在0. 5~50.0 μg/L浓度范围内有良好的线性,回归方程为Y=12723.3X-2730.22,R2=0. 9999。以仪器信噪比(S/N) 为3时所对应的标准溶液浓度为仪器的检出限,根据前处理方法计算方法的检出限为0.1μg /kg。
2. 4 回收率和精密度
在植物油样品中添加苯并芘标准溶液,添加水平分别为1μg/kg、5μg/kg和10μg/kg,每个浓度做6个平行,回收率及精密度数据如表1 所示,加标回收率在89.00%~94.46%范围内,相对标准偏差不高于2.2%,满足残留检测的要求。
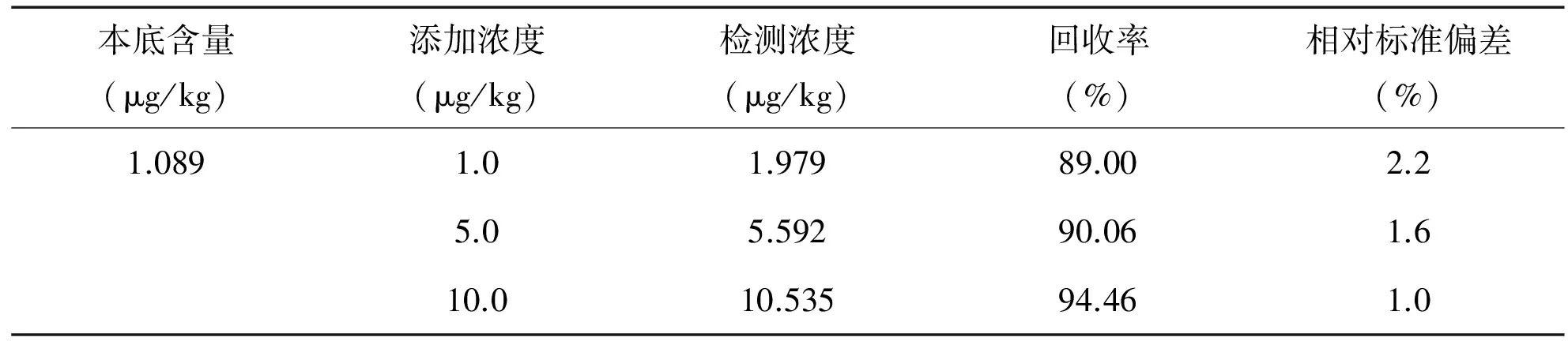
表1 样品回收率及精密度
2. 5 实际样品测定
利用本方法对市售的食用植物油样品30批进行测定,包括花生油、大豆油、棉籽油、香油等样品,检测时均无干扰,色谱分离良好,其中16批样品未检出苯并芘,13批样品检出苯并芘,含量不超过10. 0μg /kg,1批样品检出含量超过10μg/kg,为12.81μg/kg,用GB/T 22509-2008规定的方法对此样品进行了测定,检测结果与本方法结果一致,证明本方法准确可靠、适用性强。
3 结论
建立了固相萃取-高效液相色谱荧光检测器测定食用油中苯并芘的方法。样品过Cleanert BAP-3固相萃取柱净化,采用C18反相色谱柱分离,回收率及精密度均获得满意结果,该法方便、快捷、灵敏,可满足日常检测要求,有较大的推广应用前景。
[1] 王欣,周智慧,赵晓联.苯并(a)芘危害性及其检测技术[J].粮食与油脂,2011,(3):48-49.
[2] 王瑞元.我国小麦粉加工业的现状及发展中应注意的几个问题[J].粮食与食品工业,2008,15(6):1-5.
[3] 刘淑琴,王鹏.多环芳烃与致癌性[J].环境保护,1995,9:42-45
[4] 王浩,刘艳琴,杨红梅,等.高效液相色谱法测定粮食中苯并芘残留的研究[J].粮油食品科技,2007,15(1): 53-54.
[5] 董广彬,李鹏,顾鑫荣,等.反相高效液相色谱法测定动植物油脂中苯并( a) 芘含量[J].中国卫生检验杂志,2009,19(7):1529-1530.
[6] 程威威,汪学德,刘兵戈,等.HPLC-FLD和GC-MS测定芝麻油中苯并芘的方法比较[J].现代食品科技,2005, 31(10):282-286.
[7] DOST K,IDELI C.Determination of polycyclic aromatic hydrocarbons in edible oils and barbecued food by HPLC/UV-Vis detection [J].Food Chem,2012,133 (1):193-199.
[8] CAMARGO M C R,ANTONIOLLI P R,VICENTE E,et al.Polycyclic aromatic hydrocarbons in Brazilian commercial soybean oils and dietary exposure [J].Food Addit Contam B,2011,4(2):152-159.
[9] 刘艳,张芳,金哲,王国,徐鑫.食用植物油中苯并( a) 芘来源及形成机理的研究进展[J].中国油脂,2013,38(4) :53-56.
[10] 宋长虹,唐生,佟馨,郝克非,尚刚,邓斌.食用油脂中苯并(a)芘检测方法比较与优化[J].食品研究与开发,2014,35(23):83-86.
[11] YURCHENKO S,MOLDER U.The determination of polycyclic aromatic hydrocarbons in smoked fish by gas chromatography mass spectrometry with positive-ion chemical ionization[J].Journal of Food Composition and Analysis,2005,18:857-869.
[12] JANOSZKA B.HPLC-fluorescence analysis of polycyclic aromatic hydrocarbons (PAHs) in pork meat and its gravy fried without additives and in the presence of onion and garlic[J].Food Chemistry,2011,126:1344-1353.
[13] FARHADIAN A,JINAP S,ABAS F,et al.Determination of polycyclic aromatic hydrocarbons in grilled meat [J].Food Control,2010,21:606-610.
[14] CHUNG S Y,YETTELLA R R,KIM J S,et al.Effects of grilling and roasting on the levels of polycyclic aromatic hydrocarbons in beef and pork[J].Food Chemistry,2011,129:1420-1426.
[15] ISHIZAKI A,SAITO K,HANIOKA N A,et al.Determination of polycyclic aromatic hydrocarbons in food samples by automated on-line in-tube solid-phase microextraction coupled with high-performance liquid chromatography-fluorescence detection[J].Journal of Chromatography A,2010,1217:5555-5563.
[16] 剧芳,孙成,钟明.我国水体中苯并芘污染的生态风险评价[J].环境与健康杂志,2005,22(3):163-165.
Determination of the benzo(a) pyrene in vegetable oil by high performance liquid chromatography based on solid phase extraction
FAN Su-fang, MA Jun-mei, YU Jing,Wang Juan, LIU Hong-ran,LI Qiang, ZHANG Yan
(HebeiFoodInspectionandResearchInstitute,KeyLaboratoryofFoodSafetyofHebei,ShijiazhuangHebei050004,China)
In this experiment, a high performance liquid chromatography method was built to determine benzo(a) pyrene in vegetable oil based on solid phase extraction. Samples were extracted with hexane,then cleaned-up using Cleanert BAP-3 solid phase extractionl column,and separated on an C18 column using a mobile phase consisting of acetonitrile and water(V/V=80:20) by gradient elution. Finally the benzo( a) pyrene was detected with FLD.The benzo(a) pyrene showed good linearity in the range of 0. 50μg/L~50 μg/L(R2=0.9999).The limit of detection was 0.1 1μg/kg.The recoveries were 89.00%~94.46%,and the RSD was 1.0%~2.2%.The method was rapid,accurate,sensitive and simple,it could be applied to the quantification of benzo(a) pyrene in vegetable oil.
Solid phase extraction; High performance liquid chromatography; Vegetable oil; Benzo(a) pyrene
2017-04-28
范素芳(1985-),女,博士,工程师,研究方向为食品检验.
张 岩(1979-),男,博士,正高级工程师,研究方向为食品安全.
1001-9383(2017)02-0047-05
O657
A
