连翘叶中连翘酯苷A、芦丁和连翘苷提取纯化工艺优化
2017-07-20孙建瑞王大红邱智军原江锋
孙建瑞,王大红,邱智军,原江锋*
(河南科技大学食品与生物工程学院,洛阳市微生物发酵工程技术研究中心,河南 洛阳 471023)
连翘叶中连翘酯苷A、芦丁和连翘苷提取纯化工艺优化
孙建瑞,王大红,邱智军,原江锋*
(河南科技大学食品与生物工程学院,洛阳市微生物发酵工程技术研究中心,河南 洛阳 471023)
对连翘叶提取液中同时分离连翘酯苷A、芦丁和连翘苷的提取纯化工艺进行优化。以连翘酯苷A、连翘苷和芦丁的质量浓度为指标,采用高效液相色谱法分析检测,比较不同型号的大孔吸附树脂和不同工艺条件对这3 种活性成分的分离纯化能力。最佳工艺条件为:以AB-8大孔吸附树脂为吸附剂,药材-树脂比1.5∶1(g/g),上样流速2 BV/h,先用8 BV的水洗脱,再用6 BV的30%乙醇溶液和6 BV的50%乙醇溶液分别洗脱,洗脱流速3 BV/h;进一步采用C18-硅胶柱反相层析法纯化连翘酯苷A,静置沉淀的方法纯化连翘苷和芦丁,纯化后连翘酯苷A和芦丁的纯度可达到97%以上,连翘苷纯度可达到95%以上。此工艺条件能得到高纯度的3 种有效成分,为连翘叶资源的充分综合利用和产业化开发提供了参考。
连翘叶;连翘酯苷A;芦丁;连翘苷;提取工艺
连翘叶为木犀科(Oleacaae)植物连翘(Forsythia sμspensa (Thunb.) Vahl)的干燥叶[1],《中药大辞典》、《中华本草》等现代典籍记载“连翘茎叶,味苦,性寒,功能主治清热解毒,主治心肺积热”[2]。在连翘资源丰富的地区,连翘叶在我国民间常作为滋补调理饮料应用,且已有较长历史,也有将连翘叶作为保健茶饮用的习惯,普遍认为连翘叶有较好的保健价值[3-4]。而且有研究已经证实,连翘叶茶饮料具有抗衰老、抗油脂氧化、保肝、增强免疫及抗应激作用[5-9];连翘叶提取物中的苷类成分有极强的抗氧化、清除自由基、降血脂及抗疲劳作用[10-13]。
连翘叶中的主要活性成分与连翘果实类似,而连翘叶中连翘酯苷A、连翘苷的含量高于河南、山西、陕西、山东等地连翘果实的含量,其中连翘叶中连翘酯苷A的含量是连翘果实的5~10 倍[14-15],连翘叶中连翘苷的含量与连翘果实中的含量较为接近[16];在河北、陕西的连翘叶中芦丁含量也较高[17]。由于连翘叶没有进入《中华人民共和国药典》,其连翘叶相关产品的开发受到了很大的限制。根据已有文献,有从连翘果实中同时分析和测定连翘酯苷A、连翘苷和芦丁的报道[18-19];有从连翘中提取连翘酯苷A的工艺研究报道[20-21]和从连翘果实和连翘叶中提取连翘苷的工艺研究[22-25],而鲜有关于连翘果实或连翘叶中芦丁提取工艺的报道。目前,鲜有从连翘叶中复合提取纯化连翘酯苷A、芦丁和连翘苷的报道。
本研究使用大孔吸附树脂吸附和解吸附,从连翘叶中同时分离连翘酯苷A、连翘苷和芦丁,并用反相硅胶纯化连翘酯苷A,用静置沉淀纯化芦丁和连翘苷。该方法制备连翘酯苷A、连翘苷和芦丁纯度较高,工艺条件简单,对连翘叶资源的充分利用和深入开发提供理论依据,适合工业化生产。
1 材料与方法
1.1 材料与试剂
连翘叶(2014年9月采自河南豫西伏牛山地区)经河南科技大学农学院侯小改教授鉴定。
NKA-2、D101、DA201、DM130、HPD450A、HPD600、HPD826、AB-8、聚酰胺30-100、聚酰胺14-30、聚酰胺30-60大孔吸附树脂 河北沧州宝恩化工有限公司;连翘酯苷A对照品(批号:A0590-20 mg)、连翘苷对照品(批号:A0272-20 mg) 成都曼斯特公司;芦丁对照品 美国Sigma公司;其他试剂为分析纯。
1.2 仪器与设备
20A vp型高效液相色谱(high performance liquid chromatography,HPLC)系统 日本岛津公司;Milli-QG超纯水制备仪 美国Millipore公司;BS 124S型万分之一天平 赛多利斯科学仪器有限公司;KQ-300DE型数控超声清洗器 昆山市超声仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;QT-88A智能核酸蛋白检测仪、玻璃层析柱 上海琪特分析仪器有限公司;BSZ-100自动部分收集器 上海沪西分析仪器有限公司;HH-S6数显电热恒温水浴锅 常州国华电器有限公司。
1.3 方法
1.3.1 连翘叶样品预处理工艺流程
连翘叶→洗净干燥→粉碎→过40目筛得到连翘叶粉末。
1.3.2 上样溶液的制备
准确称取过40 目筛的连翘叶粉末10 g,在74 ℃条件下,液料比30∶1,53%乙醇溶液水浴浸提53 min,得提取液;在74 ℃条件下,液料比20∶1,53%乙醇溶液水浴浸提50 min,合并提取液,过滤,减压浓缩回收乙醇,浓缩至约含生药0.05 g/mL浓缩液,每100 mL的浓缩液中添加5 mL乙醇,备用。
1.3.3 树脂预处理
将11 种大孔吸附树脂用95%乙醇溶液浸泡24 h充分溶胀后,用无水乙醇洗至洗出液加适量蒸馏水无白色浑浊,再用去离子水洗至无醇味,然后用3% NaOH溶液浸泡4 h,去离子水洗至中性,再用3% HCl溶液浸泡4 h,去离子水洗至中性后,滤取,备用。
1.3.4 树脂种类选择
分别精密称取预处理好的湿树脂2 g于具塞锥形瓶中,加入上样溶液20 mL,室温振荡24 h至吸附平衡,测定吸附前后溶液中连翘酯苷A、连翘苷和芦丁的质量浓度,计算室温条件下的吸附率。将吸附平衡后的树脂抽滤,用适量蒸馏水淋洗,使流出液无色,精密加入80%乙醇溶液20 mL,同等条件下解吸附,滤过,测定滤液中连翘酯苷A、连翘苷和芦丁的质量浓度,计算解吸率。

式中:A为吸附率/%;R为解吸率/%;C0为上样溶液中化合物的质量浓度/(mg/mL);V0为上样溶液体积/mL;C1为吸附后化合物的质量浓度/(mg/mL);V1为吸附后流出液体积/mL;C2为解吸液中化合物的质量浓度/(mg/mL);V2为解吸液体积/mL。
1.3.5 树脂的静态吸附动力学
称取AB-8湿树脂2 g于具塞锥形瓶中,加入上样溶液20 mL,不时振荡,不同时间取样,测定连翘酯苷A的含量,绘制AB-8树脂的吸附动力学曲线。
1.3.6 树脂的动态吸附动力学
将提取液以3 BV/h的流速加入AB-8大孔吸附树脂柱(5 g,径高比1∶25)中,每个流分收集10 mL(0.5 BV),共处理12 BV,从4 BV开始测定连翘酯苷A的质量浓度,绘制吸附-穿透曲线。
1.3.7 吸附流速的考察
将生药含量0.05 g/mL的提取液以药材-树脂比1.5∶1(g/g)上AB-8大孔吸附树脂,上样流速设为1、2、3、4、5 BV/h,计算不同流速条件下连翘酯苷A、连翘苷和芦丁的吸附率。
1.3.8 洗脱剂乙醇体积分数的考察
将经样品吸附饱和的AB-8树脂用水洗至澄清,再依次用10%、20%、30%、40%、50%、60%、70%的乙醇溶液洗脱,每个体积分数梯度50 mL,分别测定洗脱液中连翘酯苷A、连翘苷和芦丁的质量浓度,绘制洗脱曲线。1.3.9 洗脱剂用量的考察
装AB-8树脂柱,按药材-树脂比1.5∶1(g/g)设定上样量,先用水洗脱杂质,洗至洗脱液澄清,再依次用7 BV的30%乙醇溶液和7 BV的50%乙醇溶液洗脱,流速为3 BV/h,每10 mL收集一份,测定洗脱液中连翘酯苷A和连翘苷的质量浓度,绘制洗脱曲线。
1.3.10 洗脱流速的考察
按药材-树脂比1.5∶1(g/g)上样,先以8 BV的水洗脱,再依次用6 BV的30%乙醇溶液和6 BV的50%乙醇溶液洗脱,洗脱流速分别为2、3、4、5、6 BV/h。分别收集30%和50%洗脱液,计算连翘酯苷A、连翘苷和芦丁的洗脱率和纯度。
1.3.11 活性成分的分离
用6 BV的30%乙醇溶液和6 BV的50%乙醇溶液洗脱分别得到的流分Ⅰ和流分Ⅱ,分别浓缩回收乙醇,浓缩液体积为原洗脱液的1/10,室温静置,流分Ⅰ浓缩液静置8 h后有芦丁结晶沉淀,流分Ⅱ浓缩液静置2 h即有连翘苷沉淀,沉淀完全后离心,分别得到芦丁和连翘苷粗品。流分Ⅰ浓缩液离心后的上清液用水-饱和正丁醇1∶1室温萃取2 次,弃去水层,合并每次萃取所得正丁醇相,50 ℃减压浓缩,经干燥得到连翘酯苷A粗品。分别测定连翘酯苷A、芦丁和连翘苷洗脱前后的纯度。
1.3.12 活性成分的纯化
室温用玻璃棒将甲醇充分浸泡的C18匀浆沿着柱内壁一次性倒入径高比为1∶30柱内,装成Φ12 mm×350 mm的层析柱,以1.0 mL/min甲醇冲洗2~3 BV,再用2~3 BV的30%甲醇溶液平衡柱子。将制备的连翘酯苷A粗品溶于30%的甲醇溶液后上样,用30%甲醇-0.2%冰乙酸溶液作为洗脱剂,分段洗脱洗下样品组分,收集对应物质峰的流出液,低温回收有机溶剂,冷冻干燥,HPLC测定纯度。
将芦丁粗品放入具塞三角瓶中,添加尽量少的乙醇于80 ℃溶解,若不溶解,再添加少量乙醇,直到结晶全部溶解,过滤除去不溶性杂质,室温静置,即有黄色针状晶体析出,重复操作3 次,HPLC测定纯度。
将连翘苷粗品配制质量浓度100 mg/mL的连翘苷甲醇溶液,加热溶解,用0.45 μm的滤膜过滤除杂。室温将此溶液迅速加入装有20 倍体积去离子水的离心管中混合,进行重结晶,离心重复操作3次,HPLC测定纯度。
1.3.13 色谱条件[26]
色谱柱Hypersil BDS C18柱(4.6 mm×250 mm,5 μm);流动相为甲醇(A)-水(含0.2%冰醋酸)(B),梯度洗脱:0~3 min,32%~32% A;3~25 min,32%~55% A;25~30 min,55%~55% A,测定波长235 nm,流速l mL/min,柱温30 ℃,进样量10 μL。
2 结果与分析
2.1 连翘叶中活性成分提取结果
连翘叶样品采用醇水系统进行提取后,经HPLC检测,连翘叶中连翘酯苷A的平均含量为7.16%,连翘苷2.47%,芦丁1.81%;连翘酯苷A提取率为87.61%,连翘苷提取率为83.37%,芦丁提取率为80.57%。
样品使用醇水系统进行提取,同时兼顾到3 种有效成分的结构和活性,且能把有效活性成分提取完全。连翘叶中的连翘苷为非极性化合物,易溶于甲醇、乙醇等有机溶剂,难溶于水;连翘酯苷A为极性化合物,易溶于水、甲醇、乙醇等;芦丁易溶于甲醇、热乙醇,不易溶于水,综合考虑,连翘叶的提取溶剂选择乙醇溶液,提取溶剂安全无毒,又可以回收利用。同时,在提取实验的预实验中发现,当浸提温度高于75 ℃时,连翘酯苷A提取率开始降低,而连翘苷提取率逐渐增加,推测其原因可能是连翘酯苷A分子中具有酯键,较高温度易水解,从而影响提取率[26]。
2.2 树脂筛选
以连翘酯苷A、芦丁和连翘苷3 种活性成分的吸附率和解吸率为指标,筛选11 种树脂,结果如表1所示,AB-8和D101树脂对3 种活性成分的吸附率和解吸率都比较大,但考虑到连翘酯苷A为极性化合物,连翘苷和芦丁为非极性化合物的理化性质,而D101为非极性树脂,AB-8为弱极性树脂,为更好地把物质分开,选择AB-8树脂进行分离纯化工艺研究。
2.3 树脂的静态吸附动力学
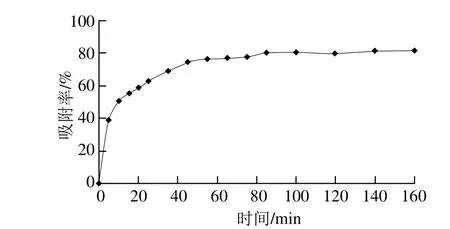
图1 AB-8树脂的静态吸附曲线Fig. 1 Static adsorption curve of AB-8 resin
AB-8树脂的吸附动力学曲线见图1,初始阶段吸附速度较快,30 min后吸附率增加缓慢,60 min后已基本达最大吸附率。
芦丁的极性介于连翘酯苷A和连翘苷之间,而且根据HPLC的检测结果,连翘酯苷A的含量最高,是连翘苷的2.9 倍,是芦丁的4 倍。所以,本研究主要目的是从富含连翘酯苷A的连翘叶中得到活性化合物,在保证连翘酯苷A含量最高的同时获得连翘苷和芦丁,以降低生产成本。
2.4 树脂的动态吸附动力学

图2 AB-8树脂的动态吸附曲线Fig. 2 The curve of dynamic adsorption of AB-8 macroporous resin
从4 BV开始测定连翘酯苷A的质量浓度,吸附-穿透曲线见图2。由图2可知,当上样8 BV时,过柱液中连翘酯苷A的质量浓度开始陡然增大,为不损失太多的连翘酯苷A,又考虑到连翘苷和芦丁的饱和吸附率,故药材-树脂比定为1.5∶1(g/g)。
2.5 吸附流速的选择
不同上样流速对吸附率的影响结果如表2所示,上样流速为1~5 BV/h时,连翘酯苷A和芦丁的吸附率随流速的增大而下降,连翘苷一直未泄漏,上样流速为2 BV/h时,虽然连翘酯苷A和芦丁的吸附率小于上样流速1 BV/h,但考虑到吸附效率和吸附效果,上样流速采用2 BV/h较为合适。

表2 上样流速对吸附率的影响Table 2 Effects of sample loading flow rate on adsorption rate
2.6 洗脱剂体积分数的选择

图3 AB-8树脂洗脱剂体积分数的考察Fig. 3 Effect of eluant concentration on desorption efficiency from AB-8 resin
AB-8树脂洗脱剂体积分数的考察结果见图3,连翘酯苷A和芦丁主要集中在30%乙醇洗脱液中,连翘苷主要集中50%乙醇洗脱液中,故选择30%乙醇溶液和50%乙醇溶液作为洗脱剂。
2.7 洗脱剂用量的选择

图4 AB-8树脂洗脱曲线Fig. 4 Elution curves from AB-8 resin
用8 BV的水洗脱,可洗去水溶性杂质,然后用30%乙醇溶液洗脱,洗至7 BV时,连翘苷的质量浓度开始高于连翘酯苷A的质量浓度,改用50%乙醇溶液洗脱继续洗脱7 BV时,连翘苷被洗脱完全(图4)。故在工业生产中,从经济方面考虑可以用6 BV的30%乙醇溶液和6 BV的50%乙醇溶液作为洗脱剂。
2.8 洗脱流速的选择
随着洗脱流速的增加,连翘酯苷A和芦丁的洗脱率逐渐减小,连翘苷的洗脱率逐渐增大,而纯度都是逐渐变小的(表3)。故综合考虑三者的洗脱率、纯度以及洗脱效率,洗脱流速设定为3 BV/h。

表3 不同洗脱流速的考察结果Table 3 Effect of elution flow rate on the purification and recovery of target compounds
2.9 活性成分的分离
用6 BV的30%乙醇溶液和6 BV的50%乙醇溶液洗脱分别得到的流分Ⅰ和流分Ⅱ,分别有两个主要的峰,其他杂质基本都被除去(图5)。洗脱前连翘酯苷A、芦丁和连翘苷的含量分别为7.80%、1.97%和3.02%,洗脱后连翘酯苷A、芦丁和连翘苷的含量分别为51.43%、13.13%和59.17%。洗脱后连翘酯苷A、芦丁和连翘苷的纯度明显比洗脱前高,大孔吸附树脂可有效提高有效成分的含量,说明该分离纯化工艺效果好,重复性好,本工艺可行。

图5 不同体积分数乙醇洗脱的HPLC图Fig. 5 HPLC Chromatograms of mixed standards and eluates with different concentrations of ethanol
利用连翘酯苷A和芦丁在水中溶解度的差异以及连翘苷不易溶于水的特点,采用简单的浓缩、静置、结晶的方法即可实现连翘酯苷A和芦丁的分离以及获得较高纯度的连翘苷,沉淀分离后的上清液用水饱和正丁醇萃取的方法进行精制,就能得到纯度50%以上的连翘酯苷A粗品,方法简单,正丁醇还可以回收利用,降低了生产成本。
2.10 活性成分的纯化

图6 三混标与制得的单体HPLC图Fig. 6 Chromatograms of mixed reference substances and purified individual components
纯化后连翘酯苷A、芦丁和连翘苷的纯度如图6所示,经纯化后连翘酯苷A和芦丁的纯度可达到97%以上,连翘苷的纯度可达到95%以上,回收率大于85%。从连翘叶提取液中初分离的连翘酯苷A粗品,因此进一步纯化是至关重要的,由于粗品中仍含有与连翘酯苷A的化学结构和极性等性质相似的化合物,常需采用制备HPLC手段才能纯化精制,但对于大规模制备而言,HPLC过程的设备投资和介质费用很高。为降低连翘酯苷A的生产成本和提高回收率,在C18-硅胶柱上用常压反相层析法对其进行了纯化精制,对C18-硅胶层析纯化连翘酯苷A的操作条件进行优化,纯化连翘酯苷A所用的反相硅胶虽然价格稍高,但使用时粗品中连翘酯苷A的纯度已经很高,带进的杂质很少,经过少量的甲醇冲洗,就可以重复利用。
3 结 论
本研究涉及一种从连翘叶中复合制备连翘酯苷A、连翘苷和芦丁的方法,采用连翘叶为原料,先用乙醇水浴提取、浓缩、过滤得到连翘叶提取液;然后含有少量乙醇的连翘叶提取液上AB-8大孔吸附树脂,用不同体积分数乙醇分段洗脱,得到流分Ⅰ和流分Ⅱ;流分Ⅰ回收乙醇,静置沉淀、乙醇重结晶得到纯度大于97%的芦丁产品,上清液用水饱和正丁醇萃取、浓缩、干燥后得到纯度大于55%的连翘酯苷A粗品,经反相硅胶纯化纯度可大于97%的连翘酯苷A产品;流分Ⅱ回收乙醇,静置沉淀,甲醇重结晶得到纯度高达95%的连翘苷产品,回收率大于85%。连翘传统以果实入药,连翘苷和连翘酯苷A是连翘的主要活性成分,也是其质控指标,而连翘叶中的连翘苷和连翘酯苷A的含量均比果实中的含量高,却被大量废弃,造成资源的严重浪费[27-28]。现有技术大多针对一种或两种有效活性成分,制备方法没有综合利用连翘资源[29-30]。本实验方法充分利用天然植物资源,从连翘叶中同时制备连翘苷、连翘酯苷A和芦丁3 种产品,最大限度利用了资源,而且本工艺简单,适合工业化生产。
[1] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 化学工业出版社, 2010.
[2] 国家中医药管理局《中华本草》编委会. 中华本草: 第十六卷[M].上海: 上海科技出版社, 1999: 157-159.
[3] 梁文藻, 董慧, 涂国士. 连翘成分分析Ⅰ. 连翘甙和连翘脂素的分离鉴定和测定[J]. 药物分析杂志, 1985, 5(1): 1-3.
[4] SCHINELLA G R, TOURNIER H, PRIETO J M, et al. Antioxidant activity of anti-inflammatory plant extracts[J]. Life Sciences, 2002, 70: 1023-1033. DOI:10.1016/S0024-3205(01)01482-5.
[5] 刘静. 连翘叶茶抗氧化抗衰老及保肝作用的实验研究[D]. 西安: 陕西师范大学, 2004.
[6] LU T, PIAO X L, ZHANG Q, et al. Protective effects of Forsythia suspensa extract against oxidative stress induced by diquat in rats[J]. Food and Chemical Toxicology, 2010, 48: 764-770. DOI:10.1016/ j.fct.2009.12.018.
[7] 杨建雄, 刘静, 李发荣, 等. 连翘叶茶抗氧化抗衰老作用的实验研究[J].营养学报, 2004, 26(1): 65-67. DOI:10.3321/j.issn:0512-7955.2004.01.016.
[8] 刘静, 杨建雄, 李小丹. 连翘叶提取物抗油脂氧化作用的实验研究[J].陕西教育学院学报, 2006, 22(2): 93-95. DOI:10.3969/j.issn.1008-598X.2006.02.025.
[9] FORMAN H, DABIES K J A, URSINI F. How do nutritional antioxidants really work: nucleophilic tone and para-hormesis versus free radical scavenging in vivo[J]. Free Radical Biology and Medicine, 2014, 66: 24-35. DOI:10.1016/j.freeradbiomed.2013.05.045.
[10] 侯改霞. 连翘叶提取物的降血脂和抗疲劳作用研究[D]. 西安: 陕西师范大学, 2004.
[11] DUTTA R K, MAHARIA R S. Antioxidant responses of some common medicinal plants grown in copper mining areas[J]. Food Chemistry, 2012, 131: 259-265. DOI:10.1016/ j.foodchem.2011.08.075.
[12] 黄亚亚, 杨建雄, 赵咏梅. 连翘叶黄酮对力竭游泳恢复小鼠的抗疲劳作用研究[J]. 天然产物研究与开发, 2009, 21(6): 1019-1022. DOI:10.3969/j.issn.1001-6880.2009.06.029.
[13] IIZUKA T, NAGAI M. Vasorelaxant effects of forsythiaside from the fruits of Forsythia suspensa[J]. Yakugaku Zasshi Journal of the Pharmaceutical Society of Japan, 2005, 125(2): 219-224. DOI:10.1248/ yakushi.125.219.
[14] 庞维荣, 赵平, 刘养清, 等. 不同生长期的连翘中连翘酯苷及芦丁含量动态研究[J]. 世界中西医结合杂志, 2007, 2(5): 277-279. DOI:10.13935/j.cnki.sjzx.2007.05.012.
[15] 李卫建, 李先恩. 连翘果实干物质与有效成分积累规律研究[J]. 中草药, 2006, 37(6): 921-924. DOI:10.3321/j.issn:0253-2670. 2006.06.049.
[16] 张杲, 李发荣, 段飞, 等. 不同采收期连翘叶中连翘苷、连翘酯苷和芦丁的含量测定[J]. 天然产物研究与开发, 2005, 17(6): 790-793. DOI:10.3969/j.issn.1001-6880.2005.06.031.
[17] 高淑丽, 刘丽华, 张阳. 高效液相色谱法同时测定不同产地、不同炮制时间连翘和连翘叶中5 种活性成分的含量[J]. 中国医院药学杂志, 2012, 32(16): 1276-1279. DOI:10.13286/j.cnki. chinhosppharmacyj.2012.16.004.
[18] 魏悦, 李晓, 李自红, 等. HPLC同时测定连翘药材及提取物中芦丁、连翘酯苷A和连翘苷的含量[J]. 中国实验方剂学杂志, 2013, 19(9): 108-111. DOI:10.11653/syfj2013090108.
[19] 付云飞, 李清, 毕开顺. RP-HPLC法同时测定不同产地连翘中的7 种成分[J]. 中草药, 2013, 44(8): 1043-1046. DOI:10.7501/ j.issn.0253-2670.2013.08.024.
[20] 刘明, 王慧森, 李更生. HPD-300型大孔吸附树脂分离纯化连翘中连翘酯苷A的工艺研究[J]. 时珍国医国药, 2012, 23(1): 68-71. DOI:10.3969/j.issn.1008-0805.2012.01.031.
[21] YUAN J F, LIU X Q, YANG J X, et al. Forsythia suspense leaves, a plant: extraction, purification and antioxidant activity of main active compounds[J]. European Food Research and Technology, 2014, 238: 527-533. DOI:10.1007/s00217-014-2179-y.
[22] 赵咏梅, 齐建红. 甲醇提取连翘苷的工艺优化研究[J]. 陕西农业科学, 2015, 61(2): 22-24. DOI:10.3969/j.issn.0488-5368.2015.02.009.
[23] 李飞鹤, 杜杰, 陈廷贵, 等. 连翘苷快速提取纯化工艺研究[J]. 食品工程, 2014(2): 32-35. DOI:10.3969/j.issn.1673-6044.2014.02.012.
[24] 李晓, 魏悦, 郭唯, 等. 连翘叶中连翘苷的提取工艺[J]. 时珍国医国药, 2013, 24(4): 843-844. DOI:10.3969/j.issn.1008-0805.2013.04.032.
[25] SHENG Z L, LI J C, LI Y B. Optimization of ultrasonic-assisted extraction of phillyrin from Forsythia suspensa using response surface methodology[J]. Journal of Medicinal Plants Research, 2012, 6(9): 1633-1644. DOI:10.5897/JMPR11.1374.
[26] 刘伟霞, 杨建雄. 基于响应面法从连翘叶中提取连翘酯苷A和连翘苷的工艺优化[J]. 天然产物研究与开发, 2012, 24(8): 1098-1104. DOI:10.16333/j.1001-6880.2012.08.019.
[27] 原江锋, 邱智军, 刘建利, 等. 河南和山西连翘叶中总木脂素、连翘酯苷A、连翘酯苷B和连翘苷的含量比较[J]. 天然产物研究与开发, 2015, 27(5): 845-848. DOI:10.16333/j.1001-6880.2015.05.018.
[28] JIAO J, GAI Q Y, LUO M, et al. Comparison of main bioactive compounds in tea infusions with different seasonal Forsythia suspense leaves by liquid chromatography-tandem mass spectrometry and evaluation of antioxidant activity[J]. Food Research International, 2013, 53(2): 857-863. DOI:10.1016/j.foodres.2012.12.018.
[29] 原江锋, 赵君峰, 刘建利, 等. 连翘叶中连翘酯苷A的提取及其抗氧化活性[J]. 食品科学, 2016, 37(1): 94-98. DOI:10.7506/spkx1002-6630-201601017.
[30] 原江锋, 赵君峰, 孙军杰, 等. 河南、山西连翘叶黄酮类和三萜酸类化合物含量比较[J]. 食品科学, 2015, 36(10): 164-167. DOI:10.7506/ spkx1002-6630-201510033.
Simultaneous Extraction Purification of Forsythoside A, Rutin and Phillyrin from Forsythia suspensa Leaves
SUN Jianrui, WANG Dahong, QIU Zhijun, YUAN Jiangfeng*
(Luoyang Engineering and Technology Research Center of Microbial Fermentation, College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China)
In this study, we optimized the simultaneous separation and purification of forsythiaside A, phillyrin and rutin from an ethanolic extract of Forsythia suspensa leaves. These target compounds were quantitatively determined by high performance liquid chromatography (HPLC). Different types of macroporous adsorption resin were compared for their abilities to separate and purify three active components from Forsythia suspensa leaves. AB-8 resin was selected as the best one, and the optimum chromatographic conditions on this adsorbent were obtained as follows: sample-to-resin ratio, 1.5:1 (g/g); sample loading flow rate, 2 bed volumes (BV)/h; sequential elution with 8 BV of deionized water, 6 BV of 30% ethanol and 6 BV of 50% ethanol at a flow rate of 3 BV/h. Further purification of forsythiaside A was carried out using a C18-silica gel column by reversed-phase chromatography, while purified phillyrin and rutin were obtained by precipitation after standing. After purification, the purity of forsythiaside A and rutin was more than 97%, and that of phillyrin was over 95%. In conclusion, under the optimized conditions, three effective components of high purity were obtained from Forsythia suspensa leaves. This study may be helpful for the comprehensive utilization and industrialization exploitation of Forsythia suspensa leaves.
Forsythia suspensa leaves; forsythoside A; rutin; phillyrin; extraction conditions
10.7506/spkx1002-6630-201714031
R284.2
A
1002-6630(2017)14-0200-06
孙建瑞, 王大红, 邱智军, 等. 连翘叶中连翘酯苷A、芦丁和连翘苷提取纯化工艺优化[J]. 食品科学, 2017, 38(14): 200-205.
10.7506/spkx1002-6630-201714031. http://www.spkx.net.cn
SUN Jianrui, WANG Dahong, QIU Zhijun, et al. Simultaneous extraction purification of forsythoside A, rutin and phillyrin from Forsythia suspensa leaves[J]. Food Science, 2017, 38(14): 200-205. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201714031. http://www.spkx.net.cn
2016-08-10
国家自然科学基金青年科学基金项目(31401672);国家自然科学基金联合基金项目(U1404307);
河南省科技厅重点攻关项目(162102110056);洛阳市科技攻关项目(1401076A)
孙建瑞(1987—),男,讲师,博士,研究方向为天然代谢产物、微生物发酵。E-mail:dasheng@hauet.edu.cn
*通信作者:原江锋(1977—),女,副教授,博士,研究方向为应用生物化学。E-mail:jiangfengyuan@163.com
