N-苯基溴代马来酰亚胺和胺的亲核取代反应
2017-07-19王立新
杨 宇,彭 林,王立新
(1.中国科学院 成都有机化学研究所,四川 成都 610041;2.中国科学院大学,北京 100049)
N-苯基溴代马来酰亚胺和胺的亲核取代反应
杨 宇1,2,彭 林1,王立新1
(1.中国科学院 成都有机化学研究所,四川 成都 610041;2.中国科学院大学,北京 100049)
针对氨基马来酰亚胺骨架的重要性,以芳香胺和N-苯基溴代马来酰亚胺为原料,通过亲核取代反应制备了氨基马来酰亚胺产物。考察了碱的类型、溶剂和反应温度等条件对亲核取代反应产率的影响。进行了氨基马来酰亚胺取代产物的Pd/C还原反应和水解反应,探索了非天然N-芳基天冬氨酸的制备条件。实验结果表明:在75 ℃条件下,以碳酸氢钠为碱,乙醇作为溶剂时,氨基马来酰亚胺的产率可达97%。亲核取代反应产物在碱性条件下水解可以获得酰亚胺单水解产物。
溴代马来酰亚胺;Pd/C还原;氨基马来酰亚胺;亲核取代
0 引言
丁二酰亚胺及其衍生物广泛存在于具有生物活性的天然产物和药物分子中,例如雷尼司他(AS-3201,ranirestat)是一种新型的醛糖还原酶抑制剂,用于治疗糖尿病合并症[1];坦度螺酮(tandospirone)是一种已商业化的药物,可以选择性地作用于5-HT1A受体,具有良好的抗抑郁和抗焦虑作用[2]。
马来酰亚胺是一种优良的亲电试剂和亲双烯体,其参与的不对称迈克尔(Michael)加成反应和环化反应是构建手性丁二酰亚胺类化合物简单有效的方法。文献[3]报道了利用金鸡纳碱催化的1,3-二羰基化合物与马来酰亚胺的不对称迈克尔加成反应,获得了具有高产率和高立体选择性的目标产物。文献[4-5]使用不同的亲核试剂与马来酰亚胺进行不对称迈克尔加成反应,来构建手性丁二酰亚胺骨架。文献[6]报道了在Cu(OAc)2/Ag2CO3的共催化作用下,马来酰亚胺和胺进行空气氧化胺化反应,以高产率获得了氨基马来酰亚胺。此外,马来酰亚胺还可以通过串联反应来构建更为复杂的丁二酰亚胺结构单元[7]。如文献[8]利用环己二胺衍生的叔胺-硫脲作为催化剂,实现了马来酰亚胺和吖内酯的不对称[4+2]串联反应,以高达99%的对映体过量值获得了桥环串联加成产物。到目前为止,虽然已报道了马来酰亚胺参与的多种类型的串联反应,但由于马来酰亚胺自身活性较低,其参与串联反应仍然比较困难。
引入具有吸电效应的溴原子,可以使溴代马来酰亚胺比马来酰亚胺具有更好的亲电性,更容易参与各种类型的反应。文献[9]研究了溴代马来酰亚胺在奎宁硫脲催化剂的作用下,和4-羟基香豆素发生的不对称迈克尔加成/烷基化串联反应,构建了含丁二酰亚胺骨架的多环加成产物。文献[10]进行了1,1′-联-2-萘酚(1,1′-bi-2-naphthol,BINOL)在碳酸钠的作用下,和3,4-二溴马来酰亚胺的双亲核取代反应。但利用N-苯基溴代马来酰亚胺来构建氨基丁二酰亚胺的方法还未见报道。
本文以N-苯基溴代马来酰亚胺为原料,与芳香胺进行亲核反应,合成了一系列氨基马来酰亚胺,该反应的条件简单温和,可直接抽滤获得高纯度的产物。该产物可以通过Pd/C还原反应获得丁二酰亚胺衍生物,为这类产物的合成提供一条实用的路径。
1 实验
核磁共振氢谱(1H nuclear magnetic resonace,1H-NMR)和核磁共振碳谱(13C nuclear magnetic resonace,13C-NMR)用Brucker-300型核磁共振仪测定,氘代二甲亚砜或者氘代氯仿为溶剂,四甲基硅烷为内标;薄层色谱硅胶和柱色谱硅胶均为青岛海洋化工厂生产;乙醇、四氢呋喃、丁醇、甲苯等试剂均为分析纯。底物溴代马来酰亚胺1根据文献[11]合成。
取代的氨基马来酰亚胺3的反应通式如式(1)所示。以产物3a的合成为例,其合成步骤为:在反应瓶中依次加入N-苯基溴代马来酰亚胺1a(5 mmol)、无水乙醇(10 mL)、苯胺2a(5 mmol)和碳酸氢钠(5 mmol),在75 ℃下搅拌反应直到原料消失(薄层层析法跟踪)。反应结束后,先冷却至室温,加入5 mL水搅拌10 min,使用布氏漏斗抽滤,即可获得淡黄色产物3a。
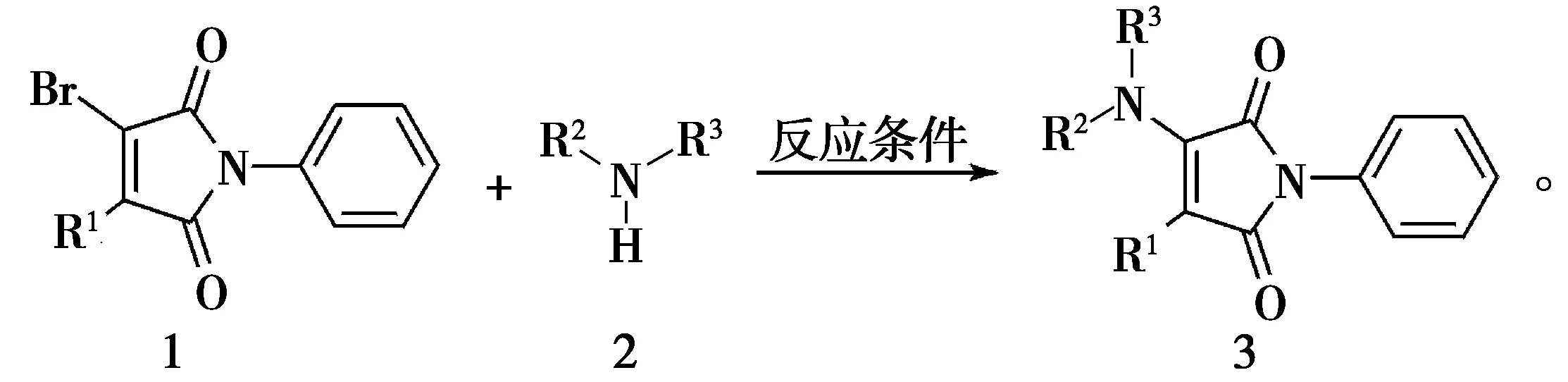
(1)
2 结果与讨论
2.1 结构表征
对产物进行了1H-NMR和13C-NMR表征,以产物3a为例,表征结果如图1所示。1H-NMR(氘代二甲亚砜为溶剂)分析表明:化学位移δ为9.86处的吸收峰归属氨基(N—H)中的氢;在δ为7.52~7.37处以及δ为7.16~7.11处的吸收峰为苯环上氢的特征吸收峰;δ为5.83处的吸收峰归属为氨基马来酰亚胺的一个烯烃氢。13C-NMR(氘代二甲亚砜作溶剂)分析表明:两个羰基碳的化学位移δ分别为171.1和166.5;氨基马来酰亚胺上与氮相连的烯基碳的δ为143.7,另一个烯基碳的δ为88.4;而与氮相连的两个苯环上碳(C—N)的δ为139.3和131.9;其余苯环碳的δ分别为129.3(2C),128.7(2C),127.3(1C),126.6(2C),123.9(1C),119.7(2C)。通过对1H-NMR和13C-NMR谱图实验数据的分析,可以证明产物3a的结构是正确的。
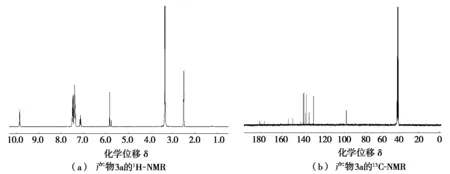
图1 产物3a的1H-NMR和13C-NMR
2.2 反应条件优化
在碱(1 mmol)催化下,以底物1a(1 mmol)和2a(1 mmol)合成3a为模板反应,见反应式(2)。对亲核取代反应条件进行优化,结果见表1。

(2)
由于在反应过程中会产生酸性溴化氢,故碱对反应起着重要作用,首先对碱进行了筛选。从表1中可以看出:当使用碳酸氢钠(NaHCO3)作碱时,取代产物的产率最好,可以达到90%(编号3)。紧接着对溶剂进行了考察,乙醇作为溶剂时,能给出很好的反应产率(编号3),而其他溶剂的效果均不理想(编号4~7)。该反应在水作溶剂的条件下,反应也能顺利进行(编号6),但产率较低。最后,对反应温度进行了考察。当反应温度由75 ℃降低至25 ℃,反应速率变慢(编号8);而升高温度至100 ℃,反应产率也没有明显变化(编号9)。通过单因素实验优化,得到了该反应的最佳条件:反应温度为75 ℃,n(1a)∶n(2a)=1∶1,碳酸氢钠作碱,乙醇为溶剂。
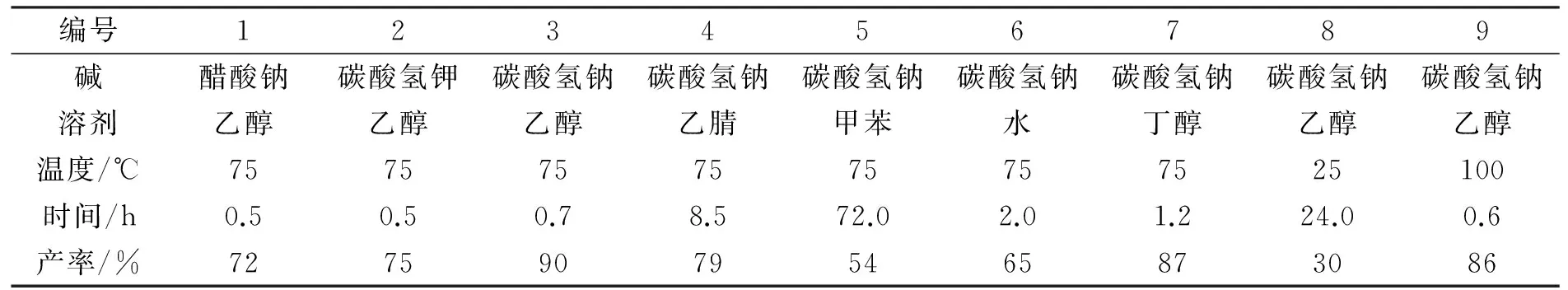
表1 亲核取代反应条件优化
2.3 底物扩展
在75 ℃条件下,以5 mmol N-苯基溴代马来酰亚胺和5 mmol取代胺为底物,以5 mmol碳酸氢钠为碱,10 mL乙醇为溶剂,考察了含不同取代基的N-苯基溴代马来酰亚胺和取代胺的亲核取代反应,反应式见式(3)。底物的扩展结果见表2。
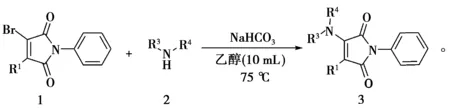
(3)
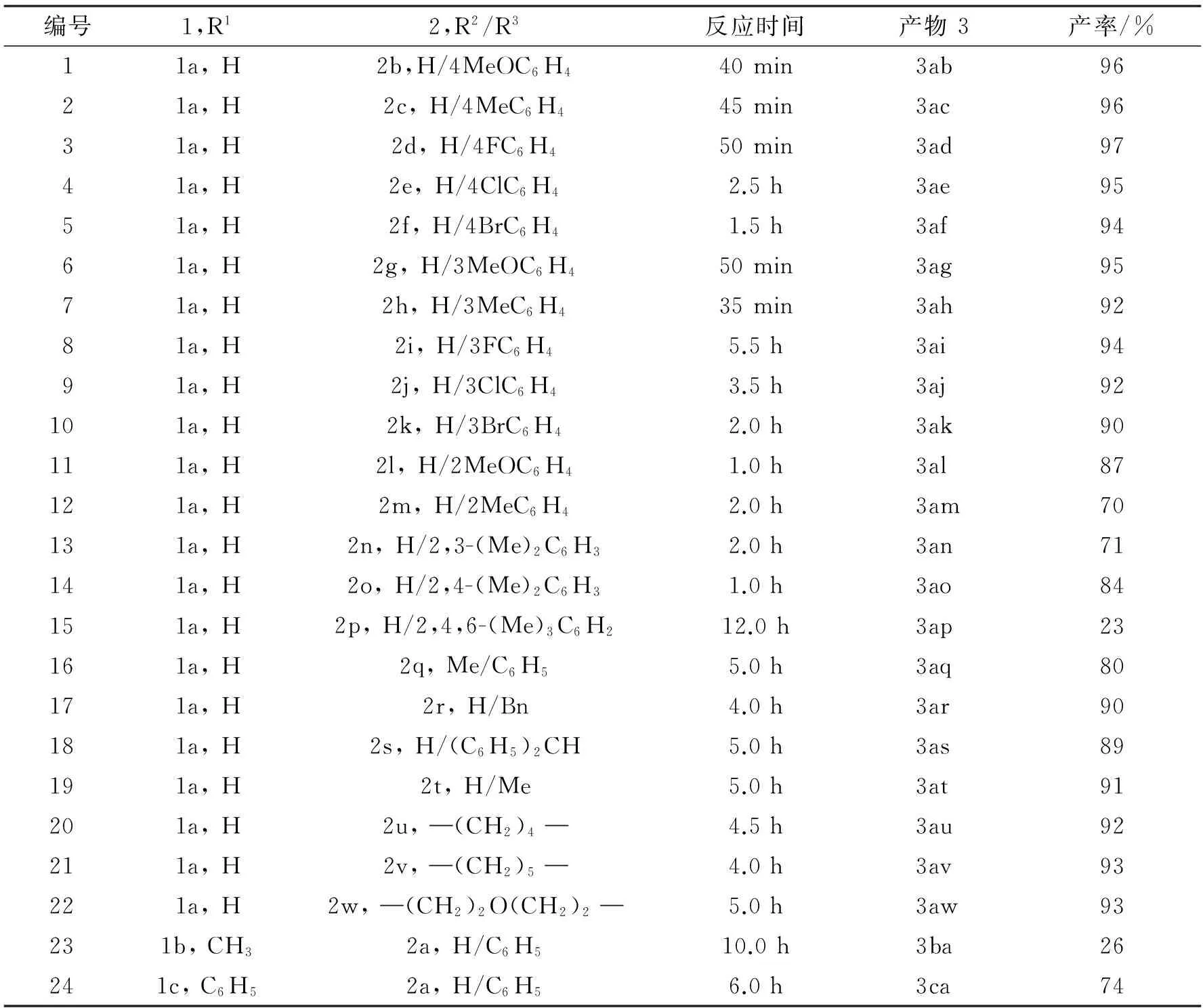
表2 底物的扩展结果
从表2中可以看出:取代的芳香胺以及脂肪胺与溴代马来酰亚胺都能进行亲核取代反应,产率在中等及以上。对于芳香胺,取代基的种类以及取代基位置对反应时间以及产率都有很明显的影响。对位取代苯胺参与该反应能取得极好的产率(3ab~3af,94%~97%产率),其中,对位溴代苯胺和对位氯代苯胺反应时间相对较长;间位取代苯胺的产率也很好,但反应时间有所延长(3ag~3ak, 90%~95%产率);邻位取代苯胺反应产率明显降低(3al~3am, 70%~87% 产率);多取代苯胺也可以很好地进行该反应(3an~3ap, 23%~84% 产率),但当2,4,6-三甲基苯胺参与反应时,反应时间延长到12.0 h,其产率也仅有23%,这可能是因为均三甲苯胺的空间位阻过大,不利于反应的进行。当N-甲基取代的苯胺作为底物时,反应也能顺利进行(3aq, 80%产率)。而对脂肪胺,不论是伯胺还是仲胺,反应都能很好地进行,但是反应时间都有所延长(3ar~3aw, 89%~93%产率)。当R1为甲基、苯基时,反应也可以进行(3ba~3ca,26%~74% 产率),只是当R1为甲基时,即使反应10.0 h,其产率也只有26%。
2.4 产物3a的衍生反应
N-芳基-α-氨基酸在合成上遇到的挑战激励着人们不断地进行探索[12]。氨基马来酰亚胺经过还原、水解反应,理论上可以获得N-芳基-α-天冬氨酸,本文进行了初步探索。图2为产物3a的衍生反应路线图。如图2所示,在Pd/C以及4 MPa H2中,先对产物3a进行催化还原,以91%的产率获得还原产物4。随后尝试将化合物4分别在酸性和碱性条件下进行水解。酸性条件下,大量原料4存在,未得到任何新物质;而在1 mL 50%(质量分数)的NaOH溶液和1 mL正丁醇(BuOH)中,以四正丁基溴化铵(Bu4N+Br-)为相转移催化剂,100 ℃条件下反应,最后以40%产率获得酰亚胺单水解产物5。
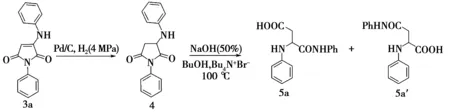
图2 产物3a的衍生反应路线图
3 结论
以乙醇为溶剂,碳酸氢钠作碱,在75 ℃条件下合成了25个氨基马来酰亚胺类衍生物。此反应条件较为温和,底物适用范围广。通过该反应制备氨基马来酰亚胺时,可以不采用过柱分离纯化的方法直接抽滤获得目标产物。在H2和Pd/C条件下,可以对产物3a进行还原。同时,还对还原产物4的水解条件进行了初步探讨,获得了酰亚胺单水解产物。
[1] MASHIKO T,HARA K,SHIBASAKI M,et al.En route to an efficient catalytic asymmetric synthesis of AS-3201[J].Journal of the American chemical society,2007,129(37):11342-11343.
[2] KAMEI K,MAEDA N,NOMURA K,et al.Synthesis,SAR studies,and evaluation of 1,4-benzoxazepine derivatives as selective 5-HT1A receptor agonists with neuroprotective effect:discovery of piclozotan[J].Bioorganic & midicanal chemistry,2006,14(6):1978-1992.
[3]BARTOLI G,BOSCO M,MELCHIORRE P,et al.Organocatalytic asymmetric conjugate addition of 1,3-dicarbonyl compounds to maleimides[J].Angewandte chemie international edition,2006,45(30):4966-4970.
[4] LIU S,MARUOKA K,SHIRAKAWA S.Chiral tertiary sulfonium salts as effective catalysts for asymmetric base-free neutral phase-transfer reactions[J].Angewandte chemie international edition,2017,56(17):4819-4823.
[5] KANG S H,KIM D Y.Diastereo-and enantioselective conjugate addition of α-substituted cyanoacetates to maleimides catalyzed by binaphthyl-based thiourea[J].Bulletin of the Korean chemical society,2015,36(9):2371-2374.
[6] AN Y L,ZHANG H H,ZHAO S Y,et al.Cu/Ag-Cocatalyzed aerobic oxidative amination and CuCl2-mediated aerobic oxidative chloroamination of maleimides[J].European journal of organic chemistry,2016,2016(32):5405-5414.
[7]WU L,WANG Y,SONG H,et al.Organocatalyzed highly diastereo-and enantioselective tandem sulfa-Michael-Mannich reaction of 2-mercaptoquinoline-3-carbaldimines with maleimides[J].Chemcatchem,2014,6(2):649-654.
[8] QIU S,LEE R,JIANG Z Y,et al.Highly enantio-and diastereoselective [4+2] cycloaddition of 5H-oxazol-4-ones with N-maleimides[J].The journal of organic chemistry,2016,81(17):8061-8069.
[9] 张勇,彭林,王立新,等.含琥珀酰亚胺结构单元的手性2,3-二氢呋喃衍生物的合成研究[J].中国抗生素杂志,2016,41(10):751-756.
[10] BRENET S,BAPTISTE B,EINHORN J,et al.BINOL-fused maleimides-a new class ofC2-symmetric chiral imides[J].European journal of organic chemistry,2013(6):1041-1045.
[11] TRUJILLO F J,CORREA B J,MIRANDA R,et al.Solvent-free synthesis of arylamides and arylimides,analogues of acetylcholine[J].Synthetic communications,2005,35(15):2017-2023.
[12] BACHMANN S,FIELENBACH D,JOERGENSEN K A,et al.Cu(I)-carbenoid-and Ag(I)-Lewis acid-catalyzed asymmetric intermolecular insertion of α-diazo compounds into N--H bonds[J].Organic & biomolecular chemistry,2004,2(20):3044-3049.
国家自然科学基金项目(21272230)
杨宇(1989-),男,四川宜宾人,博士生;王立新(1968-),男,通信作者,四川广安人,研究员,硕士,博士生导师,主要研究方向为催化不对称合成及其应用.
2017-03-15
1672-6871(2017)06-0091-04
10.15926/j.cnki.issn1672-6871.2017.06.018
O626.13
A
