HPLC法测定盐酸贝那普利片中贝那普利拉和盐酸(3S、1R)-贝那普利的含量
2017-07-19卜媛媛
卜媛媛 金 鹏 刘 艳
(淮安市食品药品检验所,江苏 淮安 223000)
HPLC法测定盐酸贝那普利片中贝那普利拉和盐酸(3S、1R)-贝那普利的含量
卜媛媛 金 鹏 刘 艳
(淮安市食品药品检验所,江苏 淮安 223000)
用HPLC法测定贝那普利拉和盐酸(3S、1R)-贝那普利含量。贝那普利拉在0.0763~30.51 µg/mL范围内线性关系良好,盐酸(3S、1R)-贝那普利在0.0263~10.504 µg/mL范围内线性关系良好。该法操作简便快捷,重现性好,结果准确可靠。
HPLC;贝那普利拉;盐酸(3S、1R)-贝那普利
1 目 的
建立灵敏的HPLC法,评价部分现行质量标准未控制贝那普利拉和盐酸(3S、1R)-贝那普利的样品质量。
2 仪器与试药
仪器:METTLER XP-6型电子分析天平、METTLER XSDU205型电子分析天平、岛津LC-20AB高效液相色谱、Aglient 1260高效液相色谱仪。试药:盐酸贝那普利对照品(UV法含量:100.0%,HPLC法含量:99.5%,中国药品生物制品检定所;批号:100768-201102)、贝那普利拉对照品(中国药品生物制品检定所;批号:100771-201001)、盐酸(3S、1R)-贝那普利对照品(CAT. NO.1048630 USP ROCKVILLE.MD LOT 10K261)、甲醇(色谱纯)、氯化钾、高氯酸钠、盐酸(分析纯)、水(纯化水),盐酸贝那普利片为省评价抽验样品。
3 实验方法
3.1 色谱条件:照高效液相色谱法(附录V D)测定,用十八烷基硅烷键合硅胶为填充剂;以氯化钾缓冲液(1000 mL中含0.090 mol氯化钾和0.010 mol盐酸,pH2.06)-水-甲醇(17∶25∶58)为混合溶液,每1000 mL混合溶液中加入612 mg的高氯酸钠为流动相;柱温为35 ℃;流速为1 mL/min。
3.2 对照品溶液制备:精密称取的盐酸贝那普利对照品(105 ℃减压干燥5 h)2.794 mg,置50 mL量瓶中,加流动相溶解并稀释至刻度,作为盐酸贝那普利对照品贮备液;精密称取贝那普利拉对照品6.102 mg,置40 mL量瓶中,加流动相溶解并定容至刻度,作为贝那普利拉对照品贮备液;精密称取盐酸(3S、1R)-贝那普利对照品2.626 mg,置50 mL量瓶中,加流动相溶解并定容至刻度,作为盐酸(3S、1R)-贝那普利对照品贮备液;精密量取上述3种贮备液各10 mL,置50 mL量瓶中,加流动相定容至刻度,作为混合对照品贮备液,精密量取混合对照品贮备液20 mL置40 mL量瓶中,加流动相定容至刻度,作为混合对照品溶液。
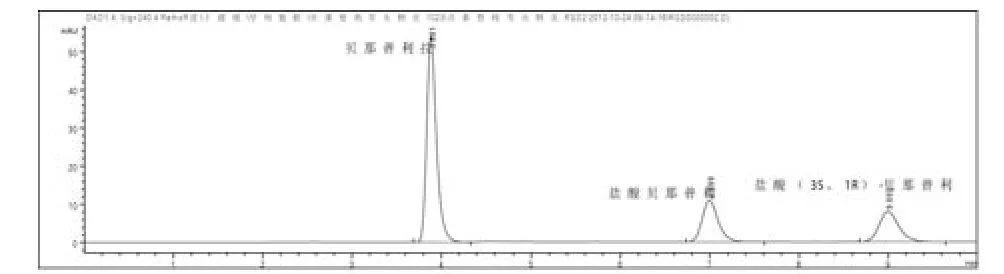
图1 混合对照品溶液色谱图

图2 供试品溶液色谱图
3.3 供试品溶液制备:取本品20片,精密称定,研细,精密称取细粉适量(约相当于盐酸贝那普利25 mg),置25 mL量瓶中,加流动相适量,超声处理15 min,放冷,用流动相稀释至刻度,摇匀,用滤膜过滤,作为供试品溶液。
3.4 测定法:按3.1项下色谱条件,精密量取对照品溶液和供试品溶液各20 µL,注入液相色谱仪,记录色谱图(图1、2),盐酸贝那普利峰与贝那普利拉峰和盐酸(3S、1R)-贝那普利峰的分离度分别为12.08、5.54。供试品溶液色谱图中如有贝那普利拉峰和盐酸(3S、1R)-贝那普利峰,按外标法以峰面积计算。
4 方法学验证
4.1 线性范围:精密量取3.2项下混合对照品贮备液0.1、1、2、5、10、20 mL,分别置40 mL量瓶中,加流动相定容至刻度,摇匀。分别精密量取上述溶液和混合对照品贮备液20 µL,注入液相色谱仪,测定峰面积,峰面积为横坐标,以浓度为纵坐标,进行线性回归。
贝那普利拉:回归方程为y=0.0369x-0.0077,R=0.9999,表明贝那普利拉在0.0763~30.51 µg/mL范围内线性关系良好。
盐酸(3S、1R)-贝那普利:回归方程为y=0.0428x-0.0113,R =0.9999,表明盐酸(3S、1R)-贝那普利在0.0263~10.504 µg/mL范围内线性关系良好。
4.2 检测限与定量限:精密量取混合对照品溶液20 μL,注入液相色谱仪,查看信噪比,不断逐步稀释直至达到规定,记录色谱图。贝那普利拉的检测限为0.008 μg/mL,定量限为0.023 μg/mL。盐酸(3S、1R)-贝那普利的检测限为0.011 μg/mL,定量限为0.026 μg/mL
4.3 稳定性:取供试品溶液(厂家:A有限公司,批号:X0254),在放置于HPLC进样盘的情况下,分别在制备后0、2、6、14、20、24 h进样,测得其峰面积,贝那普利拉和盐酸(3S、1R)-贝那普利RSD%分别为1.56%、0.84%。结果表明:供试品溶液在24 h内稳定。
4.4 重复性:按3.3项下供试品溶液制备方法,精密称取供试品(A公司,批号:X0254)6份,分别置25 mL量瓶中,加流动相溶解并定容至刻度,摇匀,过滤,分别精密量取20 µL,注入液相色谱仪,记录色谱图,按外标法以峰面积计算,贝那普利拉含量为:0.083%~0.086%、RSD%为1.2。盐酸(3S、1R)-贝那普利含量为0.075%~0.078%,RSD%为1.4。结果表明重复性良好。
4.5 准确度:精密称取供试品(厂家:B有限公司,批号:110406)细粉适量,按3.3项下方法制备9份供试品溶液,分别精密加入贝那普利拉对照品贮备液3、4、5 mL各3份,盐酸(3S、1R)-贝那普利对照品贮备液4、5、6 mL各3份,测定含量。贝那普利拉平均回收率为99.80%,盐酸(3S、1R)-贝那普利平均回收率为99.03%。
5 样品测定
取A公司30批次、B公司15批次、C公司8批次和D公司8批次样品按3.1~3.4项下方法测定,结果如下。
贝那普利拉:各厂家样品中均检出,A样品为0.03%~0.09%,B样品为0.09%~0.29%,C样品为0.08%~0.27%,D样品为0.32%~2.37%;盐酸(3S、1R)-贝那普利:D样品均未检出,B仅有1批检出,为0.01%,A和C样品均检出,分别为0.08%~0.20%、0.01%~0.04%。
A公司现行质量标准虽然设置了贝那普利拉检查项,但仅有4批检出,还有3批未检出有关物质,B公司现行质量标准没有设置贝那普利拉和盐酸(3S、1R)-贝那普利检查项,C公司现行质量标准没有设置盐酸(3S、1R)-贝那普利检查项,D公司现行质量标准虽然设置了贝那普利拉和盐酸(3S、1R)-贝那普利检查项,但贝那普利拉峰处有辅料干扰。我们建立的探索性检验方法,能够检出贝那普利拉和盐酸(3S、1R)-贝那普利,且不受辅料干扰,和盐酸贝那普利分离度良好,具有较高的灵敏度和准确度,可用于盐酸贝那普利片的有关物质检查。
[1] 国家食品药品监督管理局.新药转正标准[S].第四十五册,WS1-(X-347)-2003Z:86-87.
[2] 国家食品药品监督管理局.药品标准[S].YBH10332005.
[3] 国家食品药品监督管理局.药品标准[S].YBH05862004.
[4] 国家食品药品监督管理局.药品标准[S].YBH01662005.
[5] 国家食品药品监督管理局.药品标准[S].YBH13652004.
[6] 国家药典委员会.中国药典.二部[S].北京:中国医药科技出版社,2010:附录208-210.
R927.2
B
1671-8194(2017)16-0044-02
