miR-15b-5p在胃癌组织中的表达及其临床意义
2017-07-18万晓龙赵凌宇董水滢
万晓龙,赵凌宇,董水滢
西安交通大学第二附属医院消化内科(西安710004)
miR-15b-5p在胃癌组织中的表达及其临床意义
万晓龙,赵凌宇,董水滢
西安交通大学第二附属医院消化内科(西安710004)
目的:检测miR-15b-5p在胃癌中的表达变化,探索其对胃癌细胞功能的影响。方法:采用实时定量PCR检测35例胃癌组织及其对应的癌旁正常胃组织中miR-15b-5p的表达;构建miR-15b-5p过表达载体及合成miR-15b-5p抑制剂,并转染胃癌细胞系AGS;应用MTT法检测胃癌细胞增殖能力变化;采用流式细胞术分析miR-15b-5p对细胞周期和凋亡的影响。结果:miR-15b-5p在胃癌组织中的表达显著下调(P<0.01);转染miR-15b-5p过表达载体抑制了胃癌细胞的增殖,将细胞周期阻滞在G0/G1期,并诱导了细胞凋亡;转染miR-15b-5p抑制剂促进了胃癌细胞的增殖,使细胞进入S和G2/M期,并抑制细胞凋亡。结论:miR-15b-5p在胃癌中下调,抑制胃癌细胞的增殖,并诱导细胞凋亡。
胃癌全球范围内发病率仅次于肺癌、乳腺癌和结肠癌,位居第四位,病死率居恶性肿瘤的第二位[1]。中国是世界上胃癌高发的国家之一,胃癌的发病率居恶性肿瘤第二位,每年有近30万人死于胃癌,约40万新发病例[2]。尽管采取了包括手术切除、放射治疗、化学治疗以及其它综合性的治疗措施, 然而治疗效果欠佳。胃癌的发生发展涉及癌基因/抑癌基因的异常激活/杂合性丢失、免疫改变、表观遗传学改变等, 是一个多因素、多阶段的网络调控过程。近年来的研究表明核酸水平的调控也与胃癌的发生发展关系密切,特别是非编码微小RNA (microRNA,miRNA)通过调控其靶基因的表达影响胃癌发生发展。miRNA是一类长度为18~25nt,具有高度保守性的非编码单链小分子RNA,它通过调节靶基因的表达,参与细胞存活、增殖、分化和凋亡等生物学过程。miRNA通过与靶基因的mRNA的3′端非翻译区互补性结合,直接降解mRNA或抑制mRNA的翻译从而导致靶基因的表达下调[3]。最近的研究报道发现miR-15b-5p在肝癌中扮演者重要的角色[4],而miR-15b-5p在胃癌发生发展中作用尚未见报道。本研究旨在探讨miR-15b-5p在胃癌组织中的表达变化和其在胃癌中的作用。
材料与方法
1 材 料 西安交通大学第二附属医院外科手术切除的胃癌组织及其对应的癌旁正常胃组织35例,手术后均经病理检查确认,采集前经过医院伦理委员会批准及患者知情同意。所有患者手术前均未经化疗、放疗等治疗,样本收集后置于液氮中长期保存。人胃癌细胞系AGS由西安交通大学第二附属医院转化医学中心提供并保存。
2 仪器与试剂 -80℃冰箱(日本SANYO公司);CO2培养箱(英国RS Biotech公司);高通量微板测试系统(德国BMG Labtechnologies公司);流式细胞仪(美国FALS CALIBAR BD公司);实时定量PCR仪(美国Bio - Rad公司,iQ5 Multicolor)。新生胎牛血清(美国Gibico公司);RPMI 1640培养基(美国Gibco公司);MTT、RnaseA、碘化丙啶(美国Sigma公司);Annexin V-FITC凋亡试剂盒(美国BD BioScience公司);Trizol和Lipofectamine2000(美国Invitogen公司);qRT-PCR试剂盒和逆转录试剂盒(大连TaKaRa公司)。
3 miR-15b-5p过表达载体的构建及抑制剂的合成 通过生物信息学方法在miRbase查找miR-15b-5p序列(F5′ TTGAGGCCTTAAAGTACTGTAGCAGCACA TCATGGTTTACATGCTACAGTCAAGATGCGAATCATTATTTGCTGCTCTAGAATTTAAGGAAATTCAT3′ R)并在两端构建EcoR I和Hind III酶切位点,序列由上海生工生物工程有限公司合成。然后将该序列克隆到真核表达载体pcDNA6.2-GW/EmGFP中,并由上海生工生物工程有限公司克隆、筛选、测序鉴定。miR-15b-5p-inhibitor(5′ TGTAAACCATGATGTGCTGCTA3′)和miR-15b-5p-inhibitor阴性对照(Inhibitor NC,5′TGACTGTACTGACTCGACTG3′)也由上海生工生物工程有限公司合成。
4 细胞培养与转染 人胃癌AGS细胞系培养于含10%新生胎牛血清的RPMI 1640培养基,在5 % CO2,37 ℃孵箱中培养,取对数生长期的AGS细胞进行实验。实验分组为:pcDNA6.2空载体为对照组(miR-control)、miR-15b-5p过表达载体组(miR-15b-5p)、miR-15b-5p抑制剂阴性对照组(Inhibitor NC)、miR-15b-5p抑制剂组(miR-15b-5p inhibitor)。细胞在种植24h时,各组依照Lipofectamine2000(美国Invitogen公司)转染试剂说明书进行瞬时转染。
5 实时定量聚合酶链反应(qRT-PCR) 在临床胃癌样本组织、癌旁正常胃组织、转染24h时的AGS细胞中加入Trizol,用氯仿、异丙醇等提取总RNA。取1μ1总RNA,分别加入特异性茎环引物(内参U6-RT:5′ CGCTTCACGAATTTGCGTGTCAT3′;miR-15b-5p-RT:5′ GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTG CACTGGATACGACTGTAAAC3′),依照试剂盒说明书操作逆转录cDNA,反应温度:42℃ 15min,85℃ 5s。qRT-PCR反应,按照序列设计引物。内参U6 Forward: 5′GCTTCGGCAGCACATATACTAAAAT3′;Reverse: 5′CGCTTCACGAATTTGCGTGTCAT3′。miR-15b-5p Forward: 5′ATCCAGTGCGTGTCGTG3′;Reverse: 5′TGCTTAGCAGCACATCATG3′。扩增条件:95℃变性30s,60℃退火30s,72℃延伸30s,40个循环,72℃延伸5min终止反应。所有样品均设立3个复孔,用2-△△Ct法对结果相对定量分析。
6 MTT比色法实验 AGS细胞以5000个/孔接种于96孔板,培养基为200μl/孔。每组5个复孔,转染miR-15b-5p过表达载体和抑制剂后分别培养24、48、72h,每孔加入5mg/ml MTT溶液20μl,再培养4h,去掉上清液并加入150μl DMSO,震荡,在微板测试仪上检测光吸收值,波长为490nm。
7 流式细胞仪检测细胞周期 转染48h时收集各组细胞,每组3个复孔,用预冷的PBS洗涤2次,75%乙醇过夜固定;然后加浓度为100μg/ml碘化丙啶(PI)染液0.3ml,室温避光静置15min;采用流式细胞仪检测,激发波长是488nm,PI的红色荧光通过630nm的滤光片进行信号收集,通过Modfit LT软件分析DNA含量变化,进而分析细胞周期变化。
8 流式细胞仪检测细胞凋亡 收集转染48h的各组细胞,每组3个复孔,用预冷的PBS洗涤2次。用结合缓冲液500μ1悬浮细胞,分别加入5μ1 Annexin V/FITC和5μ1 20μg/ml的PI,混匀,室温避光静置15min。用流式细胞仪检测,PI受激发后发红色荧光,FITC发绿色荧光,检测结果用随机软件分析。
结 果
1 miR-15b-5p在胃癌组织中的表达 应用qRT-PCR检测35对胃癌组织及其癌旁正常胃组织miR-15b-5p的表达变化。结果显示,与癌旁正常胃组织相比,miR-15b-5p在胃癌组织中表达显著下调(P<0.01),平均下调至0.57倍(图1)。
2 miR-15b-5p对胃癌AGS细胞增殖的影响 在胃癌细胞系AGS细胞中分别转染空载体(miR-control)、miR-15b-5p过表达载体(miR-15b-5p)、抑制剂阴性对照(Inhibitor NC)、miR-15b-5p抑制剂(miR-15b-5p inhibitor),并在转染24h后通过qRT-PCR检测miR-15b-5p表达变化。结果显示,与miR-control组相比,miR-15b-5p过表达载体组miR-15b-5p表达显著上调(P<0.01),上调至27.5倍,而转染抑制剂后miR-15b-5p表达无显著变化(图2)。通过MTT比色法分析miR-15b-5p对胃癌细胞系AGS细胞增殖能力的影响。与miR-control组相比,过表达miR-15b-5p载体48,72h时均显著的降低了AGS细胞的增殖能力(P<0.01);与Inhibitor NC组相比,转染miR-15b-5p inhibitor48,72h时均显著的增强了AGS细胞的增殖能力(P<0.01)(图3),说明miR-15b-5p可抑制胃癌细胞系AGS细胞增殖。

与癌旁正常胃组织相比,*P<0.01
3 miR-15b-5p对胃癌AGS细胞周期的影响 在AGS细胞中分别转染miR-15b-5p过表达载体和miR-15b-5p Inhibitor 48h时,将其消化分撒为单细胞悬液,应用流式细胞仪检测细胞周期。miR-15b-5p过表达载体组与miR-control组相比,G0/G1期细胞数量显著增加(P< 0.01),S期细胞数量显著减少(P< 0.01),G2/M期细胞数量也减少(P< 0.01);miR-15b-5p Inhibitor组与Inhibitor NC组相比,G0/G1期细胞数量显著减少(P< 0.01),S期细胞数量显著增加(P< 0.01),G2/M期细胞数量无显著差异(图4)。证明miR-15b-5p使胃癌AGS细胞阻滞在G0/G1期,抑制细胞进入S和G2/M期进行增殖。

与miR-control组相比,*P<0.01
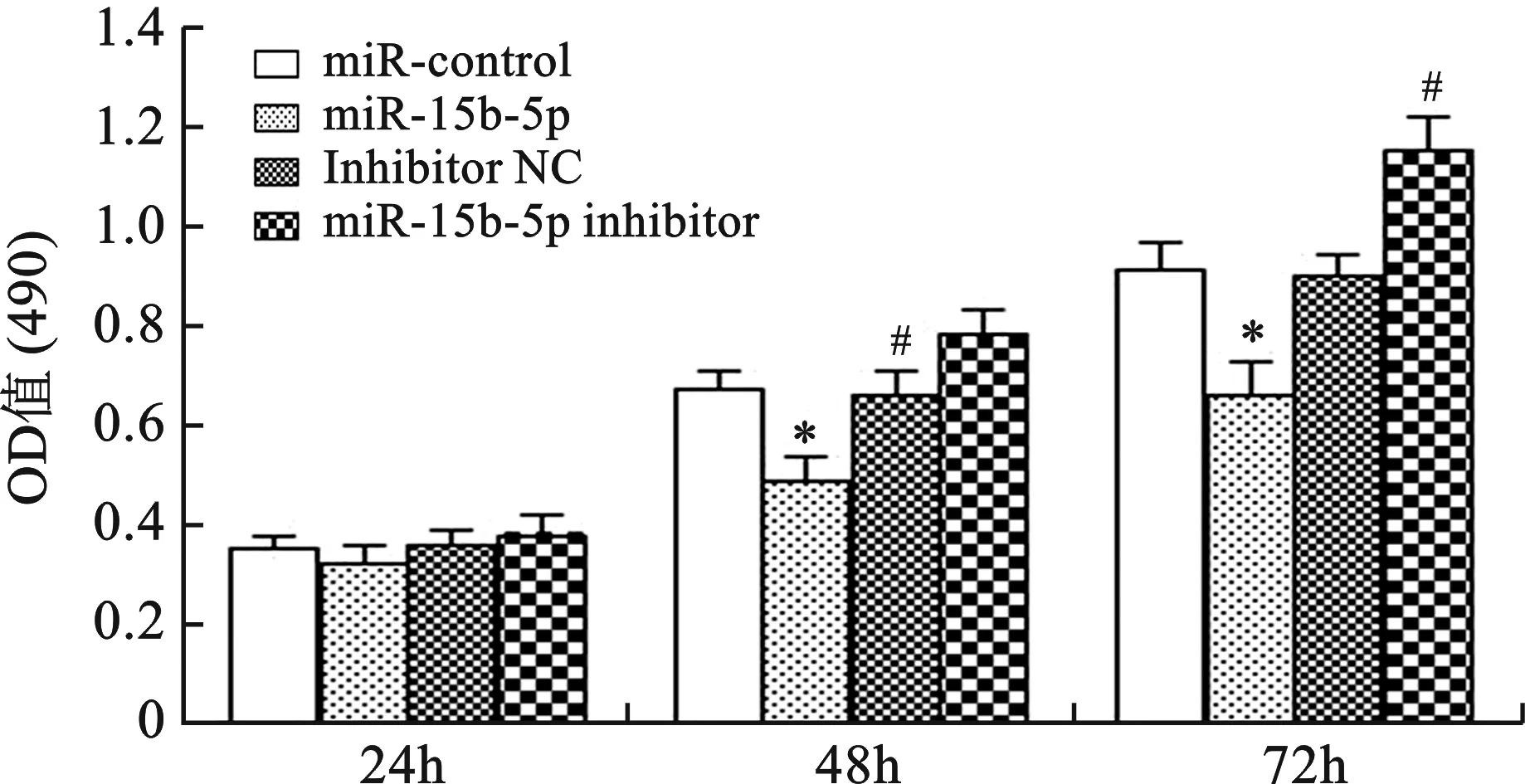
与miR-control组相比,* P<0.01;与Inhibitor NC组相比,# P<0.01

与miR-control组相比,* P<0.01;与Inhibitor NC组相比,# P<0.01
4 miR-15b-5p对胃癌AGS细胞凋亡的影响 在AGS中分别转染miR-15b-5p过表达载体和miR-15b-5p Inhibitor 48h时,收获细胞制备单细胞悬液,应用Annexin V + PI试剂盒染色,流式细胞仪检测。与miR-control组相比,miR-15b-5p过表达载体组早期凋亡细胞显著增加(P<0.01),晚期凋亡细胞也增加(P< 0.01);与Inhibitor NC组相比,miR-15b-5p Inhibitor组早期凋亡细胞显著减少(P<0.05),晚期凋亡细胞也减少(P< 0.05)(图5)。这表明miR-15b-5p可诱导胃癌AGS细胞凋亡。
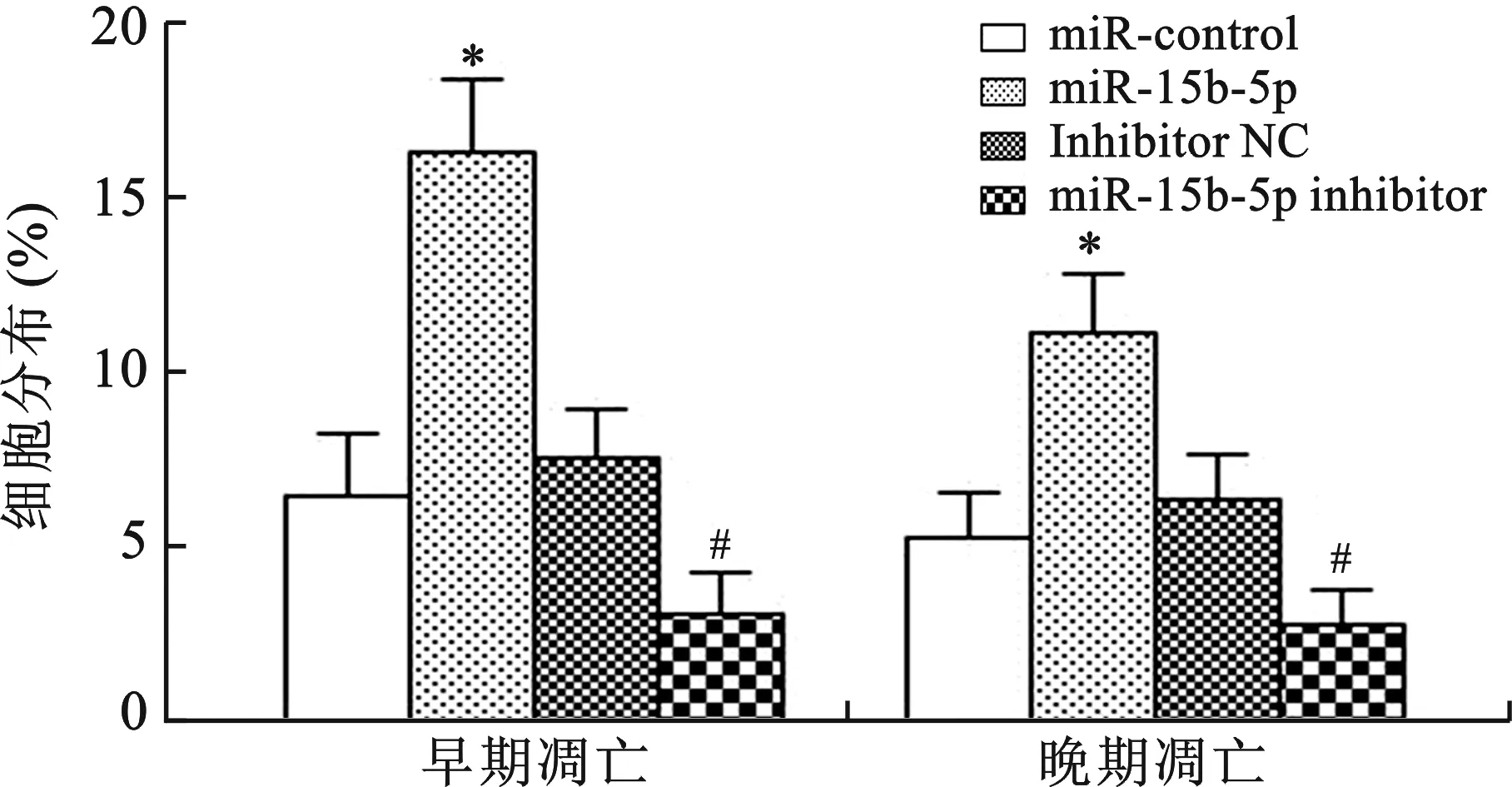
与miR-control组相比,*P<0.01;与Inhibitor NC组相比,#P<0.05
图5 miR-15b-5p对胃癌细胞系AGS细胞凋亡的影响
讨 论
研究表明miRNA在多种肿瘤组织中表达水平异常,这些miRNA通过靶向调控其下游靶基因的表达,从而参与肿瘤的发生发展,在肿瘤细胞的存活、增殖、凋亡、迁移、侵袭以及耐药等生物学特性方面都发挥着非常重要的调控作用[5-6]。不同的miRNA在不同的肿瘤中可能扮演着原癌基因或抑癌基因的角色。
目前有关胃癌的研究中,已经发现多种miRNA的表达异常与胃癌的发生、进展以及转移密切相关,例如,miR-15a、miR-124、miR-21、miR-23、miR-29a、miR-31、miR-34[7]。这些miRNA除了在胃癌中的表达有上调或下调的不同,它们也参与了胃癌的不同的发生发展过程。例如,miR-15a参与了胃癌细胞的增殖与侵袭,miR-29a参与了胃癌的转移,miR-124为胃癌临床分期的标志物。近来的研究发现miR-15b-5p参与了几种肿瘤的发生发展,但是miR-15b-5p在不同肿瘤中的表达变化并不相同,其原因可能是它在不同肿瘤中的作用机制不同。研究报道miR-15b-5p在鼻咽癌和膀胱癌中表达显著下调[8-9],而在肝癌中表达显著上调[4]。我们的研究发现,miR-15b-5p在胃癌中的表达显著下调,暗示其可能在胃癌进展中扮演抑癌基因的角色。
miR-15b-5p的生物学功能中,涉及更多的是调节肿瘤细胞生长与凋亡的功能。在不同肿瘤的进展过程中,其可能作为原癌基因存在,也可能作为抑癌基因基因发挥功能。例如,Guan等研究发现miR-15b-5p可促进子宫肌瘤细胞增殖[10]。Zhou等发现miR-15b-5p通过靶向调控TRIM29抑制鼻咽癌增殖和转移[8]。Sun等结果表明miR-15b-5p可抑制神经胶质瘤细胞增殖和侵袭[11]。Yang等发现miR-15b-5p在肝癌中通过靶向调控Rab1A诱导内质网应激和凋亡,并抑制肝癌细胞增殖[4]。本研究结果表明:miR-15b-5p可抑制胃癌AGS细胞增殖,使胃癌细胞阻滞在G0/G1期,并诱导凋亡。
综上所述,miR-15b-5p抑制胃癌细胞的增殖,阻断细胞周期,并诱导细胞凋亡,由此可见miR-15b-5p在胃癌中起着抑癌基因的作用。这一结果为寻找胃癌新的分子治疗靶标提供了实验依据,但是miR-15b-5p在胃癌进展过程中的作用机制有待于进一步探索。
[1] Arnold M,MooreSP,Hassler S. The burden of stomach cancer in indigenous populations: a systematic review and global assessment[J].Gut,2014,63(1): 64-71.
[2] Yang L. Incidence and mortality of gastric cancer in China[J]. World J Gastroenterol,2006,12(1): 17-20.
[3] 魏 疆,禄邵英.miR-27在胃癌中的表达及其作用研究[J]. 陕西医学杂志,2015, 44(5):620-624.
[4] Yang Y,Hou N,Wang X,etal. miR-15b-5p induces endoplasmic reticulum stress and apoptosis in human hepatocellular carcinoma, both in vitro and in vivo, by suppressing Rab1A[J]. Oncotarget,2015,6(18):16227-16238.
[5] Zhang B,Pan X,Cobb GP,etal. microRNAs as oncogenes and tumor suppressors[J]. Dev Biol,2007,302 (1): 1-12.
[6] Casalini P.MicroRNAs and future therapeutic applications in cancer [J].J Buon,2009,14 ( Suppl 1) : S17-22.
[7] Wu C,Zheng X,Li X,etal.Reduction of gastric cancer proliferation and invasion by miR-15a mediated suppression of Bmi-1 translation [J].Oncotarget,2016,7(12):14522-14536.
[8] Zhou XM,Sun R,Luo DH,etal. Upregulated TRIM29 promotes proliferation and metastasis of nasopharyngeal carcinoma via PTEN/AKT/mTOR signal pathway[J].Oncotarget,2016,7(12):13634-13650.
[9] Jiang X,Du L,Wang L,etal. Serum microRNA expression signatures identified from genome-wide microRNA profiling serve as novel noninvasive biomarkers for diagnosis and recurrence of bladder cancer[J]. Int J Cancer, 2015,136(4):854-862.
[10] Guan Y,Guo L,Zukerberg L,etal. MicroRNA-15b regulates reversion-inducing cysteine-rich protein with Kazal motifs (RECK) expression in human uterine leiomyoma[J]. Reprod Biol Endocrinol,2016,14(1):45.
[11] Sun G,Yan SS,Shi L,etal. MicroRNA-15b suppresses the growth and invasion of glioma cells through targeted inhibition of cripto-1 expression[J].Mol Med Rep,2016,13(6):4897-4903.
(收稿:2016-11-3)
胃肿瘤/病理学 @miR-15b-5p 细胞增殖 细胞凋亡 细胞周期
R363
A
10.3969/j.issn.1000-7377.2017.07.054
