肝X受体激动剂GW3965对高糖所致心肌细胞凋亡的影响及作用机制*
2017-07-18成永霞张大伟孙立新冯玉宽郭素芬刘贵波
成永霞,张大伟,孙立新,冯玉宽,郭素芬,刘贵波Δ
1.牡丹江医学院病理学教研室(牡丹江157011),2.牡丹江医学院解剖教研室(牡丹江157011)
·基础研究·
肝X受体激动剂GW3965对高糖所致心肌细胞凋亡的影响及作用机制*
成永霞1,张大伟2,孙立新1,冯玉宽1,郭素芬1,刘贵波2Δ
1.牡丹江医学院病理学教研室(牡丹江157011),2.牡丹江医学院解剖教研室(牡丹江157011)
目的:观察GW3965对高糖诱导的心肌细胞凋亡的影响,并初步探讨其作用机制。方法:取对数期H9c2心肌细胞,随机分为对照组(Control组)、高糖诱导组(高糖组)和高糖诱导+激动剂处理组(GW3965组)。GW3965组细胞加入10 μmol/L GW3965预处理24 h,之后高糖组和GW3965组细胞加入33 mmol/L葡萄糖继续诱导培养24 h。采用MTT法检测细胞存活率,流式细胞术检测细胞凋亡率,JC-1荧光染料法检测线粒体膜电位,Western blot检测LXRα、ERK和p38 MAPK信号通路相关蛋白的变化。结果:GW3965可以提高H9c2抑制细胞凋亡,提高细胞存活率,改善细胞线粒体膜电位变化,并抑制ERK和p38 MAPK通路活性。结论:GW3965通过介导LXRα和MAPK通路减轻高糖诱导的细胞凋亡和线粒体损伤,对心肌细胞具有保护作用。
近年来,伴随我国经济迅速发展,人民当代生活水平的提高以及饮食结构的改变,糖尿病呈现逐年攀升趋势。糖尿病心肌病(Diabetic cardiomyopathy, DCM)是糖尿病患者的主要心脏并发症之一,发病率高,危害性大,对患者健康造成严重危害,与心血管疾病的发生紧密相关,亦是导致糖尿病患者心力衰竭、休克甚至猝死的关键原因[1]。资料显示,约70 %~80 %的临床患者死于DCM[2]。虽然目前医学界针对预防和治疗DCM已经展开了大量研究,但收效甚微,并未显著减少临床患者的进展和死亡。因此深入探索DCM潜在的发病机制,寻找新型治疗靶点对提高临床患者的生存质量具有重大意义。
DCM的发病机制十分复杂,涉及众多因素。伴随研究者不断的深入发掘和探索,目前认为血糖及心肌能量代谢紊乱、钙水平异常、微血管病变、炎症反应、氧化应激、线粒体功能障碍和心肌细胞凋亡等多种因素参与DCM的发病与进展,其中心肌细胞凋亡是DCM重要病理机制之一,有效抑制心肌细胞凋亡将有利于DCM的防治[3]。
新近研究发现[4],肝X受体(Liver X receptors, LXRs)是人体内药物治疗潜在分子靶标,其激动剂可以被应用于多种疾病的治疗。有文献报道[3],LXRs激动剂T0901317能够减轻高糖诱导的氧化应激、线粒体损伤和细胞凋亡。GW3965作为一种人工合成的LXRs的另一种强效激动剂,亦被证明具有心肌保护作用,能够改变脂质代谢,诱导甘油三酸酯的合成,减轻缺血再灌注对心脏造成的损伤[5]。此外,GW3965还可以减轻胰岛素抵抗,抑制氧化应激、炎症反应、JNK和p38 MAPK信号通路的活性[6]。但GW3965对高糖诱导的心肌细胞凋亡及线粒体损伤的影响目前尚未见文献报道。
因此,本研究采用高糖诱导H9c2建立体外细胞模型,同时加入LXRs激动剂GW3965进行干预,结合MTT、流式细胞术、JC-1法及Western blot等实验技术分析细胞增殖、凋亡、线粒体膜电位以及ERK、p38 MAPK信号通路活性变化,探讨GW3965对高糖诱导的心肌细胞损伤的保护作用,初步明确具体分子机制。
材料与方法
1 材 料 大鼠心肌细胞H9c2(本实验室保存);胎牛血清(Hyclone公司);DMEM培养基(Gibco)公司;胰酶、RIPA裂解液、PMSF、BCA蛋白浓度测定试剂盒、一抗二抗去除液、IgG-HRP(碧云天生物公司);GW3965(Selleckchem公司);MTT(万类生物公司);DMSO(Sigma公司);细胞凋亡检测试剂盒、线粒体膜电位检测试剂盒(凯基生物公司);TEMED(AMRESCO公司);预染蛋白分子量标准(Fermentas公司);PVDF膜(Millipore公司);ECL发光液(七海生物公司);LXRα抗体(Abcam公司);p38 MAPK抗体(BOSTER公司);p-p38 MAPK、ERK、p-ERK抗体(Bioss公司);内参抗体β-actin(Santa公司);BSA(Biosharp公司)。
2 研究方法
2.1 细胞处理与分组:H9c2心肌细胞接种于含10 % FBS的DMEM培养基中,37 ℃,5 % CO2环境下常规培养。将生长至对数期的细胞随机分为三组:Control组、高糖组和GW3965组,胰酶消化细胞,显微镜下观察到细胞变圆后终止反应,收集细胞,低温条件下88 g离心3 min,去上清,加入1 ml培养基重新悬浮细胞。计数后按照实验分组重新将细胞接种于6孔板中,每孔4×105个,37 ℃培养箱内培养24 h后GW3965组细胞加入10 μmol/L激动剂处理24 h,之后高糖组和GW3965组细胞均加入33 mmol/L葡萄糖继续培养24 h。
2.2 MTT检测细胞活力:取对数期H9c2细胞,胰酶消化收集细胞悬液,计数并调整细胞密度。取5×103个细胞接种于培养板内,按照实验分组每组设置5个复孔,置于37 ℃,5 % CO2的培养箱内培养24 h,随后按照2.1的方法处理各组细胞。到达指定时间后向各孔内加入5 mg/ml的MTT,37 ℃孵育4 h,去除上清液,加入200 μl DMSO溶解细胞形成的紫色结晶,酶标仪测定各组细胞在490 nm波长处的吸光值。
2.3 流式细胞术分析细胞凋亡:待H9c2细胞生长密度达90 %左右,加入胰酶消化细胞,待细胞变圆后终止消化,离心收集细胞沉淀,加入培养液重新悬浮细胞,计数并调整细胞密度,接种于6孔板内,置于37 ℃,5 % CO2培养箱内培养24 h,随后按照2.1的方法处理各组细胞。到达指定时间后,309 g离心5 min收集细胞沉淀,PBS清洗2次,最后一次清洗残留约50 μl缓冲液,加入500 μl Binding Buffer吹打悬浮细胞,加入5 ml Annexin V-FITC,轻轻混匀后加入5 μl Propidium Iodide,室温避光孵育15 min,流式检测。
2.4 JC-1法检测线粒体膜电位:待H9c2细胞生长密度达90 %左右,胰酶消化收集细胞,离心收集细胞沉淀,加入培养液重新悬浮细胞,计数后接种于6孔板内,置于37 ℃,5 % CO2培养箱内培养24 h,随后按照2.1的方法处理各组细胞。到达指定时间后,550 g离心5 min收集细胞沉淀,PBS清洗2次,加入500 μl JC-1工作液,轻轻吹打悬浮细胞,37 ℃条件下孵育20 min,550 g离心5 min,1×Incubation Buffer清洗细胞2次,去除上清,加入500μl 1×Incubation Buffer重新悬浮细胞,上流式分析线粒体膜电位变化。右上象限(UR)代表正常细胞,右下象限(LR)代表凋亡细胞。
2.5 Western blot检测蛋白表达:收集各组细胞,加入含有1 % PMSF的RIPA裂解液,冰上静置5 min充分裂解细胞,12000 rpm、4 ℃离心10 min,收集上清液,得到样本蛋白;将BSA蛋白标准液进行梯度稀释,绘制标准曲线,测定蛋白浓度。组装电泳装置,分别制备浓缩胶(5 %)和分离胶(10 %),灌胶、梳子封口、30 min后拔出梳子;缓冲液稀释各样本蛋白,取40 μg进行上样,行SDS-PAGE,80 V恒压电泳2.5 h。PVDF膜转印、脱脂奶粉封闭,向杂交袋中加入对应一抗,4 ℃过夜孵育,TTBS清洗后加入IgG-HRP二抗,37 ℃孵育45 min。ECL显色、暗室曝光,扫描胶片,Gel-Pro-Analyzer软件分析目标条带光密度值。
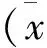
结 果
1 细胞凋亡率检测 高糖诱导后,心肌细胞H9c2凋亡率为(20.02±1.07)%,同Control组(7.76±1.02)%比较显著升高,差异具有统计学意义(P<0.01);采用激动剂GW3965干预后,细胞凋亡率为(13.04±1.19)%,与高糖组比较明显降低,差异具有统计学意义(P<0.01)。说明激动剂GW3965可以抑制高糖诱导的H9c2细胞凋亡。
2 细胞存活率检测 同对照组比较,高糖组OD值明显降低,差异具有统计学意义(P<0.01),说明高糖抑制细胞增殖。与高糖组比较,GW3965组OD值显著升高(P<0.01),细胞生存能力增强。由此可见,GW3965可以提高H9c2细胞的存活率(图1)。
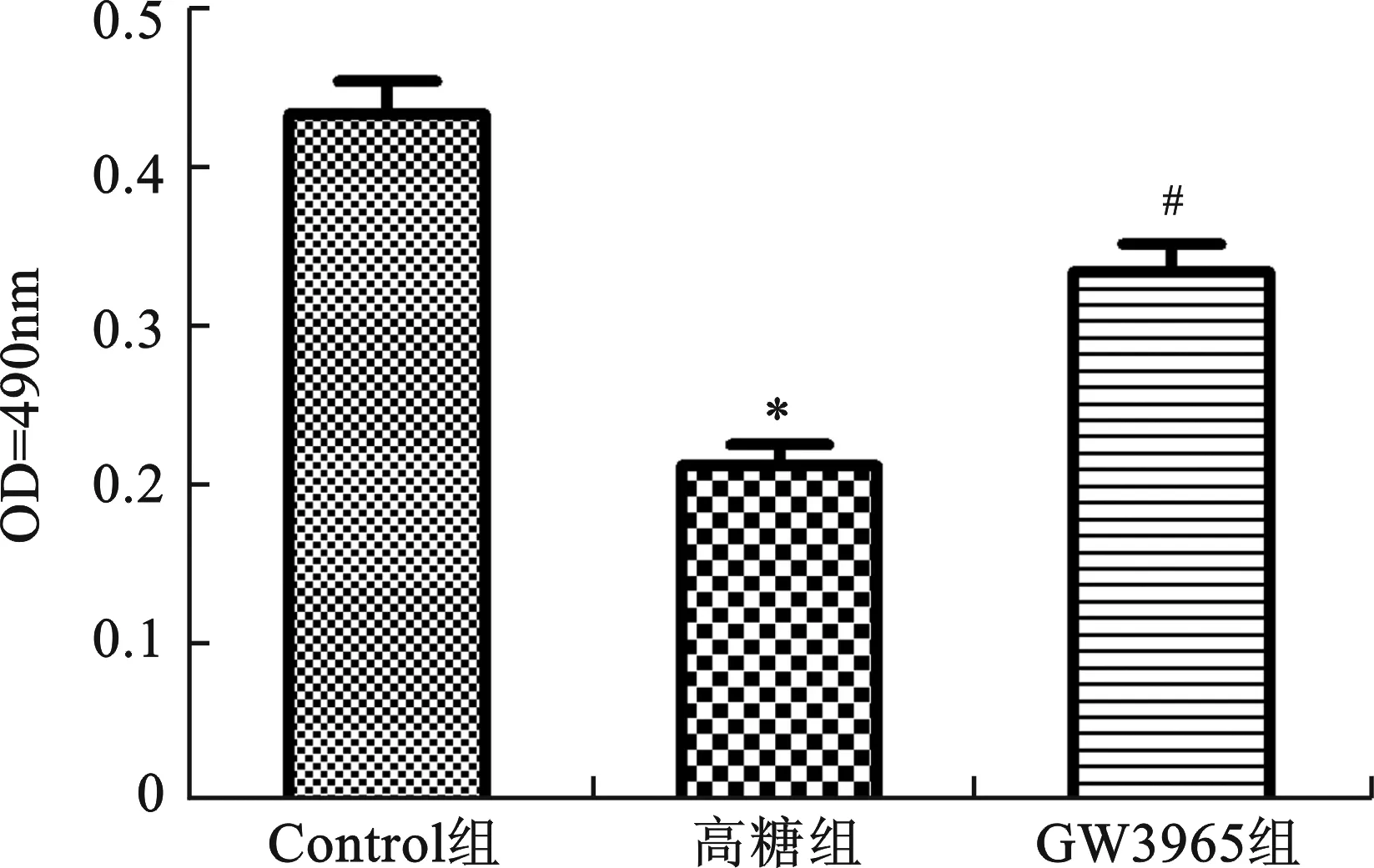
与Control组比较,*P<0.01;与高糖组比较,#P<0.01
3 线粒体膜电位检测 线粒体膜电位降低是细胞凋亡的早期时间,因此早期细胞凋亡率可以代表线粒体膜电位变化。结果显示,高糖组细胞凋亡率为(27.78±2.66)%,与Control组(3.22±1.71)%比较显著升高,具有统计学差异(P<0.01),说明高糖诱导后H9c2细胞线粒体膜电位显著下降;激动剂GW3965干预后,细胞凋亡率(11.73±1.65)%与高糖组比较显著下降,具有统计学差异(P<0.01)。由此可见,GW3965可以抑制H9c2细胞线粒体膜电位下降。

图2 Western blot检测凝胶电泳图
4 LXRα、MAPK通路蛋白检测 结果显示,同Control组比较,高糖组细胞内MAPK、ERK蛋白的表达无明显变化,LXRα、p-p38 MAPK、p-ERK蛋白的表达显著增加,差异具有统计学意义(P<0.01)。提示高糖处理H9c2细胞后,LXRα表达增加且MAPK信号通路被激活。采用激动剂GW3965处理后,同高糖组比较,LXRα蛋白的表达显著升高,p-p38 MAPK、p-ERK蛋白的表达显著下降,差异具有统计学意义(P<0.01,P<0.05)。由此可见,GW3965能够促进LXRα表达,并有效抑制MAPK信号通路活性(图2、3)。

与Control组比较,*P<0.01;与高糖组比较,#P<0.05,ΔP<0.01
讨 论
糖尿病心肌病(DCM)是一种特异性心肌病,发生于糖尿病患者心肌细胞原发性受损伤所引起广泛的心肌组织结构异常,最终表现为左心室肥厚、心肌收缩和(或)舒张功能障碍[7]。DCM能够诱导患者心功能异常,引发心肌缺血或心力衰竭,是临床糖尿病患者死亡的一个关键原因,发病机制错综复杂,目前尚不完全清楚。细胞凋亡是有机体由基因调控的细胞自由性死亡过程,又称细胞程序性死亡[8]。心肌细胞凋亡已经被业界证明是DCM病变的重要特点,一直备受关注。持续凋亡会引起心肌肥大、间质纤维化,使心肌组织受损,并进一步诱导心功能障碍[7],最终导致心理衰竭。因此有效抑制细胞凋亡被认为有利于DCM的治疗。
MAPK是生物体内重要信号转导通路之一,参与调控细胞增殖、生长、分化、分裂以及凋亡等多种生物学过程,主要包括JNK、ERK和p38三条途径。研究发现[9],p-p38 MAPK和p-ERK1/2的表达在糖尿病大鼠心脏中大量表达,并伴随心肌细胞凋亡。在2型糖尿病诱导的DCM大鼠模型中,曲美他嗪通过抑制ERK和p38 MAPK的磷酸化减少心肌纤维化,抑制心肌细胞凋亡[10]。此外,T0901317激活的LXRs可以调控MAPK通路活性,进而减轻脑出血造成的神经元细胞凋亡和脑损伤[11]。提示MAPK通路参与调控心肌细胞凋亡,很可能受LXRs表达的影响。
LXRs属于核受体超家族成员,通过结合特异性反应原件LXRE调节靶基因的表达,包括LXRα和LXRβ两种亚型。LXRα高表达于肝脏、肾脏、脂肪和肠等代谢活跃的组织,在胆固醇代谢、糖脂代谢、炎症反应和天然免疫中扮演重要角色。研究证实,LXRs在炎症反应、糖脂代谢、氧化应激和细胞凋亡中发挥重要调控作用,是人体中潜在的药理学靶受体。腹腔注射LXRs激动剂GW3965能够抑制心肌缺血再灌注引起的氧化应激、内质网应激,减轻线粒体功能障碍和心肌细胞凋亡[12]。人工合成的肝X受体T0901317能够降低ROS水平,恢复ΔΨm,抑制Cyt-C释放,降低促凋亡蛋白Bax的表达,减轻高糖诱导的H9c2细胞凋亡[3]。此外,GW3965在2型糖尿病小鼠模型中亦被证明能够改善心肌功能障碍[6]。但被GW3965激活的LXRα是否可以抑制高糖诱导的心肌细胞凋亡目前尚未证实。因此本研究对GW3965在高糖诱导的H9c2细胞凋亡中作用和机制进行初步探索。
本实验采用高糖诱导H9c2建立体外细胞模型,同时加入LXRs激动剂GW3965进行干预。采用MTT实验检测细胞存活率,流式细胞仪分析细胞凋亡率,JC-1荧光染料法检测线粒体膜电位,Western blot检测LXRα和MAPK通路相关蛋白的表达。结果显示,高糖诱导心肌细胞凋亡,抑制细胞增殖,GW3965可以显著提高H9c2细胞的存活率,降低高糖诱导的H9c2细胞凋亡,差异具有统计学意义。说明LRXs激动剂能够减轻高糖对心肌细胞造成的损伤,进一步证明了这类药物对心脏功能的保护效应。本实验还显示,高糖引起心肌细胞线粒体膜电位下降,采用GW3965干预后H9c2细胞线粒体膜电位显著升高,差异具有统计学意义。由此可见,GW3965对心肌细胞的保护作用同线粒体膜电位升高有关。此外,高糖作用于H9c2细胞后,LXRα的表达显著下降,p38 MAPK和ERK信号通路被激活,而GW3965能够增加LXRα的表达,减少p-p38 MAPK、p-ERK的表达,有效抑制p38 MAPK和ERK信号通路活性。
综上所述,GW3965激活的LXRs对心肌细胞具有保护作用,通过抑制ERK、p38 MAPK通路的活性提高线粒体膜电位,改善线粒体功能障碍,有效抑制心肌细胞早期凋亡。说明LXRs很可能是糖尿病心肌病临床治疗的潜在药理学靶受体。但本研究只是从细胞水平初步探讨了GW3965改善高糖诱导心肌细胞损伤的分子机制,后续仍需在动物水平进一步研究其对DCM大鼠心室功能的影响,从而为临床治疗提供充分的理论依据。
[1] Codinach Huix P, Freixa Pamias R. Diabetic cardiomyopathy: concept, heart function, and pathogenesis[J]. An Med Interna, 2002, 19(6):313-320.
[2] Krum H, Gilbert RE. Demographics and concomitant disorders in heart failure [J]. Lancet, 2003, 362(9378):147-158.
[3] Cheng Y, Feng Y, Zhu M,etal. Synthetic liver X receptor agonist T0901317 attenuates high glucose-induced oxidative stress, mitochondrial damage and apoptosis in cardiomyocytes [J]. Acta Histochem, 2014, 116(1):214-221.
[4] Viennois E, Mouzat K, Dufour J,etal. Selective liver X receptor modulators (SLiMs): what use in human health? [J]. Mol Cell Endocrinol, 2012, 351(2):129-141.
[5] Lei P, Baysa A, Nebb HI,etal. Activation of Liver X receptors in the heart leads to accumulation of intracellular lipids and attenuation of ischemia-reperfusion injury [J]. Basic Res Cardiol, 2013, 108(1):323.
[6] He Q, Pu J, Yuan A,etal. Liver X receptor agonist treatment attenuates cardiac dysfunction in type 2 diabetic db/db mice [J]. Cardiovasc Diabetol, 2014, 13(149).
[7] 赵莉平, 安 荣, 丁 雯,等. 糖心乐对糖尿病心肌病大鼠心功能及心肌细胞凋亡的影响 [J]. 陕西中医, 2014, 35(5):615-618.
[8] 安 荣,孔 维,赵莉平,等.糖心乐对糖尿病心肌病大鼠心肌Bnip-3、Bcl-2表达的影响[J].陕西中医,2013,34(9):1248-1251.
[9] Soetikno V, Sari FR, Sukumaran V,etal. Curcumin prevents diabetic cardiomyopathy in streptozotocin-induced diabetic rats: possible involvement of PKC-MAPK signaling pathway [J]. Eur J Pharm Sci, 2012, 47(3):604-614.
[10] Zhang L, Ding WY, Wang ZH,etal. Early administration of trimetazidine attenuates diabetic cardiomyopathy in rats by alleviating fibrosis, reducing apoptosis and enhancing autophagy [J]. J Transl Med, 2016, 14(1):109.
[11] Wu CH, Chen CC, Lai CY,etal. Treatment with TO901317, a synthetic liver X receptor agonist, reduces brain damage and attenuates neuroinflammation in experimental intracerebral hemorrhage [J]. J Neuroinflammation, 2016, 13(1):62.
[12] He Q, Pu J, Yuan A,etal. Activation of liver-X-receptor alpha but not liver-X-receptor beta protects against myocardial ischemia/reperfusion injury [J]. Circ Heart Fail, 2014, 7(6):1032-1041.
(收稿:2017-01-10)
The effect of liver X receptors agonist GW3965 on myocardial apoptosis induced by high glucose and its mechanism
Cheng Yongxia, Zhang Dawei,Sun Lixin,et al.
Pathology Teaching and Research Section,Mudanjiang Medical University (Mudanjiang 157011)
Objective: To explore the effect of GW3965 on myocardial apoptosis induced by high glucose and its mechanism. Methods: H9c2 myocardial cells were randomly divided into three groups: control group, high glucose group and GW3965 group. Cells in GW3965 group were pretreated with 10μmol/L GW3965 for 24 h. Then cultures in high glucose group and GW3965 group were induced by 33 mmol/L glucose for 24 h. MTT was used to detect cells survival. The apoptosis was detected by flow cytometry and mitochondrial membrane potential by JC-1 fluorescence staining. Western blot was used to detect the expression of proteins related to LXR, ERK and p38 MAPK signal pathway. Results: GW3965 could inhibit the apoptosis of H9c2 cells, increase the rate of cells survival and influence mitochondrial membrane potential. GW3965 inhibited the activity of ERK and p38 MAPK pathway. Conclusion: GW3965 can inhibit the apoptosis and mitochondrial damage induced by high glucose via regulating LXRα and MAPK pathway, resulting a protective effect on myocardial cells.
Myocardium @GW3965 Hyperplycemia Diabetic cardiomyopathies/physiopathology @Liver X receptors Apoptosiss
*国家青年基金资助项目(81500629)
心肌 @GW3965 高血糖症 糖尿病心肌病/病理生理学 @肝X受体 细胞凋亡
R392.3
A
10.3969/j.issn.1000-7377.2017.07.001
△通讯作者
