肾综合征出血热患者血清sVCAM-1和IL-18含量变化及其相关性分析*
2017-07-18史东沙董艳迎董宇为
高 娟,史东沙,董艳迎, 陈 晞,王 喆,董宇为,谢 明△
1.西安交通大学医学部免疫学与病原生物学系(西安 710061),2.西安高新医院(西安710075),3.西安交通大学第二附属医院泌尿科(西安710004),4.西安交通大学第一附属医院(西安 710061)
肾综合征出血热患者血清sVCAM-1和IL-18含量变化及其相关性分析*
高 娟1,2,史东沙1,董艳迎1, 陈 晞3,王 喆1,董宇为4,谢 明1△
1.西安交通大学医学部免疫学与病原生物学系(西安 710061),2.西安高新医院(西安710075),3.西安交通大学第二附属医院泌尿科(西安710004),4.西安交通大学第一附属医院(西安 710061)
目的:探讨血管细胞黏附分子-1(VCAM-1)及白细胞介素18(IL-18)在肾综合征出血热(HFRS)发病中的作用以及两者之间相关性,并观察其与肾损伤之间的关系。方法:采用双抗体夹心酶联免疫吸附(ELISA)法测定不同疾病分期52例HFRS患者血清sVCAM-1和IL-18含量变化,通过全自动生化分析仪测定其血尿素氮(BUN)和血肌酐(Cr)的水平变化,进行相关性分析,并以10例健康志愿者血清作为对照组进行对比。结果:HFRS发病早期、少尿期及多尿期及恢复期患者血清中sVCAM-1和IL-18均较正常对照组显著升高,于少尿期达高峰,多尿期下降,至恢复期患者血清中VCAM1和IL-18已接近正常水平。通过与肾损伤指标BUN和Cr的相关性分析,发现sVCAM-1和IL-18均与BUN和Cr显著相关;通过对患者血清中VCAM-1和IL-18的相关性分析,发现VCAM-1和IL-18也显著相关。结论:HFRS患者血清sVCAM-1和IL-18参与了HFRS的发病过程,可反映其病情程度,并与肾损伤程度呈正相关。
肾综合征出血热(Hemorrhagic fever with renal syndrome,HFRS)的基本病变是全身微小血管弥漫性损伤和通透性增加,且随着病期的进展而加重[1]。由于内皮细胞是血管尤其是毛细血管的主要组成部分,因此血管内皮细胞的损伤和通透性增加將导致血浆的外渗,从而引起一系列的临床症状。
近年来,对HFRS患者细胞免疫功能的研究发现,HFRS患者特异性细胞免疫功能明显增强[2]。活化的淋巴细胞分泌的IFN-γ、IL-6、TNF-α是引起HFRS血管通透性增加重要因素[3],同时IFN-γ、IL-6、TNF-α等细胞因子活化的NK细胞和CTL细胞可能参与全身小血管和毛细血管的广泛损伤[4-5]。研究证明HFRS患者血清中的细胞因子如TNF-α、VEGF的水平明显高于正常人,且与疾病的发展及病情的严重程度呈正相关[6-7]。白细胞与内皮细胞的结合需要细胞间黏附分子的协助,血管细胞黏附分子-1(Vascular cell adhesion molecule-1, VCAM-1)是主要表达于血管内皮细胞上的细胞间黏附分子(CAM),共同参与组成淋巴细胞活化的协同刺激信号,直接参与特异性T淋巴细胞的活化。白细胞介素18(Interleukin-18,IL-l8) 由活化的单核细胞释放,作用于感染的血管内皮细胞后可能诱导或上调血管内皮细胞表面粘附分子如VCAM-1的表达。研究发现,血管内皮细胞结构性表达IL-18Rβ, IL-18作用于VECs表面的IL-18R,可诱导该细胞表面粘附分子VCAM-1的表达。促进T淋巴细胞的活化。本课题采用双抗体夹心ELISA法对HFRS患者血清中可溶性血管细胞黏附分子-1(sVCAM-1)和白细胞介素18(IL-18)进行检测, 研究HFRS的发病过程与VCAM-1和IL-18的相关性,探讨其在HFRS在发病过程中的作用。
资料与方法
1 一般资料 随机选取西安市传染病医院住院的HFRS患者52例,男40例,女12例,年龄17~63岁;甲及乙型肝炎病毒感染指标均为阴性,其中发热期11例,低血压休克期4例,少尿期13例,多尿期14例,恢复期10例(由于4例低血压休克期患者均为发热及低血压休克两期重叠,为统计方便将其归入发热期统称为发病早期);根据HFRS的临床标准,轻型24例,中型14例,重型14例。所有病例的诊断均符合1997年卫生部颁发的诊断标准,所选取的病例在采血前2周内未应用免疫抑制剂及糖皮质激素类药物治疗。另外选择10例正常健康献血者作为对照组。
2 研究方法
2.1 主要试剂:检测sVCAM-1所使用双抗体夹心ELISA试剂盒为Human sVCAM-1 ELISA Kit,购自深圳晶美生物工程有限公司;检测IL-18所使用双抗体夹心ELISA试剂盒为Human IL-18ELISA Kit,购自美国RD公司。
2.2 检测方法:每次采血均为清晨空腹采肘静脉血3ml放入肝素锂抗凝试管中,3500r/min离心15min,分离血清分装,-20℃保存备用,每份血样从采集、离心至贮存整个过程均在2h之内完成。应用双抗体夹心ELISA法,将患者血清按照1∶50稀释后检测待测血清中sVCAM-1的含量,按照1∶100稀释后检测待测血清中IL-18的含量,试验过程严格按照试剂盒说明书进行。最后均在450nm处检测样品OD值,通过酶标仪换算而自动读取样品中sVCAM-1和IL-18的浓度值。
2.3 统计学方法: 应用SPSS 18.0统计学软件,计量资料以均数±标准差表示,同一指标各组样本均数之间应用组间SNK-q检验,两变量间关系采用直线相关分析;以P<0.05认为差异有统计学意义。
结 果
1 不同临床分期的HFRS患者血清sVCAM-1水平的变化 HFRS患者在发病早期(发热期及低血压休克期)血清sVCAM-1就开始升高,此期血清尿素氮(BUN)和血肌酐(Cr)水平已开始升高,分别为(8.762±6.214)mmol/L和(127.713±71.030)μmol/L;少尿期患者血清sVCAM-1含量达到峰值,BUN和Cr水平亦达到峰值分别为(48.086±84.566)mmol/L和(480.492±239.095)μmol/L;进入多尿期后sVCAM-1及BUN和Cr开始下降;进入恢复期血清sVCAM-1含量较峰值有所下降但仍高于正常对照组(P<0.05),而此期BUN及Cr水平接近正常对照(9.2857±2.992)mmol/L和(142.6857±128.902)μmol/L;sVCAM-1的变化与病程各期的变化基本一致(图1)。
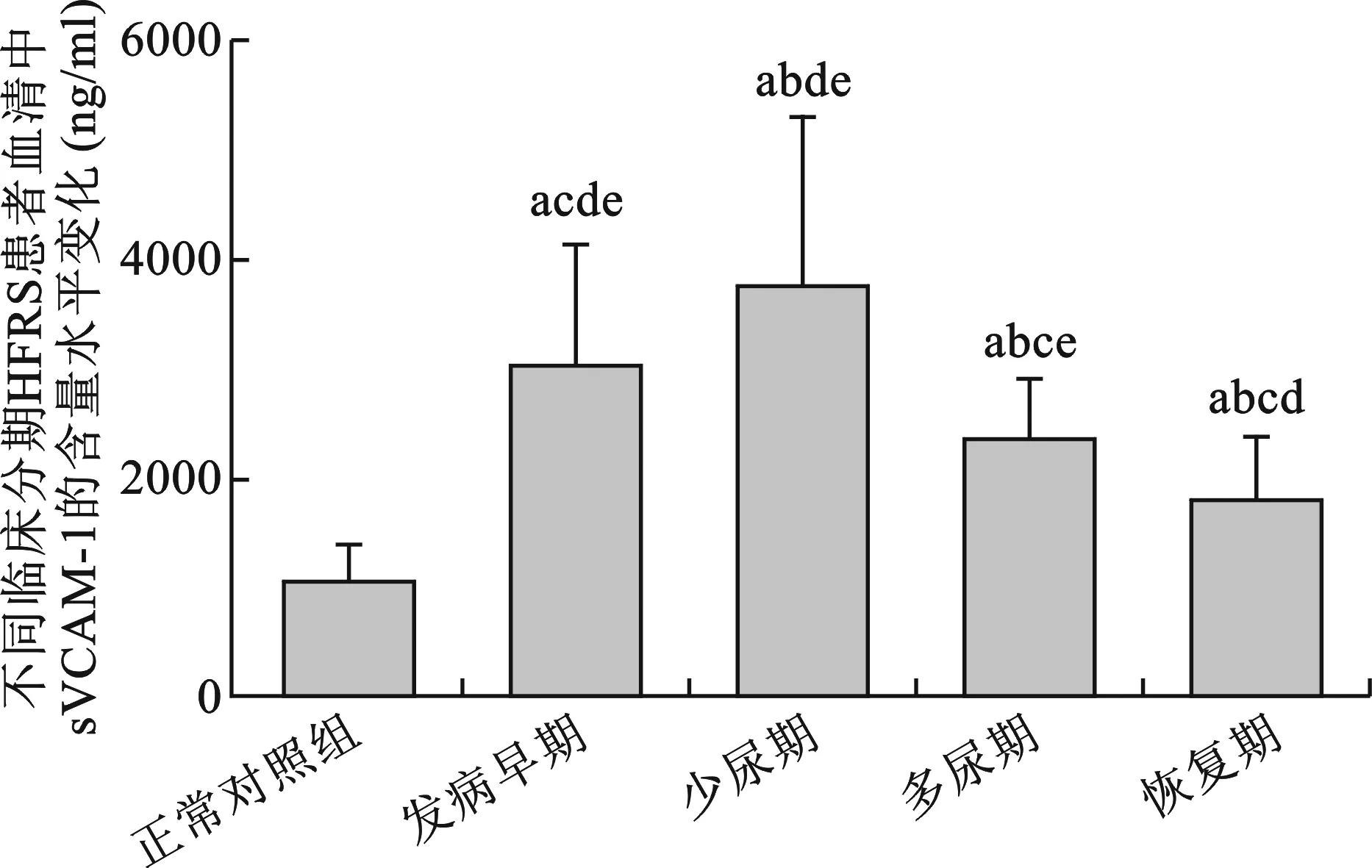
a:与正常对照组比较,P<0.05;b: 与发病早期比较,P<0.05;c:与少尿期比较,P<0.05;d: 与多尿期比较,P<0.05;e: 与恢复期比较,P<0.05
图1 不同临床分期HFRS患者血清中sVCAM-1的含量水平变化(ng/ml)
2 不同临床分期的HFRS患者血清sVCAM-1水平与肾功能指标的关系 将sVCAM-1与BUN、Cr进行相关性分析,发现HFRS患者血清sVCAM-1的水平与血清BUN(r=0.665,P<0.01))及CR(r=0.601,P<0.01)的水平具有显著相关性,且呈正相关,表明血清sVCAM-1水平与肾功能损伤程度相关。
3 不同临床类型HFRS患者血清sVCAM-1含量水平的比较 HFRS各型患者血清sVCAM-1水平较正常对照组[(1035.108±1346.195)ng/ml]明显升高,差异均具有统计学意义(P<0.05);其中血清sVCAM-1水平由低到高分别为:HFRS轻型组[(2425.904±988.798)ng/ml]、中型组[(2682.088±1449.041)ng/ml]和重型组[(3084.108±358.287)ng/ml],各型患者相比较,差异亦有统计学意义(P<0.05)。血清sVCAM-1水平与疾病的严重程度有关,见图2。
4 不同临床分期的HFRS患者血清IL-18水平的比较 HFRS患者血清中IL-18水平在发病早期[(125.5998±20.2043)ng/ml]、少尿期[(209.1144±53.9325) ng/ml]、多尿期[(169.2810±41.5990) ng/ml ]、恢复期[(105.3236±21.8850) ng/ml]均高于健康对照组[(93.5625±19.0220)ng/ml]; HFRS患者血清中IL-18的水平从发热期开始增高、少尿期达高峰、多尿期开始下降,恢复期仍高于正常对照组。各型患者IL-18相比较,差异均有统计学意义(P<0.05),见图3。

a:与正常对照组比较,P<0.05;b: 与轻型组比较,P<0.05;c:与中型组比较,P<0.05;d: 与重型组比较,P<0.05
图2 不同临床分型HFRS患者血清中sVCAM-1的含量水平变化(ng/ml)
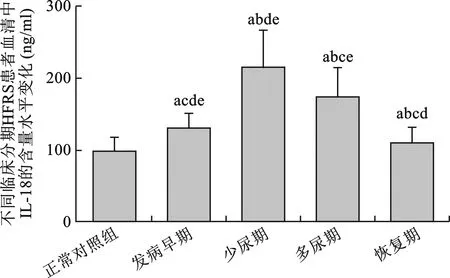
a:与正常对照组比较,P<0.05;b: 与发病早期比较,P<0.05;c:与少尿期比较,P<0.05;d: 与多尿期比较,P<0.05;e: 与恢复期比较,P<0.05
图3 不同临床分期HFRS患者血清IL-18含量水平变化(ng/ml)
5 不同临床分期的HFRS患者血清IL-18水平与肾功能指标的关系 将IL-18与BUN、Cr进行相关性分析,结果显示,HFRS患者血清IL-18含量水平与血清BUN(r=0.608,P<0.05)及血清CR(r=0.591,P<0.01)水平具有显著相关性,且呈正相关,表明血清IL-18水平与肾功能损伤程度相关。
6 不同临床类型HFRS患者血清IL-18含量水平的比较 轻症[(133.2266±30.1220) ng/ml]、中症[(161.5663±41.6895) ng/ml]、重症组[(195.2210±60.2211) ng/ml]HFRS患者血清中IL-18水平均高于健康对照组[(93.4526±19.0588) ng/ml],差异有统计学意义(P<0.05); HFRS患者血清IL-18水平从轻症组、中症组到重症组水平依次增高(P<0.05),见图4。

a:与正常对照组比较,P<0.05;b: 与轻型组比较,P<0.05;c:与中型组比较,P<0.05;d: 与重型组比较,P<0.05
图4 不同临床分型HFRS患者血清IL-18含量水平变化(ng/ml)
7 肾综合征出血热患者血清sVCAM-1和IL-18相关性分析 将不同临床分期HFRS患者血清sVCAM-1与IL-18进行相关性分析,结果显示血清sVCAM-1的水平与血清IL-18的水平具有显著相关性(相关系数r=0.836 ,P<0.01)。
讨 论
细胞粘附分子是由细胞产生的介导细胞与细胞间或细胞外基质之间相互作用的一类膜表面糖蛋白分子[8]。血管细胞黏附分子-1(VCAM-1)是一种重要的细胞黏附分子,属于免疫球蛋白超家族成员,可在IL-1、TNF-α等细胞因子作用后活化的内皮细胞表面表达,分子量100KD或110KD,是白细胞表面的整合素VLA-4的配体,参与淋巴细胞的活化、迁移以及淋巴细胞向炎症部位浸润,参与NK细胞黏附和迁移,通过介导细胞与细胞、细胞与细胞外基质间的相互作用,在机体免疫及炎症反应中发挥重要作用[9-10]。IL-l8是一种炎症性细胞因子,又称干扰素诱生因子,主要由活化的单核细胞分泌,IL-18R分布于单核细胞、T淋巴细胞、NK细胞、B淋巴细胞、血管内皮细胞及平滑肌等细胞表面,IL-l8通过与细胞表面IL-18受体(IL-18R)结合而发挥生物学作用,IL-l8具有增强血管内皮细胞粘附分子表达的作用。研究发现,血管内皮细胞结构性表达IL-18Rβ,IL-18作用于VECs表面的IL-18R,可诱导该细胞表面粘附分子VCAM-1的表达[11]。
肾综合征出血热是以肾脏损害为主伴有全身多系统多脏器损伤的自然疫源性疾病,由汉坦病毒感染引起。其发病机制是病毒直接作用和免疫病理损害,基本病变为全身微小血管弥漫性损伤,由于血浆外渗造成有效血容量不足,引起血压下降,肾小球滤过率减少和少尿[12];而小血管损伤的病理变化是内皮细胞的肿胀和退行性病变,且随着病期的进展而加重[13]。其由多种炎症反应和免疫反应介导,受免疫调节分子调控,如DcR3(诱骗受体3)的上调程度就与疾病的发展阶段和疾病的严重程度有关,同时也可以也增强单核细胞的粘附能力,同时也可以诱导VCAM-1在内皮细胞中的表达[14]。血管内皮细胞是汉滩病毒主要的靶细胞,HFRS发病过程中增强的细胞免疫攻击病毒感染的血管内皮细胞造成的免疫损伤是HFRS重要的发病机制。血管内皮细胞表达的VCAM-1为HTNV-special CD8+Tcell的活化提供共刺激信号,促进其活化,活化的HTNV-special-CD8+Tcell在清除病毒的同时亦破坏病毒感染的血管内皮细胞,进而引起血管通透性的增加。研究表明,HTNV-special-CD8+Tcell 和HFRS发病过程密切相关 ,测定HFRS患者不同临床分期的HTNV-special-CD8+Tcell 水平,可用于疾病状态的监测[15]。本研究结果显示:HFRS患者血清sVCAM-1含量较正常对照组明显升高(P<0.05),且发病早期HFRS患者血清sVCAM-1高于恢复期(P<0.05),而恢复期水平虽较峰值下降但与正常对照组比较仍升高,说明VCAM-1参与了HFRS的发病过程,且可反映该病的进展程度;HFRS患者轻、中、重型组血清sVCAM-1T 水平较正常对照组亦明显升高,差异均具有统计学意义(P<0.05);其中血清sVCAM-1水平由低到高分别为,HFRS轻型组、中型组、和重型组,各型患者相比较,差异亦有统计学意义(P<0.05),说明血清sVCAM-1水平与疾病的严重程度有关。本研究为探讨VCAM-1与肾损伤之间的关系,同时检测了反映肾损伤的肾功能指标BUN、Cr,结果显示HFRS患者血清sVCAM-1含量水平与BUN、Cr呈显著相关,说明sVCAM-1含量水平与HFRS患者肾损伤密切相关。同时,研究的结果也表明HFRS患者血清中IL-18水平在病程中均高于健康对照组,且从发热期开始增高、少尿期达高峰、多尿期开始下降,恢复期达正常水平,与血浆BUN、Cr水平呈正相关,表达规律与sVCAM-1相同。表明研究sVCAM-1和IL-l8在HFRS患者血清中表达规律及作用机制对于探讨HFRS的发病机制具有重要意义。
综上所述,HFRS患者血清sVCAM-1和IL-18水平与HFRS发病过程、病情严重程度以及肾损伤程度有关。为进一步研究细胞黏附分子(CAM)在HFRS发病及免疫损伤的关系, CAM受体在T淋巴细胞表面的表达状况将在后续的实验中进行研究。
[1] Kruger DH, Figueiredo LT, Song JW,etal.Hantaviruses--globally emerging pathogens[J]. J Clin Virol, 2015,64: 128-136.
[2] Terajima M, Ennis FA.T cells and cathogenesis of Hantavirus cardiopulmonary syndrome and hemorrhagic fever with renal syndrome[J]. Viruses, 2011,3(7): 1059-1073.
[3] 赵直光.流行性出血热患者血清TNF、IL-6检测及临床意义[J]. 内蒙古医学杂志, 2011,(2): 238-239.
[4] Hayasaka D, Maeda K,Ennis FA,etal. Increased permeability of human endothelial cell line EA.hy926 induced by hantavirus-specific cytotoxic T lymphocytes[J]. Virus Res, 2007,123(2): 120-127.
[5] Terajima M, Masanori E, Francis A. Immunopathogenesis of hantavirus pulmonary syndrome and hemorrhagic fever with renal syndrome: Do CD8+T cells trigger capillary leakage in viral hemorrhagic fevers[J]. Immunol Lett, 2007,113(2):117-120.
[6] Dong Y, Shi D, Li M,etal. Elevated serum levels of decoy receptor 3 are associated with disease severity in patients with hemorrhagic fever with renal syndrome. [J].Intern Emerg Med,2015,10(5):56773.
[7] Niikura M, Maeda A, Ikegami T,etal. Modification of endothelial cell functions byhantaan virus infection: prolonged hyper-permeability induced by TNF-alpha of hantaan virus-infected endothelial cell monolayers[J]. Arch Virol 2004, 149: 1279-1292.
[8] 郭 英,瞿宁厚.细胞间粘附分子-1研究进展[J]. 陕西医学杂志,2008,37(4):492-494.
[9] 夏启俊, 李 涛,陈 凛.血管细胞粘附分子1在肿瘤神经侵袭中的作用研究[J]. 首都医药, 2014,(14): 20-22.
[10] 何艳红. 粘附分子VCAM-1、ICAM-1和PECAM-1单核苷酸多态性与子痫前期的相关性研究[D]. 南方医科大学,2014
[11] Charles A, Dinarello, MD Denver,etal.Colo IL-18: A TH1-inducing, proinflammatory cytokine and new member of the IL-1 family[J]. J Allergy Clin Immunol ,1999,103:11-24.
[12] 宋海波,王蓉蓉,霍小华,等.滋阴法配合西药治疗肾综合征出血热46例[J].陕西中医,2013,34(4):399-400.
[13] Schonrich G, Kruger DH, Raftery MJ. Hantavirus-induced disruption of the endothelial barrier: neutrophils are on the payroll [J]. Front Microbiol, 2015,6: 222.
[14] Dong Y, Shi D, Li M,etal. Elevated serum levels of decoy receptor 3 are associated with disease severity in patients with hemorrhagic fever with renal syndrome. [J]. Intern Emerg Med,2015 ,10(5):56773.
[15] Xie M, Dong Y, Zhou Y,etal. Levels of HTNV specific CD8+T lymphocytes in PBMC from the patients with hemorrhagic fever with renal syndrome[J]. Intern Emerg Med,2013 , 8(6):5038.
(收稿:2016-10-18)
The detection of vascular cell adhesion molecule 1 and interleukin-18 in serum of patients with hemorrhagic fever with renal syndrome
Gao Juan, Shi Dongsha, Dong Yanying , et al.
Department of Immunology and Pathogenic Biology,School of Medicine,Xi’an Jiaotong University(Xi’an 710061)
Objective: To study the role of vascular cell adhesion molecule 1(sVCAM-1)and interleukin-18 in hemorrhagic fever with renal syndrome , which may contribute to clarify the pathogenesis of HFRS . Methods: Double antibody sandwich method ELISA was used to detect the expression of sVCAM-1 and interleukin-18 in the serum of 52 patients with HFRS. Results: The levels of sVCAM-1 in patients with HFRS in different stages were significantly higher than those in healthy controls (P<0.05). The levels of sVCAM-1 and interleukin-18 increased from fever stage, reached peak value in oliguric stage, and reduced till recovery stage. Conclusion: The levels of sVCAM-1 and interleukin-18 are closely correlated to the progression of HFRS. Moreover, elevated levels of sVCAM-1 and interleukin-18 have correlation with the severity and degree of kidney damage.
Hemorrhagic fever with renal syndrome/physiopathology Vascular cell adhesion molecule 1/blood Interleukin-18/blood
*西安市科技计划项目基金资助课题(GG05149)
肾综合征出血热/病理生理学 血管细胞黏附分子-1/血液 白细胞介素-18/血液
R511
A
10.3969/j.issn.1000-7377.2017.07.013
△通讯作者
