缺氧诱导因子1对糖尿病状态下血管内皮细胞表面细胞间粘附分子-1表达的调节*
2017-07-18田冰玉宋虎平
田冰玉,宋虎平
西安市第四医院眼科(西安 710004)
田冰玉,宋虎平△
西安市第四医院眼科(西安 710004)
目的 : 探讨早期糖尿病视网膜病变(DR)状态下,缺氧诱导因子1(HIF-1)对血管内皮细胞表面细胞间粘附分子-1(ICAM-1)表达的影响。方法 :收集早期DR患者及年龄匹配的健康人外周血血清,用于体外培养恒河猴视网膜血管内皮细胞系细胞(RF/6A)。分为糖尿病血清培养组(B组)、糖尿病+HIF-1反义寡核苷酸组(ASODN)(C组)、糖尿病+HIF-1正义寡核苷酸组(SODN)(D组)健康人血清培养细胞为正常对照组(A组)。使用免疫组织化学和免疫酶联吸附法(ELISA)检测HIF-1和ICAM-1的表达水平。结果: 在蛋白总量一致的情况下,A组细胞上清中sICAM-1的浓度为(13.89±1.35)ng/ml,而B组的浓度为(25.26±1.97)ng/ml ,HIF-1ASODN 转染可以明显降低细胞ICAM-1的表达水平,其浓度为(16.59±1.11)ng/ml,HIF-1SODN 转染则不能影响细胞ICAM-1的表达。各组细胞之间ICAM-1表达水平比较有统计学差异(F=81.89,P=0.00),各组之间两两比较,B组和D组之间比较无统计学差异(P=0.98),其余各组之间两两比较有统计学差异(P均<0.05)。 结论 :在体外培养条件下, HIF-1对糖尿病血清培养条件下的RF/6A细胞表达ICAM-1具有调节作用。
最新数据显示:目前我国20岁以上的糖尿病患者约9240万(人口的9.7%),而14820万成年人(15.5%)为糖尿病前期患者。我国已成为全球糖尿病患病人数最多的国家[1]。糖尿病视网膜病变(Diabetic retinopathy, DR)是糖尿病的重要并发症,是成年人重要的致盲眼病。研究证明,髓样细胞与视网膜血管内皮细胞的黏附是DR早期关键事件[2-3],这个过程和血管内皮细胞表面细胞间粘附分子-1(Intercellular adhesion molecule 1,ICAM-1)的表达有关。细胞间粘附分子-1是促炎细胞因子,可介导白细胞的粘附和聚集,在免疫、炎症等的形成过程中起重要作用[4]。缺氧诱导因子1是一种缺氧反应基因的中介因子,可传导缺氧信号,激化一些与缺氧有关的基因,使细胞适应低氧环境,同时也可引起多种病理变化[5]。缺氧诱导因子1(Hypoxia-indacible factor-1 alpha,HIF-1)能调节DR病变状态下髓样细胞与血管内皮细胞粘附[6],说明HIF-1有可能成为治疗早期DR的重要靶点,但其是否可调节内皮细胞表面粘附分子ICAM-1尚不清楚。本研究通过体外细胞实验方法,观察在早期DR条件下,HIF-1对血管内皮细胞表面ICAM-1表达的调节,进一步明确HIF-1在DR治疗中的作用机制,现报告如下。
材料和方法
1 材 料 人类血清来自2005年3月至9月在到西安市第四医院眼科门诊就诊的10例1期DR患者及年龄和性别匹配的10例健康志愿者。每一位受试者实验前均签署知情同意书,并经西安市第四医院医学伦理委员会批准。DR分期按照国际临床分类法。晨起抽取空腹血2ml, 离心5min, 取上清,用于细胞培养。
3 内皮细胞系细胞培养和分组 恒河猴视网膜脉络膜血管内皮细胞系(RF/6A)购于中国科学院上海细胞生物所。以含有10%胎牛血清的RPMI1640培养液,在37℃的5%CO2孵箱中培养。待细胞生长至约70%融合状态时,换成无血清的DMEM培养基,24h后A组加入10%健康人血清, B组加入10%DRP患者血清,C组在加入10%DR患者血清之前24h先转染HIF-1反义寡核苷酸[梭华-SofastTM基因转染试剂(厦门太阳马生物工程公司)]D组在加入10%DRP患者血清之前24h先转染HIF-1正义寡核苷酸,37℃ 的5%CO2孵箱中培养24h后收集细胞进行下一步实验。每次实验设3个复孔。共重复3次。
4 HIF-1α免疫组化 细胞爬片并固定,滴加鼠HIF-1α单克隆抗体(Chemicon公司),浓度1∶500,37℃保温30 min;滴加生物素化羊抗鼠IgG,37℃保温30 min;滴加ABC复合剂,37℃保温30 min;显色,镜下观察,水洗中止反应;苏木素轻度复染;系列酒精脱水,二甲苯透明,中性树胶封固观察。
5 ELISA 检测RF/6A细胞培养中上清液中ICAM-1水平 人sICAM-1 ELISA试剂盒(上海森雄科技实业有限公司),按照试剂盒说明,建立标准曲线后,将待测品孔每孔加入按一定比例稀释的待测样品100l,置37℃,120 min ;用洗涤液将反应板充分洗涤4~6次,在滤纸上印干;每孔加第一抗体工作液50l后置37℃,60 min后洗板;每孔加酶标抗体上作液100l后置37℃,60 min后洗板;每孔加底物上作液100l,置37℃暗处反应5~10 min;每孔加1滴终止液混匀。在酶标仪(美国BIO-RAD公司)上492 nm处测吸光度(OD值);用Curve Expert1.3绘制标准曲线,根据曲线公式计算出ICAM-1的浓度。
6 统计学方法 采用SPSS 11.0统计学软件。组间差异用单因素方差分析(ANOVA), 多组之间两两比较采用最小显著性差异法(LSD)。P<0.05为差异有统计学意义。
结 果
1 免疫组化染色结果 在正常人血清培养条件下,RF/6A细胞内即有少数阳性染色细胞出现,阳性部位主要在细胞核区,呈棕黄色染色。B组阳性染色细胞增多,阳性染色部位仍然位于胞核区。C组阳性细胞数量较A组减少。D组阳性细胞数量又增加,胞核内呈现深棕色染色(图1)。
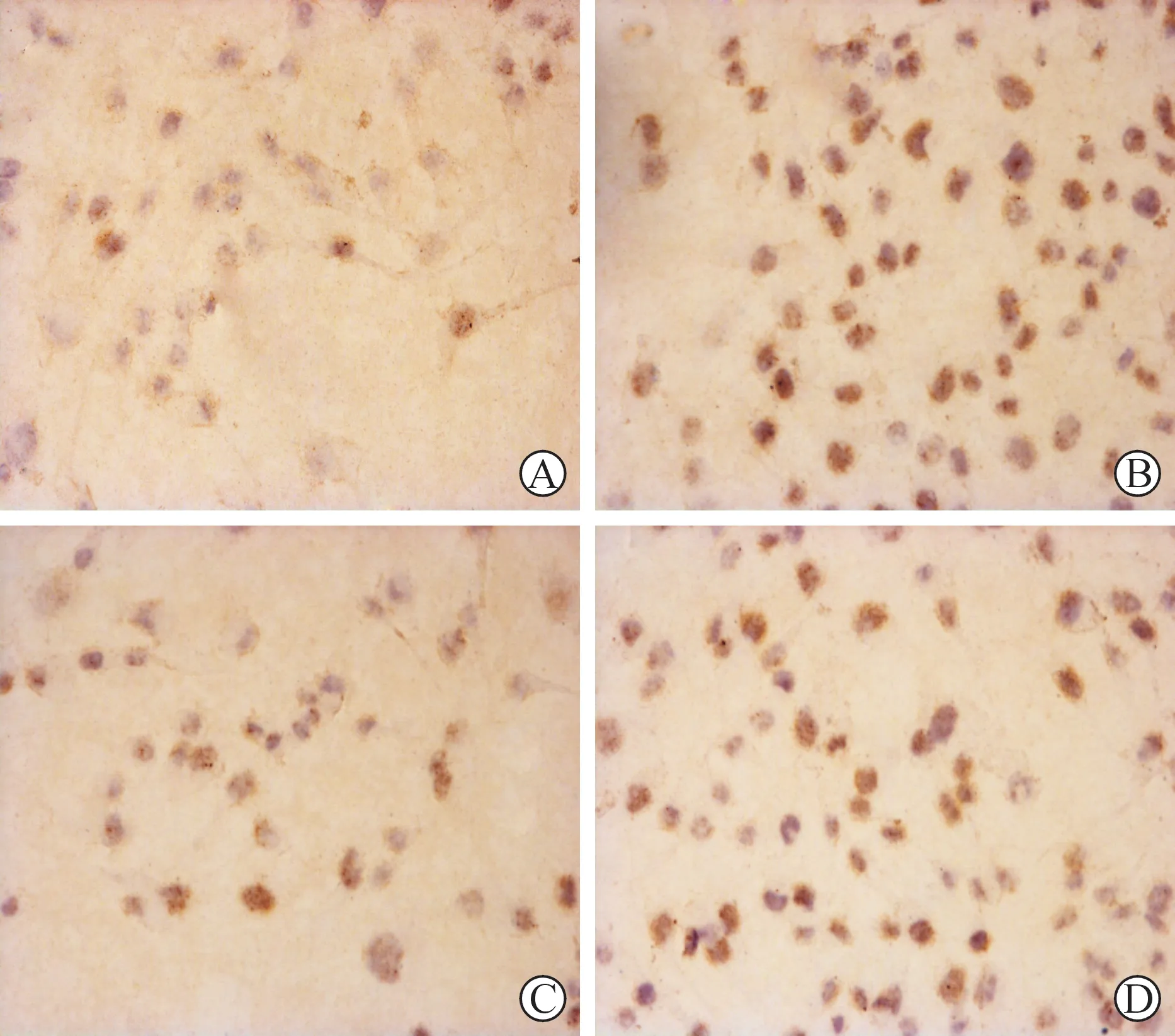
图1 四组RF/6A细胞HIF-1免疫组化染色
2 ELISA检测RF/6A细胞培养上清中ICAM-1水平 如图2 ELISA 的标准曲线显示。曲线公式为y=-0.17+55.53x+32.02x2,其中y 代表蛋白量,x代表OD值。
可是,在蛋白总量一致的情况下,A组细胞上清中sICAM-1浓度为(13.89±1.35 )ng/ml,而B组浓度为(25.26±1.97 )ng/ml ,HIF-1ASODN 转染可以明显降低细胞ICAM-1的表达水平,其浓度为(16.59±1.11 )ng/ml,HIF-1SODN 转染则不能影响细胞ICAM-1的表达。各组细胞之间ICAM-1表达水平比较有统计学差异(F=81.89,P=0.00),各组之间两两比较,B组和D组(25.28±1.02 )ng/ml之间无统计学差异(P=0.98),其余各组之间两两比较差异有统计学意义(P均<0.05)。

图2 ICAM-1的ELISA检查标准曲线
讨 论
本研究显示,当用来自DR患者的血清培养后,血管内皮细胞ICAM-1水平显著高于正常人血清培养下的水平。HIF-1蛋白表达被抑制后, ICAM-1表达水平相应下降,证明HIF-1对于ICAM-1的表达具有调节作用。 RF/6A细胞是研究视网膜血管内皮细胞病变的常用细胞系,文献证明其具有人类视网膜血管内皮细胞的特征[8]。ICAM-1是CD18位于血管内皮细胞表面的配体,是白细胞与血管内皮细胞黏附的重要分子,是血管内皮细胞的激活的标志[9]。在糖尿病血清培养条件下细胞表达ICAM-1增多的原因和糖尿病代谢紊乱有关,循环血中的炎症介质也是诱导ICAM-1 表达的重要因素。炎症和血管内皮细胞功能障碍之间可能是双向的关系,炎症会加重血管内皮细胞功能障碍,而血管内皮细胞功能障碍之后ICAM-1表达可能会更高[10]。
HIF-1α是机体适应氧损伤的重要转录调节因子,缺氧是HIF-1α表达的经典刺激因素。但非缺氧因素也能刺激HIF-1α的表达,其中细胞因子是最重要的非缺氧调节因素[11]。 糖尿病血清培养后RF/6A细胞表达HIF-1α蛋白,可能和血清中这些细胞因子有关。本实验结果显示,在糖尿病状态下,HIF-1α能调节血管内皮细胞表面ICAM-1的表达水平。已有研究显示HIF-1α的表达与 VEGF呈正相关[12],VEGF表达降低时,ICAM水平随之降低。本实验在使用反义寡核苷酸技术抑制了细胞HIF-1α表达后,糖尿病血清刺激诱导血管内皮细胞表面ICAM-1表达被抑制,HIF-1α可能通过直接和间接两种途径调节ICAM-1的表达。
本研究通过细胞实验证实,在糖尿病血清培养条件下,HIF-1α具有调控ICAM-1表达的作用,它有可能成为治疗早期DR的一个新的靶点。
[1] Yang SH, Dou KF, Song WJ. Prevalence of diabetes among men and women in China [J]. N Engl J Med,2010,362(25):2425-2426.
[2] Serra AM,Waddell J,Manivannan A,etal. CD11b+bone marrow-derived monocytes are the major leukocyte subset responsible for retinal capillary leukostasis in experimental diabetes in mouse and express high levels of CCR5 in the circulation [J]. Am J Pathol,2012,181:719-727.
[3] Li G,Veenstra AA,Talahalli RR,etal. Marrow-derived cells regulate the development of early diabetic retinopathy and tactile allodynia in mice [J]. Diabetes,2012,61:3294-3303.
[4] 杨徐杭,汶医宁.冠心病中医辨证与血清细胞间粘附分子-1的关系研究[J].陕西中医,2008,29(2):134-135.
[5] 秦 利,吴桂清,刘晓琴.妊娠期高血压疾病胎盘滋养细胞中缺氧诱导因子的表达及意义[J].陕西医学杂志,2013,42(7):793-795.
[6] 宋虎平,朱 琦,吴 琼.缺氧诱导因子1α特异性小干扰RNA对早期糖尿病大鼠视网膜白细胞黏附及髓样细胞活性的影响[J].中华眼科杂志,2015,51(5):241-245.
[7] 宋虎平,惠延年,雷春灵,等. 缺氧诱导因子1α对早期糖尿病视网膜病变状态下人粒细胞系白血病细胞表面黏附分子CD18 表达的调节[J]. 中华眼底病杂志,2010,26:169-172.
[8] Gendron RL,Good wV,Adams LC,etal.Suppressed expression of tubedown-1 in retinal neovascularization of proliferative diabetic retinopathy[J].Invest Ophthalmol Vis Sei, 2001,42:3000-3007.
[9] Gardner TW, Antonetti DA, Barber AJ,etal. Diabetic retinopathy: more than meets the eye [J]. Surv Ophthalmol, 2002, 47(Suppl 2): S253-S262.
[10] Van Hecke MV, Dekker JM, Nijpels G,etal. Inflammation and endothelial dysfunction are associated with retinopathy: the hoorn study [J]. Diabetologia, 2005, 48(7): 1300-1306.
[11] Richard DE, Berra E, Pouyssegur J. Nonhypoxic pathway mediates the induction of hypoxia-inducible factor 1alpha in vascular smooth muscle cells [J]. J Biol Chem, 2000, 275:26765-26771.
[12] 庞秋霞,米志宽,景彩霞,等.乳腺癌组织中 HIF-1α 及 VEGF-C 蛋白表达分析[J].陕西医学杂志,2014,43(11):1448-1452.
(收稿:2016-12-05)
The mediation of HIF-1to the expression of ICAM-1 by RF/6A in diabetic condition
Tian Bingyu,Song Huping.
Department of Ophthalmology,Xi’an No.4 Hospital(Xi’an 710004)
Objective: To investigate the mediation of HIF-1to the expression of ICAM-1 by retinal vascular endothelial cell under early stage of diabetic retinopathy condition. Methods:The rhesus choroid-retina vascular endothelial cell line RF/6A were cultured in RPMI 1640 medium-10% human serum, which was collected from the subjects of early stage of diabetic retinopathy and age-matched healthy control. The cells were cultured in 4 groups as control group(group A),diabetic group (group B), HIF-1anti-sense oligonucleotides (ASODN) group (group C) and HIF-1sense oligonucleotides (SODN) group (group D). ICAM-1 levels in RF/6A supernatants were determined with ELISA kit. Results: Contrast to group A, the level of ICAM-1 significantly increased in group B (25.26±1.97) ng/ml vs (13.89±1.35 )ng/ml(P=0.00). But after HIF-1bioactivity was blocked (group C), the effect on the level of ICAM-1 by diabetic serum(group B) was suppressed significantly (25.26±1.97) ng/ml in group B(16.59±1.11) ng/ml in group C vs (25.26±1.97)ng/ml in group B(P=0.00). Conclusion: In vitro, HIF-1could regulate the expression of ICAM-1 by RF/6A. HIF-1may served as a therapeutic target for the treatment and/or prevention of early diabetic retinopathy.
Diabetic retinopathy/physiopathology Inflammation Hypoxia-inducible factor-1 alpha/analysis Intercellular adhesion molecule-1/analysis Endothelium,Vascular
*陕西省自然科学基金资助项目(2011JM4048)西安市科技发展计划项目[SF1315(2)]
糖尿病视网膜病变/病理生理学 炎症 缺氧诱导因子1,亚单位/分析 细胞间粘附分子/分析 内皮,血管
R363.2
A
10.3969/j.issn.1000-7377.2017.07.009
△通讯作者
