锰超氧化物歧化酶基因转染对豚鼠耳蜗组织Caspase 3蛋白活性的影响
2017-07-18王一鸣
林 馨,王一鸣
(浙江中医药大学医学技术学院,浙江杭州 310053)
锰超氧化物歧化酶基因转染对豚鼠耳蜗组织Caspase 3蛋白活性的影响
林 馨,王一鸣
(浙江中医药大学医学技术学院,浙江杭州 310053)
采用雄性豚鼠按每天50 mg/kg给予醋酸泼尼松龙肌注连续10 d,在第6天按每天400 mg/kg给予硫酸卡那霉素肌注连续5 d的方法,制备肾虚耳聋模型。将携带MnSOD基因的慢病毒液经圆窗膜注入豚鼠耳蜗的外淋巴液中,并检测耳蜗外源性MnSOD和Caspase 3的活性。以此研究锰超氧化物歧化酶(MnSOD)基因对肾虚耳聋豚鼠耳蜗组织的Caspase 3蛋白活性的影响,探讨其对内耳氧化损伤的保护作用机制。结果表明外源性MnSOD基因转染肾虚耳聋豚鼠耳蜗组织能够抑制其Caspase 3的蛋白活性,从而对内耳氧化损伤起到保护作用。
锰超氧化物歧化酶;肾虚耳聋;Caspase 3
超氧化物歧化酶(Superoxide dismutase,SOD)是广泛存在于生物体各个组织中的重要金属酶,是唯一将超氧阴离子转化为过氧化氢的抗氧化酶。目前已知的哺乳动物体内SOD有三种异构体,分别是铜/锌超氧化物歧化酶(Cu/ZnSOD或SOD1)、锰超氧化物歧化酶(MnSOD或SOD2)和细胞外超氧化物歧化酶(ECSOD或SOD3)。Cu/ZnSOD主要存在于哺乳动物细胞的胞浆、胞核及溶酶体内,MnSOD主要存在于需氧细胞的线粒体中,ECSOD最初在人血浆、淋巴、腹水和脑脊液中发现,与肝素有较高的亲和力,三种SOD主要在它们各自的部位发挥保护功能。线粒体的氧化呼吸链是体内自由基产生的最主要场所,MnSOD是线粒体内的主要酶性自由基的清除剂,在维持线粒体功能、体内外抗氧化损伤中发挥重要作用。NAKASHIMA等[1]将带有Cu/ZnSOD和MnSOD的基因导入豚鼠耳蜗,发现能对抗氨基糖甙类药物的部分毒性,且MnSOD起主导作用,MnSOD水平的调节可能是细胞所有氧化还原状态的重要生理机制。
Caspase 3属于Caspase(Cysteine-requiring Aspartate Protease)家族,在细胞凋亡过程中起关键作用。因此Caspase 3在海内外有关哺乳动物细胞研究中最受关注。Caspase 3可以剪切procaspase 2、6、7和9,并可直接特异性剪切众多 Caspase底物,包括 PARP(poly(ADP-ribose)polymerase)、ICAD(Inhibitor of Caspase-activated deoxyribonuclease)等。上述由Caspase 3介导的蛋白剪切是细胞凋亡分子机制的重要组成部分。此外,Caspase 3对细胞起泡和细胞核的凋亡过程中也起关键作用。因此为了进一步研究MnSOD对豚鼠耳蜗组织中Caspase 3活性的影响,本课题将MnSOD基因导入肾虚耳聋豚鼠耳蜗组织产生持续高表达,测定其对Caspase 3表达的影响,从而说明MnSOD是否通过对细胞凋亡机制的抑制而起到有效的抗氧化保护作用。
1 材料与方法
1.1 实验材料及仪器
超氧化物歧化酶(SOD)分型测试盒;Caspase 3活性检测试剂盒(碧云天);EcoR I、Not I、XbaI(Fermentas)。
1.2 实验方法
1.2.1 豚鼠MnSOD基因慢病毒载体的构建
从GenBank:U39843.1获得豚鼠MnSOD基因信息,据此设计含cMnSOD基因的DNA片段,并由金斯瑞进行合成,其序列(674 bp)如下:

软件验证其翻译后氨基酸序列与GenBank:U39843.1获信息一致:
EFDLYDDDDKMLCRAVCSASRRLAPAL-
GILGVRQKHSLPDLPYDYGALQPHI -
NAEIMQLHHSKHHAAYLNNLNI
AEEKYQEALAKGDVTAQVALQ
PALKFNGGGHINHSIFWTNLSP
NGGGEPKGELLEAIKRDFGSFDK
FKEKLTAVSVGVQGSGWGWL
GFNKERGCLQIAACSNQDPLQGTTGLI
PLLGIDVWEHAYYLQLKNVRPDYLKAIWKVIKNS
合成基因(cMnSOD)克隆(EcoR I/Not I)至pLVHisSSD-Puro(慢病毒载体),获得pLV-HiscMnSOD–Puro。最终质粒进行EcoRI/XbaI酶切鉴定和基因测序鉴定,结果如图1。
1.2.2 MnSOD基因慢病毒的制备
转染前 24 h,将 293V 细胞以(4~5)×106/10 cm2平皿密度接种,加入10 mL 293V培养基37℃,5%CO2培养。细胞转染前密度应达到90%。漩涡震荡混匀Polyfect-V转染试剂。准备2个离心管,按以下顺序分别制备质粒和转染试剂稀释液。离心管1:目的基因慢病毒载体质粒5 μg,pH1 质粒 3.75 μg,pH2 质粒 1.25 μg,加 DMEM 无血清培养基至 500 μL;离心管 2:Polyfect-V 转染试剂 20 μL,加DMEM无血清培养基至500 μL。充分混匀。将转染试剂稀释液(离心管2)加入质粒DNA溶液(离心管1)中,立刻充分混匀。室温孵育转染混合液15 min。将转染混合液逐滴加入步骤1准备的细胞培养皿,前后晃动培养皿,充分混匀。37℃,5%CO2培养。4~6 h后,用10 mL新鲜的293V培养基换液。转染后24 h,用10 mL病毒培养基换液。转染后48~72 h收集细胞培养上清。500 g离心10 min去除细胞碎片;上清过0.45 μm滤膜即可直接用于慢病毒感染。
图1 pLV-HisSSD-Puro质粒图谱及测序结果Fig.1 pLV-HisSSD-Puro plasmid map and sequencing results
1.2.3 动物模型的建立,制备肾虚耳聋动物模型
选用健康活泼、无耳疾、耳廓反射灵敏的白色红目雄性豚鼠12只,体重250~350 g,由浙江中医药大学动物实验中心提供。适应性饲养1周后随机分为3组,肾虚耳聋模型组(模型组3只):50 mg/(kg·d)醋酸泼尼松龙(肌注,10 d)+400 mg/(kg·d)硫酸卡那霉素(从第6天开始,肌注,5 d)。肾虚耳聋治疗组(治疗组3只):醋酸泼尼松龙(剂量同致聋组)+硫酸卡那霉素(剂量同致聋组),同时在第6天开始经左耳圆窗膜向外淋巴液注射携带有MnSOD基因的慢病毒液体6 μL。空白对照组(空白组3只):单纯给予醋酸泼尼松龙(剂量同致聋组),在第6天经左耳圆窗膜向外淋巴液注射生理盐水6 μL。
手术操作-圆窗膜进路:10%水合氯醛麻醉动物,暴露并打开听泡,扩大骨孔,手术显微镜下辨认蜗窗膜,用尖端弯曲的10 μL微量进样器刺破圆窗膜,抽取MnSOD病毒液或生理盐水(6 μL),以3 μL/5 min的速度缓慢地注入外淋巴,注射完毕后取颞肌筋膜填于圆窗龛内,以防止穿刺部位液体回漏,缝合皮肤切口。于经左耳圆窗膜注射4周后行下一实验步骤。
1.2.4 外源MnSOD基因转染肾虚耳聋豚鼠后耳蜗组织内的MnSOD及Caspase 3活性测定
1.2.4.1耳蜗组织锰超氧化物歧化酶(MnSOD)活性测定
各组动物麻醉处死,取听泡,在解剖显微镜下剔除蜗壳,将蜗轴连同膜蜗管取下,双耳合为一份标,称重,以1 g:1 000 mL生理盐水稀释研磨,制成5%组织匀浆4 000 r/min离心15 min。取小量用Bradford法检测待测样品中的蛋白浓度。取上清30 μL按SOD分型测试盒说明书加入试剂,37℃水浴40 min后加入显色剂,静置10 min,用分光光度计550 nm下测吸光度,计算SOD总活性(U/mg pro)。取上述5%匀浆50 μL按说明书加入等体积试剂7混匀后4 000 r/min离心15 min,取上清按上述相同方法加样测定,计算Zn-Cu-SOD活性(U/mg pro)。SOD总活性减去ZnCu-SOD活性即为MnSOD活性(U/mg pro)。
1.2.4.2耳蜗组织Caspase 3活性测定
样本前处理同1.2.4.1。取上清10?L按Caspase 3活性检测试剂盒说明书加入试剂。
A.取出pNA和适量的Ac-DEVD-pNA(2mM),置于冰浴上备用。
B.如下设置反应体系:

试剂 空白对照 样品检测缓冲液待测样品Ac-DEVD-pNA(2 mM)总体积90 μL 0 μL 10 μL 100 μL 80 μL 10 μL 10 μL 100 μL
在设置反应体系时先加检测缓冲液,再加待测样品,适当混匀,注意避免在混匀时产生气泡。随后再加入 10 μL Ac-DEVD-pNA(2 mM)。
C.加入Ac-DEVD-pNA(2 mM)后混匀,注意避免在混匀时产生气泡。37℃孵育60~120 min。发现颜色变化比较明显时即可测定A405。
D.样品的A405扣除空白对照的A405,即为样品中Caspase 3催化产生的pNA产生的吸光度。
E.参考Chemicon公司的Caspase 3酶活力单位的定义,计算出样品中含有多少个酶活力单位的Caspase 3。
1.2.5 数据处理
采用SPSS17.0软件进行数据处理。统计分析采用单因素方差分析,P表示显著性,数据以均数±标准差(±s)表示。
2 实验结果
外源MnSOD基因转染肾虚耳聋豚鼠后其耳蜗组织内的MnSOD活性测定结果表明(见表1和图2),与空白组比,模型组豚鼠耳蜗组织内的MnSOD活性显著降低,差异具有统计学意义(P≤0.01)。而与模型组比,MnSOD基因转染组豚鼠耳蜗组织内的MnSOD活性显著升高,差异具有统计学意义(P≤0.05),说明MnSOD外源基因转染成功。
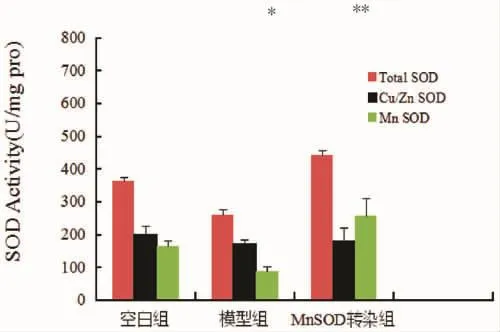
图2 豚鼠耳蜗组织内的总SOD、ZnCu-SOD及MnSOD活性Fig.2 Total SOD,ZnCu-SOD and MnSOD activities in guinea pig cochlea

表1 豚鼠耳蜗组织内的MnSOD活性(n=3)Tab.1 MnSOD activity in guinea pig cochlear tissue(n=3)
为了进一步明确外源MnSOD基因转染后对豚鼠耳蜗组织的作用,本实验检测了外源MnSOD基因转染前后肾虚耳聋豚鼠耳蜗组织内的Caspase 3活性。表2结果表明,其耳蜗组织内的Caspase 3活性测定结果如表2。肾虚耳聋模型组耳蜗组织内的Caspase 3活性与空白组相比显著升高,差异具有统计学意义(P≤0.05)。而外源MnSOD基因转染肾虚耳聋豚鼠后,MnSOD转染组的Caspase 3活性明显降低,差异具有统计学意义(P≤0.05),说明外源MnSOD基因转染抑制了虚耳聋豚鼠后耳组织内的Caspase 3的活性。
3 讨论
感音神经性聋是临床难治性疾病之一。据统计,目前我国听力障碍残疾人有2 057万,占全部人口的1.67%,其中超过80%是感音神经性聋。刘蓬等[2-3]研究证实,听力障碍多表现为肾虚的主要征象,肾虚易致耳聋。前期调查研究表明,浙江省7岁以下进行听觉语言康复训练的感音神经性聋儿童,其中辨证为肾虚型的占30.5%[4]。由于耳蜗的特殊解剖位置且具有血-迷路屏障,药物难以在耳蜗局部达到有效浓度,故目前尚无有效的治疗感音神经性聋的药物和方法。

表2 豚鼠耳蜗组织内的Caspase 3活性(n=3)Tab.2 Caspase 3 activity in guinea pig cochlear tissue(n=3)
“肾为先天之本”。肾气、肾阳是一身阳气根本。对人体有推动、温煦功能,肾阴为一身阴液根本,对人体有滋养、濡润作用。肾的精气旺盛,体内清除自由基的酶类和非酶类系统功能正常,自由基对人体的损害较小;相反,肾气衰弱,则必然引起机体正气不足,影响机体的代谢能力,则机体内清除自由基的酶类和非酶类系统功能低下,自由基造成的过氧化反应导致对人体的损害。陈扬荣等[5]研究表明肾气虚组患者的SOD活性明显低下,血浆中过氧化脂含量增多,提示肾虚与SOD活力的低下关系密切。肾虚导致内耳自由基蓄积,氧自由基的堆积是引发听毛细胞退行性变的始动因素。
近年来的研究表明自由基可通过生物膜中不饱和脂肪酸的过氧化导致生物膜形态和功能的改变,从而引起细胞坏死或凋亡,细胞凋亡是细胞在各种死亡信号刺激后发生的一系列程序性的死亡过程,Caspase家族是细胞凋亡最关键的执行因子,尤其是Caspase3[6]。多种多样刺激因素启动的信号激活Caspase3,活化的Caspase3可作用于一些其它Caspase成员,并以瀑布式活化引起细胞形态上的改变,最终完成凋亡过程,因此Caspase3的激活被认为是凋亡蛋白酶级联反应的必经之路[7-8]。Caspase 3表达阳性意味着细胞凋亡在进行过程中。
MnSOD是线粒体内的主要酶性自由基的清除剂,在维持线粒体功能、体内外抗氧化损伤中发挥着重要作用,也是内耳组织细胞中十分重要的抗氧化酶类。结果证明肾虚耳聋豚鼠耳窝组织内MnSOD水平比空白组明显降低,而转染外源MnSOD基因后,耳窝组织内MnSOD水平显著升高。同时,从Caspase3活性的检测结果可以看出,与空白组相比,肾虚耳聋豚鼠耳窝组织内Caspase3活性显著上升,而转染外源Mn-SOD基因后,Caspase3活性明显下降。由此推断,肾虚耳聋可能与耳蜗组织内清除自由基功能低下、Caspase3活性升高有关,而外源性MnSOD基因能成功在肾虚耳聋豚鼠耳窝组织内表达,并且外源性MnSOD能够显著抑制耳蜗组织内Caspase 3的活性,从而有可能抑制了耳蜗组织内的细胞凋亡途径,但其抑制凋亡的具体机制仍有待深入探讨。
[1]NAKASHIMA T,UEDA H,FURUHASHI A,et al.Large vestibular aqueduct syndrome treated by hyperbaric oxygen[J].International Journal of Pediatric Otorhinolaryngology,2000,51(3):207-210.
[2]刘 蓬,王培源,邱宝珊,等.肾阴虚对卡那霉素耳毒易感性的影响[J].中国中医基础医学杂志,2002,8(3):24-27.
[3]刘 蓬,邱宝珊,王培源,等.肾阴虚对豚鼠听力的影响及补肾中药的拮抗作用 [J].中国中西医结合耳鼻咽喉科杂志,2001,9(2):57-63.
[4]王永华,楼兰花,刘金洪,等.中药“天鼓”对卡那霉素中毒性耳聋的预防作用及机理研究[J].中国中医基础医学杂志,2001,7(10):28-31.
[5]陈扬荣,江 明,李庆阳.老年脾肾虚证LPO、SOD、血脂关系的探讨[J].中国中医基础医学杂志,2002,8(7):44-45.
[6]NOOR R,SHUAIB U,WANG Chenxu,et al.High-density lipoprotein cholesterol regulates endothelial progenitor cells by increasing eNOS and preventing apoptosis[J].Atherosclerosis,2007,192(1):92-99.
Effects of Manganese Superoxide Dismutase Gene Transfection on the Activity of Caspase 3 Protein in Guinea Pig Cochlear Tissue
LIN Xin,WANG Yi-ming
(College of Medicine and Technology,Zhejiang Chinese Medical University,Hangzhou 310053,China)
First,the model of kidney deficiency deafness was prepared,male guinea pigs were given 50 mg/kg/day prednisolone acetate for 10 days.Then from day 6 each guinea pigs were intramuscular injection kanamycin 400mg/kg/day.The lentiviral solution carrying manganese superoxide dismutase(MnSOD)gene was injected into the perilymph of guinea pig cochlea through round window membrane,and the activities of exogenous MnSOD and Caspase 3 were detected.In order to studied the effect of MnSOD gene on the activity of Caspase 3 protein in cochlear tissue of guinea pigs with kidney vacuity deafness.And explored the protective mechanism of MnSOD gene on oxidative damage in inner ear.The results showed that the cochlear tissue of guinea pigs transfected with exogenous MnSOD gene could inhibit the activity of Caspase 3 protein and protect the inner ear from oxidative damage.Inhibit the activity of Caspase 3 protein,and thus protect the inner ear from oxidative damage.
MnSOD;kidney vacuity deafness;Caspase 3
R965
:A
2016-12-10
浙江省教育厅科研项目(Y201121286)
林馨(1962-),女,浙江杭州人,主任中医师,研究方向:中西医结合耳聋康复.E-mail:595188264@qq.com
1008-830X(2017)01-0081-05
