脱脂和脱蛋白处理对虫草多糖测定的影响
2017-07-15方苏闫兴富周立彪
方苏++闫兴富++周立彪
摘要:以虫草发酵菌粉为材料,比较多糖提取过程脱脂、脱蛋白操作对硫酸-苯酚法和硫酸-蒽酮法测定多糖值的影响。研究结果表明,同一样品提取多糖时不脱脂和蛋白(A)、只脱脂(B)、只脱蛋白(C)、脱脂脱蛋白(D)对硫酸-蒽酮法与硫酸-苯酚法测定结果差异显著,2种比色法测得多糖含量值均呈现A>B>C>D,其中脱蛋白的操作比脱脂操作对2种比色法测定结果影响更大。同时还显示,硫酸-苯酚法测得的多糖含量较硫酸-蒽酮法测得值大。并通过精密度、回收率、稳定性比较发现,硫酸-苯酚法优于硫酸-蒽酮法。
关键词:虫草多糖;脱脂;脱蛋白;含量测定;硫酸-苯酚法;硫酸-蒽酮法
中图分类号: R284.1文献标志码: A
文章编号:1002-1302(2017)09-0144-03
测定多糖含量的方法主要有比色法、高效液相色谱法和酶法等,其中高效液相色谱法与酶法由于样品前处理工序比较繁琐,测定时间较长,检测费用较高等原因未能广泛使用,而比色法中的苯酚-硫酸法与蒽酮-硫酸法由于操作简单、实用性强,在多糖研究中被广泛使用[1]。比色法多糖含量测定包括提取和含量测定2部分,农业部标准食用菌中粗多糖含量的测定(硫酸-苯酚法)[2]及中国药典[3]灵芝多糖含量的测定(硫酸-蒽酮法)均为粗多糖的测定,前者是醇洗后水提,后者是水提后醇沉,均不脱脂不脱蛋白。现行的多糖提取处理与多糖测定的基本流程可归纳为:菌粉→脱脂(兼脱色)→水提→醇沉→脱蛋白→得精多糖液→显色反应→比色,实际研究中的具体操作各有不同,主要区别在于多糖提取是否经脱脂处理或是否经脱蛋白处理,包括不脱脂和蛋白[4-7]、只脱脂[8-9]和只脱蛋白处理等[10-13]。目前,采用2种比色法进行不同提取处理测定虫草多糖之间的差异还缺乏研究,因此,本研究以虫草菌粉为材料,在多糖提取过程中,通过脱脂和脱蛋白处理,用苯酚-硫酸法和蒽酮-硫酸法进行多糖的测定,研究脱脂和脱蛋白处理对虫草多糖测定结果的影响,为完善虫草多糖测定方法和虫草相关产品开发利用提供参考。
1材料与方法
1.1材料
试验材料:冬虫夏草菌来源于中国科学院微生物研究所,经5 L发酵罐发酵、过滤、烘干、粉碎研磨制得。
仪器:分光光度计UV1000,上海精科天美;离心机HC-3016,安徽中科中佳;索氏提取器GG-17 50/42,上海乔枫;旋转蒸发仪RE-52AA,上海亚荣;移液枪。
试剂:浓硫酸、苯酚、蒽酮、乙醚、氯仿、乙醇(均为分析纯)。
1.2试验设计
本试验共设4个处理,分别为A:不脱脂也不脱蛋白(对照);B:脱脂;C:脱蛋白;D:既脱脂又脱蛋白。其中處理B依次包括:脱脂、水提、醇沉、定容和多糖测定;处理C依次包括:水提、醇沉、脱蛋白、定容和多糖测定;处理D依次包括:脱脂、水提、醇沉、脱蛋白、定容和多糖测定。
1.3样品处理和多糖提取
1.3.1脱脂称取1.00 g研磨后的菌粉,滤纸包裹于盛有 250 mL 乙醚的索氏提取器,42 ℃回流2 h,取出挥发干[7]。
1.3.2水提将菌粉置于三角瓶中,加水100 mL,95 ℃下浸提1 h,浸提2次合并,8 000 r/min离心10 min后,取上清液于55 ℃下旋转蒸发,浓缩至约50 mL[9]。
1.3.3醇沉将浓缩液加入3倍体积的95%乙醇,静置于 4 ℃ 冰箱中12 h。于8 000 r/min下离心10 min,取沉淀,再用无水乙醇洗涤后离心,取沉淀90 ℃热水复溶至50 mL[9]。
1.3.4脱蛋白将上述复溶的溶液置于分液漏斗,加入Sevage试剂(氯仿 ∶正丁醇体积比4 ∶1)15 mL,振荡后静置 5 min,弃下层有机相,重复5次,得多糖液[10]。
1.3.5定容将上述制备好的多糖溶液加蒸馏水定容至100 mL待测。
1.4多糖的测定
1.4.1硫酸-苯酚法[2]
1.4.1.1苯酚溶液的配制称取80 g苯酚溶于蒸馏水,定容至100 mL,于棕色瓶中4 ℃冰箱中避光保存备用;实际使用时现用现配5%的苯酚溶液。
1.4.1.2标准曲线的制备称取干燥葡萄糖0.010 g,溶于蒸馏水定容至100 mL;分别移取0.2、0.4、0.6、0.8、1.0、1.2 mL 葡萄糖液置于具塞试管中,加蒸馏水至2 mL,另取1支试管加入蒸馏水2 mL作为空白对照。将上述每一试管中分别加入苯酚溶液1 mL,加5 mL浓硫酸,静置10 min,涡旋振荡混匀,30 ℃反应20 min,于490 nm下测定吸光度。
1.4.1.3样液的测定取定容后的样液0.20 mL,加蒸馏水至2 mL,按照标准曲线制备项下的方法,自加入苯酚溶液起,测定吸光度。
1.4.1.4多糖含量的计算根据测得的吸光度值,按以下公式计算多糖百分含量w。
式中:m1为回归方程换算出多糖浓度(mg/mL);V1为样品定容体积(mL);m2为样品浓度(mg/mL);V2为比色测定时所移取样品测定的体积(mL);0.9为葡萄糖换算成葡聚糖的校正系数。
1.4.2硫酸-蒽酮法[3]
1.4.2.1硫酸蒽酮溶液配制准确称取0.2 g蒽酮,缓慢加入100 mL浓硫酸,溶解置于棕色瓶避光保存。
1.4.2.2标准曲线的制备称取干燥葡萄糖0.010 g,溶于蒸馏水定容至100 mL,分别移取0.2、0.4、0.6、0.8、1.0、1.2 mL 葡萄糖液置于具塞试管中,加蒸馏水至2 mL,另取1支试管加入蒸馏水2 mL作为空白对照。分别加入蒽酮硫酸溶液6 mL摇匀,沸水浴15 min,冰水浴15 min,625 nm下测定吸光度。
1.4.2.3样液的测定取定容后的样液0.2 mL于具塞试管中,加蒸馏水溶解定容至2 mL,按照标准曲线制备项下的方法,自加入硫酸蒽酮溶液起,测定吸光度。
1.4.2.4多糖含量的计算同硫酸-苯酚法。
1.5回收率试验[14]
取处理D样液0.2 mL于具塞试管中,加入0.1 mg/mL标准葡萄糖溶液0.4 mL,蒸馏水定容至2.0 mL,按照“1.4.1”节硫酸-苯酚法和“1.4.2”节硫酸-蒽酮法的测定方法测定多糖含量,重复5次,按下述公式计算回收率:回收率=(c-a)/b×100%。式中:a为供试品所含多糖的量;b为加入对照品的量;c为实测值。
1.6稳定性试验[7]
按照试验设计中处理D的操作步骤,在用硫酸-苯酚法和硫酸-蒽酮法进行多糖测定时,分别延迟10、20、30、40、50、60、90、120 min后再进行吸光度测定,比较2种多糖测定方法测得的吸光度差异。
1.7数据的统计分析
采用IBM SPSS Statistics 20软件用单因素方差分析的方法对不同处理间差异进行方差分析。
2结果与分析
2.12种测定方法的标准曲线
按照上述硫酸-苯酚法标准曲线制备方法,得到葡萄糖标准曲线(图1)。硫酸-苯酚法浓度-吸光度线性回归方程[JP3]为y=11.029x+0.022,相关系数r=0.996 3,吸光度在 0.132~0684(0.01~0.06 mg/mL)范围内有良好的线性关系。
按照上述硫酸-蒽酮法标准曲线制备方法,得到葡萄糖标准曲线(图2)。硫酸-蒽酮法浓度-吸光度线性回归方程为y=8.051 4x-0.002 5,相關系数r=0.999 0,吸光度在 0.078~0.480(0.01~0.06 mg/mL)内有良好的线性关系。
2.2不同处理对2种方法测定结果的影响
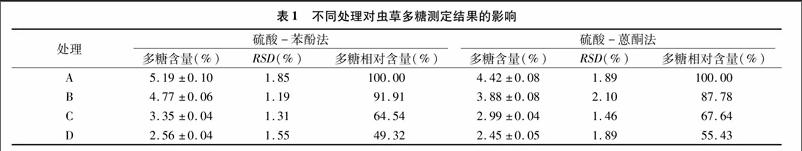
2.2.1硫酸-苯酚法从表1可以看出,A、B、C、D处理样品测得的虫草多糖含量分别为5.19%、4.77%、3.35%、2.56%,其中,B、C处理测得的含量分别为A处理的 91.91%、64.54%,D处理样品测得的精多糖含量为A处理测得的粗多糖含量的49.32%;3个处理组与对照间均差异明显。
2.2.2硫酸-蒽酮法3个处理组样品测得的多糖值分别为3.88%、2.99%、2.45%,3个处理均明显小于对照,其中B、C处理测得的虫草多糖含量分别是A处理的87.78%、67.64%,C处理对虫草多糖含量的影响比B处理影响较大;D处理样品测得的精多糖含量为A处理测得的粗多糖含量的55.43%(表1)。
2.32种测定方法的比较
2.3.1多糖值及其精密度
硫酸-苯酚法A、B、C 3种处理多糖含量测定值均大于硫酸-蒽酮法的测定值,前者分别比后者高出17.42%、22.94%、12.04%,但2种测定方法在D处理的测定结果接近。
硫酸-苯酚法A、B、C、D 4种处理测定结果的相对标准偏差分别为1.85%、1.19%、1.31%、1.55%;硫酸-蒽酮法对应A、B、C、D 4种处理样的RSD值分别为1.89%、2.10%、1.46%、1.89%,硫酸-苯酚法的RSD值低于硫酸-蒽酮法,硫酸-苯酚法较硫酸-蒽酮法具有更高的精密度。
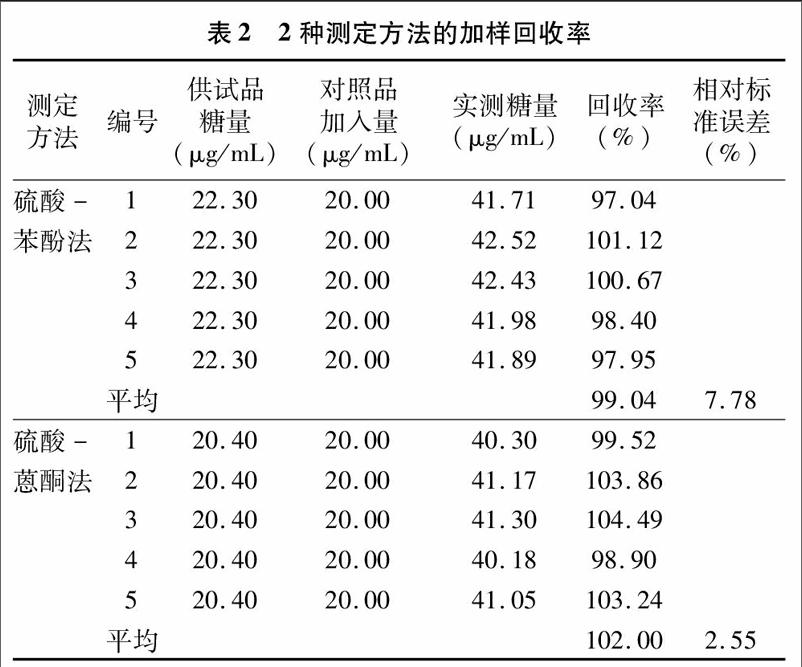
2.3.2回收率
硫酸-苯酚法与硫酸-蒽酮法回收率分别为99.04%、102.00;相对标准误差分别为1.78%、2.55%(表2)。
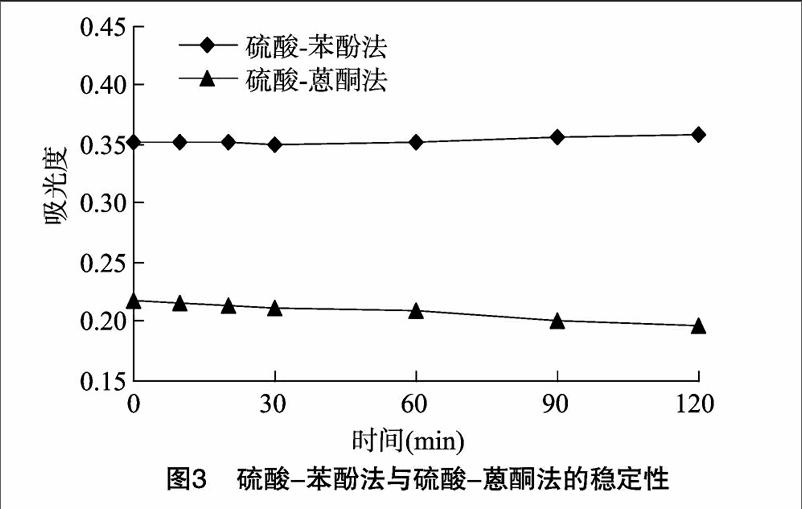
2.3.3稳定性
从图3可以看出,在0~120 min时间范围内,硫酸-苯酚法测得的吸光度随时间的变化幅度较小,相对标准误差为0.83%,硫酸-蒽酮法测得的吸光度随时间的变化较为明显,相对标准误差为3.93%。在0~30 min内,硫酸-苯酚法测得的吸光度基本稳定,硫酸-蒽酮法在0~30 min 的吸光度略有下降。
3讨论
多糖提取脱脂、脱蛋白处理都造成测定值的差异,影响因素包括有机项干扰、多糖流失及操作条件等。脱脂操作2种比色法测定的多糖含量较粗多糖含量均有减少,乙醚回流脱脂兼有脱色作用,本试验因由滤纸包裹回流,即使吸光度减少,属排除有机项干扰,无多糖损失。脱蛋白操作本试验采用的是研究中较多用到的Sevage法[10-13],2种比色法测得的多糖含量值均大幅减少,相比粗多糖含量减少达33%以上。原因在于脱蛋白Sevage试剂萃取分相时易造成多糖的流失,萃取次数多少可能是影响的主要因素,有研究结果认为,萃取次数为4次时蛋白质脱除率高,但多糖损失率也高[15]。因此,在排除蛋白干扰的同时,可能会造成多糖流失,导致脱蛋白处理的测定值表现为较大幅度减少的现象。
与硫酸-蒽酮法相比,硫酸-苯酚法测得的4种处理的多糖值均较高,可能与显色反应对干扰项的敏感程度有关。2种呈色强度分别与溶液中糖的浓度成正比,2种显色反应对干扰项的敏感度可能不同。有研究结果认为,这2种比色法在测定多个不同样品时多糖含量差别很大[16]。本试验对去除脂类和蛋白质干扰的D处理既脱脂又脱蛋白来说,2种比色法测得的多糖含量趋于接近,干扰项的存在可能是造成差异的主要因素。
从稳定性看,在120 min内硫酸-苯酚法显色更为稳定,而硫酸-蒽酮法测得的吸光度值随着比色时间的延长而减小,因为多糖在硫酸-蒽酮试剂作用下形成的衍生物可能受反应时间及环境温度变化的影响,从而造成显色反应不稳定[1]。总体上看,硫酸-苯酚法与硫酸-蒽酮法作为操作易实现、应用性强的2种比色法,均可用于虫草多糖的测定,硫酸-苯酚法的精密度更高、回收率和稳定性更好,及试剂配制、显色反应步骤也更为简易,更适于虫草多糖的测定。
参考文献:
[1]张媛媛,张彬. 苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J]. 食品科学,2016,37(4):158-163.
[2]中华人民共和国农业部. 食用菌中粗多糖含量的测定:NY/T 1676—2008[S]. 北京:中国农业出版社,2008.
[3]国家药典委员会. 中华人民共和国药典:一部[M]. 2015版. 北京:中国医药科技出版社,2015:188-189.
[4]薛俊杰,唐庆九,刘艳芳,等. 蛹虫草水溶性多糖含量测定方法的比较与优化[J]. 菌物学报,2012,31(3):443-449.
[5]苏颖,周选围. 改进苯酚-硫酸法快速测定虫草多糖含量[J]. 食品研究与开发,2008,29(3):118-121.
[6]来永斌,王琦,孙月. 蛹虫草多糖含量的测定与分析[J]. 中成药,2001,23(7):517-518.
[7]郭晓蕾,朱思潮,翟旭峰. 硫酸蒽酮法与硫酸苯酚法测定灵芝多糖含量比较[J]. 中华中医药学刊,2010,28(9):2000-2003.
[8]白云娥,王毅,漆小梅,等. 冬虫夏草、亚香棒虫草中多糖的含量测定[J]. 中国医院药学杂志,2001,21(1):19-20.
[9]刘春泉,李大婧,刘荣. 蒽酮-硫酸法测定北冬虫夏草多糖含量[J]. 江苏农业科学,2006(2):122-124.
[10]王安亭,王祖. 冬虫夏草虫草多糖的分离纯化及含量的测定[J]. 食用菌,2012(1):60-62.
[11]车振明,王燕,周黎黎. 人工蛹虫草子实体多糖分离最佳工艺研究[J]. 食品研究與开发,2004,25(5):78-79.
[12]鲁晓岩. 硫酸苯酚法测定北冬虫夏草多糖含量[J]. 食品工业科技,2002,23(4):69-70.
[13]郭思维,刘胜姿,李威. 人工冬虫夏草多糖脱色脱蛋白工艺研究[J]. 食品科技,2013,38(5):207-211.
[14]国家药典委员会. 中华人民共和国药典:四部[M]. 2015版. 北京:中国医药科技出版社,2015:375.
[15]池玥兰,王雪,王仁雷,等. 蛹虫草基质多糖的脱蛋白方法研究[J]. 食品科技,2014,39(12):202-205.
[16]夏文,杜洪志,董立莎,等. 蒽酮-硫酸法与苯酚-硫酸法测定切面红色与切面白色土茯苓药材中多糖含量的比较[J]. 时珍国医国药,2015,26(11):2572-2574.
