金针菇DNA提取方法比较
2017-07-13马晓凡李林
马晓凡 李林

摘要[目的]筛选有效的金针菇DNA提取方法。[方法]以培养的金针菇菌丝体为材料,分别采用CTAB法和试剂盒法提取金针菇DNA,并用琼脂糖凝胶电泳法和分光光度法检测所提取DNA样液的浓度与纯度。[结果]分光光度结果及电泳鉴定表明CTAB法提取的DNA产量较大但杂质多,试剂盒法提取的DNA产量小但杂质少。[结论]CTAB法和试剂盒法均可用于金针菇DNA的提取,如后续试验对提取的DNA纯度没有特别要求,可用CTAB法替代试剂盒法。
关键词 金针菇;DNA提取;CTAB法;试剂盒法
中图分类号 S646.1+5 文献标识码 A 文章编号 0517-6611(2017)02-0158-03
Abstract[Objective] To select the effective DNA extraction method for Flammulina velutipes.[Method] CTAB method and reagent kit method were used for extracting DNA separately by using F.velutipes mycelium as materials.The concentration and purity of DNA samples were detected by agarose gel electrophoresis method and spectrophotometric test.[Result] Compared to CTAB method,the purity of DNA extracted by reagent kit method was better,while the yield was smaller.[Conclusion] Both methods can be used for DNA extraction of F.velutipes,and if there is no strict demand for the purity of followup experiments,the reagent kit method can be replaced by CTAB method.
Key words Flammulina velutipes;DNA extraction;CTAB method;Reagent kit method
食用菌作为21世纪的朝阳产业,其市场前景广阔。随着产业的发展,有关食用菌的基础研究已深入到分子水平,从各种食用菌中提取高质量的DNA是其分子生物学研究的前提和关键[1-2]。目前以草菇、平菇、香菇等食用菌为材料的分子生物学研究较多,且DNA提取已有一些成功的报道[3-5],但作为世界上产量居第6位的食用真菌金針菇在分子生物学研究领域还有很多工作要做。DNA提取是获取高产、优良菌种的基础,提取的DNA纯度和产量对后续研究影响较大,为了更好地开展下游研究,有必要对金针菇DNA的提取方法进行筛选和优化。近年来国内外学者利用CTAB法及试剂盒法提取真菌DNA获得了较好的结果[6-8]。该研究通过对比不同提取方法所得DNA的产量、纯度,探寻有效提取金针菇DNA的方法,为其相关分子生物学研究提供资料。
1 材料与方法
1.1 材料
1.1.1 菌株来源。
实验室收集到的金针菇种质资源,有蔬支(SZ)、康盛(KS)、雪榕(XR)和九道菇(JD)4个品种。试验采用菌丝体作为材料提取DNA,菌丝体的培养方法是先将金针菇菌丝体斜面培养活化,之后转移到PDA平板上培养到菌丝体铺满培养基表面,材料处理采用液氮研磨法。
1.1.2 主要试剂。
CTAB抽提缓冲液、氯仿、氯仿∶异戊醇(24∶1)、苯酚∶氯仿∶异戊醇(25∶24∶1)、异丙醇、0.5×TE缓冲液、75%乙醇、5 mol/L醋酸钠、1 mol/L TrisHCl、试剂盒、1×TE、Regular Agarose G10、I型核酸染色剂、6×Loading Buffer、DNA Maker,以上试剂购于烟台三和化学试剂有限公司、天津市富宇精细化工有限公司等。
1.1.3 主要仪器。
MJ250BSHII霉菌培养箱(上海新苗医疗器械制造有限公司);Eppendorf Research plus单道可调量程移液器(上海亚亦生物科技有限公司);Practum1241CN分析天平(赛多利斯科学仪器北京有限公司);ND2000 NanoDrop分光光度计(Thermo Scientific公司);ChemiDoc MP凝胶成像系统(BioRad公司);BioRad电泳仪(BioRad公司)。
1.2 方法
1.2.1 DNA提取方法。
1.2.1.1 改良的CTAB法。①将适量金针菇研磨液倒入含700 μL 抽提缓冲液的1.5 mL灭菌离心管中,使磨碎液高度约占管2/3,轻轻搅动混匀,65 ℃水浴恒温1 h,每隔10 min轻摇1次,30~60 min后取出;②冷却2 min后加入氯仿∶异戊醇(24∶1)满管,混匀后放入离心机10 000 r/min离心10 min;③移液器吸取上清液移入另1管并加600 μL异丙醇,轻轻摇动至可见白色絮状物后离心,弃掉废液,倒置离心管30 s,直立后向沉淀中滴加720 μL 75%乙醇及80 μL 5 mol/L醋酸钠,轻弹管尖使DNA块状物浮游,放置30 min,使其溶解;④10 000 r/min离心后向沉淀滴加800 μL 75%乙醇,将DNA再洗30 min;⑤离心后倒去废液自然风干,加入50 μL 0.5×TE缓冲液(含RNase),置于37 ℃恒温箱约15 h[9-11]。
1.2.1.2 试剂盒法。严格按照植物基因组DNA提取试剂盒[天根生化科技(北京)有限公司,DP305-08]的使用说明书进行操作,并根据预试验的效果,进行改进。具体改进方法为将第2步中加入700 μL氯仿,充分振荡混匀,12 000 r/min离心10 min改为加入600 μL氯仿,充分振荡混匀,12 000 r/min离心10 min;取750 μL上清,加750 μL苯酚∶氯仿∶异戊醇(25∶24∶1)充分振荡,12 000 r/min离心10 min;取650 μL上清,加650 μL氯仿∶异戊醇(24∶1)充分振荡,12 000 r/min离心10 min。
1.2.2 DNA浓度和纯度检测方法。
1.2.2.1 浓度检测方法。 5 μL DNA提取液加入1 μL溴酚蓝上样缓冲液吸打混匀后,加至1%琼脂糖凝胶中,110 V电压电泳30 min后取出,在凝胶成像仪上观察并拍照记录。
1.2.2.2 纯度检测方法。 取1~2 μL DNA提取液,以TE缓冲液为空白对照,测各个样品在260、280 nm波长处的吸光度,并计算其比值。
2 结果与分析
2.1 吸光度比较 核酸、蛋白质分别在260、280 nm处有紫外线最大吸收峰,纯净DNA的A260/A280比值应介于1.8~2.0(>2.0表明有RNA污染,<1.8表明有蛋白质污染)。分别用CTAB法与试剂盒法提取金针菇DNA,采用分光光度法检测提取物纯度,检测结果如表1、2所示。
由表1可知,CTAB法所提取的4个品种,每品种分设4组,4个品种金针菇A260/A280的平均值分别为SZ 2.12、XR 2.14、KS 2.23、JD 3.40,排除不同品种金针菇会对试验结果产生影响的猜测,表明CTAB法可有效提取金针菇DNA,但其均值大于2.0,表明杂质较多并有RNA污染。由表2可知,试剂盒法所提取DNA浓度较低,产量少,但其A260/A280稳定于1.8~2.0,表明试剂盒法所提取DNA纯度更高。
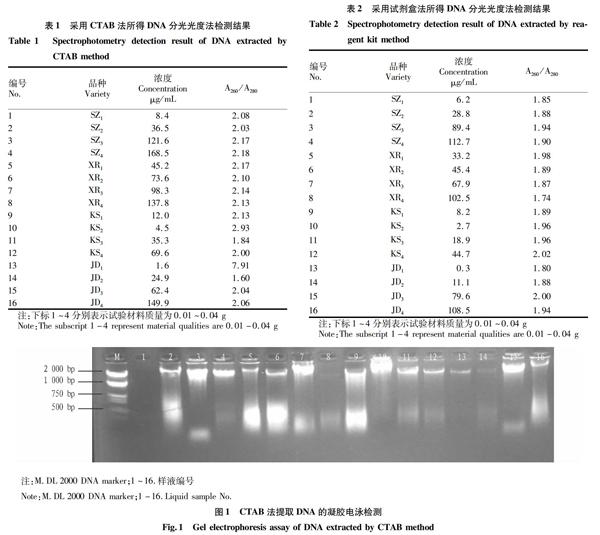
2.2 琼脂糖凝胶电泳图比较
琼脂糖凝胶电泳检测2种方法提取DNA的浓度结果如图1、2所示。由图1可知,16个点样中有15个均为有效提取,且产量较大,虽在提取DNA前已加入RNase,但在琼脂糖凝胶最前端有明显亮带,可能是未消化DNA、杂蛋白在点样孔处有残留,这些物质与DNA结合形成复合物,使DNA无法离开点样孔,部分条带有少许弥散,说明DNA存在降解。由图2可知,试剂盒法所提取的DNA产量较少,但杂质少,纯度更高。
3 结论与讨论
该试验运用CTAB法与试剂盒法这2种方法提取金针菇DNA,并对试验结果进行比较。
在提取方法上,CTAB溶解细胞膜并与核酸结合,Tris-HCl(pH 8.0)提供缓冲环境防止核酸被破坏。该法既能裂解细胞,又能有效沉淀多糖,过程中多次使用氯仿可使蛋白质与核酸分离,75%乙醇洗涤可有效去除盐离子,达到纯化DNA的目的,但过程繁琐,用时较长,酚、氯仿等试剂有挥发毒性,长期使用危害操作员健康,且重复使用离心管,易造成交叉污染。试剂盒法将硅胶膜固定在离心管中,用离心力让液体通过硅胶膜,核酸则留在膜上,经过洗涤、洗脱后得到核酸。该方法的优点是操作简单、耗时短,缺点是反复离心易损失游离的DNA。
液氮研磨是机械破壁法,研磨条件剧烈易造成DNA断裂、降解或小片段未能随大片段基因组DNA一起离心沉淀而出现条带拖尾现象,且沉淀时间不完全,洗涤时DNA丢失。
CTAB法提取的DNA产量较大但杂质多,试剂盒法提取的DNA产量小但杂质少,针对试验结果分析2种试验方法优缺点,可将两者结合,即在CTAB提取之后用试剂盒进行纯化,并在后续试验中用TE溶解DNA。
参考文献
[1] 趙春喜,马利华,杨同文.TRIS 饱和酚一步法提取食用菌 DNA[J].安徽农业科学,2008,36(28):12122.
[2] 崔素萍,康振生,赵杰,等.一种快速提取小麦叶片总 RNA 的方法[J].西北植物学报,2006,26(2):314-318.
[3] 江玉姬,谢宝贵,陈文校.草菇 DNA 提取方法初探[J].福建农业学报,2000,15(2):61-64.
[4] 闫燕,许文涛,苏春元,等.平菇基因组 DNA 提取方法的研究[J].食品工业科技,2011(9):190-193.
[5] 程水明.香菇基因组高分子量 DNA 的提取[J].生物技术通报,2006(5):84-86.
[6] 房凌旭.一种改进的 CTAB 法提取真菌 DNA[J].赤子,2015(12):198.
[7] 李渊,张永杰,刘杏忠,等.利用 CTAB 法和子囊孢子破壁法提取冬虫夏草菌 DNA[J].菌物研究,2013,11(4):261-265.
[8] 侯立娟,李玉,孟丽,等.草菇培养料中微生物总 DNA 的高效提取[J].东北林业大学学报,2011,39(11):56-60.
[9] 白永宏,陈国梁,闫冬,等.几种食用菌子实体总 DNA 提取方法的比较研究[J].安徽农业科学,2011,39(19):11409-11410.
[10] 徐彦军,刘洋.苦瓜 DNA 提取方法的比较[J].湖北农业科学,2012,51(17):3866-3868.
[11] GUO L D,HYDE K D,LIEW E C Y.Identification of endophytic fungi from Livistona chinensis based on morphology and rDNA sequences[J].New phytologist,2000,147(3):617-630.
