冬凌草甲素诱导三阴乳腺癌MDA—MB—231细胞凋亡及对细胞内活性氧水平的影响
2017-07-13齐琦张配李其响潘琼郑海伦赵素容
齐琦+张配+李其响+潘琼+郑海伦+赵素容

[摘要] 冬凌草甲素是从中药冬凌草Rabdosia rubescens中分离得到的一种贝壳杉烯二萜类的天然有机化合物,具有抗炎、抗菌、抗肿瘤等多种生物活性。该实验观察冬凌草甲素对三阴乳腺癌MDA-MB-231细胞凋亡的影响及其可能的作用机制。采用MTT法检测冬凌草甲素对MDA-MB-231细胞的增殖抑制作用,PI单染、Annexin V-FITC/PI双染流式细胞术分析冬凌草甲素对MDA-MB-231细胞凋亡的影响,活性氧(ROS)试剂盒检测细胞内ROS水平的变化,Western blot分析PARP,Bcl-2,caspase-3蛋白的表达情况。结果表明,冬凌草甲素对乳腺癌MDA-MB-231细胞具有明显的凋亡诱导作用,显著升高细胞内的ROS水平,下调抗凋亡蛋白Bcl-2的表达,并促进caspase-3及其底物PARP的切割。提示,冬凌草甲素诱导MDA-MB-231细胞凋亡的作用可能与升高细胞内ROS水平、下调Bcl-2的表达以及激活caspase-3相关。
[关键词] 乳腺癌; 冬凌草甲素; 细胞凋亡; 活性氧
[Abstract] Oridonin, which is an ent-kaurene diterpenoid isolated from traditional Chinese medicine Rabdosia rubescens, displays various bioactivities, including anti-inflammation, anti-bacteria and anti-tumor. This study aimed to investigate the effect of oridonin on apoptosis of triple-negative breast cancer MDA-MB-231 cells and its underlying mechanisms. The inhibitory effect of oridonin on proliferation of MDA-MB-231 cells was measured by MTT assay; Apoptosis was analyzed by flow cytometry with PI staining and Annexin V-FITC/PI staining; Intracellular reactive oxygen species (ROS) level was determined by ROS detection kit, and expressions of PARP, Bcl-2, caspase-3 were analyzed by Western blot. The results showed that oridonin exhibited a significant effect in inducing apoptosis of MDA-MB-231 cells, enhancing intracellular ROS level, down-regulating expression of Bcl-2 protein, and promoting cleavage of caspase-3 and its substrate PARP. These results indicated that the apoptosis-inducing effect of oridonin on MDA-MB-231 cells might be correlated with increase of intracellular ROS level, down-regulation of Bcl-2 protein and activation of caspase-3.
[Key words] breast cancer; oridonin; apoptosis; reactive oxygen
乳腺癌是世界范圍内严重危害女性健康与生命的恶性肿瘤,其发病率呈逐年增长的趋势。近年来尽管其治疗取得了长足的进步,但乳腺癌在发展中国家的发病率依然快速增长[1]。目前,外科手术、放疗和化疗是乳腺癌最主要的治疗手段。雌激素受体、孕激素受体、人类表皮生长因子受体2(HER2)均为阴性表达的乳腺癌,为三阴性乳腺癌(TNBC),该亚型的乳腺癌占乳腺癌病例数的12%~24%[2]。TNBC具有恶性程度高、侵袭性强、预后差等特征,并对内分泌治疗和抗HER2的靶向治疗均不敏感[3-4]。因此,寻找新的作用机制的治疗药物对TNBC的治疗具有重要意义。
冬凌草甲素是从中药冬凌草Rabdosia rubescens中分离得到的一种贝壳杉烯二萜类的天然有机化合物,具有抗炎、抗菌、抗肿瘤等多种生物活性[5]。其中,抗肿瘤作用的研究受到了广泛关注,研究发现,冬凌草甲素对肺癌、结肠癌、胰腺癌等显示了良好的抗肿瘤效应[6-8],且毒副作用较低,尚未见对骨髓、肝脏、肾脏、心脏等重要脏器有明显损伤作用的报道。该化合物以其显著的抗肿瘤活性及低毒副作用等优势,显示了作为新型抗肿瘤药物或辅助抗肿瘤药物的应用前景[9-10]。但冬凌草甲素抗肿瘤作用的具体机制并不明确。近年来,有研究表明某些化疗药物或化合物可通过升高肿瘤细胞内活性氧(ROS)水平杀伤肿瘤细胞[11-12]。本实验将从ROS出发,探讨冬凌草甲素诱导三阴乳腺癌MDA-MB-231细胞凋亡的作用机制。
1 材料与方法
1.1 细胞株 人乳腺癌MDA-MB-231细胞购自中国科学院上海细胞库。于含10%胎牛血清的DMEM培养液中,5%CO2细胞培养箱中常规培养。
1.2 试剂 DMEM培养液(Hyclone公司);胎牛血清(Gibco公司);冬凌草甲素(Merck公司),以二甲基亚砜(DMSO)溶解;MTT,PI(Sigma公司);Annexin V-FITC凋亡检测试剂盒(索莱宝公司);ROS探针DCFH-DA,0.25%胰蛋白酶(碧云天生物技术研究所);PARP,Bcl-2抗体(Santa Cruz公司);caspase-3抗体(Abcam公司);β-actin,HRP标记的山羊抗兔IgG(博士德公司)。
1.3 细胞存活率测定 96孔细胞培养板中每孔接种6×103个MDA-MB-231细胞,细胞贴壁后更换新的培养液,加入不同浓度(10,20,30,40,50 μmol·L-1)冬凌草甲素处理细胞,同时设不加药物的对照组(加入等体积的培养液及溶剂DMSO)和空白对照组,每组3个重复。药物处理48 h后每孔加入15 μL MTT液继续培养4 h,弃上清,每孔加入150 μL DMSO,结晶充分溶解后用酶标仪测定570 nm处吸光度A。
细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)×100%
1.4 Annexin V-FITC/PI染色法检测细胞早期凋亡 6孔细胞培养板中每孔接种3×105个细胞,细胞贴壁后换液加入含20,30,40 μmol·L-1冬凌草甲素的新培养液,设置不加药物的对照组,每個处理3个重复。药物作用24 h后收集细胞,调整细胞密度为5×105~1×106个/mL,取1 mL细胞,1 000 r·min-1离心10 min,弃上清,用PBS洗涤细胞2次。将细胞重悬于500 μL结合缓冲液中,每个样品中加入5 μL Annexin V-FITC,混匀,室温避光孵育15 min,上机前5 min加入5 μL PI,混匀,1 h内上流式细胞仪检测。
1.5 PI染色法检测总的细胞凋亡率 6孔细胞培养板中每孔接种3×105个细胞,细胞贴壁后更换新的培养液,加入20,30,40 μmol·L-1冬凌草甲素处理细胞,设置不加药物的对照组,每个处理3个重复。药物处理48 h后胰酶消化收集细胞,PBS洗涤,75%冷乙醇-20 ℃固定过夜。测试前用PBS洗涤2次,将细胞重悬于300 μL PI液中,室温避光反应30 min,上流式细胞仪分析具有subG0/G1期DNA含量的细胞比例。
1.6 细胞内ROS检测 6孔细胞培养板中每孔接种3×105个细胞,细胞贴壁后更换新的培养液,加入20,30,40 μmol·L-1冬凌草甲素处理细胞,设置不加药物的对照组,每个处理3个重复。药物作用5 h后收集细胞,加入含10 μmol·L-1 DCFH-DA的无血清培养液,37 ℃避光孵育20 min,用无血清培养液洗涤细胞3次,以充分去掉未进入细胞内的DCFH-DA,上流式细胞仪检测DCF的荧光强度。
1.7 Western blot检测凋亡相关蛋白的表达 接种细胞于6孔细胞培养板中,5×105个/孔,培养24 h后换液加入含20,30,40 μmol·L-1冬凌草甲素的新培养液,设置不加药物的对照组。药物处理24 h后胰酶消化收集细胞,PBS洗2次,每处理组细胞加入50 μL蛋白裂解液,冰上裂解30 min,提取总蛋白,以牛血清白蛋白为标准采用BCA法测定各处理组的蛋白浓度。每处理组取50 μg蛋白进行12% SDS-PAGE垂直电泳;蛋白采用湿法转膜至PVDF膜;Western封闭液室温封闭2~3 h;一抗室温孵育1~3 h或4 ℃过夜;二抗室温孵育1 h;ECL发光试剂盒显影;Bio-Rad 凝胶成像仪曝光获取图像。
1.8 统计学处理 采用SPSS 19.0统计软件对实验数据进行方差分析,组间差异比较采用LSD检验,当P<0.05时差异有统计学意义。
2 结果
2.1 冬凌草甲素对乳腺癌MDA-MB-231细胞增殖的影响 MTT实验结果表明,与对照组相比,10~50 μmol·L-1冬凌草甲素能明显抑制MDA-MB-231细胞的增殖,随着药物浓度增加其抑制作用越强(图1)。
2.2 冬凌草甲素对乳腺癌MDA-MB-231细胞早期凋亡的影响 冬凌草甲素作用MDA-MB-231细胞24 h可诱导其发生早期凋亡。对照组细胞的早期凋亡率为(1.5±0.9)%,药物处理组的细胞早期凋亡率随着冬凌草甲素浓度的增加而升高,20,30,40 μmol·L-1冬凌草甲素组的细胞早期凋亡率分别为(9.3±1.7)%,(15.4±2.1)%,(26.9±3.0)%,相比于对照组有显著性差异(P<0.01)。
2.3 冬凌草甲素对乳腺癌MDA-MB-231细胞总的细胞凋亡的影响 浓度为20,30,40 μmol·L-1的冬凌草甲素处理MDA-MB-231细胞48 h,收集细胞,PI染色流式细胞术检测总的细胞凋亡情况。结果显示,对照组的总的细胞凋亡率为(1.3±0.6)%,20,30,40 μmol·L-1的冬凌草甲素可诱导乳腺癌细胞发生显著的细胞凋亡,总的细胞凋亡率分别为(19.4±2.7)%,(39.7±2.8)%,(50.5±3.2)%,与对照组相比有显著性差异(P<0.01)。
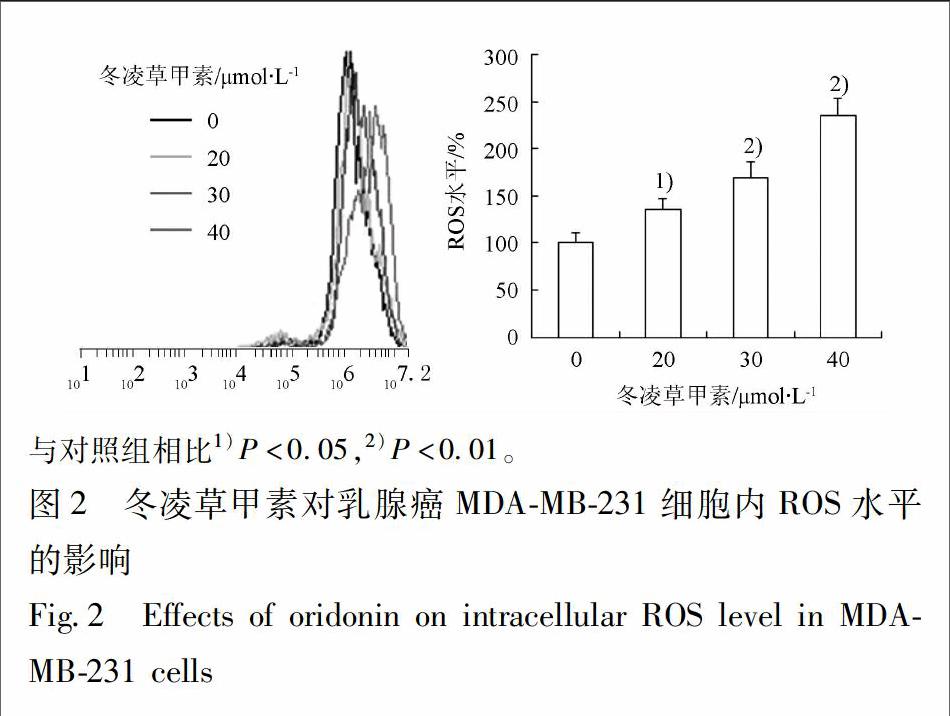
2.4 冬凌草甲素对乳腺癌MDA-MB-231细胞内ROS水平的影响 浓度为20,30,40 μmol·L-1的冬凌草甲素处理MDA-MB-231细胞5 h,收集细胞,流式细胞仪测定细胞内ROS水平的变化。结果表明,与对照组相比,冬凌草甲素能显著升高细胞内ROS水平,随着药物浓度增加其升高ROS的作用越强(图2)。
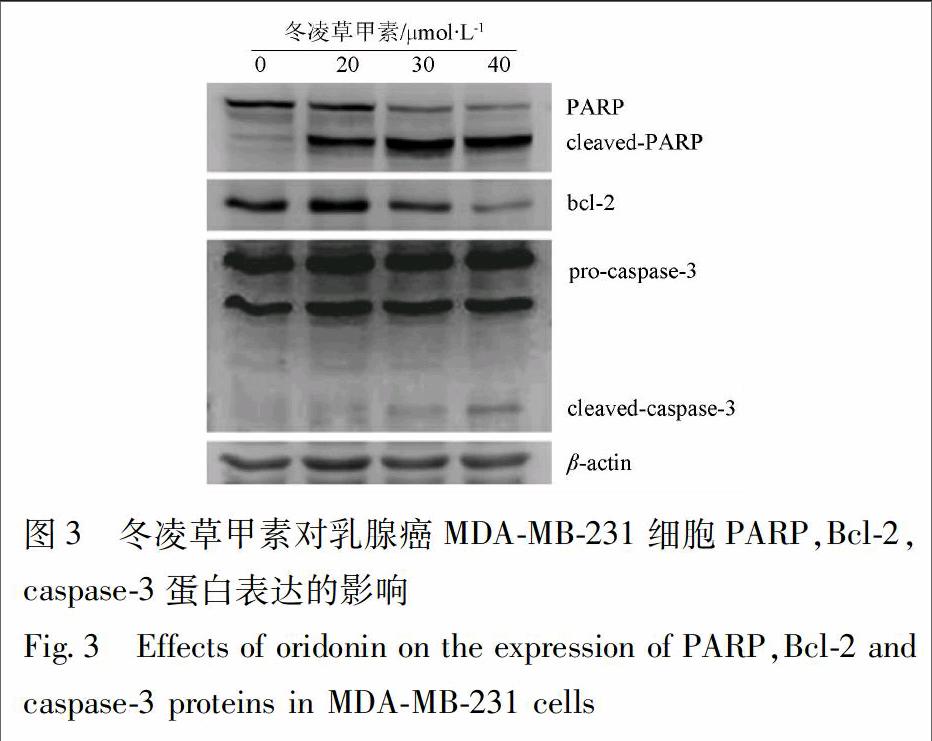
2.5 冬凌草甲素对乳腺癌MDA-MB-231细胞PARP,Bcl-2,caspase-3蛋白表达的影响 浓度为20,30,40 μmol·L-1的冬凌草甲素处理MDA-MB-231细胞24 h,采用Western blot观察凋亡相关蛋白PARP,Bcl-2,caspase-3的表达情况。结果显示,冬凌草甲素处理乳腺癌细胞后可下调抗凋亡蛋白Bcl-2的表达,促进caspase-3及其底物PARP的切割(图3)。
3 讨论
ROS依据其分子类型的不同可分为非离子型和离子型,包括过氧化氢、羟自由基、超氧阴离子自由基、单线态氧、烷过氧化自由基、脂过氧化自由基等。细胞内氧化还原状态的平衡对于细胞的存活及功能至关重要,低水平的ROS在维持细胞内稳态中发挥了重要作用[13]。研究表明,在肿瘤的发生发展进程中,细胞内的氧化还原状态通常发生异常变化,引起肿瘤细胞内ROS水平的升高[14]。升高的ROS不仅使肿瘤细胞更易于发生基因突变,且使肿瘤细胞对异常升高的ROS较正常细胞更为敏感[15]。许多抗肿瘤化合物可通过升高细胞内ROS诱导肿瘤细胞发生凋亡[16-17]。通过调节Bcl-2蛋白家族的磷酸化和泛素化,ROS可上调促凋亡蛋白的表达、下调抗凋亡蛋白的表达,进而诱导细胞凋亡[18]。Hildeman等报道,细胞内ROS的升高可通过下调Bcl-2蛋白的表达引起线粒体膜电位的下降,从而诱发细胞凋亡[19]。本实验以DCFH-DA为细胞内ROS探針,检测到冬凌草甲素可升高MDA-MB-231细胞内ROS水平,同时Western blot实验结果显示冬凌草甲素可下调抗凋亡蛋白Bcl-2的表达,提示其可能通过升高细胞内ROS而下调Bcl-2的表达参与细胞凋亡的诱导。
细胞凋亡是受死亡信号调节并伴随天冬氨酸特异性半胱氨酸蛋白酶(caspases)活化的一种自主而有序的细胞死亡形式,是多基因严格调控的过程[20]。Bcl-2蛋白家族在细胞凋亡过程中起着关键性作用,分为抗凋亡成员和促凋亡成员两大类,前者包括Bcl-2,Bcl-XL,Mcl-1等,可保护线粒体膜的完整性;后者包括Bax,Bak,Bad等,可促使多种凋亡诱导因子的释放,通过激活caspases触发细胞凋亡[21]。caspases蛋白酶家族在细胞凋亡过程中发挥着重要作用,其中caspase-3是介导细胞凋亡的关键分子,该分子被上游信号Bcl-2等激活后可引发酶促级联反应,通过切割其底物核蛋白PARP,导致细胞凋亡的发生[22]。本实验中,冬凌草甲素处理MDA-MB-231细胞24 h,可下调抗凋亡蛋白Bcl-2的表达,并引发caspase-3和PARP的切割,提示冬凌草甲素可能通过提高线粒体膜的通透性、激活caspase-3而诱导细胞凋亡。
本实验结果表明,冬凌草甲素可诱导MDA-MB-231细胞凋亡,其机制可能与升高细胞内ROS水平、下调Bcl-2的表达并激活caspase-3相关,但ROS下调Bcl-2表达的分子机制尚需进一步研究。
[参考文献]
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359.
[2] Rakha E A, Ellis I O. Triple-negative/basal-like breast cancer: review[J]. Pathology, 2009, 41(1): 40.
[3] Stagg J, Allard B. Immunotherapeutic approaches in triple-negative breast cancer: latest research and clinical prospects[J]. Ther Adv Med Oncol, 2013, 5(3): 169.
[4] Foulkes W D, Smith I E, Reis-Filho J S. Triple-negative breast cancer[J]. N Engl J Med, 2010, 363(20): 1938.
[5] Wang S, Zhong Z, Wan J, et al. Oridonin induces apoptosis, inhibits migration and invasion on highly-metastatic human breast cancer cells[J]. Am J Chin Med, 2013, 41(1): 177.
[6] Xiao X, He Z, Cao W, et al. Oridonin inhibits gefitinib-resistant lung cancer cells by suppressing EGFR/ERK/MMP-12 and CIP2A/Akt signaling pathways[J]. Int J Oncol, 2016, 48(6): 2608.
[7] Liu Q Q, Chen K, Ye Q, et al. Oridonin inhibits pancreatic cancer cell migration and epithelial-mesenchymal transition by suppressing Wnt/β-catenin signaling pathway [J]. Cancer Cell Int, 2016, 16: 57.
[8] Ren C M, Li Y, Chen Q Z, et al. Oridonin inhibits the proliferation of human colon cancer cells by upregulating BMP7 to activate p38 MAPK [J]. Oncol Rep, 2016, 35(5): 2691.
[9] Liu Z, Ouyang L, Peng H, et al. Oridonin: targeting programmed cell death pathways as an anti-tumour agent[J]. Cell Prolif, 2012, 45 (6): 499.
[10] Li C Y, Wang E Q, Cheng Y, et al. Oridonin: an active diterpenoid targeting cell cycle arrest, apoptotic and autophagic pathways for cancer therapeutics [J]. Int J Biochem Cell Biol, 2011, 43 (5): 701.
[11] Zou X, Liang J, Sun J, et al. Allicin sensitizes hepatocellular cancer cells to anti-tumor activity of 5-fluorouracil through ROS-mediated mitochondrial pathway [J]. J Pharmacol Sci, 2016, 131(4): 233.
[12] Wang H, Zhang T, Sun W, et al. Erianin induces G2/M-phase arrest, apoptosis, and autophagy via the ROS/JNK signaling pathway in human osteosarcoma cells in vitro and in vivo[J]. Cell Death Dis, 2016, 7(6): e2247.
[13] D′Autreaux B, Toledano M B. ROS as signalling molecules: mechanisms that generate specificity in ROS homeostasis[J]. Nat Rev Mol Cell Biol, 2007, 8(10): 813.
[14] Mondal A, Bennett L L. Resveratrol enhances the efficacy of sorafenib mediated apoptosis in human breast cancer MCF7 cells through ROS, cell cycle inhibition, caspase 3 and PARP cleavage[J]. Biomed Pharmacother, 2016, 84: 1906.
[15] Locasale J W, Vander Heiden M G, Cantley L C. Rewiring of glycolysis in cancer cell metabolism[J]. Cell Cycle, 2010, 9(21): 4253.
[16] Zhong F, Tong Z T, Fan L L, et al. Guggulsterone-induced apoptosis in cholangiocarcinoma cells through ROS/JNK signaling pathway [J]. Am J Cancer Res, 2016, 6(2): 226.
[17] Zhang M, Su L, Xiao Z, et al. Methyl jasmonate induces apoptosis and pro-apoptotic autophagy via the ROS pathway in human non-small cell lung cancer [J]. Am J Cancer Res, 2016, 6(2): 187.
[18] Li D, Ueta E, Kimura T, et al. Reactive oxygen species (ROS) control the expression of Bcl-2 family proteins by regulating their phosphorylation and ubiquitination[J]. Cancer Sci, 2004, 95(8): 644.
[19] Hildeman D A, Mitchell T, Aronow B, et al. Control of Bcl-2 expression by reactive oxygen species [J]. Proc Natl Acad Sci USA, 2003, 100(25): 15035.
[20] Gillies L A, Kuwana T. Apoptosis regulation at the mitochondrial outer membrane[J]. J Cell Biochem, 2014, 115(4): 632.
[21] Mohana-Kumaran N, Hill D S, Allen J D, et al. Targeting the intrinsic apoptosis pathway as a strategy for melanoma therapy [J]. Pigment Cell Melanoma Res, 2014, 27(4): 525.
[22] Cullen S P, Martin S J. Caspase activation pathways: some recent progress[J]. Cell Death Differ, 2009, 16(7): 935.
[責任编辑 张宁宁]
