茉莉酸甲酯调控下人参发状根皂苷合成相关基因表达的研究
2017-07-13王康宇于丽莉张美萍尹锐林彦萍赵
王康宇+于丽莉+张美萍+尹锐+林彦萍+赵明珠+孙春玉+王义

[摘要] 通过外源添加茉莉酸甲酯(MeJA),研究其调控液体培养条件下人参发状根中皂苷生物合成途径相关酶基因在诱导子作用时表达情况。以四年生吉林人参主根诱导的人参发状根无性系为材料,利用香草醛-硫酸比色法测定MeJA 处理前后人参发状根的总皂苷含量;同时,利用荧光实时定量PCR测定MeJA 处理前后人参发状根中鲨烯合成酶(squalene synthase,SQS)、鲨烯环氧酶(squalene epoxidase,SQE)、氧化鲨烯环化酶(oxidized squalene cyclase,OSC)、达玛烷二醇合成酶(dammarenediol synthase,DS)、β-香树脂合成酶(β-amyrin synthase,β-AS)和环阿屯醇合成酶(cycloartenol synthase,CAS)基因的相对表达量。结果表明:获得MeJA添加到人参发状根中最佳添加浓度为6×10-4μmol·L-1、添加时间为22 d、作用时间为5 d;MeJA的添加可以提高人参发状根中过氧化物酶(PPD)、过氧化氢酶(CAT)和过氧化物酶(PPD)的酶活性;經过MeJA处理后人参发状根中人参皂苷生物合成途径的SQS,SQE,OSC,DS,β-AS基因的表达变化均有显著提高,然而CAS基因的表达变化不显著。因此说明在添加MeJA处理后,皂苷生物合成途径中SQS,SQE,OSC,DS,β-AS基因表达情况与PPD,CAT,PPO的酶活性的变化趋势也相一致。
[关键词] 人参发状根; 人参皂苷生物合成; 茉莉酸甲酯(MeJA); 基因表达
[Abstract] In order to obtain the expression of ginsenoside biosynthetic pathway related enzyme gene in ginseng hairy root under the control of elicitors, methyl jasmonate (MeJA) was added exogenously as elicitors. Ginseng hairy root clones induced by 4-year-old ginseng root was used as material, total saponin content in ginseng hairy root before and after MeJA treatment was determined by vanillin-sulfuric acid colorimetry, Meanwhile, relative expression of squalene synthase genes, squalene epoxidase genes, oxidized squalene cyclase genes, dammarenediol synthase genes, β-amyrin synthase genes, cycloartenol synthase genes before and after MeJA treatment were determined by Real-time PCR. The optimum conditions of MeJA which added to ginseng hairy root were obtained, the optimum additional concentration was 6×10-4μmol·L-1, the optimum additional time was 22 d, and the optimum action time was 5 d. The addition of MeJA could improve the enzymatic activity of peroxidase (PPD), catalase (CAT) and peroxidase (PPD) in ginseng hairy root. The expression of SQS,SQE,OSC,DS and β-AS genes of ginsenoside biosynthetic pathway increased significantly after MeJA treatment, while the change of CAS gene expression were not significant. The expression of key enzyme SQS,SQE,OSC,DS and β-AS genes in ginsenoside biosynthetic pathway was consistent with the changes of PPD,CAT,PPO enzymatic activity.
[Key words] ginseng hairy root; ginsenoside biosynthesis; methyl jasmonic acid(MeJA); gene expression
人参Panax ginseng C. A. Meyer是驰名中外的五加科人参属植物,闻名遐迩的“东北三宝”之一[1]。吉林省是我国人参的主要产地,占全球人参总产量的70%,人参产业不仅是吉林省重要的经济组成部分,更是我国国民经济中最具特色的新兴产业之一。人参中的主要活性成分为人参皂苷,按其化学性质可分为:人参皂苷二醇型(A型),包括Ra,Rbl,Rb2,Rc,Rd,Rh2等;人参皂苷三醇型(B型),包括Re,Rf,Rg1,Rg2,Rh1等;齐墩果酸型(C型),如Ro[2-3]。按苷元的基本类型可以分为:达玛烷型、齐墩果酸型和奥克梯隆型[3-4]。人参组织培养中人参发状根具有生长速度快,周期短,皂苷含量较高等特点,似的利用人参发状根组织培养作为细胞工厂定向生产人参皂苷的研究已经成为热点问题。但目前,我国对人参发状根的研究主要集中在发状根的诱导[5-7]、有效成分的提取分析[8-9],关于人参皂苷生物合成途径中调控皂苷合成的关键酶在人参发状根中的研究甚少。
研究表明茉莉酸类化合物可以在植物生长发育过程起到胁迫信号的重要作用[10]。外源性添加茉莉酸类物质(茉莉酸或茉莉酸甲酯等)不仅对植物的生长起作用,也能显著的影响植物的次级代谢活动[11-12]。当外源添加时激活信号转导通路,迫使植物产生应激反应,产生大量次生代谢产物应对各种胁迫病害[14-16]。因此,目前使用茉莉酸甲酯等小分子化合物作为诱导子成为了研究的热门方法,刺激植物合成大量具有商业价值的次生代谢产物[13,17]。
本研究以吉林人参为材料,诱导和筛选获得人参发状根无性系,通过筛选MeJA调控人参发状根生物合成人参皂苷的最佳作用浓度,最佳添加时间、最佳作用时间的条件,从而研究MeJA调控人参皂苷生物合成途径中重要的相关酶基因的表达情况。利用荧光实时定量PCR技术实时检测MeJA调控下人参皂苷生物合成途径中重要相关酶基因的表达,不仅可以为研究诱导子调控人参皂苷的生物合成提供数据支持,更可以为人参发状根体系作为细胞工厂定向生产人参皂苷提供理论依据和技术手段。
1 材料
实验材料为四年生人参主根诱导获得的人参发状根,由吉林农业大学-吉林省人参基因资源开发与利用工程研究中心提供。
人参皂苷Rg1单体对照品(批号110754-200826)采购于中检所、茉莉酸甲酯购于美国Sigma公司、RevertAidTM first strand cDNA Synthesis Kit反转录试剂盒采购于美国MBI公司、荧光实时定量qPCR试剂盒购于德国Qiagen公司、其他试剂均购于百泰克公司和北京化工厂(分析纯)。
荧光实时定量PCR扩增仪为美国ABI公司的7500型、高速冷冻离心机为美国Thermo公司的Fresco21型、恒温振荡培养箱为哈东联公司的HZQ-F160型、超微量核酸蛋白浓度检测仪为德国耶拿公司的Scandrop250型。
2 方法
2.1 筛选吉林人参发状根无性系
配置1/2MS固体培养基,倒入培养皿中,在培养皿背面画1.0 cm×1.0 cm的正方格用于测量人参發状根生长速度。选取生长良好的人参发状根切取发状根根尖部位1.0 cm长度,接于画好正方格的平板上于黑暗处培养。选择生长状况良好的,接种于1/2MS液体培养基中,培养条件为22 ℃,110 r·min-1振荡培养,以备后续实验。
2.2 茉莉酸甲酯(MeJA)的制备及添加
利用本实验室条件下构建好的人参发状根动力培养模型[18],分别考察MeJA最佳添加浓度、时间、作用时间对人参发状根的影响。选择配置MeJA溶液的基础浓度为200 μmol·L-1,设置7个添加浓度梯度分别为0,1,2,3,4,5,6 μL,筛选出MeJA最佳添加浓度;设置7个添加时间梯度分别为第14,16,18,20,22,24,26天,添加已经筛选出最佳添加浓度的MeJA,筛选出MeJA最佳添加时间;在已经确定MeJA最佳添加浓度和最佳添加时间的条件下,设置7个MeJA作用时间分别为1,2,3,4,5,6,7 d,作用时间过后更换新鲜1/2MS培养基后继续培养,筛选出MeJA最佳作用时间。每次筛选实验时,均设置相同条件下不做任何处理的5瓶对照组,筛选实验重复3次。
2.3 人参发状根生长量及皂苷含量的测定
以干、鲜重为指标进行发状根生长量的测定,干重为将新鲜材料取出后置于40 ℃以下条件的烘箱中烘干至恒重。
鲜重增加量(g/瓶)=收获时鲜重(g/瓶)- 接种时鲜重(g/瓶)
干重增加量(g/瓶)=收获时干重(g/瓶)- 接种时干重(g/瓶)
人参发状根中总皂苷提取方法是利用的索氏回流提取法、总皂苷含量检测方法是使用的硫酸香草醛-硫酸比色法 [18-19]。以人参皂苷Rg1对照品质量浓度为横坐标,不同浓度对照品吸光度为纵坐标,绘制人参皂苷的标准曲线,并获得标准曲线回归方程为Y=0.230 7X+0.002 7,R2=0.996 8,从而可以检测出待测样本中皂苷含量。
2.4 过氧化物酶(PPD)、多酚氧化酶(PPO)、过氧化氢酶(CAT)活力的测定
称取1.0 g发状根于研钵中,加入2 mL磷酸缓冲液(PPO活力pH 8.0,POD活力pH 5.5,CAT活力pH 7.8)充分研磨后,将匀浆后转入离心管中,再次向研钵中加入1.5 mL磷酸缓冲液,充分冲洗研钵后,将其转入离心管中,8 000 r·min-1离心10 min(POD,CAT),4 000 r·min-1离心15 min(PPO),取上清液3 mL至于干净试管中。向空白管和测定管中依次加入0.5 mol·L-1磷酸缓冲液2.5 mL(POD活力pH 5.5),4 mL(PPO活力pH 8.0),3 mL(CAT活力pH 7.8)。随后分别对POD,CAT,PPO活力进行测定。
2.4.1 POD活力测定[20] 在已经准备好的预处理溶液中加入1.0 mL 2% H2O2溶液、1.0 mL 0.5 mol·L-1愈创木酚溶液和0.5 mL酶溶液。先将对照组置于沸水浴中5 min使加入的酶失活,然后对照组和待测组同时置于37 ℃水浴处理10 min,取出后分别加入2 mL 20% TCA溶液终止反应,最在470 nm处检测A,并计算POD活力。POD活力=ΔA470 nm /(0.01×T) ×D(T为反应时间;D为稀释倍数)。
2.4.2 PPO活力测定[20] 在已经准备好的预处理溶液中加入1 mL 0.2 mol·L-1儿茶酚溶液,向对照组和待测组中分别加入1 mL酶溶液。置于37 ℃水浴处理10 min,取出后立即加2 mL 20% TCA溶液混匀终止反应,最后在525 nm处检测A,并计算PPO活力。PPO活力=ΔA525 nm/(0.01×t) ×D(T为反应时间;D为稀释倍数)。
2.4.3 CAT活力测定[20] 在已经准备好的预处理溶液中加入2 mL蒸馏水,在待测组中加入0.4 mL酶溶液,置于25 ℃水浴中预热处理3 min后加入0.6 mL 0.1 mol·L-1的H2O2,最后在240 nm处检测A,并计算CAT活力。CAT活性=(ΔA240×VT)/(0.1×V1×t×FW)(VT为粗酶溶液总体积;V1为使用粗酶溶液体积;FW为待测样本鲜重;t为反应时间)。
2.5 MeJA对人参发状根中皂苷生物合成相关基因表达的影响
2.5.1 吉林人参发状根的总RNA的提取 利用Trizol法提取吉林人参发状根的总RNA。对总RNA使用RNA纯化试剂盒进行纯化处理,并将其回溶于20 μL DEPC处理过的ddH2O中,最后利用核酸浓度检测仪Scandrop250测定RNA浓度。
2.5.2 人参发状根RNA的反转录 利用美国MBI公司的RevertAidTM first strand cDNA Synthesis Kit反转录试剂盒,将Total RNA反转录为cDNA,保存备用。
2.5.3 实时定量PCR的引物设计与合成 利用Vector NTI Advance 11.0软件设计GADPH,SQS,SQE,OSC,DS,β-AS,CAS基因的实时定量PCR扩增引物,并委托由华大基因(BGI)公司完成合成,引物序列见表1。
2.5.4 荧光实时定量PCR 荧光实时定量PCR反应体系参照试剂盒,根据常规PCR结果设置反应参数,每个模板3次重复。PCR循环参数为:预变性 95 ℃ 10 min;变性 95 ℃ 15 s;退火60 ℃ 1 min;延伸72 ℃ 30 s。将荧光实时定量PCR过程中收集的全部数据,使用美国ABI公司提供的SDS V2.3软件进行系统分析,并计算2-ΔΔCT,获得每个基因的相对表达量。
3 结果与分析
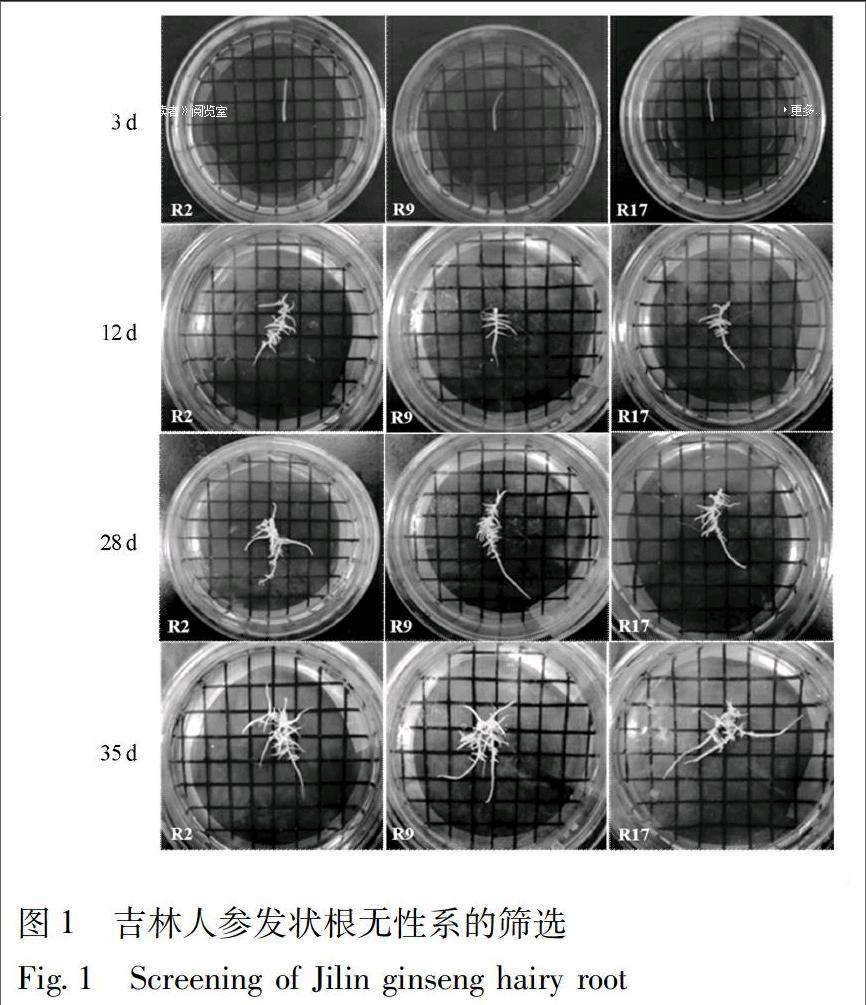
3.1 吉林人参发状根无性系的筛选
本实验对诱导获得的吉林人参的发状根通过单根培养,共筛选出23个人参发状根无性系,并将其命名为R1-R23。当培养到第3天时,人参发状根在1/2MS平板培养中开始有明显伸长;当培养到第12天时,人参发状根的伸长长度约为刚培养时长度的2倍,且出现较多分枝;当培养到第28天时,人参发状根伸长长度约为刚培养时长度的4倍,且出现根系的分枝上再次分枝,伴随愈伤化现象出现;当培养到第35天,发状根的分枝可达到30根以上,见图1。综合比对结果,人参发状根系无性系R9在35 d培养周期中,其生长速度较快,能够产生较多分枝,主根与分枝均呈现较高透明程度,并且颜色为乳白色,愈伤化程度较低,与其他22个人参发状根无性系相比优势显著,因此,确定R9人参发状根无性系为最优材料,并将其转移到1/2MS液体培养基中在22 ℃,150 r·min-1,暗培养条件下继续培养,以备后续实验使用。
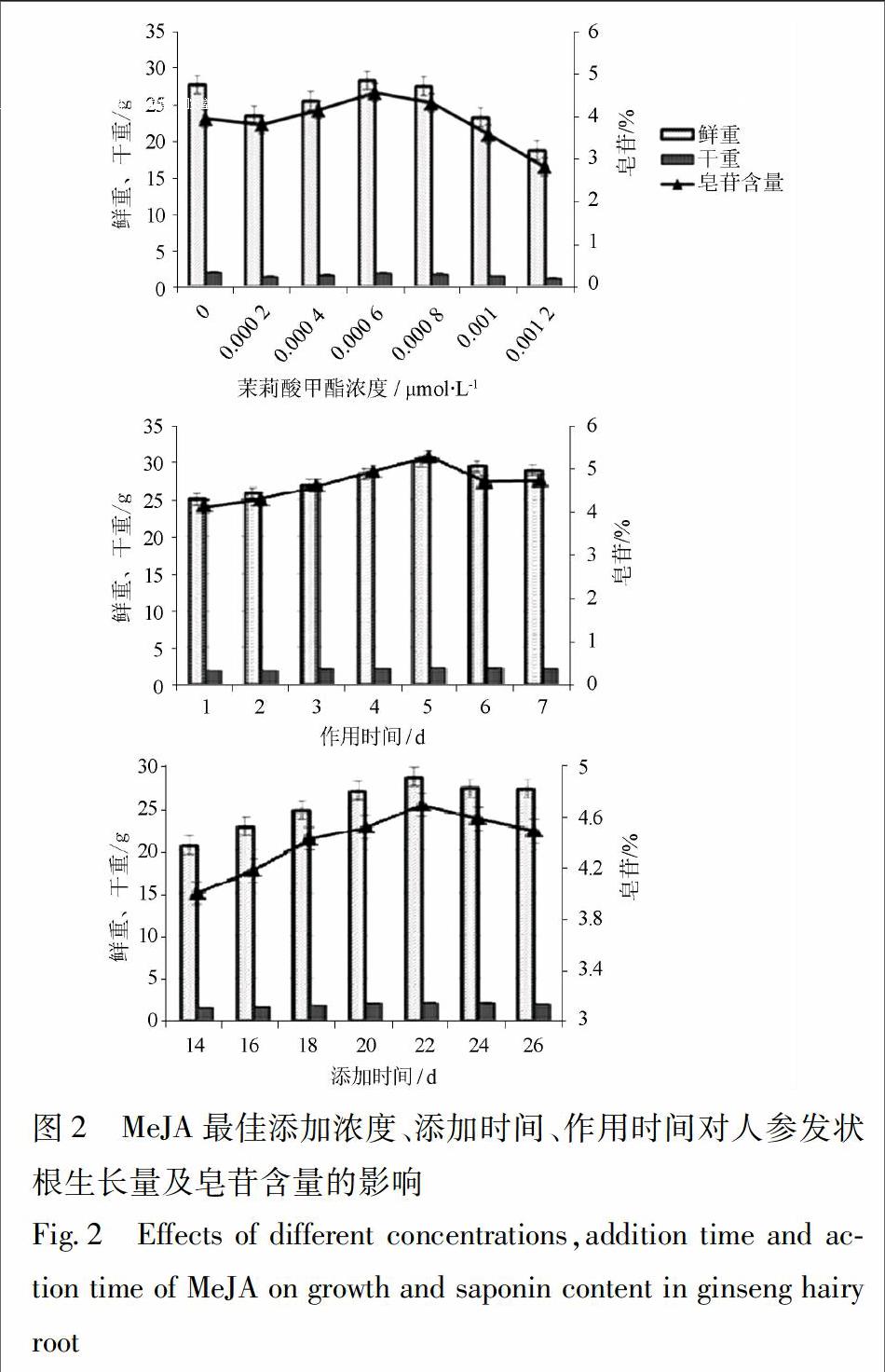
3.2 MeJA对人参发状根生长量与皂苷含量的影响
在筛选最佳添加浓度、添加时间和作用时间时MeJA对人参发状根的生长量、皂苷含量的影响显著,最佳条件下处理组的生长量和皂苷含量高于对照组。本实验通过筛选获得MeJA最佳添加浓度为6×10-4μmol·L-1、最佳添加时间为22 d,最佳作用时间为5 d,见图2。
3.3 MeJA对人参发状根中PPD,PPO,CAT 3种酶活力的影响
在MeJA的最佳添加条件下,分别检测了POD,CAT,PPO的酶活性,见图3。结果显示:POD酶活力在第6小时出现第1个小峰值。随着MeJA作用时间的增加,POD酶活力也升高,当POD酶活力在第20小时达到了最大值,测试组POD酶活力比对照组高1.40倍。随着作用时间继续增加,POD酶活力不断降低,当36 h后时POD酶活力与对照组的基本接近。PPO酶活力随着MeJA作用时间增加逐渐升高,当到第18小时 PPO的活力达到了最大值,随着酶活力开始下降,24 h后PPO酶活力与对照组的逐渐接近。CAT酶活力在第6小时出现第1个小峰值,随着MeJA作用时间的不断增加,测试组CAT酶活力也不断升高,CAT酶活力在第14小时达到了最大值,测试组CAT酶活力比对照组高1.43倍。随着作用时间不断增加,CAT酶活力开始逐渐降低,24 h后CAT酶活力与对照组的基本接近。因此,POD,PPO,CAT这3种作为保护植物面对外界刺激启动应激反应的酶类,同时还可以清除应激反应引发的活性氧。随着MeJA在调控人参发状根的作用时间的不断增加,POD,CAT,PPO这3种保护酶类的活性也随之升高,清除MeJA刺激人参发状根应激反应产生活性氧能力也不断提升,最终可以起到保护发状根细胞的膜结构,从而增加人参发状根对外界的抗性。
3.4 MeJA调控人参发状根中皂苷生物合成相关基因表达研究
本实验研究了MeJA对人参发状根中人参皂苷生物合成的SQS,SQE,OSC,DS,β-AS,CAS基因表达的影响,见图4。0 h作用的作为未经处理的对照组,经过MeJA处理后的人参发状根与对照组相比,SQS,SQE,OSC,DS,β-AS基因的表达变化均有显著提高。结果表明:在添加MeJA调控后第12小时,SQS基因的表达量达到最大值,高于对照组8.2倍;在添加MeJA调控后第24小时,SQE基因的表达量达到最大值,高于对照组11.04倍;在添加MeJA调控后第4小时,OSC基因的表达量呈现小幅度的上升,随后又呈现下降,在调控后第8小时,OSC基因表达量再次呈现上升,直到第16小时OSC基因的表达量达到最大值,高于对照组11.38倍,随着作用时间继续增加,其表达量逐步下降,但始终高于对照组。在添加MeJA调控后第20小时,DS和β-AS基因的表达量分别达到最大值,且分别高于对照组13.91,12.59倍。然而在添加MeJA调控后的人參发状根与未经处理的对照组发状根相比CAS基因的表达量变化不显著。
4 讨论
外源性添加茉莉酸类物质(茉莉酸或茉莉酸甲酯等)不仅对植物的生长起作用,也能显著的影响植物的次级代谢活动。当外源添加时激活信号转导通路,迫使植物产生应激反应,产生大量次生代谢产物应对各种胁迫病害[10-16]。因此,目前使用茉莉酸甲酯等小分子化合物作为诱导子成为了研究的热门方法,刺激植物合成大量具有商业价值的次生代谢产物。
本实验通过对吉林人参发状根外源添加MeJA作为诱导子,从结果可以发现:在添加MeJA调控人参发状根液体悬浮培养下,不仅可以促进悬浮培养条件下的人参发状根的生长,更可以定向影响人参发状根中皂苷生物合成。在MeJA添加刺激作用下,人参皂苷生物合成途径中SQS,SQE,OSC,DS,β-AS,CAS等关键酶基因的表达是一种动态的变化,通过MeJA刺激作用SQS,SQE,OSC,DS,β-AS基因的表达能发生快速响应,在添加作用6 h后,这5种关键酶基因的表达迅速升高。黄超等[21]利用钒酸盐小分子化合物作为诱导子,添加到人参细胞悬浮培养物中,研究发现:处理组中SQS,SQE,DS基因的表达量分别高于对照组7.6,10.3,17.8倍,同时处理组中CAS基因的表达量与对照组相比变化不显著。该实验结果与本实验得出的处理组中SQS,SQE,OSC,DS,β-AS基因的表达量分别高于对照组的结论基本相一致。因此,在添加MeJA处理后,人参皂苷生物合成途径中关键酶SQS,SQE,OSC,DS,β-AS基因的表达与总皂苷含量变化的趋势相一致。
在人参皂苷生物合成代谢过程中,SQS基因被认定是一个起十分关键作用的限速酶基因,是人参皂苷合成的关键调控位点,控制皂苷中碳元素的流向。通过添加MeJA刺激时,SQE基因的表达比SQS基因的表达具有更高的持续性和更强的表达作用,推测当受到MeJA刺激时,SQE基因在人参皂苷合成途径中的关键作用比SQS基因更为重要。DS和β-AS基因表达量的最高峰值出现于MeJA刺激后的20 h左右,比SQS,SQE,OSC基因表达最大峰值稍晚,见图5。此外,CAS基因是萜类化合物中甾醇类中的相关基因,从而出现表达量变化平稳,变化不显著。因此,这些基因表达规律的结果体现了人参皂苷生物合成代谢过程中关键酶基因表达存在着空间时序性的相关理论。
外源添加MeJA作为诱导子,可以引发植物的防御反应。本实验结果发现,在添加MeJA 调控作用6 h后PPD与CAT的酶活力在开始升高,当添加20 h和14 h后分别达到酶活力的最大峰值,随着添加MeJA调控时间继续增长,到达36~72 h时测试组中PPD与CAT的酶活力逐渐恢复到与对照组一致的水平;在添加MeJA 调控作后从开始到第22小时测试组中PPO的酶活力始终高于对照组,达到24 h时测试组中PPO的酶活力逐渐恢复到与对照组一致的水平。
同时,在人参发状根关键酶基因的表达方面也有着变化,在添加MeJA调控作用的第6~8小时中,人参皂苷生物合成代谢途径中的SQS,DS,β-AS关键酶基因的表达量开始升高,当作用时间达到12~14 h这3个基因的表达量处于最大峰值,随后开始逐渐下降;在添加MeJA调控作用的第2~24小时中,OSC关键酶基因表达量始终高于对照组,分别在第4和第16小时表达量出现峰值,在添加24 h后开始逐渐降低;在添加MeJA调控作用的第12~24小时中,SQE关键酶基因表达量始终于高于对照组,当作用时间达到第24小时表达量出现最大峰值,随后开始下降。因此,在添加MeJA调控人参发状根后,PPD,CAT和PPO的酶活力变化趋势与人参皂苷生物合成代谢途径中关键酶SQS,SQE,OSC,DS,β-AS基因的表达量变化趋势是相一致的。
[参考文献]
[1] Taik K Y, Yun S L, You H L, et al. Anticarcingenie effect of Panax ginseng C.A. Meyer and identification of active compounds[J]. J Korean Med Sci, 2001,16:6
[2] 王菡,富强,王丽思,等. 人参皂苷生物合成的相关酶及其基因的研究进展[J]. 人参研究,2012(1):40.
[3] Kim J Y, Zhang D, Yang D C. Biosynthesis and biotechnological production of ginsenosides[J]. Biotechnol Adv,2015,33:717.
[4] 李平亚.人参皂苷NMR标准图谱[M].北京:化学工业出版社,2012.
[5] 李天航,杨晶,王艳芳,等. 发状根在药用植物基因工程研究进展[C].天津: 2010年中国药学大会暨第十届中国药师周,2010.
[6] 张献龙,唐克轩.植物生物技术[M].北京:科学出版社,2004:279.
[7] 王建华,薛健,侯春喜,等.人参发状根的愈傷组织诱导[J].吉林农业大学学报,2008,30(5):700.
[8] 罗玉.利用毛状根的培养生产植物次生代谢物[J].云南农业科技,2002(2): 40.
[9] 张兴,刘晓娟,吕巧玲.毛状根生产次生代谢产物的研究进展[J].化工进展,2007,26(9):1228.
[10] 蒋科技,皮妍,侯嵘,等.植物内源茉莉酸类物质的生物合成途径及其生物学意义[J].植物学报,2010,45 (2):137.
[11] Howe G A. Jasmonates as signals in the wound response[J]. J Plant Growth Regul, 2004, 23: 223.
[12] Wasternack C, Stenzel I, Hause B, et al. The wound response in tomato-role of jasmonic acid[J]. J Plant Physiol, 2006, 163:297.
[13] M Kawauchi, T Arima, O Shirota, et al. Production of sesquiterpene-type phytoalexins by hairy roots of HyOS Cyamus albus co-treated with cupper sulfate and methyl jasmonate[J]. Chem Pharm Bull, 2010, 58: 934.
[14] 蔡昆争,董桃杏,徐涛.茉莉酸类物质(JAs) 的生理特性及其在逆境胁迫中的抗性作用[J].生态环境,2006,15(2):397.
[15] 傅俊范,孙嘉曼,周如军,等.茉莉酸甲酯对人参β-1,3-葡聚糖酶和几丁质酶活性的影响[J].中国农学通报,2012,28(9):214.
[16] 张智慧,聂燕芳,何磊,等.外源茉莉酸甲酯诱导水稻抗瘟性相关防御酶和内源水杨酸的变化[J].植物病理学报,2010,40(4):395.
[17] 徐立新,赵寿经,梁彦龙,等.外源调节物质对人参毛状根生长及皂苷合成的影响[J].吉林大学学报:工学版,2010,40(6):1619.
[18] 张丹.人参发状根悬浮培养体系的建立及发酵动力学研究[D].长春:吉林农业大学,2012.
[19] 盖玉红,王文慧,王沥浩,等.人参发状根与栽培人参有效成分的比较研究[J].北方园艺,2013(7):166.
[20] 王颖.前体物质对西洋参愈伤组织生长及代谢的影响研究[D].长春:吉林农业大学,2007.
[21] 黄超.小分子化合物的添加提高人参皂苷产量及其作用机制探索[D].上海:华东理工大学,2013.
[责任编辑 吕冬梅]
