彩色马铃薯花色苷研究进展
2017-07-05吕英奇童海翔姚峥嵘张蜀敏谢开云任茂智
吕英奇,童海翔,姚峥嵘,张蜀敏,谢开云,董 攀*,任茂智
(1.重庆大学生命科学学院,重庆 401331;2.国际马铃薯中心亚太中心,北京 100081)
综述
彩色马铃薯花色苷研究进展
吕英奇1,童海翔1,姚峥嵘1,张蜀敏1,谢开云2,董 攀1*,任茂智1
(1.重庆大学生命科学学院,重庆 401331;2.国际马铃薯中心亚太中心,北京 100081)
彩色马铃薯色彩丰富,薯形美观,营养全面,其功能成分花色苷,被公认为是人类健康饮食中的天然抗氧化剂来源。文章概述了彩色马铃薯花色苷的类型、含量、分布以及提取,重点阐述了彩色马铃薯花色苷合成路径的结构基因和调控基因,对彩色马铃薯的应用前景进行展望,以期为马铃薯天然色素资源开发利用和彩色马铃薯育种提供参考。
彩色马铃薯;花色苷;结构基因;调控基因
马铃薯(Solanum tuberosum L.)起源于距今约1万年前的南美洲秘鲁境内安第斯山脉的的的喀喀湖[1],最早为印第安人所驯化,距今已有7 000多年的栽培历史。16世纪由西班牙和英国探险家带回欧洲种植,在欧洲粮食安全上曾发挥过重要作用,如19世纪由于马铃薯晚疫病造成的爱尔兰大饥荒,导致数以百万人因饥饿而死亡,直到现在欧洲多国人民仍把马铃薯作为不可替代的主粮。明朝万历年间(公元1573~1619年),马铃薯随着欧洲传教士传入中国,在中国已有约400年的栽培历史,在中国很多贫困地区,马铃薯有着“一季土豆半年粮”的重要地位。然而,马铃薯在中国的主要消费方式仍是作为蔬菜,中国政府为了解决粮食安全问题,于2015年提出了“马铃薯主粮化”战略,旨在期望通过把马铃薯加工成适合中国人消费习惯的馒头、面条和米粉等主食产品,逐渐使马铃薯成为中国第四大主粮。根据联合国粮农组织统计数据,2013年全世界谷物生产总量在24.79亿t左右,薯类生产总量约为8.4亿t,薯类作物已经逐渐成为世界主粮版图中不可缺少的一部分。马铃薯资源非常丰富,在国际马铃薯中心(International Potato Center,CIP)收藏的材料达16 489份。从营养角度讲,马铃薯是世界十大营养食品之一,素有“能源植物”、“地下苹果”和“第二面包”等多种美誉,富含淀粉、维生素以及人体必需的23种氨基酸等。
彩色马铃薯,是普通栽培马铃薯的自然变异,其块茎薯皮或薯肉的颜色为红色、粉色、蓝色和蓝紫色等[2],于2008年被首次正式定义[3]。与普通马铃薯相比,彩色马铃薯不仅颜色丰富、薯形美观,还富含具有强抗氧化活性的物质花色苷[4]。国内外许多研究表明,花色苷具有抗突变、抗氧化、抗菌抗炎、抗增生、预防心血管疾病、保护肝脏和抑制肿瘤细胞发生等多种生理功能,其抗氧化性能是维生素C的20倍,维生素E的50倍,能够有效清除自由基,被公认为是人类健康饮食中天然抗氧化剂来源,对人体有良好的保健和治疗作用[5]。尽管国际马铃薯中心收集的彩色马铃薯仅有304种,但马铃薯起源地秘鲁报道的彩色马铃薯品种多达3 000种,足见彩色马铃薯种质资源的多样性[6]。
从1936年Chmielewska[7]最早开始系统研究彩色马铃薯花色苷,80年的研究历程中,各国科学家在彩色马铃薯种质资源的收集与育种,花色苷的分布、含量和种类、提取和纯化、理化性质和效用以及花色苷的合成及调控机制,彩色马铃薯的开发与利用等方面开展了大量的工作。本文重点回顾近10年关于彩色马铃薯花色苷研究进展,以期为马铃薯天然色素资源开发利用和彩色马铃薯育种提供参考。
1 彩色马铃薯块茎花色苷的分布、种类和含量
植物花色苷(Anthocyanin)是花色素(Anthocyanidin)与各种单糖通过糖苷键结合形成的糖基化衍生物的总称,水溶性,属于类黄酮物质,广泛分布于陆生植物花朵、果实、茎和叶等器官中的一类有色物质,赋予植物粉红、红、紫和蓝等颜色[8]。
1.1花色苷的分布
马铃薯花色苷在根、茎、叶、花和块茎(薯皮和薯肉)中均有分布,其分布存在组织差异,一般在块茎中的含量高于其他组织[9]。在块茎中的分布也是不均匀的,张静等[10]以及Jansen和Flamme[11]分别对中国云南的11个地方彩色马铃薯品种以及31种彩色马铃薯块茎的花色苷含量及分布分别进行研究,均发现花色苷主要存在于薯皮中。Reyes等[12]在对紫肉的马铃薯研究中发现,尽管薯皮中花色苷含量较薯肉高0.9~1.6倍,但薯皮对花色苷的贡献只有整个块茎的20%左右,紫色马铃薯的花色苷主要来自于薯肉。在细胞水平,Kosieradzka等[13]通过荧光显微观察植株块茎的横切面发现,花色苷主要集中在细胞的液泡中。
1.2花色苷的种类
当花色苷上的糖基部分被水解后,糖苷配基(水解产物的非糖部分)就是花色素。不同植物中发生糖苷化的位点(C3、C5和C7位等)和数目的差异,及酞化程度的不同使植物中存在着不同的花色苷谱,其结构复杂,但都以花色素为基本结构。自然界天然存在的花色素有19种(根据B环羟基化和甲基化位置及数目进行分类),通常只有6种存在于食品中,以天竺葵色素(Pelargonidin),矢车菊色素(Cyanidin)(又名花青素)和飞燕草色素(Delphinidin)为主,由此再衍生出其他3类色素:芍药花色素(Peonidin)(由矢车菊色素甲基化形成);矮牵牛花色素(Petunidin)及锦葵色素(Mavlvidin)(由飞燕草色素不同程度甲基化而来)[14,15]。天竺葵色素呈砖红色,矢车菊色素和芍药花色素呈紫红色,而飞燕草色素、矮牵牛花色素和锦葵色素则表现蓝紫色系[16-18](图1)。上述6种主要的花色素在马铃薯中均已发现[19,20]。但是不同品种彩色马铃薯块茎中花色素种类和含量是存在差异的。目前,研究中常用到的彩色马铃薯,主要有红肉品种(Red-fleshed potato)、紫肉品种(Purple-fleshed potato)、红皮黄肉品种(Yellow-fleshed and red-skinned potato)和深蓝皮黄肉紫维管束环品种(Deep blue-skinned, yellow-fleshed potato with a smallpurple vascular ring)等。红肉品种(‘Rosalinde’、‘Herbie’、‘Highland Burgundy Red’、‘红云 1号’、‘云薯 603’、‘S06-277’和‘剑川红’等)含有的最主要花色素类型是天竺葵色素[21-26]。紫肉品种中,根据不同的品种,所含有的主要花色素类型有所不同。‘Salad Blue’、‘Valfi’、‘Blue Congo’、‘紫云1号’、‘云薯303’、‘S03-2685’、‘S06-1693’、‘S05-603’和‘师大6号’等紫肉品种含有一种主要的花色素矮牵牛花色素,‘Vitelotte’品种则含有2种主要的花色素锦葵色素和矮牵牛花色素[20,23,26,27]。然而Eichhorn和Winterhalter[21]报道‘Vitelott’含有最丰富的花色素是锦葵色素;云南地方紫肉品种‘YNZH’含有的最丰富花色苷也是锦葵色素[25]。红皮黄肉品种‘Red Laura’含有的主要花色素类型是天竺葵色素[28]。深蓝皮黄肉紫维管束环品种‘Shetland Black’含有的最主要花色素类型是矮牵牛花色素和芍药花色素[21,27,28]。

图1 彩色马铃薯花色苷主要类型及花色苷颜色Figure 1 Main kinds of anthocyanins in colored potatoes and their colors
1.3花色苷的含量
在总的花色苷含量方面,彩色马铃薯品种相对高于其他普通马铃薯品种[25]。然而在不同彩色马铃薯品种之间总花色苷含量是不同的。国内外很多研究机构对收集的彩色马铃薯总花色苷含量进行了比较。Pęksa等[23]对4个紫肉马铃薯品种(‘Salad Blue’、‘Vitelotte’、‘Valfi’和‘Blue Congo’)和3个红肉马铃薯品种(‘Rosalinde’、‘Herbie’和‘Highland Burgundy Red’)的花色苷总含量进行了比较,红肉品种中‘Highland Burgundy Red’花色苷含量最高(171.08 mg/100g干重),紫肉品种中‘Vitelotte’的花色苷含量最高(184.75 mg/100g干重)。Lachman等[29]和Brown等[30]的研究也表明,紫肉马铃薯品种总花色苷含量高于红肉品种,但是,另外的研究却得出相反的结果,红肉品种的总花色苷含量高于紫肉品种[2,12,31]。Rodriguez-Saona等[24]对33个红色马铃薯品种花色苷含量进行测定,发现其含量为2~40 mg/100g鲜重,2个无性系‘NDOP5847-1’和‘NDC4069-4’在所测材料中花色苷含量最高(>35 mg/100g鲜重)。张静等[10]对来自云南的11个地方彩色马铃薯品种块茎的花色苷含量及分布进行研究,11个品种中‘格杂红皮’的总花色苷含量最高,达到77.4 mg/100g鲜重。殷丽琴等[20]采用HPLC法定量分析8个彩色马铃薯品种块茎的总花色苷含量,在1.34~63.32 mg/100g鲜重变化,其中‘紫云1号’的总花色苷含量最高。不同品种花色苷总量不同,即便同一品种在不同的研究中也不一样,表明花色苷总量的差异,不仅与品种的遗传因素相关,栽培条件、气候环境、贮藏条件以及提取方法等都可能影响花色苷的含量变化。
2 彩色马铃薯块茎花色苷的提取
据统计,目前已在27个科,73个属,数万种植物发现花色苷的存在,从植物中已分离得到500多种花色苷[32]。研究工作者们以黑莓、葡萄、红萝卜、蓝莓和马铃薯等彩色蔬果为研究材料在花色苷的提取方面开展了大量的工作,根据提取材料、提取目的及花色苷类型的不同,提取方法也略有差异,Silva等[33]梳理了主要的花色苷提取方法,详细阐述了每种方法的优缺点(表1)。

表1 花色苷不同提取方法的主要优点和缺点Table 1 Main advantages and disadvantages of different extraction methods of anthocyanins
花色苷通常带有若干未被取代的羟基或糖基,是一种极性化合物。根据“相似相溶”原理,花色苷易溶于水、甲醇和乙醇等极性溶液,而其稳定性受酶、温度、氧气、光、pH和金属离子等理化性质影响,在中性和碱性条件下不稳定。经典的传统溶剂法,采用的就是酸和极性溶液相组合的方式进行提取。Harborne[34]最早用甲醇:盐酸(97:3,v/v)在室温下抽提马铃薯花色苷。随后,丙酮和氯仿溶液[24],15%(v/v)的乙酸甲醇溶液[19],0.1%(v/v)盐酸甲醇溶液[35],0.1%(v/v)盐酸甲醇溶液[4],5%乙酸和70%乙醇[36]等溶液组合和比例都被用来提取马铃薯花色苷。童丹等[37]比较不同提取剂对定西地产‘黑美人’马铃薯花青素提取率的影响,结果表明,用0.5%(v/v)盐酸乙醇作为提取溶剂,花青素提取率最高。杨玲等[38]比较‘紫罗兰’马铃薯的提取条件和稳定性,发现95%乙醇和1.5 mol/L盐酸提取液提取效果最好。刘建垒等[39]对影响马铃薯花青苷提取的因素进行正交试验,得到最佳的提取条件中提取剂为体积分数为70%的乙醇。代小梅等[40]同样通过正交试验,认为体积分数为80%的乙醇为最佳提取液。Lachman等[41]在对花色素的提取过程中,增加了提取溶剂中酸(70%,80%,90%和100%)和丙酮(80%)的含量,减少了均质化处理的时间,大大提高了花色素的提取效率。马铃薯花青苷的提取条件,除了提取溶剂外,还包括光照、温度、提取时间和pH等,因此,最佳的提取条件是上述各种条件的较优组合。但是考虑到食品中残留甲醇和氯仿的毒性,通常选用乙醇溶液,在酸的选择上,通常考虑使用盐酸,但为了获得更接近于天然状态的花色苷,也采用弱有机酸或中性溶剂做初步提取,弱有机酸多用甲酸、乙酸、丙酸、柠檬酸和酒石酸,中性溶剂一般采用丙酮作提取剂。
为了使提取过程更加对环境友好,减少溶剂的消耗,降低温度,缩短时间等绿色提取技术被开发出来,如超临界流体萃取法、超声波辅助萃取法、加压溶剂萃取法、微波辅助萃取法和高压脉冲电场辅助提取法等(表1)。不同研究人员用超声波辅助萃取法提取马铃薯花色苷,都发现这种方法与传统的溶剂法相比,可以显著提高提取效率[42-45]。廉玉姬等[46]采用溶剂浸提法(95%乙醇,0.1 mol/L盐酸)、超声波破碎提取法以及液氮-丙酮法3种不同提取方法对紫色马铃薯‘Bora Valley’的花色苷进行提取,结果表明通过超声波破碎法得到的花色苷含量最高。Puértolas等[47]采用脉冲电场提取法对紫色马铃薯的花色苷进行提取时,发现该方法提高了花色苷的提取率,并且可以使用环境友好型的水替代有机溶剂乙醇。Cardoso等[48]比较2种不同的花色素提取方法:超临界流体萃取法(助溶剂为CO2或CO2乙醇5%(v/v)混合物,压力100 bar,温度65°C)和加压液体萃取法(助溶剂为酸化到pH 2.6的乙醇溶液,压力100 bar,温度80°C),得出加压液体萃取法更加适合大量花色素的提取,而且提取效率高于超临界流体萃取法。
3 彩色马铃薯块茎花色苷的合成与调控
在很多模式植物(玉米、牵牛花和拟南芥)中,花色苷的生物合成途径及调控过程已经被阐明[49,50],花色苷由“一般苯丙烷类途径”合成,从苯丙氨酸到花色苷经历3个阶段(图2):第1阶段是苯丙烷代谢途径,这是许多次生代谢共有的,由苯丙氨酸到4-香豆酰CoA。第2阶段是花色苷合成途径上游,由4-香豆酰CoA和丙二酰CoA到二氢山萘酚,是类黄酮醇代谢的关键反应。第3阶段是花色苷合成途径下游,在这一阶段完成各种花色苷的合成,将无色的二氢山萘酚转化成有色的花色苷。整个合成途径主要受两类基因的调控:结构基因和调控基因。
3.1结构基因

图2 马铃薯花色苷合成途径Figure 2 Pathway of anthocyanin biosynthesis in potato
在不同类型花色苷合成的过程中,受到多种酶的调控,而结构基因编码的正是这些直接参与花色苷形成的酶类,如苯丙氨酸裂解酶(PAL),反肉桂酸4-单加氧酶(C4H),4-香豆酸-CoA连接酶(4CL),查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄烷酮3-羟化酶(F3H)、二氢类黄酮还原酶(DFR)、类黄酮3'-羧化酶(F3'H)、类黄酮3',5'-羧化酶(F3'5'H)、花色素合成酶(ANS)、类黄酮葡萄糖苷转移酶(UFGT)等。目前马铃薯花色苷生物合成途径中所有的结构基因均已被克隆,并在NCBI和马铃薯基因组网站上可以查询(表2)。栽培种与野生种的结构基因同源性高,达到90%以上,说明马铃薯的花色苷结构基因在遗传选择中变异系数低,高度保守,如CHI和F3H。在基因结构方面,有的基因不含内含子,如StPAL、St4CL、StANS等,而有的基因含有多个内含子,如St4CH、StF3H、StDFR等。
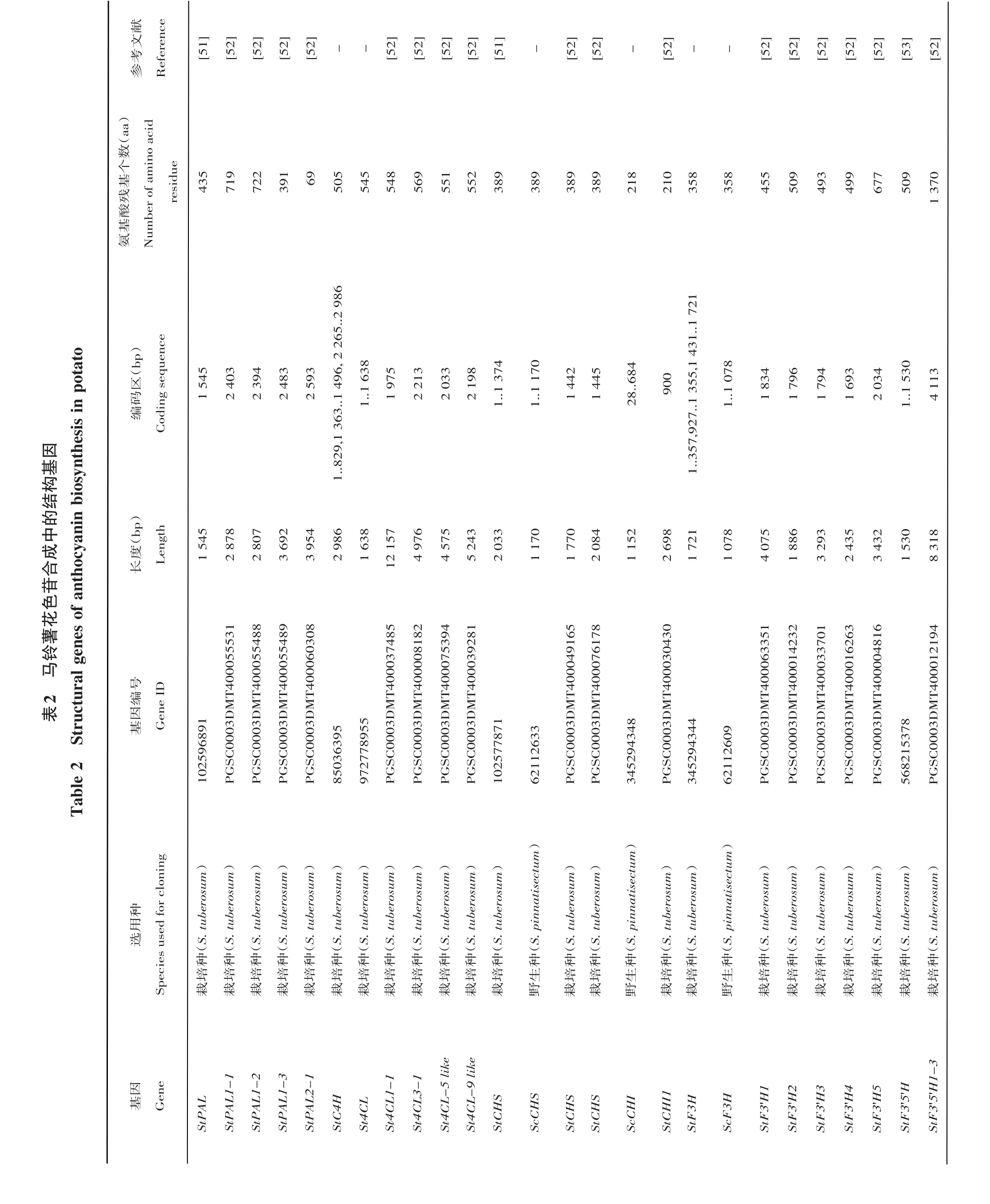

同时,大量结构基因的表达模式也已建立。Liu等[52]研究表明,大量结构基因(C4H、4CL、CHS、CHI、F3H、F3'H、F3'5'H、DFR、ANS)在四倍体紫色马铃薯(‘黑美人’)的表达高于普通马铃薯(‘新大坪’)的表达。Payyavula等[55]对5个不同性状的马铃薯品种(‘NY144’(白)、‘Challenger’(黄)、‘ORO4198-1’(深黄)、‘AmaRosa’(红)和‘Magic Molly’(紫))的酚谱和花色苷谱进行比较,发现在红色和紫色马铃薯的苯丙烷代谢途径中,PAL的酶活明显较高,并促进大量苯丙素类结构基因的表达。关巍等[56]选用块茎着色程度不同的6个马铃薯无性系以及栽培品种‘早大白’,研究彩色马铃薯PAL活性与花色苷积累的相关性,结果表明,花色苷含量与PAL活性呈线性正相关。李先平等[57]以彩色马铃薯杂交群体‘TZ521’为材料对花色苷合成途径关键酶基因在彩色马铃薯块茎中的表达进行分析,结构基因(CHS、CHI、F3H、DFR、ANS、3GT、F3'H和F3'5'H)在彩色马铃薯中都有表达,但在薯肉和薯皮中表达模式并不相同。F3'5'H和DFR均在紫色或红色薯肉中检测到,但在所有白色薯肉中未检测到,因此被认为与彩色马铃薯块茎肉色表达紧密相关。而其他6个结构基因的表达与块茎的颜色并没有相关性。胡朝阳等[58]在紫色马铃薯中研究F3'5'H,DFR、UFGT和CHS 4个基因时,发现紫色马铃薯StCHS的表达具有组织特异性,且该基因的表达部位与花色苷的积累部位基本符合,F3'5'H,DFR和UFGT 3个基因在紫色马铃薯不同组织中(根、茎、叶、叶柄和块茎)表达水平不同,F3'5'H、DFR在叶柄中表达最强,而UFGT在茎和叶柄中表达最强。Lu和Yang[59]在马铃薯野生种和栽培种中相继完成马铃薯4个花色苷合成相关基因(CHS、F3H、3GT和DFR)的cDNA克隆,并对其功能进行了初步验证,同时研究发现这4个基因在花、匍匐枝和顶芽中优先表达,在根中仅3GT基因表达,在块茎皮中4个基因均被白光诱导表达。
通过转基因等技术手段,结构基因的功能陆续被阐明。紫色马铃薯与红色马铃薯颜色的差异是由于在进化过程中红色马铃薯中的F3'5'H基因的第一外显子中插入了微型反向重复转座元件(MITE),导致F3'5'H不能正常表达相应的酶,使呈现紫色的矮牵牛色素不能合成,块茎的颜色不能呈现紫色,而是红色,如果将F3'5'H基因转入红色马铃薯中,转化植株的茎变为紫色,薯皮也由原来的红色变为紫色[53,60,61]。卢其能等[61]利用农杆菌介导法转入3GT基因,转基因植株花色苷含量较对照高出7倍。Wei等[62]构建超表达3GT基因的马铃薯转基因株系,发现所有转基因植株花色苷的含量均显著增加,认为3GT基因在改良马铃薯色彩和提高膳食中花色苷含量方面具有潜力。Kosieradzka等[13]在马铃薯中分别转入大麦CHS的cDNA和矮牵牛F3H和DFR的cDNA,发现在3种转基因植株中,过表达CHS的块茎中花色苷含量最多。Kamil等[63]在马铃薯中过量表达3种基因(CHS、CHI和DFR)的单独及其组合,通过检测转基因植株的各项营养指标及小鼠活体检验得出,DFR基因是提高紫色马铃薯营养价值最高效的基因。
3.2调控基因
花色苷合成路径上的调控基因的编码产物为转录因子,能够调控结构基因的表达,影响色素的时空积累,目前研究比较多的3类调控花色苷合成的转录因子有:(1)R2R3-MYB蛋白;(2)myc家族的bHLH蛋白;(3)WD40蛋白[64]。其可能的调控方式有转录激活调控,转录抑制调控和转录后水平的调控。这3类转录因子可以直接独自参与调控结构基因,如MYB转录因子[65,66];也能多种转录因子相互作用,协同调控花色苷的合成,如MBW三元复合体(MYB-bHLH-WD40)[67]。在花色苷合成的调控基因方面,马铃薯的研究是相对滞后的,但近些年国内外也开展了大量工作进行马铃薯花色苷合成调控基因的克隆,表达谱分析及功能验证。黄艳岚[68]在紫色马铃薯紫皮中还获得花色苷合成过程中编码转录激活因子R2R3-MYB的基因的保守序列 Stmyb211和Stmyb280。同时,黄艳岚等[69]根据同源克隆的方法,在紫色马铃薯紫皮中获得马铃薯Stmyc基因cDNA序列,其长度为1 106 bp,对其进行初步表达分析,显示该基因在紫色马铃薯中属组成型表达。刘仕芸[70]分离克隆紫色马铃薯花色素合成的转录激活基因Stmyc538,Stmyc450,Stmyb499和Stwd40,并鉴定了其在紫色马铃薯叶、茎、皮、肉及根部的组织特异性表达,发现上述4个转录激活基因在组织的表达中并没有规律性。Jung等[71]在紫皮马铃薯‘W5281.2’中克隆得到编码R2R3-MYB转录因子的Stan2,并将其转入粉红皮色品种‘Desiree’,白皮品种‘Bintje’和2个白皮后代(来自‘W5281.2’和‘07506-01’的杂交),转基因植株的叶、花和块茎(薯皮、薯肉)都出现不同程度的紫色。刑铮[72]采用同源克隆的方法对马铃薯R2R3-MYB转录因子进行克隆,获得StR2R3-MYB1基因的CDS全序列,构建StR2R3-MYB1的YFP融合表达载体,将其定位在细胞核上,实时荧光定量PCR结果显示,该基因在根、茎和叶的表达量依次升高。Taihelen等[73]构建了42个MYB和58个bHLH转录因子基因的马铃薯克隆植株,发现其中的花色素苷强度及赤霉病抗性发生了变化。李旺[74]首次在马铃薯栽培品种‘Desiree’的块茎中分离克隆得到bHLH转录因子基因StAN1b,各组织处的半定量RT-PCR分析显示,StAN1b在薯皮、叶和芽中表达水平较高,而在薯肉中不表达。Li[75]从‘Chieftain’马铃薯中克隆出编码转录因子WD40的StAN11,该片段包含4段WD重复序列,将此基因导入马铃薯品种‘Desiree’中,块茎颜色加深,结构基因中DFR的表达发生了上调,推测StAN11是通过调节DFR的表达来改变花色素的生成。李先平等[57]对MYB的调节基因AN2和MTF2,WD40的调节基因AN11以及bHLH的调节基因AN1和JAF13在紫色马铃薯薯皮和薯肉的表达进行分析,发现只有AN2可能与马铃薯块茎肉色表达相关。
4 彩色马铃薯的应用前景
彩色马铃薯是马铃薯家族中一类具有独特遗传特性和经济价值的特殊品种类型,在中国一些省、市开始种植和销售,其中种植面积较大的只有‘黑美人’(‘黑金刚’)、‘紫罗兰’和‘转心乌’等老品种或少量新育成的品种。随着近几年来人们对彩色食品的追捧偏爱,且彩色马铃薯市场价格与紫葡萄、蓝莓等相比更加便宜,更具价格优势,因此彩色马铃薯有望成为特色蔬菜丰富菜篮子,成为老百姓家中常见菜肴。如果能够借鉴水果玉米的育种经验,相信在马铃薯育种家的不懈努力下,生吃的“水果马铃薯”不久后也将会出现在人们的日常生活中,成为又一新型保健食品。
马铃薯主粮化在中国已经开始实行,马铃薯制品如馒头、面条等已投放市场,中国马铃薯产业也在蓬勃发展,越来越多的人群接受了这种新式主粮,而彩色马铃薯馒头、面条因其鲜艳的色泽和丰富的营养将会被更多的人青睐。国外早已开发出了具有天然色彩的薯片、薯泥、薯粉、薯饮料等特色商品。这些特色彩色马铃薯制品具有广阔的市场空间,拓展了彩色马铃薯的经济价值。另外,彩色马铃薯花色素是天然植物源色素,最有希望代替合成色素和其他天然色素,在食品、化妆品、保健品和医药等领域广泛开发应用。
[1] Spooner D M,Mclean K,Ramsay G,etal.A single domestication for potato based on multilocus amplified fragmentlength polymorphism genotyping[J].Proceedings ofthe National Academy of Sciences of the United StatesofAmerica,2005,102(41):14694-14699.
[2] Brown C R,Wrolstad R,Durst R,et al.Breeding studies in potatoes containing high concentrations of anthocyanins[J]. American Journalof Potato Research,2003,80(4):241-249.
[3] 郭赵娟,吴焕章.彩色马铃薯营养价值与主要品种[J].现代农业科技,2008(17):107.
[4] Andre C M,Schafleitner R,Guignard C,etal.Modification of the health-promoting value of potato tubers field grown under drought stress:emphasis on dietary antioxidantand glycoalkaloid contents in five native andean cultivars(Solanum tuberosum L.)[J].Journal of Agriculturaland Food Chemistry,2009,57(2):599-609.
[5] Castañeda-Ovando A,Pacheco-HernándezMDL,Páez-Hernández M E,etal.Chemical studies of anthocyanins:A review[J].Food Chemistry,2009,113(4):859-871.
[6] 苏梅.秘鲁彩色土豆[J].农产品市场周刊,2011(4):32-33.
[7] Chmielewska Z.Sur les colorants des pommes de terre violette 'Negresse'[J].BullSoc Chim,1936(5):1575-1588.
[8] Hernández-Briones A,Velázquez G,Vázquez M,et al.Effects of adding fish gelatin on Alaska pollock surimi gels[J].Food Hydrocolloids,2009,23(8):2446-2449.
[9]Burton W G.The potato[M].New York:John Wiley and Sons Inc, 1989.
[10]张静,郭华春,姚春雪.11个云南地方马铃薯品种块茎的花色苷含量及其分布[M]//屈冬玉,陈伊里.马铃薯产业与粮食安全.哈尔滨:哈尔滨地图出版社,2009.
[11] Jansen G,Flamme W.Coloured potatoes(Solanum tuberosum L.)-anthocyanin content and tuber quality[J].Genetic Resources and Crop Evolution,2006,53(7):1321-1331.
[12] Reyes L F,Miller J C,Cisneros-Zevallos L.Antioxidantcapacity, anthocyanins and total phenolics in purple-and red-fleshed potato(Solanum tuberosum L.)genotypes[J].American Journal of Potato Research,2005,82(4):271-277.
[13] Kosieradzka I,Borucki W,Matysiak-Kata I,et al.Transgenic potato tubers as a source of phenolic compounds.Localization of anthocyanins in the peridermis[J].Journal of Animal and Feed Sciences,2004,13(1):87-92.
[14] Hondo T,Yoshida K,Nakagawa A,et al.Structural basis of blue-color development in flower petals from Commelina communis[J].Nature,1992,358(6386):515-518.
[15] Martin C,Prescott A,Mackay S,et al.Control of anthocyanin biosynthesis in flowers of Antirrhinum majus[J].Plant Journal, 1991,1(1):37-49.
[16] Davies A J,Mazza G.Copigmentation of simple and acylated anthocyanins with colorless phenolic compounds[J].Journal of Agriculturaland Food Chemistry,2002,41(5):716-720.
[17] Strack D,Busch E,Klein E.Anthocyanin patterns in European orchids and their taxonomic and phylogenetic relevance[J]. Phytochemistry,1989,28(8):2127-2139.
[18] Ananga A,Georgiev V,Tsolova V.Manipulation and engineering of metabolic and biosynthetic pathway of plant polyphenols[J]. Current PharmaceuticalDesign.2013,19(34):6186-6206.
[19] Jrl L C,Lancaster J E,Conner A J.Light regulation of anthocyanin,flavonoid and phenolic acid biosynthesis in potato minitubers in vitro[J].Functional Plant Biology,1998,25(8): 915-922.
[20] 殷丽琴,彭云强,钟成,等.高效液相色谱法测定8个彩色马铃薯品种中花青素种类和含量 [J].食品科学,2015,36(18): 143-147.
[21] Eichhorn S,Winterhalter P.Anthocyanins from pigmented potato (Solanum tuberosum L.)varieties[J].Food Research International, 2005,38(8-9):943-948.
[22] Naito K,Umemura Y,Mori M,et al.Acylated pelargonidin glycosides from a red potato[J].Phytochemistry,1998,47(1): 109-112.
[23] Pęksa A,Kita A,Kułakowska K,et al.The quality of protein of coloured fleshed potatoes[J].Food Chemistry,2013,141(3): 2960-2966.
[24] Rodriguez-Saona L E,Giusti M M,Wrolstad R E.Anthocyanin pigment composition of red-fleshed potatoes[J].Journal of Food Science,1998,63(3):458,465.
[25]卢其能,杨清.马铃薯花色苷种类含量和稳定性初步研究[J].安徽农业科学,2007,35(16):4811-4813.
[26]罗弦,杨雄,苏跃,等.彩色马铃薯品种块茎花色苷HPLC-MS分析[J].种子,2013,32(7):30-34.
[27] Hillebrand S,Heike B,BulletN,etal.Isolation and characterization of anthocyanins from blue-fleshed potatoes(Solanum tuberosum L.)[J]. Food,2009(s1):15-20.
[28] Burmeister A,Bondiek S,Apel L,etal.Comparison ofcarotenoid and anthocyanin profiles of raw and boiled Solanum tuberosum and Solanum phureja tubers[J].Journal of Food Composition and Analysis,2011,24(6):865-872.
[29] Lachman J,Hamouz K,Orsák M,et al.The influence of flesh colour and growing locality on polyphenolic content and antioxidant activity in potatoes[J].Scientia Horticulturae,2008, 117(2):109-114.
[30] Brown C R,Durst R W,Wrolstad R,et al.Variability of phytonutrient content of potato in relation to growing location and cooking method[J].Potato Research,2008,51(3-4):259-270.
[31] Rodriguez-Saona L E,Wrolstad R E.Influence of potato composition on chip color quality[J].American Journal of Potato Research,1997,74(2):87-106.
[32] Kong J M,Chia L S,Goh N K,et al.Analysis and biological activities of anthocyanins[J].Phytochemistry,2003,64(5): 923-933.
[33] Silva S,Costa E,Calhau C,et al.Anthocyanin extraction from plant tissues:a review[J].Critical Reviews in Food Science and Nutrition,2015:262-275.
[34] Harborne J B.Plantpolyphenols.1.Anthocyanin production in the cultivated potato[J].BiochemicalJournal,1960,74(part2):262-269.
[35] Mathisen E,Diallo D,Andersen O M,et al.Antioxidants from the bark of Burkea africana,an African medicinal plant[J]. Phytotherapy Research,2002,16(2):148-153.
[36] Han K H,Shimada K,Sekikawa M,et al.Anthocyanin-rich red potato flakes affect serum lipid peroxidation and hepatic SOD mRNA levelin rats[J].Bioscience Biotechnology and Biochemistry,2007,71(5):1356-1359.
[37]童丹,杨声,韩黎明,等.定西地产“黑美人”马铃薯中花青素提取工艺研究[J].甘肃高师学报,2015,20(5):50-52.
[38] 杨玲,刘利军,赵永莉.不同提取剂对紫罗兰马铃薯花青素提取含量的影响[J].石油化工应用,2008,27(5):7-9.
[39] 刘建垒,房岩强,刘聪,等.紫色马铃薯花色苷的提取及性质研究[J].食品与发酵工业,2009,35(7):179-182.
[40] 代小梅,高梦,姜丽.紫甘薯花色苷粗提物的抗氧化性特性研究[J].农产品加工,2015(21):12-15.
[41] Lachman J,Hamouz K,Orsák M,et al.Impact of selected factors-Cultivar,storage,cooking and baking on the content of anthocyanins in coloured-flesh potatoes[J].Food Chemistry, 2012,133(4):1107-1116.
[42] Mane S,Bremner D H,Tziboula-Clarke A,et al.Effect of ultrasound on the extraction of total anthocyanins from Purple Majesty potato[J].Ultrasonics Sonochemistry,2015,27:509-514.
[43]崔倩.紫马铃薯花色苷的提取纯化和结构鉴定[D].杭州:浙江大学,2011.
[44] 倪勤学,高前欣,霍艳荣,等.微波辅助提取紫马铃薯花色苷及其稳定性的研究[J].食品科技,2011,36(4):170-175.
[45] 闫秋丽,朱诗优,杨鑫鑫,等.花青素提取、纯化及稳态化技术研究进展[J].食品科技,2011,36(10):219-222.
[46] 廉玉姬,夏霖,林光哲.紫色马铃薯Bora valley花青素的提取与含量的测定[J].临沂师范学院学报,2009,31(6):85-88.
[47] Puértolas E,Cregenzán O,Luengo E,et al.Pulsed-electricfield-assisted extraction of anthocyanins from purple-fleshed potato[J].Food Chemistry,2013,136(3-4):1330-1336.
[48] Cardoso L C,Serrano C M,Quintero E T,et al.High pressure extraction of antioxidants from Solanum stenotomun peel[J]. Molecules,2013,18(3):3137-3151.
[49] Bartel B,Matsuda S P.Plant biology.Seeing red[J].Science, 2003,299(5605):352-353.
[50] Holton T A,Cornish E C.Genetics and biochemistry of anthocyanin biosynthesis[J].PlantCell,1995,7(7):1071-1083.
[51] Xu X,Pan S,Cheng S,etal.Genome sequence and analysis ofthe tuber crop potato[J].Nature,2011,475(7355):189-195.
[52]Liu Y,Lin WK,Deng C,etal.Comparative transcriptome analysis of white and purple potato to identify genes involved in anthocyanin biosynthesis[J].Plos One,2015,10(6):20-27.
[53]Jung CS,Griffiths HM,Jong DMD,et al.The potato P locuscodesfor flavonoid 3',5'-hydroxylase[J].Theoretical and Applied Genetics, 2005,110(2):269-275.
[54]Keifenheim DL,Smith AG,Tong C B S.Cloning and accumulation of anthocyanin biosynthesis genes in developing tubers[J].American Journalof Potato Research,2006,83(3):233-239.
[55] Payyavula R S,Singh R K,Navarre D A.Transcription factors, sucrose,and sucrose metabolic genes interact to regulate potato phenylpropanoid metabolism[J].Journal of Experimental Botany, 2013,64(16):5115-5131.
[56]关巍,石瑛,王凤义.彩色马铃薯PAL活性与花色苷积累的相关性研究[J].吉林农业科学,2014,39(1):74-79.
[57] 李先平,王冬冬,陈秀华,等.花青素合成途径关键酶基因在彩色马铃薯块茎中的表达分析[J].西南农业学报,2015,28(5): 1888-1894.
[58] 胡朝阳,周友凤,龚一富,等.紫色马铃薯查尔酮合成酶基因(CHS)的克隆及分析[J].中国农业科学,2012,45(5):832-839.
[59] Lu Q N,Yang Q.cDNA cloning and expression of anthocyanin biosynthetic genes in wild potato(Solanum pinnatisectum)[J]. African Journalof Biotechnology,2006,5(10):811-818.
[60]Momose M,Abe Y,OzekiY.Miniature inverted-repeattransposable elements of stowaway are active in potato[J].Genetics,2010,186 (1):59-66.
[61]卢其能,杨清,沈春修.马铃薯类黄酮-3-O-葡萄糖基化酶基因的克隆与表达分析[J].华北农学报,2009,24(4):11-16.
[62] Wei Q,Wang Q Y,Feng Z H,et al.Increased accumulation of anthocyanins in transgenic potato tubers by overexpressing the 3GT gene[J].PlantBiotechnology Reports,2012,6(1):69-75.
[63]Kamil K,Michal S,Anna K,et al.Transgenic potato plants with overexpression of dihydroflavonol reductase can serve as efficient nutrition sources[J].Journal of Agricultural and Food Chemistry, 2013,61(27):6743-6753.
[64]Ramsay N A,Glover B J.MYB-bHLH-WD40 protein complex and the evolution ofcellulardiversity[J].Trends in PlantScience,2005, 10(2):63-70.
[65] Drabsch Y,Hugo H,Rui Z,etal.Mechanism ofand requirementfor estrogen-regulated MYB expression in estrogen-receptor-positive breast cancer cells[J].Proceedings of the National Academy of Sciencesofthe United States ofAmerica,2007,104(34):13762-13767.
[66] Tohge T,Nishiyama Y,Hirai M Y,et al.Functional genomics by integrated analysis of metabolome and transcriptome of Arabidopsisplants over-expressing an MYB transcription factor[J].Plant Journal,2005,42(2):218-235.
[67]Cominelli E,Sala T,Calvi D,et al.Over-expression of the Arabidopsis AtMYB41 gene alters cell expansion and leaf surface permeability[J].Plant Journal,2008,53(1):53-64.
[68]黄艳岚.马铃薯花青素转录激活基因的克隆与序列分析[D].海口:华南热带农业大学,2006.
[69] 黄艳岚,刘仕芸,张树珍,等.马铃薯花青素转录激活基因(stmyc)的克隆及表达分析[J].农业生物技术学报,2009,17(5): 941-942.
[70] 刘仕芸.马铃薯花青素候选转录激活基因的克隆与分析[D].海口:华南热带农业大学,2007.
[71] Jung C S,Griffiths H M,Jong D M D,et al.The potato developer (D)locus encodes an R2R3 MYB transcription factor that regulates expression of multiple anthocyanin structural genes in tuber skin[J].Theoretical and Applied Genetics,2009,120(1): 45-57.
[72] 邢铮.马铃薯基因StR2R3-MYB1的克隆与功能分析[D].长沙:湖南农业大学,2014.
[73]Taihelen H,Goyer C,Murphyagnes M.Potato MYB and bHLH transcription factors associated with anthocyanin intensity and common scab resistance[J].Botany-botanique,2013,91(10): 722-730.
[74]李旺.马铃薯花色苷生物合成调控基因StAN11和StAN1b分离与分析[D].南京:南京农业大学,2013.
[75] Li S.Transcriptionalcontrolofflavonoid biosynthesis:Fine-tuning of the MYB-bHLH-WD40(MBW)complex[J].Plant Signaling and Behavior,2014,8(12):27522.
Research Progress in Anthocyanin of Colored Potatoes
LU Yingqi1,TONG Haixiang1,YAO Zhengrong1,ZHANG Shumin1,XIE Kaiyun2,DONG Pan1*,REN Maozhi1
(1.Schoolof Life Sciences,Chongqing University,Chongqing 401331,China; 2.CIP-China Center for Asia Pacific(CCCAP),Beijing 100081,China)
ract:Colored potatoes are beautifully shaped and rich in nutrients.Their functional component anthocyanins are universally accepted as a major source of naturalantioxidants in a healthy diet.In this review,the types,contents, distributions and extraction methods of the anthocyanins in colored potatoes were briefly summarized.And the structuraland regulatory genes involved in the anthocyanins biosynthesis were described in details.In a word,the review was supposed to provide some useful reference for developing and utilizing the anthocyanins in colored potatoes and breeding varieties ofcolored potatoes.
ords:colored potato;anthocyanin;structuralgene;regulatory gene
S532
A
1672-3635(2017)03-0165-13
2016-06-12
国家自然科学基金面上项目(31672206);重庆市薯类作物专用新品种创制与清洁安全加工主题专项(cstc2015shms-ztzx80003);国家重点基础研究发展计划(973计划)(2013CB127101-4)。
吕英奇(1995-),女,本科生,从事马铃薯分子生物学研究。
董攀,博士,讲师,主要从事植物分子生物学研究,E-mail:dongpan@cqu.edu.cn。
