超高效液相串联质谱同时测定茶叶中的8种有效物质
2017-06-28杜欢欢蔡艳妮宋可盈
杜欢欢,蔡艳妮,江 海,2,3,宋可盈
(1.陕西理工大学 生物科学与工程学院,陕西 汉中 723000;2.陕西省资源生物重点实验室,陕西 汉中 723000;3.陕南秦巴山区生物资源综合开发协同创新中心,陕西 汉中 723000;4.武汉市经济技术开发区第一中学,湖北 武汉 430056)
超高效液相串联质谱同时测定茶叶中的8种有效物质
杜欢欢1,蔡艳妮1,江 海1,2,3,宋可盈4
(1.陕西理工大学 生物科学与工程学院,陕西 汉中 723000;2.陕西省资源生物重点实验室,陕西 汉中 723000;3.陕南秦巴山区生物资源综合开发协同创新中心,陕西 汉中 723000;4.武汉市经济技术开发区第一中学,湖北 武汉 430056)
建立了一种同时测定茶叶中8种有效成分(儿茶素、表儿茶素、表没食子儿茶素、没食子儿茶素没食子酸酯、表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯、茶氨酸、咖啡因)的超高效液相色谱串联质谱分析方法。样品用体积分数70%的甲醇水浴提取,采用Waters ACQUITY BEH C18色谱柱分离,串联四级杆质谱多反应离子监测测定,外标法定量。结果表明,8种有效成分在各自的线性范围内线性关系良好,相关系数大于0.991,平均回收率(n=5)在94.7%±5.2%~104.7%±6.1%之间。方法的检出限在3.0~60.0 ng/mL之间,定量限在6.0~200.0 ng/mL之间。
超高效液相色谱; 质谱; 儿茶素; 咖啡因; 茶氨酸; 分析检测
茶(Camelliasinensis),属于山茶科,为常绿灌木或小乔木植物,植株高达1~6 m。茶树喜欢湿润的气候,在中国长江流域以南地区广泛栽培。茶树叶子制成茶叶,泡水后便可使用,是传统的保健饮品,世界三大饮料之一,在我国有悠久的使用历史[1]。三皇五帝时代便有神农以茶解毒的故事,唐·陆羽《茶经》:“茶之为饮,发乎神农氏”。明《本草纲目》记载:“茶苦而寒,阴中之阴,最能降火”,能清热解暑、消食化痰、生津止渴、降火明目[2]。现代科学研究表明,茶中富含茶多酚、咖啡碱、氨基酸、多糖等生物活性物质[3-4],具有降血压、降血糖、预防动脉粥样硬化、抗菌消炎、利尿止痢等临床药理作用,同时具有抗氧化、抗衰老、助消化、缓解疲劳等保健功效[5-8]。准确对茶叶中有效成分的分析检测对茶叶鉴定、茶叶品质评价、茶树选育、茶叶深加工、茶产品开发等方面具有重要意义。
目前茶叶中有效成分的检测方法主要有分光光度法[9]、高效液相色谱-紫外法[10-14]、高效液相串联质谱法[15]、滴定法[16]、近红外光谱分析法[17]、核磁共振法(Nuclear Magnetic Resonance,NMR)[18]、毛细管电泳法[19]及流动注射分析法[20]等。高效液相色谱法(High Performance Liquid Chromatography,HPLC)具有分离度好、准确度高的特点,是目前检测儿茶素、咖啡因、茶氨酸应用最广泛、技术最成熟的方法。但高效液相色谱法在分析茶叶中有效成分的过程中存在速度慢、结构性质相似的组分分离度低、一次进样分离组分少等不足。超高效液相串联质谱相较于高效液相色谱具有分析速度快、分离度高、检测限低、分析准确、检测样品种类多等特点。本文采用超高效液相串联质谱建立一种同时分析茶叶中8种有效成分的分析方法,旨在为陕西茶产业发展提供技术支撑。
1 材料与方法
1.1 材料与试剂
甲酸(色谱纯,天津市科密欧化学试剂有限公司)、乙腈(色谱纯,Fisher/飞世尔)、甲醇(色谱纯,MERCK默克公司);儿茶素(Catechin,C)、表儿茶素(Epicatechin,EC)、表没食子儿茶素(Epigallocatechin,EGC)、没食子儿茶素没食子酸酯(Gallocatechingallate,GCG)、表儿茶素没食子酸酯(Epicatechingallate,ECG)、表没食子儿茶素没食子酸酯(Epigallocatechingallate,EGCG)、茶氨酸(L-Theanine)、咖啡因(Caffeine)等8种标准品(上海源叶生物,纯度均不低于99%)。
茶叶样品为陕西省汉中市市售绿茶,粉碎,过60目分样筛,备用。
1.2 仪器设备
超高效液相色谱-串联四级杆质谱(Waters UPLC-TQD,美国Waters公司);电喷雾离子源;MILLI-Q纯水机(美国Millipore公司);电子天平AUD220D(十万分之一,日本岛津公司);ZN-02中草药粉碎机(北京兴时利和科技发展公司);H-6数显恒温水浴锅(国华电器公司),离心机(湖南湘仪)。

表1 UPLC流动相梯度程序
1.3 液相色谱分析条件
液相色谱的色谱柱为ACQUITY BEH C18柱(50.0 mm×2.5 mm,粒径1.7 μm),流速为250 μL/min,柱温为30 ℃,进样体积为5 μL。流动相选择的A是乙腈,B是体积分数0.1%甲酸,流动相梯度见表1。
1.4 质谱分析条件
质谱分析的离子源为电喷雾正离子源(ESI+),扫描方式为正离子扫描,检测方式为多反应监测(MRM),离子源温度为120 ℃,去溶剂气流量为500 L/hr,溶剂气温度为300 ℃。
1.5 样品的制备
准确称取0.50 g均匀磨碎的茶叶样品放入三角烧瓶中,加入70 ℃的体积分数70%甲醇水溶液25.0 mL,称定质量。用玻璃棒充分搅拌均匀后,立即移入70 ℃水浴中,浸提10 min,用滤纸擦干烧瓶表面后,再次称定质量,不足部分用体积分数70%甲醇水溶液补足,3000 r/min离心,取上清液5.0 mL,用体积分数70%甲醇水溶液定溶于10 mL容量瓶,用0.22 μm滤膜过滤,待测[14]。
1.6 标准溶液的配制
精密称取8种茶叶有效成分标准品:
C为2.40 mg; Caffeine为2.57 mg; GCG为2.18 mg; EGCG为2.12 mg; ECG为2.00 mg; EC为1.50 mg; EGC为1. 95 mg; L-Theanine为2.34 mg。
用超纯水定容至10 mL,得到8种有效成分标准品母液,浓度分别是:C为0.24 mg/mL;Caffeine为0.257 mg/ mL;GCG为0.218 mg/mL;EGCG为0.212 mg/mL;ECG为0.200 mg/mL;EC为0.15 mg/mL;EGC为0.195 mg/mL;L-Theanine为0.234 mg/mL。
1.7 方法学实验
1.7.1 标准曲线的绘制及检测限、定量限实验
依据样品中8种物质的含量,分别稀释1.6中标准母液,得到不同浓度的标准曲线工作液。浓度梯度见表2。按照1.3、1.4所述的液相和质谱条件进样分析,以各组分的分峰面积为纵坐标,浓度为横坐标,分别绘制出标准工作曲线。
根据8种有效成分质谱MRM模式下响应不同,将配制好的最低浓度标准溶液分别进样,按照3倍信噪比(S/N)所对应的信号峰面积可计算得到方法的检出限(LOD),按10倍信噪比(S/N)所对应的信号峰面积可计算得到方法的定量限(LOQ)。

表2 8种有效成分标准曲线浓度梯度 单位:μg/mL
1.7.2 精密度、稳定性和重复性实验
取制备好的茶叶样品,连续进样5次,每次进样5.0 μL,计算8种物质(C、Caffeine、GCG、EGCG、ECG、EC、EGC、L-Theanine)峰面积的RSD值,计算方法的精密度。
分别取样品溶液,放置不同的时间(0、4、8、12、24 h),在液相色谱-质谱分析条件下进样分析,计算8种物质(C、Caffeine、GCG、 EGCG、ECG、EC、EGC、L-Theanine)峰面积的RSD值,考察方法的稳定性。
平行取茶叶样品5份制备样品溶液,进行液相色谱-质谱检测,检测后计算8种物质含量的RSD值,考察方法的重复性。
1.7.3 回收率实验
采用加标回收率实验,在经标准曲线计算得到的样品中精密加入相应的标准品(C为0.60 μg;Caffeine为111.8 μg;GCG为54.4 μg;EGCG为263.4 μg; ECG为181.4 μg;EC为280.5 μg;EGC为130.0 μg;L-Theanine为152.0 μg),制备供试溶液,通过检测分别计算出8种有效成分的加标回收率。
2 结果与分析
2.1 质谱条件的优化
将8种有效成分的标准品分别配制成1.00 mg/L标准的水溶液,在流动相混合状态下,按10 μL/min流速进样,通过全扫描(Scan模式)确定8种化合物的(M+1)质子化离子峰(母离子)的质荷比(m/z)。二级质谱分析(子离子扫描)得到各自碎片离子的信息,选取丰度较高、干扰较小的两个碎片子离子,作为定量离子和定性离子,优化锥孔电压(Cove voltage)和碰撞电压(Collision energy),得到最优质谱分析条件。图1为表儿茶素(EC)的离子扫描图,母离子(图1(a))291,子离子(图1(b))139。同理得到其他标准物质的母离子、子离子,结果见表3。
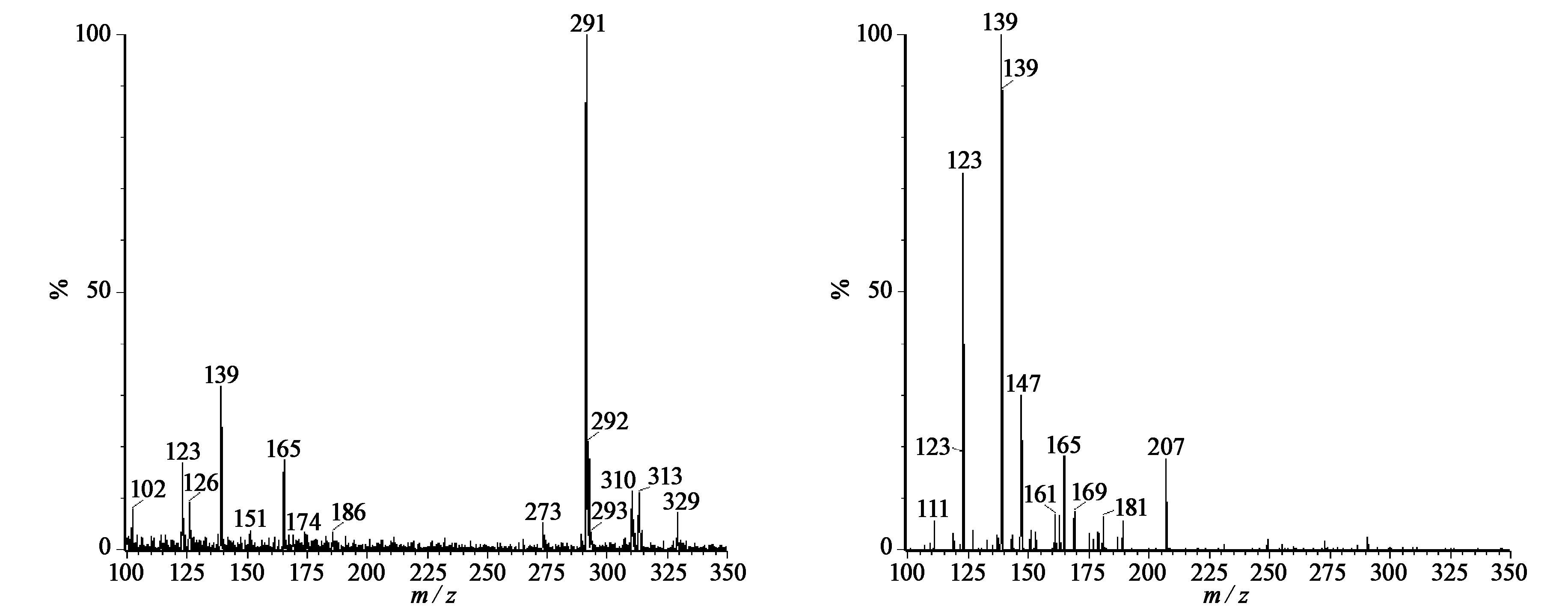
(a) EC母离子 (b) EC子离子图1 EC母离子与子离子的二级质谱

表3 8种有效成分UPLC-MS/MS测定参数
注:Q为定量离子,q为定性离子
2.2 方法学考察的结果
2.2.1 线性范围、检出限和定量限
在优化的液相-质谱条件下对茶叶中8种有效成分进行分析,以浓度为横坐标,峰面积为纵坐标绘制标准曲线,标准品的多反应监测(MRM)色谱图见图2。结果表明8种物质的相关系数r均达到0.991以上,尤其Caffeine和EC能达到0.999以上,表明在该液相质谱条件下8种成分具有良好的线性关系。
根据1.7.1所述方法确定检出限和定量限。结果表明,8种有效成分的最低检出限LOD在3.0~60.0 ng/mL之间,最低定量限LOQ在6.0~200.0 ng/mL之间。结果见表4。
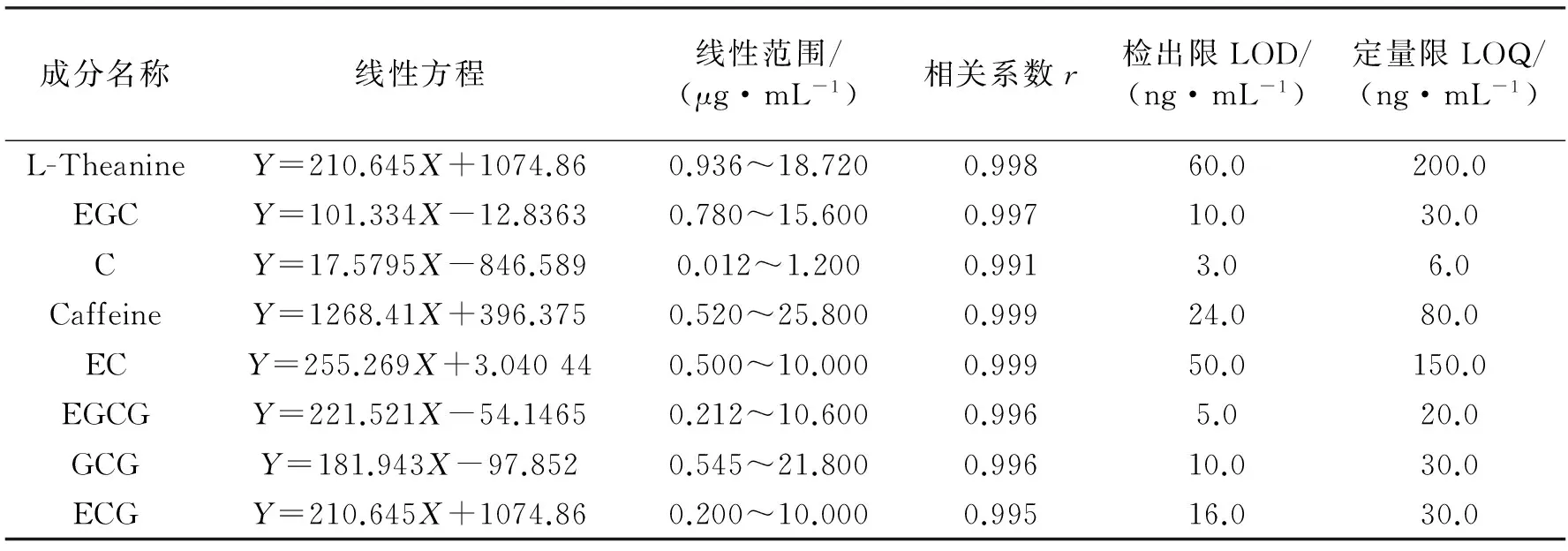
表4 8种有效成分的标准工作曲线、线性范围、相关系数、检出限及定量限

注:各标准品的名称见色谱图右上角所示。图2 茶叶中8种有效成分标准品在ESI+模式下的MRM色谱图
2.2.2 精密度、稳定性与重复性
实验结果表明,8种有效成分的精密度实验的峰面积RSD值均小于5%,说明方法精密度良好;检测不同时间的茶叶样品,得到8种有效成分的峰面积并计算出RSD值均小于5%,结果显示8种有效成分检测结果在24 h内无显著差异,表明了该方法稳定性良好;对8种有效成分的含量做了5次平行实验,结果显示5次重复性实验的RSD值均小于3%,表明了该方法的重复性良好。
2.2.3 回收率
对茶叶中8种有效成分分析进行回收率考察,不同组分进行5次平行测定,测定结果见表5。结果表明8种有效成分的回收率在94.7%±5.2%~104.7%±6.1%之间。

表5 8种有效成分回收率及其RSD(n=5)
2.3 样品的测定结果
按照1.5中的方法处理汉中绿茶得到3个平行样品溶液,在色谱质谱优化条件下进样分析,8种有效成分MRM图像分离度良好。将所得峰面积带入2.2.1中的标准曲线,计算出样品中8种有效成分的含量:L-Theanine为3.26±0.04 mg/g,EGC为5.19±0.17 mg/g,C为0.02±0.004 mg/g,Caffeine为3.10±0.07 mg/g,EC为11.26±0.23 mg/g,EGCG为5.92±0.19 mg/g,GCG为2.53±0.03 mg/g,ECG为4.19±0.03 mg/g。
3 讨 论
3.1 儿茶素类同分异构体问题
茶叶中的有效成分,有多对同分异构体。如仅以m/z进行分析,区别不开,但它们的结构不同,用色谱可以区分。比如GCG和EGCG是一对同分异构体,母离子m/z为460,子离子都为139。但GCG的出峰时间为4.92 min,EGCG的出峰时间为4.23 min,用液相色谱就能够容易区分。C和EC也具有相同的现象,母离子m/z为291,子离子都为139,但C的出峰时间为2.13 min,EC的出峰时间为3.94 min,同样用液相色谱就能够容易区分开。
3.2 Caffeine与C出峰时间重合问题
在实验中发现Caffeine与C出峰时间均为2.13 min,在液相紫外检测时不能有效分开,不能进行精确定量,出现检测错误。利用质谱,就可以根据其母离子和子离子对其进行分开的检测,得到准确的检测结果。
3.3 质谱调谐过程中儿茶素类化合物母核问题
在实验中发现,这几种儿茶素的正离子定量子离子大多数为139。儿茶素化合物的基本结构见图3,在经过碰撞打碎之后形成的139子离子最可能的正离子子离子见图4。

图3 儿茶素类化合物结构式 图4 儿茶素类化合物子离子139母核
3.4 方法优势与不足
本方法采用超高效液相分离,利用质谱进行检测,具有较高的分离度,各组分分离检测效果理想。重复性、准确性、精密度良好,同时回收率达到了94.7%±5.2%~104.7%±6.1%之间,具有良好的回收率;本实验的检测周期仅为9.5 min,比高效液相检测明显缩短了时间;样品的处理方法简便;对仪器试剂要求低,使用的都是常用的试剂、仪器。
超高效液相色谱串联质谱技术在对茶叶的鉴别和质量控制中具有较大的应用价值,由于其仪器价格昂贵,普及程度较低,质谱图的解析对专业人员的技术要求高。但随着超高效液相色谱串联质谱的普及,这项技术将在茶叶生化成分的定性和定量分析、未知组分的结构鉴定、茶叶质量安全检测和指纹图谱等方面的研究中得到广泛应用,对不同类别茶叶质量做出更准确的评价。
[1] 陈训,周艳.中国茶叶研究状况分析[J].贵州科学,2008,26(2):8-15.
[2] 卢明.茶叶的研究与应用[J].中国社区医师:医学专业,2005,7(22):16-16.
[3] 陈睿.茶叶功能性成分的化学组成及应用[J].安徽农业科学,2004,32(5):1031-1033.
[4] 宛晓春,李大祥,张正竹,等.茶叶生物化学研究进展[J].茶叶科学,2015(1):1-10.
[5] 张晓梦,倪艳,李先荣.茶多酚的药理作用研究进展[J].药物评价研究,2013,36(2):157-160.
[6] 王向阳,周政子,刘绘景.茶多酚对萝卜干3种致病菌的抑菌机理研究[J].中国食品学报,2013,13(8):96-101.
[7] 王丽丽,黄建安,刘仲华.茶叶降脂功效及其作用机理研究进展[J].中国茶叶,2011(9):12-15.
[8] JAIN N K,SIDDIQI M A,WEISBURGER J H,et al. Protective effects of tea on human health[M]. Trowbridge:Cromwell Press,2006:6-171.
[9] KIVITS G A A,SMAN van der F J P,TIJBURG L B M. Analysis of catechins from green and black tea in humans[J]. International Journal of Food Science and Nutrition,1997,48(6):387-392.
[10] 侯冬岩,回瑞华,李铁纯,等.高效液相色谱法对绿茶中茶多酚含量的测定[J].食品科学,2010,31(24):305-307.
[11] 刘锦文,李红玉,石瑞君,等.高效液相色谱法测定茶多酚中EGCG和ECG的含量[J].食品工业科技,2010,31(11):372-374.
[12] 张继,王惠明,马君义,等.高效液相色谱法测定绿茶中茶多酚及咖啡因[J].理化检验:化学分册,2012(3):312-314.
[13] 康明艳,李悦,魏文静,等.高效液相色谱法测定茶叶中的茶多酚[J].食品研究与开发,2014(15):94-95.
[14] 付静,江海,李新生.超高效液相色谱法测定绿茶中5种儿茶素[J].分析试验室,2013(7):69-74.
[15] TAO Wu-qun,ZHOU Zhi-guang,ZHAO Bin,et al. Simultaneous determination of eight catechins and four theaflavins in green,black and oolong tea using new HPLC-MS-MS method[J]. Journal of Pharmaceutical and Biomedical Analysis,2016,131:140-145.
[16] 王烨军,徐奕鼎,黄建琴,等.酒石酸亚铁比色法和高锰酸钾滴定法测定茶多酚的比较[J].茶业通报,2010,32(2):61-63.
[17] 陈华才,吕进,俸春红,等.近红外光谱法测定茶多酚中总儿茶素含量[J].中国计量学院学报,2005,16(1):17-20.
[18] DAVIS A L,CAI Y,DAVIES A P,et al. 1H and 13C NMR Assignments of Some Green Tea Polyphenols[J]. Magnetic Resonance in Chemistry,2015,34(11):887-890.
[19] WATANABE T,NISHIYAMA R,YAMAMOTO A,et al. Simultaneous analysis of individual catechins,caffeine,and ascorbic acid incommercial canned green and black teas by micellar electrokinectic chromatography [J]. Analytical Sciences,1998,14(2):435-438.
[20] 米娟,王九春,马永钧,等.流动注射化学发光法测定茶叶中的茶多酚[J].宁夏大学学报(自然科学版),2011,32(2):168-171.
[责任编辑:谢 平]
Simultaneous determination of eight active substances in tea by ultra performance liquid chromatography-tandem mass spectrometry
DU Huan-huan1,CAI Yan-ni1,JIANG Hai1,2,3,SONG Ke-ying4
(1.School of Bioscience and Engineering,Shaanxi University of Technology,Hanzhong 723000,China;2.Provincial Bio-Resource Key Laboratory,Hanzhong 723000,China;3.Qinling-Bashan Mountains Bioresources Comprehensive Development C. I. C.,Hanzhong 723000,China;4.The First Senior Middle School of Wuhan Economic and Technological Development,Wuhan 430056,China)
A determination method was developed using ultra performance liquid chromatography-tandem mass spectrometry to simultaneously determining eight kinds of effective components in tea (Catechin,Epicatechin,Epigallocatechin,Gallocatechingallat,Epicatechingallate,Epigallocatechingallate,L-Theanine and Caffeine). The sample was extracted with 70% methanol by water bath,using Waters ACQUITY UPLCTMBEH C18chromatographic column and Mass spectrometry was conducted by using positive (ESI+) electrospray ionization and Multi-reactions monitoring (MRM) models,with external standard method. The results showed that the eight kinds of active ingredients in their respective inside had good linear range and the correlation coefficient was greater than 0.991,the average recoveries (n=5) between 94.7%±5.2% and 104.7%±6.1%.Method detection limit between 3.0~60.0 ng/mL,method of quantitative limit between 6.0~200.0 ng/mL.
ultra performance liquid chromatography(UPLC); mass spectrometry; catechins; caffeine; L-Theanine; analysis of detection
2096-3998(2017)03-0074-07
2017-01-06
2017-02-27
陕西省质量技术监督局计划项目(SDBXM25-2015)
杜欢欢(1990—),男,陕西省咸阳市人,陕西理工大学硕士研究生,主要研究方向为食品质量与安全控制技术;[通信作者]江海(1977—),男,四川省西昌市人,陕西理工大学高级实验师,硕士生导师,主要研究方向为资源生物的开发利用和食品质量安全控制。
TS272.7
A
