外源钙与外生菌根协同对樟子松生长的影响
2017-06-28尹大川祁金玉邓继峰沈阳农业大学林学院辽宁沈阳08662辽宁辽河平原森林生态系统定位研究站辽宁昌图2500黑龙江省林科院森林保护研究所黑龙江哈尔滨50040
尹大川,祁金玉,邓继峰,都 慧,邓 勋(沈阳农业大学林学院,辽宁 沈阳 0866;2辽宁辽河平原森林生态系统定位研究站,辽宁 昌图 2500;黑龙江省林科院森林保护研究所,黑龙江 哈尔滨 50040)
外源钙与外生菌根协同对樟子松生长的影响
尹大川1,2*,祁金玉1,2,邓继峰1,2,都 慧1,邓 勋3(1沈阳农业大学林学院,辽宁 沈阳 110866;2辽宁辽河平原森林生态系统定位研究站,辽宁 昌图 112500;3黑龙江省林科院森林保护研究所,黑龙江 哈尔滨 150040)
为了研究外生菌根菌与外源 Ca2+是否可以协同对樟子松苗木生长的影响.本研究利用菌物学、生物化学和生态学等研究方法,通过对菌根化樟子松一年生苗木施加适当浓度的外源Ca2+,并对苗木各部分各项生长和生理指标进行检测.结果表明:(1)适当浓度的外源Ca2+和外生菌根菌(ECMF)协同能够更好的促进樟子松苗木的生长.当Ca≤20mmol/L时,苗木高生长达到最大,为11.4cm和10.6cm,比对照高32.6%和23.3%.生物量与光合色素含量均高于不施Ca处理组.说明施用适当浓度的外源Ca可以放大菌根对苗木的促生作用.(2)适当浓度的外源Ca2+和外生菌根菌协同能够更好的提升樟子松苗木的抗氧化能力.施Ca处理主要可以诱导苗木各部分CAT和POD活力上升,通过较高水平的抗氧化酶系,提高苗木质量.(3)适当浓度的外源 Ca2+和外生菌根菌协同能够更好的提高樟子松细胞耐渗透能力.本研究中,外源 Ca2+,可以有效同外生菌根菌协同,增加苗木各部分的可溶性蛋白含量.通过主成分分析(PCA)表明,在各项渗透物质指标当中,可溶性蛋白的贡献率最大.表明外源Ca和外生菌根可以有效诱导植物提高体内可溶性蛋白含量,提高抗逆性.(4)菌根苗通过施用适当浓度的外源Ca2+达到加大壮苗的目的是可行的.综合本研究的各项结果,不难看出,苗木的生长和生理指标的变化一致,生长迅速且健壮的苗木,其体内抗氧化酶系统和细胞中渗透物质的含量也相应的增高.在育苗初期,在苗圃或大田施用外源 Ca2+(或钙肥)与外生菌根菌协同以期达到更好的壮苗之效果,是可行的.
外生菌根菌;外源钙;樟子松;促生;抗逆
樟子松(Pinus sylvestris var. mongolica)是我国北方主要的造林树种,具有良好的耐旱、耐瘠薄等特点.基于此,使其在我国北方,尤其是东北地区的植被恢复和园林绿化方面都发挥着重要的作用.而造林成功与否的关键因素是苗木的质量.在众多促进樟子松生长和提高其抗逆性的方法当中,引入植物根际有益微生物无疑是一种相对较好的方法,它有利于改善苗圃土壤微环境,可以有效促进苗木的生长、增强苗木的抗逆性,并预防土传病害的发生[1].
外生菌根菌(ECMF)是森林生态系统中最重要的菌类之一,它与林木根系形成结构致密的菌丝体或菌丝鞘,部分菌丝进入根系皮层细胞间隙形成相互联结的哈氏网[2].其在对寄主的影响方面,最直观的表现就是对寄主生长和生理指标的影响[3].如接种菌根的火炬松苗木鲜重增加 20%,对马尾松苗接种Pt(Pisolithustinctorius)菌根苗和非菌根苗相比,干重、苗高和地径均有明显的提高[4].接种褐环乳牛肝菌可以使马尾松叶绿素含量与可溶性糖含量增加[5].研究表明,接种外生菌根菌可以显著提高白皮松叶绿素及营养物质的含量,提高苗木的耐旱能力[6].
钙元素是植物细胞的重要成分,也是植物受到外界环境胁迫的重要信号分子,在细胞信号跨膜转导的过程中充当第二信使的角色.对细胞内矿质养分和有机化合物具有重要的调节作用[7-9].在环境干旱的条件下,钙离子可以参与脱落酸的跨膜传递,调节干旱胁迫导致的气孔关闭,诱导基因表达,从而增强植物的抗逆性[10].钙离子在植物水分调节中,通过对质膜水孔蛋白磷酸化作用,调节植物根细胞在外界高浓度离子渗透胁迫下的吸水活性[11].同时,钙离子还可以改善土壤的理化性质和增加土壤的团聚作用,对调节土壤微生态发挥着良好的作用[12].
在前期的研究基础上[13],本研究通过菌物学、植物生理学与生物化学方法,以东北辽西北半干旱地区的主要造林树种樟子松为研究对象.通过室内接种盆栽的方式,研究不同浓度的外源Ca2+和外生菌根协同作用对樟子松苗木生长和生理生化指标的影响.为辽西北半干旱地区苗圃高质量育苗与逆境造林改善生态环境提供理论依据.
1 材料与方法
1.1 材料来源
樟子松种子由辽宁省固沙造林研究所惠赠,褐环乳牛肝菌(S.luteus)分离自辽宁省彰武县章古台实验林场樟子松人工林下.该地区自然条件为东经 122°11′15″~122°30′00″,北纬 42°37′30″~42°50′00″之间,属亚湿润干旱区,年降水量 450~550mm.年蒸发量1200~1450mm,年均温5.7℃,最高35.2℃,最低-29.5℃,土壤为风沙土.
1.2 前期准备工作
种子处理:将供试种子用0.5%高锰酸钾消毒30min,清水冲洗数次后,用灭菌湿纱布包裹保湿,在人工气候箱中,置于 25℃下催芽,每天早晚用无菌水各冲洗一次,直至出芽.
无菌土制备:将草炭土、蛭石和河沙按2:1:1的比例配制混合土,置高温高压灭菌器中 121℃下灭菌2h,装入营养钵(直径15cm×高13cm)中.
播种:在2015年4月将经催芽的樟子松种子播入营养钵中,每钵30颗种子,上覆2cm厚无菌土,浇透水后放入沈阳农业大学大棚中培养,待幼苗出土后,定苗至每钵 20株左右.进行常规的日常管护.
菌剂制备:用直径 5mm的无菌打孔器,切取在PDA平板培养基上培养好的ECMF(培养30d)菌饼,接种于盛有250mL PD液体培养基的三角瓶(500mL)中,每瓶接种 3片菌饼.置于摇床上(25℃、150r/min)振荡培养30d.得到液体菌剂,使用前用搅碎机将菌丝体搅碎做匀浆处理.
1.3 实验设计
在出苗 1个月后,采用打孔灌根的方式进行ECMF接种处理,每盆接种ECMF菌剂50mL.每处理5次重复.待形成菌根后添加CaCl2浓度处理,试验分别用3种不同CaCl2浓度处理(浓度为0、10、20mmol/L),在形成菌根1周后,均匀浇灌CaCl2溶液,每盆浇灌100mL.
1.4 相关指标测定
1.4.1 苗木生长指标测定 接菌处理之后,实行正常管护.继续生长 3个月(此时高生长已经停止),取样一次,每个处理随机抽取生长健壮的樟子松苗木10株,每个处理3次重复.用直尺和游标卡尺测定苗木的苗高和地径,用天平称量苗木鲜重,然后将苗木放入105℃的烘箱中,烘干至恒重,称量苗木的干重.随机抽取樟子松细根20段,将其剪成1cm长度的根段,在光学显微镜下观查每一根段的菌根数.按下列公式计算菌根侵染率:
菌根侵染率(%)=外生菌根侵染的根段数/检查的总根段数×100(%)
1.4.2 苗木抗氧化保护酶活力测定 CAT和POD粗酶液制备:准确称取樟子松针叶、根、茎各 0.1g,液氮研磨,按质量体积比加入 pH7.0的50mmol/L冷磷酸缓冲液10mL,4℃、10 000r/min低温离心 20min,上清液即为酶液[14].CAT和POD采用南京建成CAT和POD测定试剂盒测定.
SOD粗酶液制备:准确称取樟子松针叶、根、茎各0.1g,液氮研磨,按质量体积比加入pH7.8的 50mmol/L 冷磷酸缓冲液10mL,4℃、10000r/min低温离心20min,上清液即为酶液[14].SOD采用南京建成SOD测定试剂盒测定.
1.4.3 苗木渗透调节物质测定可溶性蛋白含量测定:准确称取樟子松针叶、根、茎各0.5g,加入10mL蒸馏水,冰浴研磨,吸取上清液,10000rpm/ min离心5min,留上清液.每个处理3次重复.参照Christos[15],采用考马斯亮蓝G250法测定.
可溶性糖含量测定:准确称取樟子松针叶、根、茎各0.5g,用5mL蒸馏水研磨4000r/min离心15min,留上清液,取上清液l mL定容到100mL容量瓶,稀释10倍.每个处理3次重复.参照尹大川[16],采用蒽酮比色法测定.
游离脯氨酸含量测定:准确称取樟子松针叶、根、茎各0.5g放入试管中,加入5.0mL的3%磺基水杨酸溶液,将试管浸入沸水浴中提取15min,过滤.吸取滤液2.0mL于试管内.每个处理3次重复.采用水合茚三酮比色法测定[17].
1.4.4 苗木光合色素含量测定:采用丙酮研磨法,参照William and Paul[18]方法.准确称取樟子松针叶 0.5g,加入 10mL丙酮,冰浴研磨,吸取上清液,10000r/min离心 5min,留上清液.在分光光度计上分别测定各处理在663nm和645nm处的光吸收值A663和A645.每个处理3次重复.
1.5 数据处理
所得数据用SPSS 13.0进行单因素差异显著性分析(ANOVA) P=0.05,并用 origin8.5绘图,利用Canoco5.0对各指标进行主成分分析(Principal Component Analysis,PCA).
2 结果与分析
2.1 外源钙与外生菌根协同对樟子松苗木生长的影响
接菌的3个处理[Ca(0), Ca(10)和Ca(20)]的菌根侵染率均达到了65.0%以上(图1),3个处理之间无显著差异(P>0.05).关于各处理之间无显著差异原因可能是在培养初期,各条件比较一致,菌根真菌与苗木形成菌根的条件也是基本没有差异.人工接种外生菌根真菌,当菌根合成之后,如果外界环境(如水分、养分等)没有巨大的变化时,菌根的侵染率基本恒定.这个结果与课题组前期研究结果一致[14].表明人工接种褐环乳牛肝菌(S.luteus)与樟子松合成外生菌根接种成功(图 2),在 Ca2+存在条件下不影响菌根的合成.

图1 不同处理菌根侵染率Fig.1 Colonization rates of different treatments
与对照相比(即不施用 Ca),各处理组均可显著促进苗木的生长(图3A).在苗高方面,生长4个月后(合成菌根后3个月),Ca(10)处理组苗高达到最大,为 11.4cm,与不施钙处理组存在显著差异(P≤0.05).Ca(20)处理组苗高达到 10.6cm,虽然高于对照,但低于 Ca(10)处理组,可能是高浓度的Ca2+对苗木的生长有一定的抑制作用,但本研究并未设计更高浓度的Ca2+处理,因此,无法得出确切的结论,具体原因有待进一步研究探讨.在地径方面,施 Ca处理组的苗木地径均高于对照(图3B),分别为0.08和0.11cm,与对照组均达到显著差异(P≤0.05)水平.值得说明的是,就苗高和地径2个指标来看,一般大田当中的一年生实生苗根据地域的不同,苗高也会存在明显的差异.在辽宁地区,一年实生樟子松苗的苗高一般不超过12cm.但由于苗木是在室内条件下培养的,外部环境相对稳定,比较利于苗木的生长,因此可能存在一定的徒长现象.但由于处理条件相同,该数据基本可以说明问题.

图2 菌根合成情况(10×)Fig.2 Mycorrhizal synthesis conditions (10×)
在生物量方面,施钙处理组无论是鲜重还是干重均高于对照(图 3C、D).尤其在干重方面, Ca(20)处理组在干物质积累方面虽然与 Ca(10)处理组无显著差异(P>0.05),但从数值上看却高于 Ca(10)处理组,说明其干物质积累、提高苗木质量方面优于Ca(10)处理组.
综上所述,在苗木合成菌根后,适当的施用一定浓度的Ca2+,可以有效促进苗木的生长,这样处理比单一接种菌根菌效果要理想.

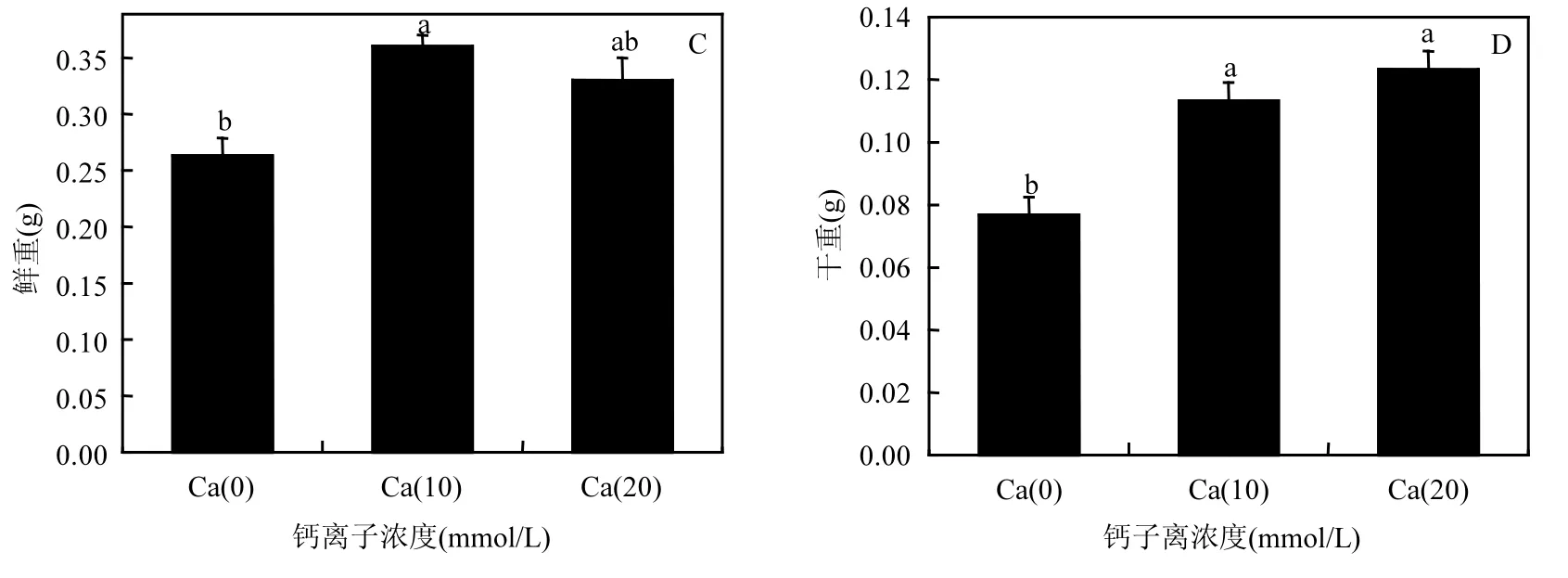
图3 不同处理苗木的生长指标Fig.3 Growth parameters of different treatments
2.2 外源钙与外生菌根协同对樟子松苗木抗氧化酶活力的影响
各处理组均可显著提高苗木的CAT和POD活力水平(图4A-F).在CAT活力方面,苗木的根、茎、叶,各取样部位在 CAT活力提升方面均对Ca2+有良好的响应.其中 Ca(10)处理组在苗木CAT达到最高水平,尤其是苗木茎部的CAT活力上升程度最高,为116.83U/mgprot(图4B).苗木各部分Ca(10)处理组均为CAT最高值,且与其它两种处理均存在显著差异(P≤0.05).在POD活力方面,Ca(20)处理组对苗木根和茎的POD提升起很大的作用,对于叶部POD活力的提升作用不明显.在 SOD活力提升方面,Ca2+主要提高茎和叶的SOD活力水平(图4G-I),但与对照相比,提高的幅度均不大,有的甚至没有达到显著差异水平(P>0.05).
综上所述,对于菌根化樟子松苗木,适当施加Ca2+对苗木抗氧化保护酶的活力提高有很好的促进作用,说明外源 Ca2+与外生菌根菌协同可以有效提高苗木的抗氧化能力与相关抗逆性.
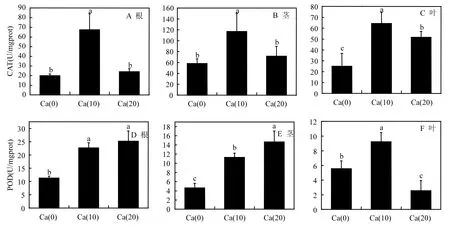

图4 不同处理苗木的抗氧化酶活性Fig.4 Activities of antioxidant enzyme of different treatments
2.3 外源钙与外生菌根协同对樟子松苗木细胞渗透调节物质含量的影响
可溶性蛋白是一种重要的细胞渗透调节物质,它与植物细胞的衬质势有很大关联.可溶性蛋白的含量升高可以有效降低细胞的衬质势,可以有效维持植物细胞处于较低的水势,抵抗水分胁迫带来的伤害.因此,可以将苗木可溶性蛋白含量的高低作为苗木抗逆性强弱的指标之一.在苗木可溶性蛋白含量方面,施加外源 Ca2+对苗木可溶性蛋白含量主要影响在于苗木的叶部(图 5C).尤其是 Ca(10)处理组,可溶性蛋白含量与另外两个处理的含量均存在显著差异(P≤0.05).对于苗木的根和茎则影响不大,含量提升并不明显.
可溶性糖是调节渗透胁迫的小分子物质,在植物抗逆性调节当中,其原理与可溶性蛋白类似.与对照相比,各处理组均可显著提高苗木可溶性糖含量(图 5D-F).尤其对于苗木的茎部,两个施用外源 Ca2+处理组与对照组相比均达到显著差异(P≤0.05)水平,二者可溶性糖含量分别达到128.44和113.77μg/g.其次是苗木根部,与对照相比,Ca(10)处理组可溶性糖含量达到 120.03µg/g,与对照达到显著差异(P≤0.05)水平.而对于叶部可溶性糖含量,外源Ca2+的提升作用并不明显.
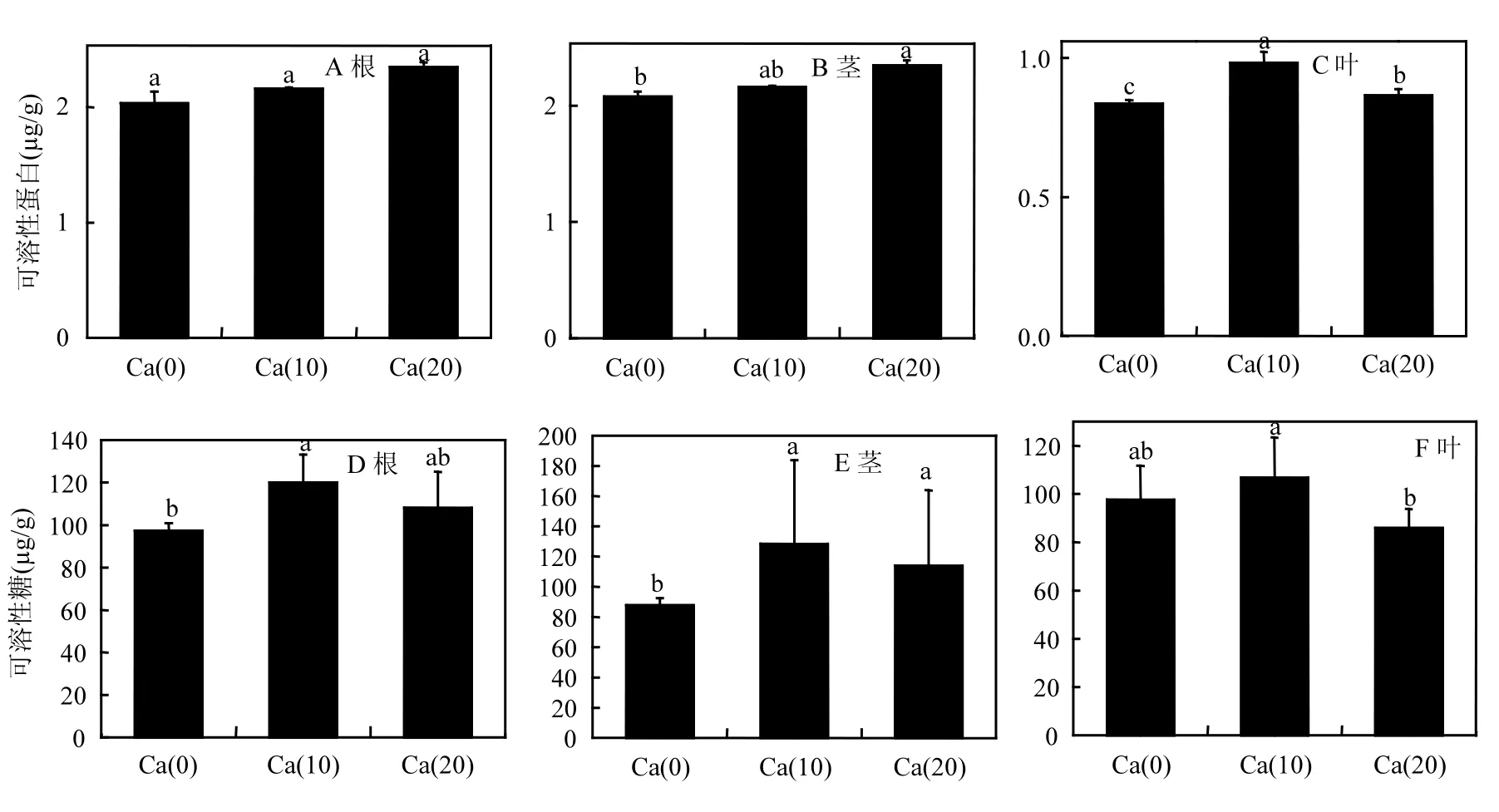

图5 不同处理苗木的渗透调节物质含量Fig.5 Content of osmotic adjustment substances of seedlings
脯氨酸是植物细胞质中一种游离氨基酸,具有很高的水溶性.它可以保护细胞膜系统,维持胞内酶的结构,减少细胞内蛋白质的降解,脯氨酸含量的增高能够降低植物细胞的渗透势,防止细胞脱水.本研究当中,对于苗木游离脯氨酸含量,各处理主要影响苗木根和叶部的脯氨酸含量.尤其以根部最为明显(图5G-I).与对照相比,两种施加外源Ca的处理组游离脯氨酸含量均与对照组达到显著差异(P≤0.05)水平.而对于茎部,结果却恰恰相反,具体原因不明,需要进一步研究.
2.4 外源钙与外生菌根协同对樟子松苗木光合色素含量的影响
光合色素含量的高低,直接决定着植物生长的好坏.本研究中,与对照相比,各施加外源Ca处理组均可以有效提高苗木针叶当中叶绿素含量(图6).其中Ca(10)处理组无论对苗木叶绿素a还是叶绿素 b的提高程度均显著高于其他处理组.以上结果表明,在苗木合成菌根以后,适当施用低浓度的外源Ca2+,可以有效促进苗木的生长,提高苗木质量.
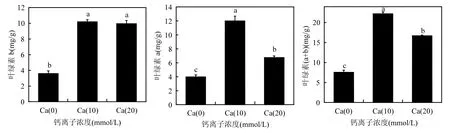
图6 不同处理苗木光合色素含量Fig.6 photosynthetic pigment of different treatments
3 讨论
苗木质量的高低最直观的指标就是生长指标,它可以直接评价苗木生长的好坏程度.对于樟子松接种其高效外生菌根菌,可以有效促进其生长,这早已是学界所承认的研究定论.关于外生菌根促进苗木生长的研究也非常的多.吴小芹研究发现,接种外生菌根菌可以有效增强松苗水分和养分的吸收,从而增强松苗的生长势,可以有效地抵抗松枯梢病[19].与此同时,菌根促进植物生长的重要机制之一就是促进树木对营养元素的吸收[20-21].而钙元素是植物细胞的重要成分,也是植物受到外界环境胁迫的重要信号分子.钙离子在植物水分调节中,通过对质膜水孔蛋白磷酸化作用,调节植物根细胞在外界高浓度离子渗透胁迫下的吸水活性,从而使植物可以有效抵御渗透胁迫,度过难关[11].因此,在本研究当中,施加外源钙Ca2+能够与外生菌根菌协同,加大原有的菌根对植物的促进作用.有研究表明,适当增加Ca2+能有效同丛枝菌根发生协同增效作用,促进玉米生长.但在高钙体系,当施入Ca2+>20mmol/L时,玉米地上部分和根系部分氮磷钾累积量随着外源钙浓度增加而减少,说明高钙对氮、磷和钾的有拮抗关系[22].在本研究结果当中也出现了虽无显著差异(P>0.05),但 Ca(20)处理组苗高数值上低于Ca(10)处理组苗高的情况.但是由于本研究所限,该结论需要进一步进行研究验证.苗木的生长质量是决定造林成功与否的主要因素.在本研究中,接种外生菌根菌后再施加外源 Ca2+,可以有效放大外生菌根对苗木的促生作用,加快苗木的生长.与此同时,苗木的可溶性蛋白含量升高,光合效率增大,抗氧化酶活性增强,生长和生理指标的变化一致,说明适当浓度的外源 Ca2+和外生菌根菌协同能够更好地加速苗木的形态建成,提高苗木的生长势.
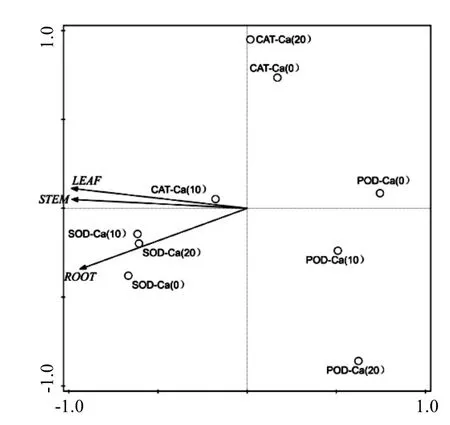
图7 苗木抗氧化酶PCA分析Fig.7 PCA of antioxidant enzyme
通过合成菌根施加外源 Ca2+后,对苗木抗氧化酶的观察发现,与对照相比,经外源 Ca2+处理后的苗木表现出更高的酶活性.在菌根化之后,适当浓度的外源 Ca2+能更好地将菌根的功能适当放大.CAT、POD和SOD是植物体内主要的抗氧化环境胁迫的酶系,通过它们的变化程度可以反映植物的抗逆性[23].在本研究当中,对于适当浓度的外源 Ca2+添加,能够更好地联合外生菌根菌诱导苗木产生更高水平的CAT和POD,尤其是 Ca(10)处理组表现尤为突出.而SOD没有达到显著差异(P>0.05)水平可以说明“浓度要适当”.主成分分析(PCA)结果表明,施Ca处理主要可以诱导苗木各部分CAT和POD活力上升(图7),使得CAT和POD在保护酶体系的变化上,对苗木的贡献率最大,提高苗木的抗逆性.

图8 苗木渗透调节物质PCA分析Fig.8 PCA of osmotic adjustment substances
可溶性蛋白和糖是植物细胞内主要的渗透调节物质,可溶性蛋白具有较强的亲水性,它能明显增强细胞的持水力,而可溶性蛋白含量的增加可以束缚更多的水分,减少外界条件下胁迫对细胞致死的机会[24],可溶性糖可以提高细胞液浓度,降低水势,增加保水能力,可以起到与可溶性蛋白对细胞相似的保护效果[25-26].本研究当中,施加适当浓度的外源Ca2+,可以有效和外生菌根协同,增加苗木各部分的可溶性蛋白含量.PCA分析表明,各渗透物质可以有效的被分散开来,在处理之后的各项指标当中,贡献率最大的是可溶性蛋白含量(图 8).这与苗木生长状况的结果是一致的,蛋白含量升高,苗木细胞渗透性和保水能力有所增强,可以有效抵御外界胁迫,提高苗木抗胁迫能力,降低苗木的死亡率.研究表明,脯氨酸的积累需要碳水化合物,而糖是提供碳骨架来源[27].本研究当中,除了茎部之外,其它各部分可溶性糖和脯氨酸的变化趋势基本上是一致的.关于游离脯氨酸含量与植物抗逆性的关系在科学界尚有争论.大量研究表明,植物体内游离脯氨酸含量与植物耐胁迫的能力呈正相关[28],有的与植物耐胁迫的能力呈负相关[29-30].本研究当中,在不同的部位,脯氨酸含量呈现不同,这种“反常”的现象还需要进一步设计实验研究.
本研究利用打孔灌根接种外生菌根真菌处理一年生樟子松苗木,在合成菌根一个月后施用适当浓度的外源 Ca2+.苗木的生长势和体内生理抗性指标的变化是协调统一的,生长强壮的苗木,其体内生理活性应该相应增强.综合本研究的各项结果,不难看出,苗木的生长和生理指标的变化一致,生长迅速且健壮的苗木,其体内抗氧化酶系统和细胞中渗透物质的含量也相应的增高.在育苗初期,在苗圃或大田施用外源 Ca2+(或钙肥)与外生菌根协同达到更好的壮苗之效果,是可行的.当然,我们仅仅是通过盆栽试验做了一个初步的尝试,在苗圃当中的大面积施用还没有进行,具体结果不得而知.在苗圃和大田当中,各种限制因素远比盆栽复杂.比如,土壤环境.本研究采用无菌土壤进行盆栽试验,目的是为了保证接种的菌根尽可能种类单一,而事实上,苗木是在大棚环境培养的,不可能不受到土壤微生物的影响,但由于之前对土壤进行了灭菌处理,相关微生物重新组建菌落需要时间,况且我们的实验周期仅为4个月,因此即使土壤微生物存在一定影响,由于苗木培养时间和培养条件均一致,所以本文的试验结果可以说明问题.本文仅研究了外生菌根菌对干旱-半干旱区樟子松的生长和生理影响,需进一步加强对该地区土壤的生态环境改良效果的研究,完善外生菌根真菌对干旱-半干旱区环境治理和生态修复功能.综上所述,本研究结果可以为今后进一步研究提供数据借鉴,同时也可以为辽西北半干旱地区苗圃高质量育苗与逆境造林改善生态环境提供理论依据.
4 结论
4.1 适当浓度的外源Ca2+(Ca2+≤20mmol/L)和外生菌根协同能够更好的促进樟子松苗木的生长.
4.2 适当浓度的外源 Ca2+(Ca2+≤20mmol/L)和外生菌根协同能够更好的提升樟子松苗木的过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)等抗氧化酶活性,更好得抵御环境胁迫带来的活性氧(ROS)积累.
4.3 适当浓度的外源 Ca2+(Ca2+≤20mmol/L)和外生菌根协同能够更好的提高樟子松细胞可溶性糖、蛋白和游离脯氨酸含量,提升细胞的耐渗透能力.
4.4 菌根苗通过施用适当浓度的外源Ca2+达到加大壮苗的目的是可行的.
[1]尹大川,杨立宾,邓 勋,等.绿木霉对樟子松苗木生长指标及生理生化指标的影响 [J]. 北京林业大学学报, 2015,37(1):78-83.
[2]周祟莲,齐玉臣.外生菌根与植物营养 [J]. 生态学杂志, 1993, 12(1):37-44.
[3]杜善周,毕银丽,吴王燕,等.丛枝菌根对矿区环境修复的生态效应 [J]. 农业工程学报, 2008,24(4):113-116.
[4]李志真.外生菌根菌的培养技术与应用 [J]. 福建林业科技, 1993,20(1):71-74.
[5]王 艺,丁贵杰.外生菌根对马尾松幼苗生长、生理特征和养分的影响 [J]. 南京林业大学学报(自然科学版), 2013,37(2):97-102.
[6]张小龙,张 洪,张 香,等.外生菌根菌剂对白皮松幼苗生长效应的研究 [J]. 林业科学研究, 2005,18(2):133-136.
[7]Hirschi K D, The calcium conundrum. Both versatile nutrient and specific signal [J]. Plant Physiology, 2004,136(1):2438-2442.
[8]王晓锋,刘 红,张 磊,等.澎溪河消落带典型植物群落根际土壤无机氮形态及氮转化酶活性 [J]. 中国环境科学, 2015, 35(10):3059-3068.
[9]Sanders D, Brownlee C, Harper J F. Communicating with calcium [J]. Plant Cell, 1999,11(4):691-706.
[10]Shinozaki K, Yamaguchi. Gene expression and signal transduction in water-Stress response [J]. Plant Physiology, 1997,115(2):327-334.
[11]Johansson I, Larsson C, Kjellbom P. The major integral proteins of spinach leaf plasma membranes are putative aquaporins and are phosphorylated in response to Ca2+and apo-plastic waterpotential [J]. Plant Cell, 1996,89(7):1181-1191.
[12]朱 义,何池全,杜 玮,等.盐胁迫下外源钙对高羊茅种子萌发和幼苗离子分布的影 [J]. 农业工程学报, 2007,23(11):133-137.
[13]Yin D, Deng X, ChetIlan, et al, Physiological responses of Pinussylvestrisvar.mongolica seedlings to the interaction between Suillusluteus and Trichoderma virens [J]. Current Microbiology, 2014,69(3):334-342.
[14]尹大川,邓 勋,Ilan Chet,等.厚环乳牛肝菌(Suillusgrevillei)N40与绿木霉(Trichoderma virens)T43复合接种下樟子松苗木的生理响应 [J]. 生态学杂志, 2014,33(8):2142-2147.
[15]Christos D G,KonstantinosG,George Z. Mechanism of Coomassie brilliant blue G-250binding to proteins: a hydrophobic assay for nanogram quantities of proteins [J]. Analytical and Bioanalytical Chemistry, 2008,391:391-403.
[16]尹大川,邓 勋,Ilan Chet,等.绿木霉(Trichoderma virens)T43对四种重要林木病原菌的抑制效果及抑菌机理 [J]. 生态学杂志, 2014,33(7):1911-1919.
[17]Yin D C, Deng X, Song R Q. Synergistic effects between S. luteus and T. virens on Korean spruce seedlings growth and drought resistance to Scotch pine seedlings [J]. Journal of forestry research, 2016,27(1):193-201.
[18]William P I, Paul R B. Extinction coefficients of chlorophylla and b in N, N-dimethyl formamide and 80% acetone1 [J]. Plant Physiology, 1985,77:483-485.
[19]吴小芹,高 悦.几种外生菌根菌对松苗抗非根部病害的影响[J]. 林业科学, 2007,43(6):88-93.
[20]Mauch F, Mauch-Mani B, Boller T. Antifungal hydrolases in peatissue. II. Inhibition of fungal growth by combination of chitinase and β-1,3-glucanase [J]. Plant Physiology, 1988,88:936-942.
[21]Griffiths R P, Baham J E, Caldwell B A. Soil solution chernistry of ectomyeorrhizal mats in forest [J]. Soil Biology and Biocheniistry, 1994,26:331-337.
[22]李少朋,毕银丽,陈昢圳,等.外源钙与丛枝菌根真菌协同对玉米生长的影响与土壤改良效应 [J]. 农业工程学报, 2013,29(1):109-116.
[23]He. L, QinJJ, Long L Y, et al. Net cadmium flux and accumulation reveal tissue-specific oxidative stress and detoxification in Populus×canescens [J]. PhysiologiaPlantarum, 2011,143(1):50-63.
[24]沙 伟,刘焕婷,谭大海,等.低温胁迫对扎龙芦苇SOD、POD活性和可溶性蛋白含量的影响 [J]. 齐齐哈尔大学学报, 2008,24(2):1-4.
[25]谭晓荣,胡韬纲,戴 媛,等.不同干旱方式对小麦幼苗可溶性蛋白含量及总抗氧化力的影响 [J]. 河南工业大学学报(自然科学版), 2008,29(1):42-47.
[26]朱 政,蒋家月,江昌俊,等.低温胁迫对茶树叶片 SOD、可溶性蛋白和可溶性糖含量的影响 [J]. 安徽农业大学学报, 2011, 38(1):24-26.
[27]王增进,张玉先.大豆盐胁迫研究进展 [J]. 黑龙江八一农垦大学学报, 2005,17(6):26-29.
[28]蒋明义,荆家海,王韶唐.水分胁迫与植物膜脂过氧化 [J]. 西北农业大学学报, 1991,19(2):88-94.
[29]汪 峰,类成霞,蒋瑀霁,等.长江中下游两种典型水稻土微生物对砷污染的响应 [J]. 中国环境科学, 2014,34(11):2931-2941.
[30]易杨杰,张新全,高 杨,等.不同狗牙根品种对聚乙二醇胁迫反应的差异 [J]. 北方园艺, 2008,9:96-99.
Effects of Ectomycorrhizal cooperating with exogenous calcium on Pinussylvestris var. mongolica growth.
YINDa-chuan1,2*, QI Jin-yu1,2, DENG Ji-feng1,2, DU Hui1, DENG Xun3(1.College of Forestry, Shenyang Agricultural University, Shenyang 110866, China;2.Research Station of Liaohe-River Plain Forest Ecosystem, Changtu 112500, China;3.Forestry Protection Institute of Heilongjiang Forestry Academy, Harbin 150040, China). China Environmental Science, 2017,37(6):2295~2304
This study aimed to test whether ectomycorrhizal fungi and exogenous Ca2+have collaboratively influence on the growth trait of Pinus sylvestris var. mongolica seedlings. During our study, several research methods like mycology, biochemistry, and ecology were used. And the appropriate concentration of exogenous Ca2+was applied to one-year-old mycorrhizal seedlings, then the growth and physiological traits of various parts of seedlings were tested. The results indicated that: (1)Appropriate concentration of exogenous Ca2+associated with ECMF could better promote the growth of P. sylvestris var. mongolica seedlings. When Ca concentration≤20mmol/L, the plants height reached to the maximum, which were 11.4cm and 10.6cmseparately,andwere 32.6% and 23.3% higher than control, which treated without applying Ca concentration. Both of biomass and photosynthetic pigment contents were higher than the treatments without applying Ca concentration. The results above showed that an appropriate concentration of exogenous Ca could magnify the effect of mycorrhizal on growth of seedlings. (2) Appropriate concentration of exogenous Ca2+associated with ECMF could better promote the antioxidant ability of P. sylvestris var. mongolica seedlings. By applying exogenous Ca2+, the CAT and POD activities in every part of seedlings were increased, and the quality of seedlings were improved due to the high levels of antioxidant enzyme system. (3) Appropriate concentration of exogenous Ca2+associated with ECMF could better promote the resistance to penetration of P. sylvestris var. mongolica seedlings. In the paper, by using exogenous Ca2+together with ECMF could effectively increase the content of soluble protein of P. sylvestris var. mongolica seedlings. The PCA analysis indicated that, the soluble protein have the greatest contribution among all osmolytes indicators. The result also showed that exogenous Ca2+and ECMF could lead to the increasement of content of soluble protein in plants, and their stress resistance was improved as well. (4) It is possible to achieve the goal of promoting the growth and physiological traits of seedlings by applying the appropriate concentration of exogenous Ca2+. In conclusion, apparently, the variation trends of growth and physiological traits were similar, the internal antioxidant enzyme system and osmolytes content were higher in the rapid growth and strong seedlings. In the early seedling stage, by applying the appropriate concentration of exogenous Ca2+(or calcium fertilizer) associated with ECMF in the greenhouse or field would obtain better strong seedling results, and this method is feasible.
ectomycorrhizal fungi;exogenous Ca2+;Pinus sylvestris var. Mongolica;growth;resistance
X173,Q89
A
1000-6923(2017)06-2295-10
尹大川(1987-),男,黑龙江齐齐哈尔人,讲师,博士,研究方向为森林保护学与环境微生物学.发表论文9篇.
2016-11-08
国家自然科学基金资助项目(31670649,31200484);沈阳农业大学引进人才启动项目(2015年度)
* 责任作者, 讲师, yindachuan@126.com
