宁波市耐三代头孢菌素志贺菌携带β-内酰胺酶与基因分型
2017-06-28周伟艳沈玄艺徐景野许小敏
周伟艳,郑 剑,叶 硕,沈玄艺,徐景野,许小敏
宁波市耐三代头孢菌素志贺菌携带β-内酰胺酶与基因分型
周伟艳1,郑 剑1,叶 硕1,沈玄艺1,徐景野1,许小敏2
目的 了解本市耐三代头孢菌素志贺菌携带ESBLs及其基因型,为疾病防控提供依据。方法 采用直接和增菌培养法,分离患者标本中志贺菌;药敏采用K-B法,ESBLs志贺菌表型确证采用纸片法;CTX-M、OXA、TEM和SHV耐药基因采用PCR法;耐药基因分型采用核苷酸序列法,用BLAST分析比较确定基因型别。结果 药敏筛检出69株耐三代头孢菌素志贺菌,占ESBLs志贺菌的74.19%。检出CTX-M(CTX-M-1群和CTX-M-9群)、OXA和TEM耐药基因,检出率分别为79.71%、79.01%和26.09%,未检出CTX-M-2群和SHV耐药基因。DNA序列比对CTX-M-1群以CTX-M-15 型为主,还检出7个其它型;CTX-M-9群则以CTX-M-14型多,其它型检出6个;49株OXA和18株TEM耐药基因测序后均为1型(OXA-1型和TEM-1型)。携带2种以上耐药基因的志贺菌21株,占30.43%。结论 本市志贺菌对头孢曲松等三代头孢菌素耐药率较高,检出的ESBLs酶型种类多,CTX-M(CTX-M-1群的CTX-M-15 型和CTX-M-9群的CTX-M-14型)是主流酶型,且可同时携带多种耐药基因,给疾病防控带来困难。OXA-1型的高携带率,提示我们应加强分析。B群志贺菌无论是表型的耐药性,还是耐药基因检出率均高于D群志贺菌,该发现有助志贺菌的扩散与流行研究。
志贺菌;耐三代头孢菌素;超广谱β-内酰胺酶;基因分型
志贺菌是细菌性痢疾(以下简称菌痢)的病原,国内外常见的肠道传染病。由于人群普遍易感,全球每年约有1.65亿人发生该菌感染,危害严重[1]。我国和发展中国家是菌痢的高发地区,严重危害人们的健康与生命。志贺菌的超广谱β-内酰胺酶(extended spectrumβ-lactamases, ESBLs)有众多的酶基因型,是ESBLs志贺菌在全球扩散与流行的原因[2]。随着头孢菌素类抗菌药物在治疗菌痢的增加,耐三代头孢菌素的ESBLs志贺菌呈上升趋势。ESBLs主要有TEM、SHV、CTX-M和OXA等4大类耐药基因,及数百个酶型,且在不规则使用该类抗菌药物和抗菌药物选择性压力下产生的酶基因型在不断增加[3],给治疗带来困难。为了解宁波市ESBLs志贺菌耐三代头孢菌素情况和携带耐药基因种类,我们对分离和收集到的志贺菌进行耐药性筛选和耐药基因检测与测序分析,现将结果报告如下。
1 材料与方法
1.1 菌株来源 253株志贺菌由宁波市感染性腹泻病监测网络实验室从病人标本中分离或县级以上医院分离后上送,其中男性135例,女性118例,年龄10月龄~92岁,<10岁儿童占61.74%。
1.2 培养基和仪器 GN、SS琼脂、麦康凯琼脂、伊红-美蓝琼脂为北京陆桥技术有限公司产品,显色培养基为郑州博赛生物制品研究所产品,志贺菌诊断血清为卫生部兰州生物制品研究所产品;MH琼脂及抗生素药敏纸片为英国OXOID公司产品;20E生化鉴定试剂条为法国生物梅里埃公司产品。DNA提取试剂为大连宝生物TaKaRa MiniBEST 细菌基因组提取试剂盒3.0,均在有效期内使用。PCR反应试剂均购自大连宝生物公司,PCR扩增仪为德国Eppendorf公司的Mastercycler梯度PCR。
1.3 细菌分离与鉴定 志贺菌检测采用文献方法[4-5]进行。1)直接分离培养: 标本接种于SS平板和麦康凯平板或显色培养基,36±1 ℃培养24 h;2)增菌分离培养: 标本接种于GN肉汤,36±1 ℃增菌培养8 h,再用上述平板分离。挑取可疑菌落接种于克氏双糖琼脂36±1 ℃培养24 h,双糖管为-/+、H2S-似可疑菌,用营养琼脂分纯,API进行系统生化鉴定。符合志贺菌生化的菌株,再用诊断血清作玻片凝集,确定血清型。253株志贺菌分为福氏志贺菌(B群)170株,占67.19%、宋内志贺菌(D群)83株,占32.81%。
1.4 药敏筛查ESBLs志贺菌与耐药基因检测
1.4.1 药敏筛查 用K-B纸片法检测21种常用抗菌药物筛查耐三代头孢菌素的志贺菌,质控方法和结果判定参照CLSI(2014)抗菌药物敏感性试验执行标准[6];ESBLs表型确证采用CLSI推荐的纸片法[7]。质控菌株为大场埃希氏菌(ATCC25922)。
1.4.2 耐药基因检测 1)引物合成 CTX(CTX-M-1型、CTX-M-2型和CTX-M-9型)、OXA、TEM、SHV的引物序列根据GenBank,使用软件Primer 5. 0进行设计,由上海塞百盛生物工程公司合成。所用引物见表1。2) DNA提取 待检菌接种营养琼脂平板培养过夜,采用TaKaRa公司的MiniBEST细菌基因组提取试剂盒(3.0)。按说明书操作提取志贺菌基因组DNA。3)PCR扩增 采用Premix TapTM试剂盒(2.0)按说明书配置PCR反应体系,扩增志贺菌耐药基因。CTX-M(1、2、9群)、SHV、TEM和OXA等耐药基因的PCR反应条件:95 ℃预变性5 min,94 ℃摸板变性1 min,55 ℃退火45 s(SHV为60 ℃退火45 s),72 ℃延伸1 min,共35个循环,最后72 ℃延伸10 min。反应结束后,取PCR产物5 μL点样于1%琼脂糖凝胶(内含0.5 μg/mL溴化乙锭)电压10V/cm,电泳30 min,BIO-RAD凝胶成像系统观察标准分子量条带与检测预期条带的分子量大小。
表1 志贺菌耐药基因PCR引物及产物长度
Tab.1 PCR primers and the length of products for resistance genes ofShigella

基因名称Gene序列(5'-3')Sequence(5'-3')产物长度(bp)lengthofproductsOXA[8]F:TTTTCTGTTGTTTGGGTTTT610R:TTTCTTGGCTTTTATGCT-TGTEM[9]TEM[9]F:ATAAAATTCTTGAAGACGAAA851R:GACAGTTACCAATGCTTAATCASHV[10]SHV[10]F:ATGCGTTATATTCGCCTGTG477R:GTTAGCGTTGCCAGTGCTCGCTX-M-1群[11]F:ACGCTGTTGTTAGGAAGTGT862R:TTGAGGCTGGGTGAAGTAAGCTX-M-2群[11]F:ACGCTACCCCTGCTATTTAG868R:CAGAAACCGTGGGTTACCTX-M-9群[11]F:AGTGCAACGGATGATGTTC870R:GGCTGGGTAAAATAGGT-CAC
1.4.3 测序与基因分型 PCR扩增阳性产物送上海英骏公司,用ABI3730全自动基因分析仪对测序引物扩增片段进行正反方向核苷酸序列测定,测序结果进行consed拼接,在GenBank(www.ncb.inlm.nih.gov) 用BLAST分析比较后确定扩增产物基因型别。
2 结 果
2.1 药敏结果 253株志贺菌经9类20种抗菌药物耐药性检测,除2株B群志贺菌对抗菌药物全部敏感外,有233株志贺菌耐药在4~13种之间,以耐4~6类为多,按多重耐药性定义(同时耐抗菌药物≥3类)为多重耐药菌。耐三代头孢菌素前三的是头孢噻肟、头孢曲松和头孢他啶,耐药率分别为53.57%、25.69%和21.74%,未检出耐碳青霉烯类抗生素的志贺菌。见表2。
表2 B群志贺菌和D群志贺菌耐药情况
Tab.2 Resistance of group B and group DShigella
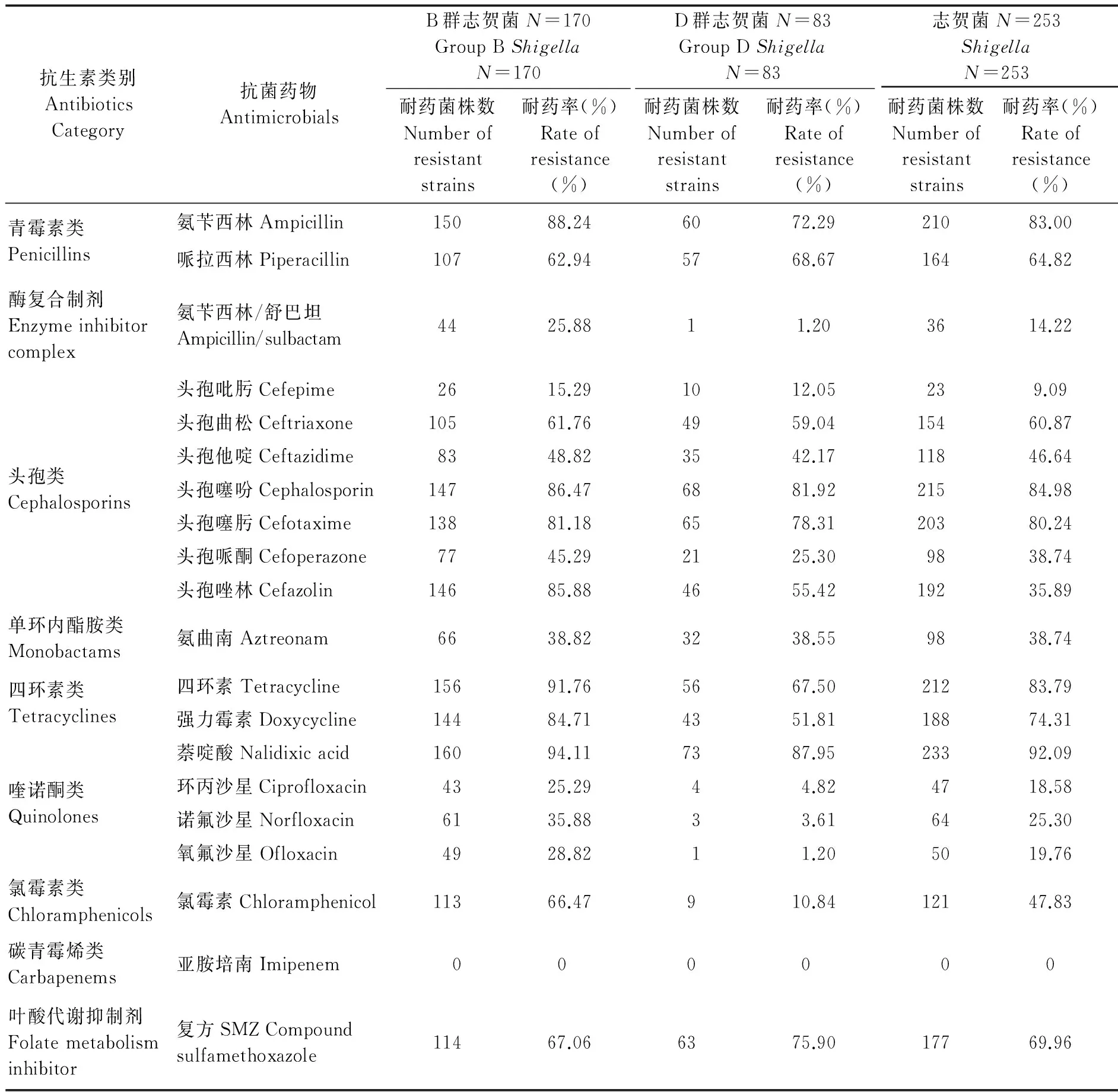
抗生素类别AntibioticsCategory抗菌药物AntimicrobialsB群志贺菌N=170GroupBShigellaN=170D群志贺菌N=83GroupDShigellaN=83志贺菌N=253ShigellaN=253耐药菌株数Numberofresistantstrains耐药率(%)Rateofresistance(%)耐药菌株数Numberofresistantstrains耐药率(%)Rateofresistance(%)耐药菌株数Numberofresistantstrains耐药率(%)Rateofresistance(%)青霉素类Penicillins氨苄西林Ampicillin15088.246072.2921083.00哌拉西林Piperacillin10762.945768.6716464.82酶复合制剂Enzymeinhibitorcomplex氨苄西林/舒巴坦Ampicillin/sulbactam4425.8811.203614.22头孢类Cephalosporins头孢吡肟Cefepime2615.291012.05239.09头孢曲松Ceftriaxone10561.764959.0415460.87头孢他啶Ceftazidime8348.823542.1711846.64头孢噻吩Cephalosporin14786.476881.9221584.98头孢噻肟Cefotaxime13881.186578.3120380.24头孢哌酮Cefoperazone7745.292125.309838.74头孢唑林Cefazolin14685.884655.4219235.89单环内酯胺类Monobactams氨曲南Aztreonam6638.823238.559838.74四环素类Tetracyclines四环素Tetracycline15691.765667.5021283.79强力霉素Doxycycline14484.714351.8118874.31喹诺酮类Quinolones萘啶酸Nalidixicacid16094.117387.9523392.09环丙沙星Ciprofloxacin4325.2944.824718.58诺氟沙星Norfloxacin6135.8833.616425.30氧氟沙星Ofloxacin4928.8211.205019.76氯霉素类Chloramphenicols氯霉素Chloramphenicol11366.47910.8412147.83碳青霉烯类Carbapenems亚胺培南Imipenem000000叶酸代谢抑制剂Folatemetabolisminhibitor复方SMZCompoundsulfamethoxazole11467.066375.9017769.96
2.2 产酶情况 对233株多重耐药志贺菌经纸片确认,证实93株为产ESBLs志贺菌,检出率为39.91%,其中B群志贺菌76株,占32.62%,D群志贺菌17株,占7.30%。属耐三代头孢菌素的69株,占ESBLs志贺菌的74.19%。
2.3 耐药基因分布 69株耐三代头孢菌素志贺菌中检出CTX-M(CTX-M-1群和CTX-M-9群)、OXA和TEM耐药基因,未检出CTX-M-2群和SHV耐药基因,携带率以CTX-M基因(CTX-M-1群和CTX-M-9群)最高,占79.71%;OXA耐药基因次之。见表3。耐药基因阳性产物测序后, 与GenBank的blast比对,CTX-M-1群以CTX-M-15 型为主(26/69),其它酶型包括CTX-M-3型(7株)、CTX-M-55型(5株)、CTX-M-79型(4株)、CTX-M-22型(4株)、CTX-M-5型(3株)、CTX-M-64型(3株)、CTX-M-123型(1株);CTX-M-9群以CTX-M-14型为主(32/69),其它酶型包括CTX-M-24型(15株)、CTX-M-27型(4株)、CTX-M-19型和CTX-M-21型(各2株)、 CTX-M-16型和CTX-M-13型(各1株)。49株OXA和18株TEM耐药基因测序后均为1型(OXA-1型和TEM-1型)。携带两种以上耐药基因的志贺菌21株,占30.43%,分别是CTX-M-1群(CTX-M-15型)+TEM-1型5株,占7.25%;OXA-1型+CTX-M-1群(CTX-M-15型)4株,占5.80%;CTX-M-9群(CTX-M-14型)+TEM-1型7株,占10.14%;OXA-1型+CTX-M-9群 (CTX-M-14型) 5株,占7.25%。
表3 69株耐三代头孢菌素志贺菌检出耐药性基因情况
Table 3 The detection of resistance genes from 69 strains of the third-generation cephalosporins-resistantShigella
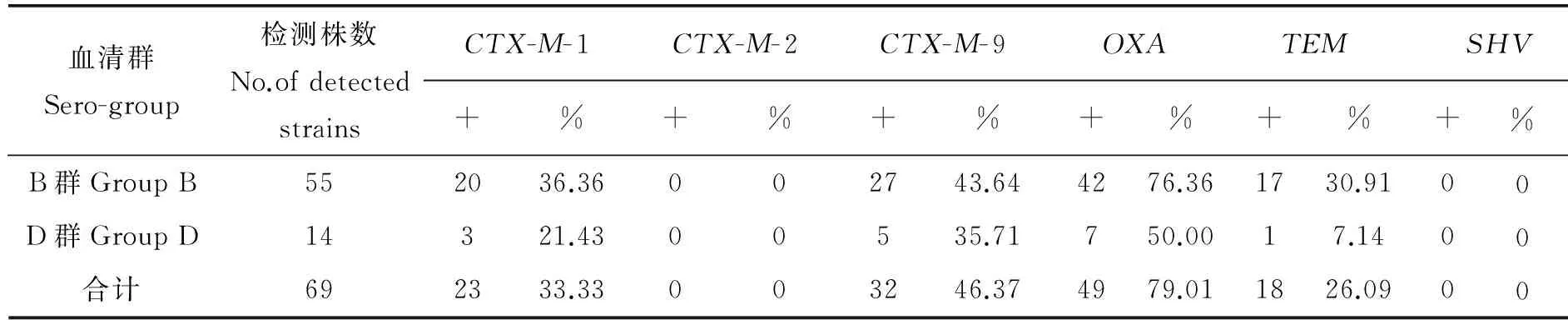
血清群Sero-group检测株数No.ofdetectedstrainsCTX-M-1CTX-M-2CTX-M-9OXATEMSHV+%+%+%+%+%+%B群GroupB552036.36002743.644276.361730.9100D群GroupD14321.4300535.71750.0017.1400合计692333.33003246.374979.011826.0900
3 讨 论
国内外细菌耐药性监测显示志贺菌的耐药性在增强,多重耐药菌ESBLs株越来越多,耐第三代头孢菌素志贺菌明显增多[12],这可能是不规则用药和各领域广泛使用抗菌药物的结果,而志贺菌通过自身多机制协同获得耐药也是增强的原因。药敏检测显示有92.09%(233/253)的志贺菌为多重耐药菌,菌株对抗菌药物的耐药性较强,对头孢曲松等三代头孢菌素耐药率高达53.57%(133/253),其中ESBLs株36.76%(93/253),产酶率74.19%(69/93),耐药谱几乎覆盖了除耐碳青霉烯以外的所有抗生素,其耐药性有超过大肠埃希菌和肺炎克雷伯菌等肠杆菌科细菌的趋势[13],由此可见我市志贺菌耐药的严重性,应引起我们的高度重视。此外,还发现耐药性与菌株的血清型存在关联,D群志贺菌无论是耐药种类,还是ESBLs株数均明显低于B群志贺菌,其原因有待进一步探讨。
志贺菌对三代头孢菌素的耐药是由质粒介导产生,可水解灭活头孢菌素类等多种抗生素,其ESBLs流行酶型与各地使用抗生素种类有关,且耐药基因的种类在增加中[14]。从69株耐三代头孢菌素志贺菌中检出了CTX-M(CTX-M-1群、CTX-M-9群)、TEM和OXA三类耐药基因,检出率分别为79.71%、79.01%和26.09%,其中有30.43%(21/69)的志贺菌携带二种以上耐药基因,表明本市志贺菌具有携带多种耐药基因能力,可通过多种耐药传播机制或渠道获得,其复杂性有待进一步研究。CTX-M耐药基因自1995年扩散以来,迅速成为全球流行最广的ESBLs基因型。在我国以CTX-M-9群最为多见,并从北京、河北等地的志贺菌中分离到多种CTX-M。检测显示本市志贺菌耐药流行优势酶型以CTX-M(CTX-M-1群、CTX-M-9群)为主,OXA为辅,与国内外报道的以CTX-M 为主结论一致,但不同于TEM 和SHV为辅的结论[15]。阳性产物测序与GenBank Blast比对显示,CTX-M-1群以CTX-M-15型为主,还检出了CTX-M-3等其它7个型;CTX-M-9群以CTX-M-14型为主,检出了CTX-M-24等其它6个型。前者与北京地区报道相同[16],后者亚型与俞云松等一致[17],是我市志贺菌中流行优势酶基因型的代表型。同时,有30.43%(21/69)耐三代头孢菌素志贺菌携带两种及以上耐药基因,反映了我市志贺菌的携带耐药基因的多样性与复杂性,合理、规范地使用抗菌药物,是减少志贺菌耐药性的关键。耐药基因比较结果显示CTX-M-15型与CTX-M-3型的序列仅有一个氨基酸的差别(Asp240→Gly的替换),却能增强志贺菌对头孢他啶的催化能力;CTX-M-64型是CTX-M-14型和CTX-M-15型的嵌合体,对三代头孢菌素增加了水解活性[18],提高了志贺菌的耐药性。
OXA耐药基因具有较强的扩散能力,也是引起头孢类抗菌药物耐药的重要原因,有些亚型对碳青霉烯类抗菌药物有较高的活性,更引起人们的关注。以往该基因很少从产ESBLs志贺菌中检出,主要存在于铜绿假单胞菌和鲍曼不动杆菌中[19]。检测发现产ESBLs志贺菌携带OXA-1型耐药基因高达79.01%,高于苗元等报道的25.3%志贺菌携带OXA-1型耐药基因[20],且对氨苄西林等青霉素类抗菌药物的耐药性较高,符合OXA耐药特征。其检出率仅次于CTX-M,也是本地志贺菌主要的流行耐药酶型,与OXA不属于志贺菌主要耐药酶型的结论不同[21],在国内较少见报道,我们应加强检测与分析,有利于发现耐碳青霉烯类的新亚型。在分子水平上OXA耐药基因可分为五个组,志贺菌的OXA耐药基因属第III组,主要包括OXA-1、OXA-4、OXA-30和OXA-31等型。42株携带OXA耐药基因志贺菌的阳性产物经测序分析均为OXA-1型,无其它型别,显示本市携带OXA耐药基因志贺菌的主要流行型是OXA-1,与文献报道一致[22]。此外,存在不同血清群志贺菌携带OXA耐药基因有所差别的现象。B群志贺菌有76.36%(42/55)的菌株携带率,高于D群志贺菌的50.00%(7/14),应进一步探讨血清学与耐药性的相关性。
本次检测的TEM耐药基因是产ESBLs志贺菌中检出率最低的(18/69),经测序分型全部为TEM-1型,与国内TEM耐药基因流行型一致[23]。其耐药性是通过酶活性中心附近的编码基因发生1个或多个氨基酸突变,形成一系列酶蛋白衍生物,影响底物识别和形成速率,进而影响到酰基酶的水解,从而拓展了对头孢类抗菌药物的特异性,突变所在的活性位点不同,造成不同的耐药谱,仍有待我们继续关注与检测。TEM-1型耐药基因虽不是导致志贺菌对三代头孢菌素耐药的主要原因,但可协助菌株增强耐药性。并且该耐药基因是革兰阴性菌中最常见的传统β-内酰胺酶,也是引起医院感染细菌暴发疫情的主要酶型,应引起我们的关注。SHV耐药基因的特征与TEM耐药基因相似,都是传统的β-内酰胺酶,有许多亚型,曾在国内仍至亚洲发生过流行,本次虽未检出,尚须加强检测与防范。
总之,本市志贺菌携带多种产ESBLs耐药基因,在表型上表现出较强耐药性。共检出CTX-M(CTX-M-1群和CTX-M-9群)、OAX、TEM三群耐药基因,检出率较高。测序发现CTX-M(CTX-M-1群和CTX-M-9群)耐药基因的型别多样,以CTX-M-15型和CTX-M-14型为主流酶型,其菌株的耐药基因是在质粒上编码,可通过转化、转导、转座和接合转移等多种方式在志贺菌内或不同细菌间传递,造成产ESBLs志贺菌的扩散与流行。不同血清群志贺菌无论是表型的耐药性,还是携带耐药基因,均为B群高于D群志贺菌,这对细菌耐药的流行防控具有重要意义。因此,在日常检测中应加强对志贺菌的耐药性监测,及时分析,为临床合理治疗、科学用药提供帮助,杜绝不规范用药,以减少菌痢的发生。
[1] Mandomando I, Jaintilal D, Pons MJ, et al. Antimicrobial susceptibility and mechanisms of resistance inShigellaandSalmonellaisolates from children under five years of age with diarrhea in rural Mozambique[J]. Antimicrob Agents Chemother, 2009, 5(6): 2450-2454. DOI: 10.1128/AAC.01282-08
[2] Nguyen TV, Le PV, Le CH, et al. Antibiotic resistance in diarrheagenicEscherichiacoliandShigellastrains isolated from children in Hanoi, Vietnam[J]. Antinicrob Agents Chanother, 2005, 49(2): 816-819. DOI: 10.1128/AAC.49.2.816-819.2005
[3] Tan WB. Advances in genetic mechanism of bacteria resistance[J]. J Patho Biol, 2009, 4(7):543-544.(in Chinese)
谭文彬. 细菌耐药的基因机制研究进展[J].中国病原生物杂志,2009,4(7):543-544.
[4] Ye YW, Wang YS, Shen ZY. National Guide To Clinical Laboratory Procedures[M].The third edition. Nanjing: Southeast University Press, 2003:822-823.(in Chinese)
叶应妩,王毓三,申子喻.全国临床检验操作规程[M].3版.南京:东南大学出版社, 2003: 822-823.
[5] Ministry of Health of the PRC. WS 287-2008 The diagnostic criteria of bacterial and amebic dysentery[S]. Beijing: People’s Medical Publishing House, 2009. (in Chinese)
中华人民共和国卫生部. WS 287-2008细菌性和阿米巴性痢疾诊断标准[S]. 北京: 人民卫生出版社, 2009.
[6] CLSI. Performance standards for antimicrobial disk susceptibility tests; Approved standard[S]. 14th ed. Wayne: Clinical and Laboratory Standards Institute, 2014.
[7] Clinical and Laboratory Standards Institute.M100-S20 Performance standards for antimicrobial susceptibility testing;twentieth informational supplement[S].Wayne: Clinical and Laboratory Standards Institute, 2014.
[8] Ashraf M, Furuta AK, Shimomura K, et al. Genetic characterization of multidrug resistance inShigellaspp. from Japan[J]. J Med Microbiol, 2006, 55(pt12): 1685-1691. DOI: 10.1099/jmm.0.46725-0
[9] Wang Y, Xu YC, Yang QW, et al. The research on TEM-type-β-lactamases among clinical isolates ofEscherichiacoliandKlebsiellapneumoniain nineteen hospitals[J]. J Clinic Lab Sci,2008,26(2):85-89.(in Chinese)
王瑶,徐英春,杨启文,等.19家医院大肠埃希菌和肺炎克雷伯菌中TEM型β-内酰胺酶的研究[J].临床检验杂志,2008,26(2):85-89.
[10] Woodfond N. Rapid characterization of beta-lactamases by multiplex PCR[J]. Methods Mol Biol, 2010, 64(2): 181-192.
[11] Eckert C, GautierV, Saladin-Allard M, et al. Dissemination of CTX-M-type-lactamases among clinical isolates of Enterobacteriaceae in Paris, France[J]. Antimicrob Agents Chemother, 2004, 48(4): 1249-1255. DOI: 10.1007/978-1-60327-279-7_14
[12] Fu YM, Zhang WL, Xu JF, et al. Analysis of CTX-M genotype and resistance of extended-spectrum β-lactamase-producing isolates ofKlebsiellapneumonia[J]. J Harbin Medical Univ, 2006,40(6):433-436.(in Chinese)
付英梅,张文莉,许建丰,等. 产超广谱β-内酰胺酶肺炎克雷伯菌CTX-M基因型和耐药性分析[J].哈尔滨医科大学学报, 2006,40(6):433-436.
[13] Zhu DA, Sun JY, Fan HQ, et al. The resistance ofShigellaand the genotype screening of extended-spectrum β-lactamase in Shanghai[J]. Chin J Infect Chemother, 2009, 9(2): 126-129.(in Chinese)
朱东安,孙景勇,范惠清,等.上海地区志贺菌耐药性及超广谱β-内酰胺酶的基因分型[J].中国感染与化疗杂志,2009,9(2):126-129.
[14] Mandomando I, Jaintilal D, Pons MJ, et al. Antimicrobial susceptibility and mechanisms of resistance inShigellaandSalmonellaisolates from children under five years of age with diarrhea in rural Mozambique[J]. Antimicrob Agents Chemother, 2009, 53(6): 2450-2454. DOI: 10.1128/AAC.01282-08
[15] Fankhauser C, Zingg W, Francois P, et al. Surveillance of extended spectrum deta lactamase producingEnterobacteriaceaein a Swiss tertiary care hospirtal[J]. Swiss Med Wkly, 2009, 139(51-52): 747-751.
[16] Bao CM, Guo TS, Cui EB, et al. The research for the distribution of resistant genes of ESBLs-producing isolates ofShigellasonnei[J]. Military Med, 2011, 35(2):122-127.(in Chinese)
鲍春梅,郭桐生,崔恩博,等,产ESBLs宋内志贺菌耐药基因分布研究[J].军事医学,2011,35(2):122-127.
[17] Yu YS, Ji SJ, Chen YG. Advances of producing CTX-type extended spectrum beta-lactamase[J]. Clinic Microbiol Anti-infect Forum, 2004, 10.(in Chinese)
俞云松,季淑娟,陈亚岗. 产CTX-M型超广谱β-内酰胺酶研究进展. 临床微生物与抗感染论坛, 2004, 10.
[18] Nagano Y, Nagano N, Wachino J, et al. Novel chimeric beta-lactamase CTX-M-64, a hybrid of CTX-M-15-Like and CTX-M-14 beta-lactamases, found in aShigellasonneistrain resistant to various oxyimino-cephalosporins, including ceftazidime[J]. Antinicrob Agents Chemother, 2009, 53(1): 69-74. DOI: 10.1128/AAC.00227-08
[19] Weldhagen G, Poirel L, Nordmann P. Ambler class A extended-spectrum beta-lactamases inPseudomonasaeruginosa: novel developments and clinical impact[J]. Antimicrob Agents Chemother, 2003, 47: 2385-2392
[20] Miao Y, Lu LX, Wu BH, et al. The research on resistant characteristics of OXA-1-type extended-spectrum beta-lactamase-carrying isolates ofShigellain Beijing[J]. Hebei Med, 2014, 36(7): 1081-1082.(in Chinese)
苗元,卢立新,吴本和,等.北京地区携带OXA-1型超广谱β-内酰胺酶志贺菌耐药特点研究[J].河北医药,2014,36(7):1081-1082.
[21] Ji WJ, Xu XW, Dong F. The research on genotype and resistance of extended-spectrum beta-lactamase-producing isolates ofShigellafrom pediatric [J]. J Microbiol Immunol, 2010, 30(5): 472-476.(in Chinese)
纪文静,徐樨巍,董方.儿科产超广谱 β-内酰胺酶志贺菌的基因型和耐药性研究.中华微生物和免疫学杂志,2010,30(5): 472-476.
[22] Zhang CL, Liu QZ, Wang J, et al. Epidemic and virulence characteristic ofShigellaspp. with extended-spectrum cephalosporin resistance in Xiaoshan District, Hangzhou, China[J]. BMC Infect Dis,2014,14:260.DOI: 10.1186/1471-2334-14-260
[23] Guo P, He XS, Mei CZ, et al. Detection of Beta lactamase and integron genes in 242 strains ofKlebsiellapneumoniaisolated in a hospital from 2012 to 2013[J]. Chin J Zoonoses, 2015, 31(5): 437-440. (in Chinese)
郭普, 贺晓珊, 梅传忠,等. 某医院2012-2013年242株肺炎克雷伯菌β-内酰胺酶及整合子耐药基因检测[J]. 中国人兽共患病学报2015, 31(5): 437-440.
Gene typing of ESBLs-producing third-generation cephalosporins-resistantShigellain Ningbo, China
ZHOU Wei-yan, ZHENG Jian, YE Shuo, SHEN Xuan-yi, XU Jing-ye, XU Xiao-min
(NingboMunicipalCenterforDiseasesPreventionandControl,Ningbo315010,China)
We investigated the third-generation cephalosporins-resistantShigellaand its genotype in Ningbo, China, providing a basis for disease prevention and control. Pathogenic bacteria were analyzed by direct isolation combined with enrichment culture isolation. Antimicrobial susceptibility was determined by K-B disk diffusion method and PCR was used for detecting multidrug resistance genes likeCTX-M,OXA,TEMandSHV. BLAST analysis was used to determine the genotype. Results showed that 69 strains of third-generation cephalosporins-resistantShigellawere detected by drug sensitivity screening, accounting for 74.19% of ESBLsShigella. Drug resistance geneCTX-M(CTM-M-1 andCTM-M-9),OXAandTEMwere detected. The detection rate were 79.71%, 79.01% and 26.09% respectively.With noCTX-M-2 andSHV, DNA sequence alignment showedCTX-M-1 group were mainly ofCTX-M-15 type besides seven other types;CTX-M-9 group were mainly ofCTX-M-14 type besides six other types; 49 strains ofOXAand 18 strains of TEM were sequenced to be type 1 (OXA-1 andTEM-1 type). The 21Shigellastrains carrying more than two drug resistance genes accounts for 30.43%.Shigellain Ningbo has high third-generation cephalosporins-resistance rate and many kinds of ESBLs enzymes were detected. The mainstream enzyme type was CTX-M,meanwhile they also carried a variety of drug resistance genes, which could bring difficulties to disease prevention and control. The high carrying rate of OXA-1 type suggests that we should pay more attention. The detection rate of group B was higher than that of group D, including not only the phenotype resistance but also the drug-resistance genes; these findings will be useful in the study of the drug resistance prevalence ofShigella.
Shigella; third-generation cephalosporins-resistant; ESBLs; gene typing
Xu Xiao-min Email: xjl19990802@sina.com
10.3969/j.issn.1002-2694.2017.06.014
许小敏,Email:xjl19990802@sina.com
1.宁波市疾病预防控制中心,宁波 315010; 2.宁波市第二医院,宁波 315010
R378
A
1002-2694(2017)06-0542-06
2017-01-12 编辑:李友松
宁波市重大(重点)项目(No.2013C51014)和宁波市优秀中青年卫生技术人才项目(No.2011145)联合资助
Supported by the Major (Key) Project of Ningbo (No.2013C51014);and the health Technical Personnel Project of Excellent Young and Middle-aged in Ningbo(No.2011145)
