携Gelsolin单抗靶向超声造影剂的制备及体外靶向实验
2017-06-28秦颢诚张宇虹李洁明温晓娜唐建武冉海涛
秦颢诚,武 俊*,周 盟,张宇虹,宋 宇,李洁明,温晓娜,唐建武,冉海涛
(1.大连医科大学附属第二医院超声科,辽宁 大连 116027;2.大连医科大学病理教研室 辽宁省肿瘤转移重点实验室,辽宁 大连 116027;3.重庆医科大学附属第二医院超声科,重庆 400010)
携Gelsolin单抗靶向超声造影剂的制备及体外靶向实验
秦颢诚1,武 俊1*,周 盟1,张宇虹1,宋 宇1,李洁明1,温晓娜1,唐建武2,冉海涛3
(1.大连医科大学附属第二医院超声科,辽宁 大连 116027;2.大连医科大学病理教研室 辽宁省肿瘤转移重点实验室,辽宁 大连 116027;3.重庆医科大学附属第二医院超声科,重庆 400010)
目的 制备一种以肿瘤淋巴转移相关特异性膜抗原蛋白——凝溶胶蛋白(Gelsolin)为靶点的纳米级高分子造影剂,并观察其体外寻靶及显影能力。方法 通过改良的双乳化法制备高分子PLGA-COOH造影剂,以碳二亚胺法将造影剂与Gelsolin单抗连接,制备出GSN-PLGA靶向超声造影剂。检测该造影剂的一般性质,评估Gelsolin单抗与造影剂表面连接情况,评价其体外寻靶能力并进行体外显影实验。结果 GSN-PLGA靶向超声造影剂平均粒径为(575.67±4.71)nm,表面电位(-11.46±1.19)mV,造影剂表面GSN单抗结合率达96.93%。体外摄取实验显示细胞表面高表达Gelsolin抗体的小鼠腹水型肝癌高淋巴转移细胞株(Hca-F细胞)可较多摄取GSN-PLGA靶向造影剂。体外显像实验显示靶向超声造影剂体外显影效果较好。结论 GSN-PLGA靶向超声造影剂可与高表达Gelsolin的Hca-F细胞特异性结合,且体外显影效果较好。
超声检查;造影剂;靶向;聚乳酸羟基乙酸;凝溶胶蛋白
淋巴转移是上皮来源恶性肿瘤早期转移的主要方式,与肿瘤不良预后密切相关,早期发现和干预对延长患者生存期具有重要意义。目前常规影像学检查主要通过肿瘤的形态学特征和血流灌注特征进行诊断,不能确切反映肿瘤的生物学行为,在肿瘤转移的预警及早期识别中具有明显的局限性。既往研究[1]报道,当小鼠肝癌淋巴转移细胞株的转移能力降低时,凝溶胶蛋白(Gelsolin)主要位于细胞浆和细胞骨架中,而当细胞株淋巴转移能力增强时,其还出现在细胞膜上。高分子聚合物聚乳酸羟基乙酸(poly lactic-co-glycolic acid, PLGA)具有较好的生物兼容性及生物可降解性,目前已广泛应用于超声造影剂微泡的制备[2]。本研究选用PLGA作为成膜材料,制备携Gelsolin单抗的PLGA靶向高分子造影剂,并观察其体外寻靶及显影情况。
1 材料与方法
1.1非靶向超声造影剂的制备 采用改良的双乳化溶剂挥发法,精确称取100 mg羟基端乳酸-羟基乙酸共聚物(PLGA-COOH,聚合比50∶50),充分溶解于 2 ml二氯甲烷中(连续相),加入0.2 ml双蒸水(分散相),以VCY-500超声波处理器(上海研永超声设备有限公司)声振(声功率100 W,开4 s、关2 s,共120 s)获得乳白色的一次乳化液,向其内加入5 ml的4%聚乙烯醇(polyvinyl alcohol, PVA)溶液,继续声振(声功率50 W,开4 s、关2 s,共90 s)获得二次乳化液。而后加入20 ml的2%异丙醇溶液,于室温下以85-2型恒温磁力搅拌器(上海蓝凯仪器仪表有限公司)搅拌2~4 h,使二氯甲烷充分挥发,待微泡表面固化,以双蒸水反复离心洗涤(8 000转/分)后收集微泡,加入少量甘露醇并分散于1 ml双蒸水中,冷冻干燥24~48 h后充入氟碳气体,即获得PLGA非靶向超声造影剂冻干粉。
1.2靶向超声造影剂的制备 称取10 mg PLGA非靶向超声造影剂,分散溶解于适量pH=5.5的MES缓冲液(浓度0.1 mol/L)中,加入适量耦联活化剂EDC/NHS(EDC/NHS最终浓度比为2∶5),室温振荡孵育30 min,以双蒸水反复离心洗涤(8 000转/分),去除未反应的EDC及NHS,再以pH=8.0的MES缓冲液(浓度0.1 mol/L)溶解活化的PLGA造影剂,加入40 μl浓度为200 μg/ml的Gelsolin单抗(终浓度为1.5 mmol/L),室温下振荡孵育1~2 h,再以双蒸水反复离心洗涤(8 000转/分),收集微泡,冷冻干燥24~48 h后充入氟碳气体,即获得GSN-PLGA靶向超声造影剂冻干粉。
1.3靶向超声造影剂性质检测 称取20 mg的GSN-PLGA靶向超声造影剂冻干粉充分溶解于5 ml双蒸水中,取少量涂于载玻片上。采用Olympus BX51-P型偏光显微镜观察靶向造影剂的形态、分布。另取1 ml造影剂溶液,采用Malvern 3000 SSA激光粒径仪检测造影剂粒径及Zeta电位。
1.4免疫荧光法检测GSN-PLGA表面Gelsolin单抗的连接情况 称取100 mg PLGA-COOH和少量DiI荧光染料充分溶解于2 ml二氯甲烷中(避光条件下),获得DiI标记的靶向PLGA造影剂及非靶向PLGA造影剂。分别称取10 mg DiI标记GSN-PLGA靶向超声造影剂及PLGA非靶向超声造影剂冻干粉,并以5 ml双蒸水充分溶解,各加入20 μl异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的羊抗小鼠IgG抗体,于4℃振荡2 h,以双蒸水反复离心洗涤 (8 000转/分)后,于Zeiss LSM 510 META激光共聚焦显微镜下对比观察两种造影剂抗体连接情况,并以Beckman Coulter CytoFLEX S流式细胞仪检测抗体结合率。
1.5细胞培养 将小鼠腹水型肝癌高、低淋巴转移细胞株(Hca-F、Hca-P,由大连医科大学病理教研室提供)作为悬浮细胞,在含15%胎牛血清的1640完全培养液中于37℃、5% CO2、完全饱和湿度条件下培养,传代培养2~3代。取对数生长期的Hca-F及Hca-P细胞,离心洗涤(8 000转/分)后收集细胞,以1×106/孔的密度接种于6孔板内(共接种24个孔),以不含胎牛血清的1640完全培养液饥饿培养4 h后保存备用。
1.6靶向超声造影剂体外摄取实验 将上述准备的细胞分为4组,每组各6个孔:Hca-F细胞非靶向PLGA组,各孔内加入150 μl香豆素-6标记的非靶向造影剂;Hca-F细胞抗体封闭组,先向各孔内加入20 μl Gelsolin单抗封闭细胞表面蛋白表达,20 min后向每孔内加入150 μl香豆素-6标记的靶向造影剂;Hca-P细胞GSN-PLGA组和Hca-F细胞GSN-PLGA组,各孔内均加入150 μl香豆素-6标记的靶向造影剂。细胞吞噬造影剂后,激光共聚焦显微镜下观察细胞质可发出绿色荧光。将6孔板移入孵箱内继续孵育2 h,以磷酸缓冲盐溶液(phosphate buffer saline, PBS)离心洗涤 (8 000转/分)3次,每孔加入1 ml的4%多聚甲醛固定液固定15 min,再经PBS离心洗涤(8 000转/分)3次,以20 μl DAPI(4',6-diamidino-2-phenylindole,4', 6-二脒基-2-苯基吲哚)进行细胞核染色,可将细胞核染成蓝色,而后以PBS再次离心洗涤(8 000转/分)后收集细胞。取适量细胞于LSM 510 META激光共聚焦显微镜(ZEISS,德国)下观察各组细胞摄取造影剂情况。采用Beckman Coulter CytoFLEX S流式细胞仪测定Hca-F细胞及Hca-P细胞的荧光强度。

图1 偏光显微镜下观察,GSN-PLGA靶向超声造影剂微泡大小均一,分散均匀(×600) 图2 Malvern激光粒径仪检测GSN-PLGA靶向超声造影剂粒径为575.45 nm(A),表面电位为-11.51 mV(B)
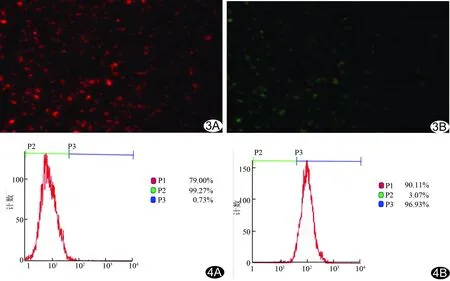
图3 与二抗结合后GSN-PLGA靶向超声造影剂荧光显微镜观察(×400) A.DiI标记后的造影剂发出红色荧光; B.FITC标记的二抗与造影剂结合后发出绿色荧光 图4 流式细胞仪检测单抗连接率 A.PLGA非靶向超声造影剂; B.GSN-PLGA靶向超声造影剂
1.7体外显影实验 称取20 mg的GSN-PLGA靶向超声造影剂冻干粉,以20 ml双蒸水重悬稀释,调整浓度至1 mg/ml、0.5 mg/ml和0.25 mg/ml,各取2 ml置于琼脂糖凝胶孔内,另取2 ml脱气水置于凝胶孔内作为对照。采用百盛MyLab Twice超声诊断仪进行实时成像,线阵探头,频率5~12 MHz,机械指数0.06。

2 结果
2.1靶向高分子造影剂的一般性质 GSN-PLGA靶向超声造影剂外观为白色粉末状,水溶性好,显微镜下观察造影剂复溶后大小均一,形态规则,分散均匀(图1),平均粒径为(575.67±4.71)nm(图2A),造影剂表面电位为(-11.46±1.19)mV(图2B)。
2.2靶向造影剂表面Gelsolin单抗连接情况 DiI标记的GSN-PLGA靶向超声造影剂表面Gelsolin一抗与FITC标记的羊抗小鼠二抗连接后,DiI发出红色荧光(图3A),结合二抗的微泡发出绿色荧光(图3B)。而DiI标记的非靶向PLGA超声造影剂仅可见红色荧光,未见绿色荧光。流式细胞仪测得PLGA非靶向超声造影剂荧光抗体(单抗)结合率为0.73%(图4A),GSN-PLGA靶向超声造影剂荧光抗体(单抗)结合率为96.93%(图4B)。
2.3靶向超声造影剂体外寻靶能力 Hca-F细胞非靶向PLGA组、Hca-F细胞抗体封闭组、Hca-P细胞GSN-PLGA组及Hca-F细胞GSN-PLGA组的平均荧光强度分别为(108.39±1.29)、(123.31±1.25)、(140.15±0.98)、(189.09±1.14),总体差异有统计学意义(F=6741.287,P<0.001)。两两比较,Hca-F细胞GSN-PLGA组荧光强度高于其他3组(P均<0.05);Hca-F细胞抗体封闭组及Hca-P细胞GSN-PLGA组的荧光强度均高于Hca-F细胞非靶向PLGA组,差异有统计学意义(P均<0.05)。体外摄取实验激光共聚焦显微镜下表现见图5,Hca-F细胞非靶向PLGA组及Hca-F细胞抗体封闭组细胞仅摄取极少量的造影剂,表现为微弱的绿色荧光。细胞表面高表达Gelsolin蛋白的Hca-F细胞可摄取更多GSN-PLGA靶向造影剂,其绿色荧光较细胞表面低表达Gelsolin蛋白的Hca-P细胞更强(图5G、5I),即该靶向造影剂针对Gelsolin靶点的靶向性较强。

图5 激光共聚焦显微镜图(×400) A~C.Hca-F细胞非靶向PLGA组; D~F.Hca-F细胞抗体封闭组; G~I.Hca-P细胞GSN-PLGA组; J~L.Hca-F细胞GSN-PLGA组 (图A、D、G、J为细胞摄取造影剂后细胞质发出绿色荧光;图B、E、H、K为经DAPI染色的细胞核发出蓝色荧光;图C、F、I、L为细胞质和细胞核合并图像)
2.4体外显影效果 GSN-PLGA靶向超声造影剂体

图6 不同浓度下GSN-PLGA靶向超声造影剂及脱气水体外显影情况 A.1 mg/ml; B.0.5 mg/ml; C.0.25 mg/ml; D.脱气水
外显影效果见图6,造影剂回声均匀细腻,后方回声无衰减,且随造影剂浓度增加造影效果更优。
3 讨论
超声造影在肿瘤的诊断和鉴别诊断方面发挥着重要作用。但非靶向的超声造影剂属于血池显像,不能透过血管内皮间隙渗透至肿瘤组织内,因此不能获得肿瘤的特异性成像,在对良恶性肿瘤的鉴别方面具有局限性。研究[3]报道,肿瘤血管内皮间隙可允许直径<700 nm的微粒穿过。因此,通过改进超声造影剂的成膜材料,制备纳米级超声造影剂,使其直径<700 nm,便可穿越肿瘤组织血管内皮间隙到达肿瘤靶区。如将纳米级超声造影剂与肿瘤相关抗原单克隆抗体或特异性配体连接,可在体内识别并结合肿瘤组织表面的特异性分子,实现造影剂在肿瘤组织中的主动靶向富集,从而提高超声对肿瘤早期诊断的特异性。
自超声造影剂问世以来,微泡成膜材料和填充气体不断改进,超声造影剂的体积逐渐减小,显影效果逐步提高。随着近年高分子化学的快速发展,应用高分子材料与空气或其他难溶性气体制备出的微泡超声造影剂具有微泡均匀度好,体内稳定性高,体内外存留时间长、抗压力性能好,声衰减微弱等特点[4-5]。PLGA是一种新型的成膜材料,具有生物兼容性及可降解性,用其制备的纳米微泡不仅可包载化疗药物,还能够与表面带有氨基的单克隆抗体、配体、各种特异性短肽等活性物质通过共价键耦联在一起,且性质稳定,是理想的超声造影剂材料[6-8],本实验通过改良双乳化法制备的纳米级超声造影剂微泡大小较均一,形态规则,分散均匀,体外显影效果亦较好。
淋巴转移是肿瘤致死的主要原因之一,及早诊断并及时治疗有助于延长肿患者的生存期并提高生存质量。既往肿瘤超声分子成像和靶向治疗研究主要是针对肿瘤新生血管及肿瘤细胞的成像和抑制,目前血管外分子靶点的特异性成像已成为研究热点。有研究[9]报道,Gelsolin是一种重要的骨架调节蛋白,在Ca2+依赖下调节细胞骨架actin的聚合和解聚,进而影响细胞的形态和运动,在细胞的黏附、侵袭和迁移过程中发挥重要作用。Gelsolin的高表达在部分肿瘤中可增加肿瘤细胞的运动能力,进而促进肿瘤的侵袭和转移。在细胞伪足形成的头端,Gelsolin能够通过支架蛋白RACK1与整合素αvβ3结合并形成黏着斑,促进细胞局部的形变;在细胞迁移的尾端,Gelsolin能够通过支架蛋白RACK1实现黏着斑的解聚,使细胞间的黏附性降低,从而促进细胞的迁移[10-11]。研究[12]报道,通过shRNA干扰下调Gelsolin在具高淋巴道转移力的Hca-F细胞中的表达,不仅可明显降低Hca-F细胞体外迁移和侵袭能力,还可降低体内淋巴结黏附能力,表明Gelsolin基因有促进淋巴道转移的作用。Abbeele等[13]在对Hela、MDA-MB231和PC-3细胞的研究中也发现,干扰下调Gelsolin蛋白表达后肿瘤细胞的侵袭及迁移能力也随之降低。本研究通过碳二亚胺法将Gelsolin单抗成功耦联于PLGA纳米微泡,制备携Gelsolin单抗的高分子造影剂,此方法是利用PLGA-COOH中羧基与Gelsolin单抗中的氨基进行共价结合[14],连接不易断裂。本研究体外寻靶实验结果表明GSN-PLGA靶向超声造影剂可与细胞表面高表达Gelsolin的小鼠肝癌高淋巴转移细胞进行特异性结合。
综上所述,本研究制备的GSN-PLGA靶向超声造影剂可与高表达Gelsolin的Hca-F细胞特异性结合,且体外显影效果亦较好。相信该靶向超声造影剂今后将有望为肿瘤淋巴转移的分子显像提供新的助力,从而进一步实现肿瘤淋巴道转移的早期预警。
[1] Qazi AS, Sun M, Huang Y, et al. Subcellular proteomics: Determination of specific location and expression levels of lymphatic metastasis associated proteins in hepat-ocellular carcinoma by subcellular fractionation. Biomed Pharmacother, 2011,65(6):407-416.
[2] Wheatley MA, Forsberg F, Oum K, et al. Comparison of in vitro and in vivo acoustic response of a novel 50:50 PLGA contrast agent. Ultrasonics, 2006,44(4):360-367.
[3] Hughes M, Marsh J, Lanza G, et al. Improved signal processing to detect cancer by ultrasonic molecular imaging of targeted nanoparticles. J Acoust Soc Am, 2011,129(6):3756-3767.
[4] Wilson KE, Wang TY, Willmann JK. Acoustic and photoacoustic molecular imaging of cancer. J Nucl Med, 2013,54(11):1851-1854.
[5] Sciallero C, Grishenkov D, Kothapalli SV, et al. Acoustic characterization and contrast imaging of microbubbles encapsulated by polymeric shells coated or filled with magnetic nanoparticles. J Acoust Soc Am, 2013,134(5):3918-3930.
[6] Mahapatro A, Singh DK. Biodegradable nanoparticles are excellent vehicle for site directed in-vivo delivery of drugs and vaccines. J Nanobiotechnology, 2011,9:55.
[7] Niu C, Wang Z, Lu G, et al. Doxorubicin loaded superparamagnetic PLGA-iron oxide multifunctional microbubbles for dual-mode US/MR imaging and therapy of metastasis in lymph nodes. Biomaterials, 2013,34(9):2307-2317.
[8] Figueiredo M, Esenaliev R. PLGA nanoparticles for ultrasound-mediated gene delivery to solid tumors. J Drug Deliv, 2012,2012:767839.
[9] Silacci P, Mazzolai L, Gauci C, et al. Gelsolin superfamily prote-ins: Key regulators of cellular functions. Cell Mol Life Sci, 2004,61(19-20):2614-2623.
[10] Serrels B, Sandilands E, Serrels A, et al. A complex between FAK, RACK1, and PDE4D5 controls spreading initiation and cancer cell polarity. Curr Biol, 2010,20(12):1086-1092.
[11] Chan MW, Arora PD, Bozavikov P, et al. FAK, PIP5KIgamma and gelsolin cooperatively mediate force-induced expression of alpha-smooth muscle actin. J Cell Sci, 2009,122(Pt 15):2769-2781.
[12] 王绍清,孙明忠,刘淑清,等.Gelsolin表达下调降低鼠源肝癌细胞的侵袭能力.中国肿瘤临床,2009,36(16):948-952.
[13] Van den Abbeele A, De Corte V, Van Impe K, et al. Downregulation of gelsolin family proteins counteracts cancer cell invasion in vitro. Cancer Lett, 2007,255(1):57-70.
[14] 王星,冉海涛,王志刚,等. 携RGD肽靶向高分子造影剂的制备及体外靶向实验.中国医学影像技术,2011,27(12):2403-2406.
Prepartation of Gelsolin-targeted ultrasound contrast agent and experiment in vitro
QINHaocheng1,WUJun1*,ZHOUMeng1,ZHANGYuhong1,SONGYu1,LIJieming1,WENXiaona1,TANGJianwu2,RANHaitao3
(1.DepartmentofUltrasound,theSecondAffiliatedHospitalofDalianMedicalUniversity,Dalian116027,China;2.DepartmentofPathology,DalianMedicalUniversity,KeyLaboratoryforTumorMetastasisofLiaoningProvince,Dalian116027,China; 3.DepartmentofUltrasound,theSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China)
Objective To prepare a kind of Gelsolin-targeted ultrasound contrast agent (GSN-PLGA) and to explore its targeting and imaging effection in vitro. Methods The high molecular PLGA-COOH ultrasound contrast agents were prepared by a modified double emulsion technique and then conjugated with Gelsolin monoclonal antibody by carbodiimide technique. The physical property of contrast agent was determined. And the connectivity condition of ultrasound contrast agent with Gelsolin monoclonal antibody was estimated. The targeting ability and the effect of enhancing ultrasound imaging in vitro were explored. Results The average diameter of GSN-PLGA was (575.67±4.71)nm. The potential was (-11.46±1.19) mV. And the binding rate of Gelsolin monoclonal antibody was 96.93%. In vitro experimentshowed more GSN-PLGA could be intaked by Hca-F cells and the ultrasound imaging cloud be enhanced greatly. Conclusion The GSN-PLGA nanoparticle can bind to Hca-F cells specifically and can enhance the ultrasound imaging greatly.
Ultrasonography; Contrast media; Target; Poly lactic-co-glycolic acid; Gelsolin
国家自然科学基金(81501476)、辽宁省自然科学基金(214023001)。
秦颢诚(1990—),男,江苏连云港人,在读硕士。研究方向:肿瘤分子显像与靶向治疗。E-mail: 351518028@qq.com
武俊,大连医科大学附属第二医院超声科,116027。E-mail: wujun108@sina.com
2016-09-03
2017-02-25
R445.1; R-332
A
1003-3289(2017)06-0826-06
10.13929/j.1003-3289.201609013
