重金属Cr(VI)、Pb及Cu胁迫对双齿围沙蚕体腔细胞的DNA损伤
2017-06-27张来军陈永敢杭瑜瑜
张来军,陈永敢,杭瑜瑜
海南热带海洋学院生命科学与生态学院,三亚 572022
重金属Cr(VI)、Pb及Cu胁迫对双齿围沙蚕体腔细胞的DNA损伤
张来军*,陈永敢,杭瑜瑜
海南热带海洋学院生命科学与生态学院,三亚 572022
为探讨重金属Cr(VI)、Pb以及Cu对沙蚕体腔细胞DNA的毒性效应,以双齿围沙蚕为受试动物,重金属按不同剂量水平,Cr(VI):10、100和200 mg·L-1,Pb:5、50和100 mg·L-1,Cu:1、10和20 mg·L-1,分别胁迫沙蚕24 h,以不加任何重金属离子的海水为对照,采用单细胞凝胶电泳技术,检测其体腔细胞DNA损伤程度。结果表明,与空白对照组相比,3种重金属离子的各浓度组都能引起沙蚕体腔细胞DNA损伤,且3种重金属胁迫浓度与细胞DNA损伤程度之间存在显著的剂量-效应关系。双齿围沙蚕可以作为单细胞凝胶电泳的实验材料用于重金属所致环境污染的生物监测指示生物。
重金属;双齿围沙蚕;遗传毒性;DNA损伤;体腔细胞;彗星实验
重金属污染,是指由重金属或其化合物造成的环境污染。随着我国沿海经济的高速发展和城市化进程的加剧,大量含重金属等有毒物质的废水排放,使河口生态环境遭到严重破坏。重金属污染物不易降解,能迅速由水相转入固相(悬浮物和沉积物),进入沉积物中蓄积,使沉积物成为重金属等化学物质的主要存储库。这些污染物或因环境变化再释放到水体中,对水体造成“二次污染”[1]。海洋生物通过摄食、呼吸或其体表与水体的渗透交换作用,使水体中重金属进入其体内,导致其功能蛋白质、DNA等结构受到破坏和失活,使代谢、遗传等功能遭到破坏。为了能准确、及时、全面地反映海洋环境质量现状及发展趋势,需要随时进行环境检测,传统的环境检测方法,物理监测和化学监测,能对环境中的化学物质精确定量,却不能反映其对生物体的效应。因此近年来,生物监测的应用越来越广泛,逐渐成为环境监测的重要组成部分。
单细胞凝胶电泳(single cell gel eletrophoresis, SCGE),或彗星电泳(comet assay),是用于各种动物细胞DNA损伤检测的一种较为成熟的技术,具有简便、快速、灵敏等特点,广泛应用于毒理学、生物学、医学、环境生物监测等领域。环境污染中的生物、物理、化学因素都能导致细胞DNA损伤,引起基因突变和细胞癌变。所以判断细胞DNA是否出现损伤情况在环境监测方面尤为重要。SCGE能够检测不同生物不同细胞的不同类型的遗传毒理损伤情况。有研究表明,SCGE与其他常用的遗传生态毒理学生物标志物相比,在对水生生物遗传毒理检测中更具敏感性[2]。目前SCGE已被广泛用于鱼和贻贝细胞的实验室标准检测中[3-5]。
沙蚕,又名海虫,海蛆,属环节动物门多毛纲动物。栖息于水-陆交错带特别是沉积物中,在海洋生态系统食物链物质传递中担负着重要功能,是最易受到环境有毒有害物质伤害的生物之一。国内外已有一些研究报道在环境污染物作用下,沙蚕体内抗氧化防御系统变化,也有用其乙酰胆碱酯酶活性评价污染物的毒性效应[6-9],但以沙蚕为材料应用SCGE研究DNA损伤指数并用来评价环境污染情况的报道并不多见[10]。本文采用SCGE技术,以双齿围沙蚕(Perinereis aibuhitensis)为试验动物,研究重金属胁迫对沙蚕体腔细胞DNA损伤的影响,探讨SCGE技术在沙蚕中的应用,旨在找出除贻贝、牡蛎等软体动物和少数鱼类之外适宜于海洋环境污染生物监测的指示动物,也进一步阐明Cr(VI)、Cu与Pb的毒理学作用机制,为海洋水环境污染评价等提供更多的参考。
1 材料与方法 (Materials and methods)
1.1 实验材料
实验用双齿围沙蚕购买于三亚五洲渔具店,将购买的沙蚕放入培养皿中,清洗体表,进行初步筛选,选择大小相似的个体,放入塑料箱中,加入灭菌的海沙和天然海水暂养3 d。暂养期间,每天更换一次海水,水温为25 ℃,盐度为31~32,pH值为8.5,3 d后再用于重金属胁迫实验。
1.2 实验方法
1.2.1 重金属盐溶液的配制和沙蚕暴露实验
参考国家渔业水质标准GB11607—89,铬、铅和铜3种离子浓度分别小于等于0.1、0.05和0.01 mg·L-1,3种重金属盐选用重铬酸钾(K2Cr2O7)、醋酸铅(C4H6O4Pb·3H2O)、硫酸铜(CuSO4·5H2O),以灭菌海水配制成低、中和高3个浓度组,浓度分别为标准浓度的100倍、1 000倍和2 000倍,胁迫浓度则分别为Cr(VI):10、100和200 mg·L-1,Pb:5、50和100 mg·L-1,Cu:1、10和20 mg·L-1溶液。
选择体表健康无伤痕的沙蚕,称重,分为4组,平均体质量为(3.29±0.46) g,将沙蚕1只/瓶置于150 mL三角瓶中。瓶内加入5 mL不同浓度梯度Cr(VI)的海水,室温25 ℃下进行暴露实验,每24 h更换相同Cr(VI)浓度的海水,并清理排出的废物,同一浓度梯度胁迫沙蚕5只。空白对照组不加任何重金属离子。同样方法处理Pb、Cu胁迫沙蚕,24 h后用于彗星电泳。
1.2.2 体腔细胞的提取
根据Eyambe等的方法[11]提取体腔细胞,稍有改动。胁迫结束后,将不同浓度组的沙蚕每组随机选取2条,剪取其身体中后部约1 cm长的躯干,移入2 mL离心管中,加入4 ℃体腔细胞提取液(简称EM,无水乙醇与生理盐水(质量分数为0.7%)的体积比为5∶95,2.5 mg·mL-1Na2EDTA,10 mg·mL-1愈疮木酚甘油醚,pH 7.3)400 μL,1 min后。再加入4 ℃磷酸缓冲液(简称PBS,组成为NaCl 8 g,KCl 0.2 g,Na2HPO41.44 g,KH2PO40.24 g,定容至1 000 mL,pH 7.4)1.5 mL,弃沙蚕,得到体腔细胞。800~1 000 r·min-1,离心3 min,弃上清,两管合为一管,重新加入1 mL PBS。显微镜下观察细胞活力,调整细胞密度,准备电泳。
1.3 SCGE检测
按Zhang等[12]的方法并加以改良进行彗星电泳。将洁净的载玻片在质量分数为0.6%的常熔点琼脂糖中浸没后取出,置37 ℃烘箱烘干,以备电泳。将细胞悬液和质量分数为1%的低熔点胶按1∶1体积混合均匀,铺在预处理后的载玻片上,4 ℃放置5 min,使琼脂糖完全固化。将铺好胶的载玻片放入新鲜配制的裂解液(2.5 mol·L-1NaCl、0.1 mol·L-1Na2EDTA、0.01 mol·L-1Tris-HCl、质量分数为1%的肌氨酸钠,pH 10,体积分数为1%的Triton X-100,体积分数为10%的二甲基亚砜(DMSO))中,裂解90 min。蒸馏水冲洗后,将载玻片放入电泳缓冲液(0.3 mol·L-1NaOH、1 mmol·L-1Na2EDTA,pH>13)中,变性解旋20 min,电泳20 min (26 V、300 mA)。用400 mmol·L-1Tris-HCl缓冲液(pH 7.5)中和3次,每次5 min,从裂解到中和的所有过程需在4 ℃下进行。将载玻片置于溴化乙锭(20 μg·mL-1)中染色20 min后,荧光显微镜下观察拍照。
1.4 数据处理
每个处理随机取约50个细胞,用CASP软件进行分析,可得到尾部DNA含量(TDNA%)、尾矩(Tail Moment, TM)和Olive尾矩(Olive Tail Moment, OTM)等诸多参数。本实验选用TDNA%作为衡量细胞DNA损伤程度的评价指标。
用SPSS13.0对数据进行单因素方差分析(ANOVA),分析比较各浓度组之间及其与对照组之间TDNA%差异的显著性,实验重复3次。
2 结果(Results)
2.1 沙蚕的体腔细胞
将细胞均匀分散在PBS中,经吹打、稀释后,在显微镜下直接观察(×200),见(图1),可以看到沙蚕体腔细胞呈均匀的圆形,数量多,纯度高,杂质少。再将细胞用甲醇固定,瑞氏染液染色后(图2),发现黄细胞数量最多,其细胞个体大,但细胞核较小,这类细胞构成沙蚕细胞免疫的重要组成部分。少量嗜中性细胞,有较大核质比(图中未显示),以及个体较小但数量多的嗜碱性细胞。

图1 双齿围沙蚕的体腔细胞(×200)Fig. 1 The coelomocytes of Perinereis aibuhitensis (×200)

图2 双齿围沙蚕体腔细胞中的组织黄细胞(×200)Fig. 2 The chlorogogen cells of Perinereis aibuhitensis coelomocytes (×200)
2.2 重金属对沙蚕体腔细胞彗星电泳TDNA%的影响
图3为不同浓度Cu胁迫沙蚕24 h后,几种典型的体腔细胞彗星电泳图像。

图3 暴露于不同浓度Cu 24 h后沙蚕体腔细胞的彗星电泳图(×400)注:A—对照组;B—1 mg·L-1组;C—10 mg·L-1组;D—20 mg·L-1组。Fig. 3 Comet assay of Perinereis aibuhitensis coelomocytes after 24 h-exposure to different concentrations of Cu (×400)Note: A-control; B-1 mg·L-1; C-10 mg·L-1; D-20 mg·L-1.
用CASP软件分析各个处理组拍摄的彗星图像,所得到的TDNA%与3种重金属及其浓度之间的关系如图4、图5、图6所示。3种浓度梯度Cr(VI)离子胁迫后得到的TDNA%值均大于对照组值,但是仅浓度为200 mg·L-1的高浓度组与对照组比较达到显著性水平(P<0.05)(图4),且高浓度组相比10、100 mg·L-1低、中浓度组也有显著差异。Pb各处理组TDNA%值均显著大于对照组(P<0.05),且100 mg·L-1高浓度组TDNA%相比对照组差异显著(P<0.01),与5、50 mg·L-1低、中浓度组相比也有显著差异(P<0.05)(图5)。3种浓度Cu胁迫所得到的TDNA%显著高于对照组(P<0.05),10 mg·L-1和20 mg·L-1的中浓度组和高浓度组的TDNA%相比对照组差异显著性水平更高(P<0.01),相比1 mg·L-1的低浓度组也具有显著差异(P<0.05)(图6)。Cr(VI)、Pb、Cu这3种重金属离子胁迫沙蚕,经彗星电泳后所得到的TDNA%值随胁迫浓度的升高而升高,胁迫浓度与TDNA%之间存在着明显的剂量-效应关系。
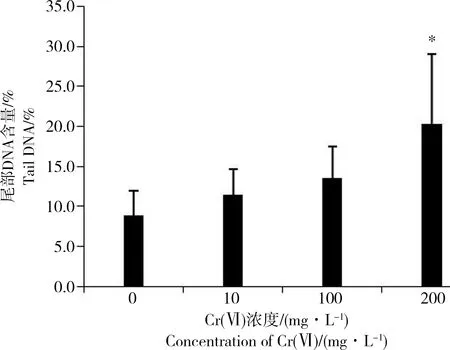
图4 Cr(VI)对双齿围沙蚕体腔细胞彗尾DNA百分含量的影响注:与对照组比,*差异显著,0.01 图5 Pb对双齿围沙蚕体腔细胞彗尾DNA百分含量的影响注:与对照组比,*差异显著,0.01 上述结果表明,重金属Cr(VI)、Pb、Cu污染下,沙蚕体腔细胞DNA出现了损伤。损伤的程度与重金属的浓度呈正相关。 图6 Cu对双齿围沙蚕体腔细胞彗尾DNA百分含量的影响注:与对照组比,*差异显著,0.01 本文采用的实验材料双齿围沙蚕,广泛分布于我国沿海潮间带和河口区,是最大高潮线附近底栖生物中的优势种[13]。适宜养殖,在实验室条件下饲养容易,饲养的条件及设备都极为简单。其体腔中充满体腔液,体腔液中的细胞均不同程度地与免疫过程有关,或其代谢作用和分泌作用与体液免疫相关[14],体腔中的黄细胞吸收血液中的代谢废物后,溶解或整个细胞脱离细胞群,落入体腔液中,经由肾管排出体外。沙蚕体腔细胞的提取方法操作简单,得到的细胞数量多,存活率高,能够满足SCGE实验的需要。这为以沙蚕为材料应用SCGE技术进行海洋环境污染生物监测创造了理想条件。 选择3种重金属离子Cr(VI)、Pb、Cu作用于沙蚕,提取其体腔细胞,利用SCGE检测重金属对双齿围沙蚕的遗传毒性。在一定的浓度范围内,随3种离子胁迫浓度的提高,TDNA%值均分别随之增加,即离子的浓度与沙蚕体腔细胞DNA的损伤程度之间存在着明显的剂量-效应关系。SCGE技术灵敏地检测出了重金属对沙蚕体腔细胞的损伤程度,也在一定程度上反映出水体或沉积物中重金属的污染情况。由此揭示了沙蚕对重金属所致的毒性效应极为敏感,可以将沙蚕应用于SCGE技术,对重金属污染物进行遗传毒理分析。 重金属是近岸海域最主要的污染物之一,由于其在环境中不易代谢、分解、转变,且易于沉降,所以沉积物被认为是海洋环境中重金属最终的蓄积地。唐博等[1]对珠江口和北部湾2个海域海底沉积物的Zn、Pb、Cu、Cr这4种重金属元素污染程度和生态风险进行了评价,结果表明,Cu在2个区域均达严重污染程度,Zn、Pb、Cr在珠江口沿岸均达到中等污染程度,在北部湾的部分区域达到中等污染程度。目前常采用底栖生活的贝类和游泳生物中的鱼类做为监测生物进行海洋生物监测。将这2类海洋生物与SCGE技术结合对海洋环境中的各种污染物,如有机物[4-5,15]、重金属[16-17]和农药[18-20]等进行遗传毒理学研究已有大量报道。Nagarani等[21]以氯化汞胁迫Therapon jarbua,利用SCGE技术检测了腮、肾及血细胞的DNA损伤,揭示了同种生物不同细胞类型对重金属胁迫的敏感性不同。Al-Subiai等[22]以Mytilus edulis L.为材料,以不同浓度的铜胁迫,用SCGE评价其遗传损伤的同时,结合组织病理学检查,用多种生物标志物的方法综合评价重金属铜对这种生物的影响,认为这种综合评估方法适宜于评估污染物的短期及长期毒性效应。将沙蚕作为SCGE实验材料的报道相对较少,Lewis和Galloway[10]用甲磺酸甲酯(MMS)胁迫3种沙蚕Arenicola marina, Nereis diversicolor和Nereis virens,用SCGE检测不同种及不同的细胞类型对污染物的敏感性差异,后来又用纳米二氧化钛胁迫沙蚕,并认为高浓度的纳米二氧化钛引起了体腔细胞及其DNA的损伤[23]。Catalano等[24]用PAHs胁迫一种沙蚕Hediste diversicolor,检测了过氧化氢酶、谷胱甘肽还原酶,并进行了SCGE和微核实验等,认为这种沙蚕是理想的有机污染的生物指示物。我国沙蚕常被用做抗氧化防御系统、乙酰胆碱酯酶等检测的研究材料,用其DNA损伤参数评价环境毒物遗传毒性的报道极少。随着海洋环境污染监测越来越受到重视,双齿围沙蚕在近岸海域污染的生物监测和环境风险评估中将会发挥重要的作用。 致谢:感谢海南医学院实验中心的大力支持。 [1] 唐博, 龙江平, 金路, 等. 珠江口和北部湾附近海域沉积物重金属生态风险比较[J]. 热带海洋学报, 2015, 34(3): 75-81 Tang B, Long J P, Jin L, et al. The contrast of heavy metals’ ecological risk in marine sediments between the Beibu Gulf and the Pearl River Delta [J]. Journal of Tropical Oceanography, 2015, 34(3): 75-81 (in Chinese) [2] 蔡继翔, 刘烨, 梁明才, 等. 单细胞凝胶电泳应用研究进展[J]. 生物信息学, 2016, 14(2): 95-99 Cai J X, Liu Y, Liang M C, et al. Research progress about the application of single cell gel electrophoresis [J]. Chinese Journal of Bioinformatics, 2016, 14(2): 95-99 (in Chinese) [3] 卞方杰, 邢美燕, 杨健, 等. 彗星实验技术在水生与土壤环境中的毒理学应用[J]. 生态毒理学报, 2015, 10(3): 63-70 Bian F J, Xing M Y, Yang J, et al. The toxicologic applications of the comet assay in the aquatic and soil environment [J]. Asian Journal of Ecotoxicology, 2015, 10(3): 63-70 (in Chinese) [4] Woo S, Kim S, Yum S, et al. Comet assay for the detection of genotoxicity in blood cells of flounder (Paralichthys olivaceus) exposed to sediments and polycyclic aromatic hydrocarbons [J]. Marine Pollution Bulletin, 2006, 52(12): 1768-1775 [5] 王晓艳, 蒋凤华, 冯丽娟, 等. 石油烃对栉孔扇贝血淋巴细胞DNA损伤的初步研究[J]. 生态毒理学报, 2012, 7(3): 305-311 Wang X Y, Jiang F H, Feng L J, et al. Effect of petroleum hydrocarbons on DNA damage of hemolymph cells inscallop Chlamys farreri: A preliminary research [J]. Asian Journal of Ecotoxicology, 2012, 7(3): 305-311 (in Chinese) [6] Solé M, Kopecka-Pilarczyk J, Blasco J. Pollution biomarkers in two estuarine invertebrates, Nereis diversicolor and Scrobicularia plana, from a Marsh ecosystem in SW Spain [J]. Environment International, 2009, 35(3): 523-531 [7] Pérez E, Blasco J, Solé M. Biomarker responses to pollution in two invertebrate species: Scrobicularia plana and Nereis diversicolor from the Cádiz bay (SW Spain) [J]. Marine Environmental Research, 2004, 58(2-5): 275-279 [8] 孙福红, 周启星, 张倩如. 石油烃、Cu2+对沙蚕的毒性效应及对其抗氧化酶系统的影响[J]. 环境科学, 2006, 27(7): 1415-1419 Sun F H, Zhou Q X, Zhang Q R. Toxic effect of petroleum hydrocarbons and copper on polychaete Nereis diversicolor and on its antioxidant enzyme systems [J]. Environmental Science, 2006, 27(7): 1415-1419 (in Chinese) [9] 王晶, 周启星, 张倩茹, 等. 沙蚕暴露于石油烃、Cu2+和Cd2+毒性效应及乙酰胆碱酯酶活性的响应[J]. 环境科学, 2007, 28(8): 1796-1801 Wang J, Zhou Q X, Zhang Q R, et al. Toxic effects petroleum hydrocarbons, copper and cadmium on polychaete Perinereis aibuhitensis Grube and on its responses in acetycholinesterase activity [J]. Environmental Science, 2007, 28(8): 1796-1801 (in Chinese) [10] Lewis C, Galloway T. Genotoxic damage in polychaetes: A study of species and cell-type sensitivities [J]. Mutation Research, 2008, 654(1): 69-75 [11] Eyambe G S, Goven A J, Fitzpatrick L C, et al. A non-invasive technique for sequential collection of earthworm (Lumbricus terrestris) leukocytes during subchronic immunotoxicity studies [J]. Laboratory Animals, 1991, 25: 61-67 [12] Zhang L J, Jia J F, Hao J G, et al. A modified protocol for the comet assay allowing the processing of multiple samples [J]. Mutation Research, 2011, 721: 153-156 [13] 田雨露. 双齿围沙蚕(Perinereis aibuhitensis)的形态学研究及其对Pb2+的毒性响应[D]. 青岛: 中国海洋大学, 2014: 1-8 Tian Y L. Morphological study and toxic effects of Pb2+on polychaete Perinereis aibuhitensis [D]. Qingdao: Ocean University of China, 2014: 1-8 (in Chinese) [14] 朱江. 镉-菲复合污染对安德爱胜蚓(Eisenia andrei)和白线蚓(Fridericia bulbosa)的生态毒理效应研究[D]. 上海: 上海交通大学, 2008: 92-97 Zhu J. Study on ecotoxicological effects of combined pollution between cadmium and phenanthrene on earthworm (Eisenia andrei) and enchytraeid (Fridericia bulbosa) in soil [D]. Shanghai: Shanghai Jiao Tong University, 2008: 92-97 (in Chinese) [16] Bhagat J, Ingole B S. Genotoxic potency of mercuric chloride in gill cells of marine gastropod Planaxis sulcatus using comet assay [J]. Environmental Science and Pollution Research International, 2015, 22(14): 10758-10768 [17] Dallas L J, Cheung V V, Fisher A S, et al. Relative sensitivity of two marine bivalves for detection of genotoxic and cytotoxic effects: A field assessment in the Tamar Estuary, South West England [J]. Environmental Monitoring and Assessment, 2013, 185(4): 3397-3412 [18] Devi V J, Nagarani N, Babu M Y, et al. A study of proteotoxicity and genotoxicity induced by the pesticide and fungicide on marine invertebrate (Donax faba) [J]. Chemosphere, 2013, 90(3): 1158-1166 [19] Devi V J, Nagarani N, Babu M Y, et al. Genotoxic effects of profenofos on the marine fish, Therapon jarbua [J]. Toxicology Mechanisms and Methods, 2012, 22(2): 111-117 [20] Barranger A, Heude-Berthelin C, Rouxel J, et al. Parental exposure to the herbicide diuron results in oxidative DNA damage to germinal cells of the Pacific oyster Crassostrea gigas [J]. Comparative Biochemistry and Physiology C: Toxicology & Pharmacology, 2016, 180: 23-30 [21] Nagarani N, Devi V J, Kumaraguru A K. Identification of DNA damage in marine fish Therapon jarbua by comet assay technique [J]. Journal of Environmental Biology, 2012, 33(4): 699-703 [22] Al-Subiai S N, Moody A J, Mustafa S A, et al. A multiple biomarker approach to investigate the effects of copper on the marine bivalve mollusk, Mytilus edulis [J]. Ecotoxicology and Environmental Safety, 2011, 74(7): 1913-1920 [23] Galloway T, Lewis C, Dolciotti I, et al. Sublethal toxicity of nano-titanium dioxide and carbon nanotubes in a sediment dwelling marine polychaete [J]. Environmental Pollution, 2010, 158(5): 1748-1755 [24] Catalano B, Moltedo G, Martuccio G. Can Hediste diversicolor (Nereidae, Polychaete) be considered a good candidate in evaluating PAH contamination? A multimarker approach [J]. Chemosphere, 2012, 86(9): 875-882 ◆ DNA Damage of Coelomocyte inPerinereisaibuhitensisInduced by Chromium(VI), Lead and Copper Zhang Laijun*, Chen Yonggan, Hang Yuyu College of Life Sciences and Ecology, Tropical Ocean College of Hainan, Sanya 572022, China 8 April 2016 accepted 5 September 2016 To investigate the toxic effect of heavy metal on marine organisms, Perinereis aibuhitensis were exposed to heavy metal Cr(VI), Pb and Cu at three different concentrations, Cr(VI): 10, 100 and 200 mg·L-1, Pb: 5, 50 and 100 mg·L-1, Cu: 1, 10 and 20 mg·L-1for 24 h. The DNA damage of coelomocyte cells in Perinereis aibuhitensis was detected by single cell gel electrophoresis (comet assay). The result showed that every concentration group of three kinds of heavy metals can cause the DNA damage, compared with the blank group. There was a significant relationship between the concentration of heavy metal and the degree of DNA damage in cells. Perinereis aibuhitensis can be used as experimental material for single cell gel electrophoresis experiments, and then it can be used as indicator for monitoring marine environmental pollution caused by heavy metals using the comet assay method. heavy metal; Perinereis aibuhitensis; genotoxicity; DNA damage; coelomocyte; single cell gel electrophoresis 国家自然科学基金(31260139);海南省自然科学基金(313050) 张来军(1968-), 女, 博士, 研究方向为细胞生物学, E-mail: ldxyzhlj@126.com 10.7524/AJE.1673-5897.20160408002 2016-04-08 录用日期:2016-09-05 1673-5897(2017)2-216-06 X171.5 A 张来军(1968—),女,副教授,主要从事细胞生物学教学及遗传毒理学研究,发表学术论文20余篇。 张来军, 陈永敢, 杭瑜瑜. 重金属Cr(VI)、Pb及Cu胁迫对双齿围沙蚕体腔细胞的DNA损伤[J]. 生态毒理学报,2017, 12(2): 216-221 Zhang L J, Chen Y G, Hang Y Y. DNA damage of coelomocyte in Perinereis aibuhitensis induced by chromium(VI), lead and copper [J]. Asian Journal of Ecotoxicology, 2017, 12(2): 216-221 (in Chinese)

3 讨论(Discussion)
