基于数据非依赖型采集质谱技术的血液脂质分子高通量分析
2017-06-27李文娟万祎李桐高世雄胡建英
李文娟,万祎,李桐,高世雄,胡建英
北京大学城市与环境学院,北京100871
基于数据非依赖型采集质谱技术的血液脂质分子高通量分析
李文娟,万祎*,李桐,高世雄,胡建英
北京大学城市与环境学院,北京100871
脂质是生物体的重要代谢分子,参与重要的细胞生物功能,已有报道表明环境中污染物会干扰生物体正常循环及代谢机制,导致脂肪代谢紊乱。基于数据非依赖型(DIA)采集质谱技术,通过优化UPLC-QTOF MS(超高效液相色谱飞行时间质谱联用)液相分离方法,开发了少量人体血液样品中脂质代谢分子的高通量分析方法,并将其应用于57个普通人群的血液样品分析,在10 μL人体血液样品中检出2 598个信号,经脂代组学质谱库匹配解析鉴定出八大类1 780个脂质分子,其中分子数目占比最大的脂质为甘油磷脂类(37%),其次依次为脂肪酸类(23%)、固醇脂类(13%)、甘油脂类(10%)、鞘脂类(9.0%)、孕烯醇酮脂类(4.8%)。上述研究建立的脂质分子高通量分析方法为以脂质代谢为毒性终点的污染物毒性筛查和毒理机制研究提供方法学基础。
脂质代谢组学;DDA;DIA;UPLC-QTOF MS;超高效液相色谱飞行时间质谱联用
脂质是生物体内重要的生物分子,不仅是生物膜的骨架成分,而且参与细胞的重要生物功能[1],如细胞信号转导等[2-4]。脂代组学于2003年作为单独学科正式提出[5],对脂质代谢分子的种类及其生物体生理功能进行系统研究[6-7]。毒理学研究表明环境污染物会影响脂肪细胞的分化,导致脂肪发育异常,产生的脂类毒性可能最终导致糖尿病、高血压、心脏病等疾病[8]。例如,多氯联苯类物质暴露会导致老鼠血浆中的超低密度脂蛋白水平升高[9];滴滴涕暴露会导致老鼠血浆和脂肪组织中胆固醇和三酸甘油脂的升高,增加肝脏中三酸甘油脂的合成[10];硫丹和狄氏剂暴露会改变老鼠体内的脂肪酸组成[11];全氟辛酸暴露会显著改变老鼠脂肪代谢相关基因的表达[12]等。由于脂质分子种类繁多,包括八大类约4万多个代谢分子,该类分子的高通量分析是环境污染物毒性筛查和毒理机制解析的重要技术手段[13]。
脂质分子高通量分析的关键是快速准确鉴定种类众多的代谢分子。目前,应用最为广泛的质谱扫描方法是数据依赖型DDA(data-dependent acquisition)模式,即在质谱MS全扫过程中选取一部分符合条件的母离子进行MS/MS分析得到碎片子离子,将母离子与子离子匹配分析确定分子结构,DDA模式已经被广泛应用于脂代组学的研究[14-16]。虽然DDA模式可以实现同时获取母离子与子离子碎片,由于受选择条件限制,DDA模式一次进样只能获取部分前体离子的母-子离子信息,需要多次进样才能获得众多目标代谢分子的母离子及相匹配子离子信息,分析时间长、数据分析复杂,而且多次进样容易产生较高的系统误差。为克服DDA模式的不足,数据非依赖型DIA(data-independent acquisition)扫描模式被提出,该模式通过质谱仪低和高碰撞能量的交替切换,实现脂质分子母-子离子信息无选择限制的同时获取及匹配,保证一次进样获得完整分析[17]。DIA模式现已应用于蛋白组学的研究[18-19],在脂代组学等小分子的研究比较少。Plumb等[20]应用DIA模式分析研究大鼠尿中的内源性代谢物并与DDA模式比较,证明一次进样DIA模式分析能够获得与DDA模式多次进样一致的鉴定结果。
本研究基于UPLC-QTOF MS分析平台,通过优化液相分离方法等仪器条件,采用DIA扫描模式,实现一次进样实时获得所有母离子信号的全面碎片信息,通过谱库比对高通量鉴定出脂质代谢分子,开发血液中脂质分子的高通量分析方法。
1 材料与方法(Materials and methods)
1.1 试剂与仪器
6种脂类标准品:十二烷酸(lauric acid)(纯度>98.0%),18:1神经酰胺(ceramide (d18:1/18:1(9Z)) (纯度>98.0%),18:1双甘油酯(18:1 DG) (纯度>98.0%),18:1(Δ9-Cis)磷脂酰胆碱(18:1 (Δ9-Cis) PC (DOPC)) (纯度>98.0%),18:1(Δ9-Cis)磷脂酰甘油(18:1 (Δ9-Cis) PG (sodium salt)) (纯度>98.0%),胆固醇(cholesterol) (纯度>98.0%);相应氘代内标(用于进样过程平衡仪器):16:0-D31神经酰胺(16:0-D31 ceramide) (纯度>99%),16:0 D31-18:1磷脂酰胆碱(16:0 D31-18:1 PC) (纯度>99%),16:0 D31-18:1磷脂酰甘油(16:0 D31-18:1 PG) (纯度>99%),D7胆固醇(cholesterol (D7)) (纯度>99%)均购自Avanti公司北京希凯生物科技有限公司代理处。甲醇、乙腈、氯仿、异丙醇、甲基叔丁基醚(MTBE)购自Fisher公司(New Jersey, USA;HPLC级),甲酸、乙酸铵购自迪马科技(Dima Technology TNC, USA;HPLC级),氨水购自北京化工厂(分析纯),实验中溶剂用水均为超纯水(电导率18.2 MΩ·cm)。
ACQUITYTM超高效液相色谱仪(Waters, Milford, MA, USA);四级杆飞行时间质谱仪(ESI-Q-TOF) (Waters, Micromass, Manchester, UK);MassLynx V4.1工作站软件(Waters, Inc., USA);Progenesis QI软件(Waters, Inc., USA);Milli-Q超纯水机(Millipore, Bedford, MA, USA),高速冷冻离心机(SIGMA 3-18K, SIGMA, Germany),真空冷冻干燥机(DRC-1000程序冻干仓(EYELA, Tokyo, Japan),FDU-2001干燥仓(EYELA, Tokyo, Japan)),数控超声波清洗器(KQ-500DE, 昆山市超声仪器有限公司,中国)。
1.2 血液样品采集与准备
人类血液样本收集已获北京大学伦理委员会批准。所有参与者采取静脉血标本,彻底清洗臂与乙醇擦拭后,抽取到含有肝素钠抗凝的采血管中。所有的样品存放在-80℃直到分析。每位参与者均完成了一份调查问卷涵盖生活信息和社会人口学特征,包括年龄、身体质量指数(BMI)、教育史等。调查人群平均年龄(35.27±2.52)岁,身体质量指数(BMI)为22.83±2.61,人群包括2名硕士及以上学历,6名初中学历,28名高中学历,21名大专或本科学历。
1.3 血液样品提取
本研究优化了Pizarro等[21]报道的血脂分析前处理方法。首先,取10 μL血浆样品于4 mL棕色玻璃样品瓶中,加入同位素标记的内标,加入100 μL超纯水和400 μL甲醇,混合震荡2 min,加入1.4 mL MTBE,在15 ℃条件下超声萃取15 min,结束后立即加入500 μL超纯水,10 ℃下8 000 r·min-1离心10 min,收集上层液体,真空冻干机冻干,进样分析前加入4 ℃下的定容溶剂(V(氯仿)∶V(甲醇)∶V(水)=1∶2∶0.8)200 μL,进样分析前从每个定容后样品取10 μL震荡混匀成质量控制样本QC(Quality Control)样品,样品保存在-80 ℃。
1.4 UPLC-QTOF MS分析
本研究比较分析了3种不同的液相色谱分离柱,包括ACQUITY UPLC®BEH C8(1.7 μm填料内径,2.1 mm×100 mm)、HSS T3色谱柱(1.8 μm填料内径,2.1 mm×100 mm)和CSH C18色谱柱(1.7 μm填料内径,2.1 mm×100 mm) (Waters, Inc., USA)。BEH C8色谱柱的流动相水相(A)为0.1%氨水,有机相(B)为甲醇∶异丙醇(体积比为85∶15)。梯度洗脱程序如下,正离子模式下:0~0.5 min 30% B,0.5~2 min B从30%线性增加到50%,2~3 min B从50%线性增加到70%,3~4.5 min B从70%线性增加到90%,4.5~5 min B从90%线性增加到100%并维持3 min,8~8.1 min恢复30% B并保持4 min;负离子模式下:0~0.5 min 30% B,0.5~2 min B从30%线性增加到50%,2~3 min B从50%线性增加到95%,3~5 min B从95%线性增加到100%并维持3 min,8~8.1 min恢复30% B并保持4 min。流速均为0.2 mL·min-1,进样体积3 μL,柱温40 ℃,样品室温度8 ℃,总洗脱时间12 min。T3色谱柱的流动相水相(A)为含10 mmol·L-1乙酸铵的乙腈∶水(体积比为60∶40)的盐溶液,有机相(B)为含10 mmol·L-1乙酸铵的乙腈∶异丙醇(体积比为10∶90)的混合溶液,色谱梯度洗脱程序等液相参数采用Pizarro等[21]的参数,总洗脱时间15.5 min,进样体积10 μL,流速0.4 mL·min-1。CSH C18色谱柱的流动相水相(A)为含10 mmol·L-1乙酸铵的乙腈∶水(体积比为60∶40)的盐溶液,有机相(B)为含10 mmol·L-1乙酸铵和0.1%(体积分数)甲酸的乙腈∶异丙醇(体积比为10∶90)的混合液,色谱梯度洗脱程序等液相参数采用Sarafian等[22]的参数,总洗脱时间20 min,进样体积5 μL,流速0.4 mL·min-1。
质谱均选择电喷雾(ESI)离子源,采用MSE的Continuum模式采集数据,扫描范围m/z为50~1 200,扫描时间0.15 s,雾化气为N2,毛细管电压正负离子模式分别为3.0 KV、2.0 KV,锥孔电压分别为40 V、45 V,Extraction锥孔电压均为4.0 V,源温度100 ℃,脱溶剂气温度400 ℃,锥孔气流量50 L·h-1,脱溶剂气流量600 L·h-1。QTOF检测器使用甲酸钠溶液校正3 ppm以内,使用亮氨酸脑啡肽锁定离子质量数,正负离子模式分别为556.2771、554.2615。进样分析过程中使用QC指示仪器稳定性。
1.5 组学数据解析
UPLC-QTOF MS所采数据通过Progenesis QI软件进行峰对齐、峰提取、去卷积化、峰识别和峰匹配后得到包含脂质分子质量数(m/z)、碎片子离子质量数(m/z)、保留时间(RT(min))、相对峰面积的数据集并据此通过相关脂质数据库:lipidMAPS(http://lipidMAPS.org)、METLIN(http://metlin.scripps.edu)搜索匹配鉴定,允许相对分子量偏差设为10 mDa,并将结果按照脂肪酸类(FA)、甘油脂类(GL)、甘油磷脂类(GP)、鞘脂类(SP)、固醇脂类(ST)、孕烯醇酮脂类(PR)、糖脂类(SL)、多聚乙烯类(PK)脂质八大类[23]及其子类别进行分类总结。人群血样脂质分子轮廓图由OriginLab 2016呈现。
2 结果与讨论(Results and discussion)
2.1 方法优化
由于脂质分子分析过程中存在共流出质量数重叠干扰现象,脂质的分离对鉴定分析复杂基质中的脂质分子非常重要。已有报道研究中使用比较广泛的液相分离色谱柱是C18[24-28],但是C18对极性弱的脂质分子具有很强的保留性,T’Kindt等[15]和Pizarro等[21]提出利用HSS T3柱单独分离分析极性弱的分子。考虑到C8色谱柱对于弱极性脂质分子具有适中的保留性,本研究系统比较了C8、C18和T3柱对众多脂质分子的分离鉴定效果。通过10个人体血液样品脂质分子的分离鉴定结果比较,发现C8柱和C18柱检出的脂质分子数量(n=1 559、n=1 510)显著高于T3柱(n=826),这可能归因于脂质分子较高的脂溶性,而适用于较强极性分子的T3柱难以有效分离,使得质谱无法有效区分鉴定。对比C18和C8柱的鉴定结果,发现C18柱在甘油磷脂类、鞘脂类、多聚乙烯类3类极性较强物质中检出脂质分子稍高于C8柱,而其他非极性较强类甘油脂类、固醇脂类、孕烯醇酮脂类物质比C8柱低,此结果与C18柱对非极性物质高保留性相一致。特别值得注意,在负离子模式下,C18柱分离鉴定的脂质分子数目(n=145)仅为C8柱(n=462)的1/3(表1)。

图1 C8色谱柱分离6种典型脂质标准物质的色谱图Fig. 1 Chromatograms of six lipid standards by C8 column

表1 不同分析方法鉴定出的脂质分子数量Table 1 Numbers of identified lipid molecules by different UPLC columns
注:+、-分别表示正、负离子模式。FA, GP, GL, PK, PR, SL, SP, ST表示脂肪酸类、甘油磷脂类、甘油脂类、多聚乙烯类、孕烯醇酮脂类、糖脂类、鞘脂类、固醇脂类。
Note: +, - represents positive and negative ion modes separately. FA, GP, GL, PK, PR, SL, SP, ST stand for fatty acyls, glycerol phospholipids, glycerolipids, poly ketides, prenolipids, saccharolipids, sphing olipids, sterol lipids.
进一步选取脂肪酸类、甘油脂类、甘油磷脂类、鞘脂类、固醇脂类中的6种典型脂质分子:lauric acid、18:1 DG、18:1(Δ9-Cis) PC、18:1(Δ9-Cis) PG、ceramide (d18:1/18:1(9Z))、cholesterol作为标准物质对比C8和C18柱的分离鉴定效果。结果显示,6种标样在C8柱分离分析的响应比C18柱高了2.5~5.5倍,而且对象物质在C8柱具有很好的峰形和分离效果(图1)。另外,C18与T3柱液相方法中水相有机相均为不同溶剂配比并添加甲酸、乙酸铵盐溶液,洗脱时间20 min、15.5 min时间较长,相比之下,C8柱采用的不含盐溶液(0.1%氨水,甲醇∶异丙醇的体积比为85∶15),洗脱时间仅为12 min。因此,C8色谱柱更适用于脂质分子的高通量鉴定分析。
董庄排闸、引闸各布置1孔,孔深15m。闸基高程5.4~8.4m主要为第②层壤土,构成地基主要持力层,具中等压缩性,弱透水性,强度较高,渗透稳定性较好。高程3.3~5.4m为第②2层砂壤土,具中等压缩性,中等透水性,具液化潜势。高程1.7~3.3m为第②3层粉砂,饱和,中密,中等透水性,承载力较高,具液化潜势。高程1.7m以下为第③层壤土,可塑~软塑,具中高等压缩性,微透水性,工程地质性质相对较差。
2.2 血液样品中脂质分子的高通量鉴定
为了对样品中代谢分子进行精准鉴定,需要实时获得对象分子的母离子及相匹配子离子信息。目前最为常用的鉴定扫描模式为DDA模式,但该模式鉴定速率慢、容易丢失信号、需要多次进样分析[29-31]。本研究中,采用DIA模式进行高质高效的峰对齐、峰提取、峰识别及峰匹配实现高通量准确鉴定。如图2所示,首先以QC样品为参照对每个样品进行色谱峰的对齐,平衡进样分析过程中仪器的波动,减少因仪器不稳定引起的系统误差;然后通过以保留时间(RT(min))、质核比(m/z)、色谱峰形3个维度的信号提取,实时获得所有母离子及相匹配子离子信息;同时以元素同位素丰度和色谱峰保留时间保证峰识别及匹配结果的精确性,并通过相关脂质数据库搜索匹配,最终输出包含相对峰面积、加合物形式、同位素丰度、脂质分子名称和结构、碎片断裂方式等鉴定结果的数据集。
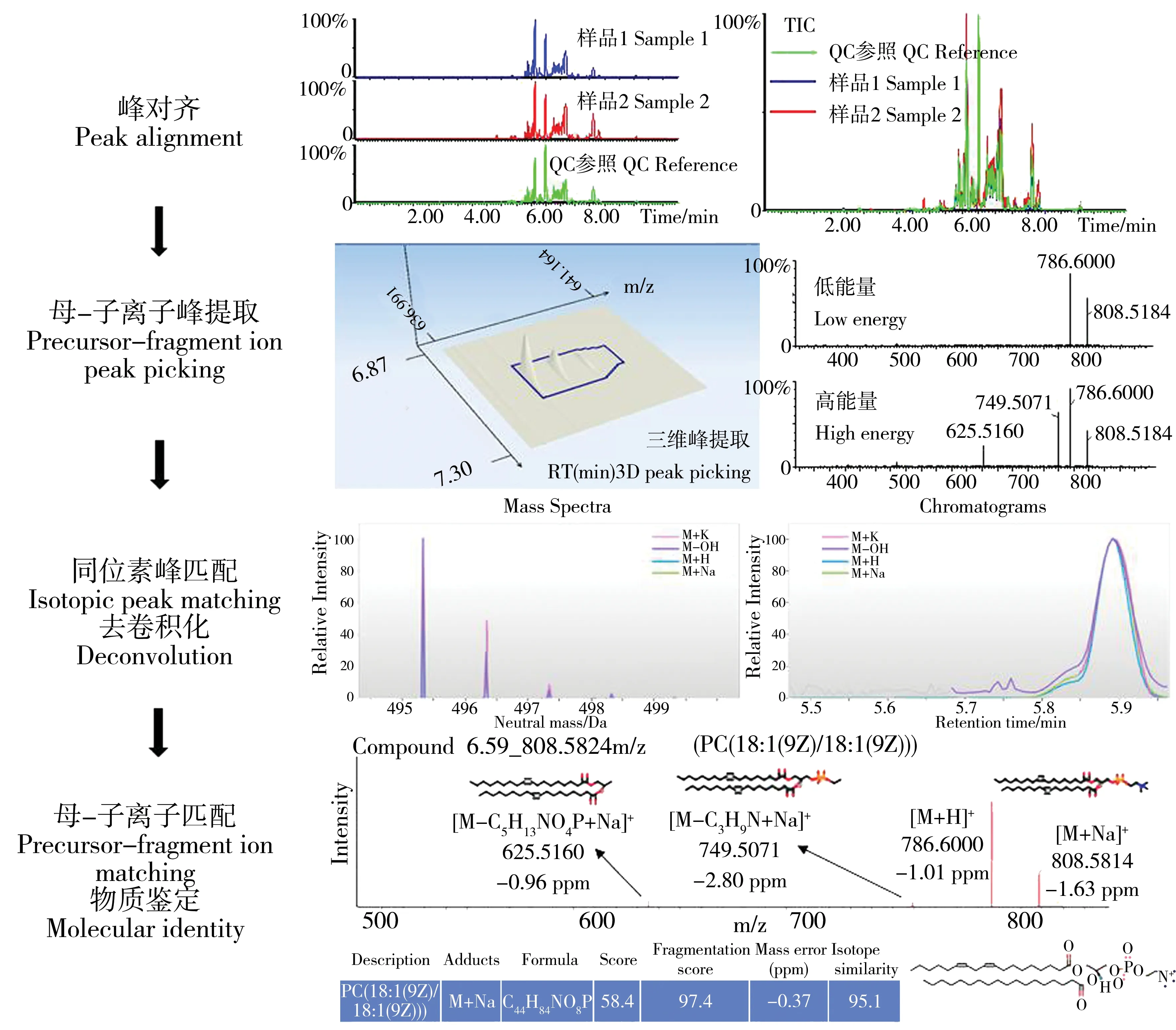
图2 基于数据非依赖型采集质谱技术的脂质分子高通量鉴定过程Fig. 2 High throughput identification of lipid molecules by UPLC-QTOF MS in DIA mode
本研究采用母离子和子离子碎片同时扫描的模式,通过三维比对进行母离子和碎片匹配,大大提高了扫描鉴定速率,每个样品只需一次进样分析即可获得所有鉴定信息,比传统的DDA模式能获得更全面的鉴定结果。比如,Sandra等[24]采用DDA模式,需要4次进样分析才能完成样品的脂质分子的全谱扫描;Wang等[32]研究表明,DDA模式需要多次进样分析才能获取足够多的MS/MS匹配信息。将本研究建立的DIA高通量鉴定分析方法应用到人群血液样品,可在10μL少量人体血液样品中检测提取到2598个信号,经脂代组学数据解析出脂质分子1780个,脂质八大类物质均有检出。而Pizarro等[21]于2013年报道了经典的脂质分子提取分析和鉴定方法,使用MTBE超声辅助提取30μL人体血浆样品中的脂质分子并采用DDA模式可采集到837个质谱信号,分析鉴定出352个脂质分子。与经典的脂质分析研究相比,本研究鉴定出的脂质分子数量是Pizarro等的近5倍。
进一步采用六种典型脂质标准物质对鉴定的准确性进行验证。如表2所示,经DIA模式鉴定出lauric acid、18:1 DG、18:1 (Δ9-Cis)PC、18:1(Δ9-Cis)PG、Ceramide (d18:1/18:1(9Z))、Cholesterol的母离子分别为199.1698、643.5277、808.5832、773.5355、562.5199、369.3521。除了lauric acid,其他物质都有与母离子相匹配的子离子碎片,所获得的物质质谱信息与谱库相比具有78~97%的相似度。标样的扫描鉴定结果证实分析方法对脂质分子的分离分析鉴定有效可靠。
2.3 血液中脂质分子的分布特征

表2 典型脂质标准物质的鉴定信息Table 2 Detail information of the six lipid standards

图3 57个血液样品中的八大类脂质分子(a)及其子类别(b)Fig. 3 Profiles of eight classes of lipid molecules (a) and corresponding subclass (b) in 57 human blood samples
除SL、PK、PR类脂质分子检出响应相对较低外,其余五大类脂质分子大部分检出强度较高。其中,数量占比最大的脂类是GP类(n=659,37%),其次依次为FA类(n=411,23%)、ST类(n=232,13%)、GL类(n=181,10%)、SP类(n=160,9.0%)(图3(a))。GP类物质是构成所有哺乳动物的膜体成分[34],是蛋白质合成、膜胆固醇平衡和甘油三酯储存和分泌必不可少的细胞膜组成成分[35],尤其是PC是肺表面的最大组分[36]。本研究中,数量占比最大的甘油磷脂类检出子类别也最多,包括PC类分子(n=136,20.64%)、磷脂酰丝氨酸类(PS) (n=136,20.64%)、PE类(n=130,19.73%)、磷脂酸类(PA) (n=104,15.78%),磷脂酰甘油类(PG) (n=80,12.14%)、磷脂酰肌醇类(PI) (n=50,7.59%)、LPC(n=13,1.97%)、LPE(n=7,1.06%) (图3(b)),其中PC类物质含量响应相对较高,这与T’Kindt等[16]的研究成果相一致。由于本方法的液相加入了氨水,甘油脂类化合物绝大多以氨加合物形式在正离子模式下检出,能达到104的信号响应,其中占比最高的是TG(n=99,54.70%),其次是DG(n=65,35.91%)。这是由于TG类物质是在血浆中循环最丰富的脂质,被报道处于毫摩尔水平[37]。SP类物质涵盖协助信号转导、吞噬作用、肥大细胞脱颗粒及多重耐药性的生物活性物质[38],本研究检测出涵盖CER、SM类等鞘脂类物质。ST类脂质分子是细胞膜的重要组成部分,已被报道在肺表面活性剂中具有重要功能[39]。FA类分子分为饱和与不饱和2种,可为人体提供热量,保护脏器,构成身体细胞组织,具有调控基因表达、维持细胞因子和脂蛋白平衡,调节身体机能等[40]生理功能。上述脂质分子共同形成脂质代谢网络,参与生物体的能量存储和信号传导等重要生命活动,这些分子的同时高通量扫描分析为环境污染物暴露对脂质代谢网络的影响提供了分析基础。
综上所述,本研究基于DIA扫描模式,针对极性差异较大的脂质分子,优化了液相分离的仪器分析条件,显著提高了脂质分子的检测灵敏度和检出数目,开发了少量血液中脂质分子的高通量分析方法,实现一次进样实时获得母离子及匹配碎片信息,通过谱库比对脂质代谢分子鉴定,方法的准确性得到脂质标准物质的验证。将该高通量分析鉴定方法应用于普通人群血液样品的脂质分子分析,在10 μL人体血液样品中鉴定出脂肪酸类、甘油脂类、甘油磷脂类、鞘脂类、固醇脂类、孕烯醇酮脂类、糖脂类、多聚乙烯类8类脂质1 780个分子。其中,占比例最大的脂质分子为甘油磷脂类(37.02%),其次依次为脂肪酸类(23.09%)、固醇脂类(13.03%)、甘油脂类(10.17%)、鞘脂类(8.99%)。该研究建立的脂质分子高通量分析方法为以脂质代谢为毒性终点的污染物毒性筛查和毒理机制研究提供方法学基础。
[1] 王涛, 梅旭荣, 钟秀丽, 等. 脂质组学研究方法及其应用[J]. 植物学报, 2010, 45(2): 249-257
Wang T, Mei X R,Zhong X L, et al. Research methods and application of lipid [J]. Journal of Plant Science, 2010, 45(2): 249-257 (in Chinese)
[2] Schaefer E J, Bongard V, Beiser A S, et al. Plasma phosphatidylcholine docosahexaenoic acid content and risk of dementia and Alzheimer disease:The Framingham Heart Study [J]. Archives of Neurology, 2006, 63(11):1545-1550
[3] Hodge A M, Simpson J A, Gibson R A, et al. Plasma phospholipid fatty acid composition as a biomarker of habitual dietary fat intake in an ethnically diverse cohort [J]. Nutrition Metabolism & Cardiovascular Diseases, 2007, 17(6): 415-426
[4] Alarcón J M, Brito J A, Hermosilla T, et al. Ion channel formation by Alzheimer's disease amyloid beta-peptide (Abeta40) in unilamellar liposomes is determined by anionic phospholipids [J]. Peptides, 2006, 27(1): 95-104
[5] Han X L, Gross R W. Global analyses of cellular lipidomes directly from crude extracts of biological samples by ESI mass spectrometry: A bridge to lipidomics [J]. Journal of Lipid Research, 2003, 44: 1071-1079
[6] Zhou X, Mao J, Ai J, et al. Identification of plasma lipid biomarkers for prostate cancer by lipidomics and bioinformatics [J]. Plos One, 2012, 7(11): e48889
[7] Gorden D L, Ivanova P T, Myers D S, et al. Increased diacylglycerols characterize hepatic lipid changes in progression of human nonalcoholic fatty liver disease; comparison to a murine model [J]. Plos One, 2011, 6(8): e22775
[8] La M M, Emond C, Kim M J, et al. Toxicological function of adipose tissue:Focus on persistent organic pollutants [J]. Environmental Health Perspectives, 2013, 121(2): 162-169
[9] Arsenescu V, Arsenescu R I, King V, et al. Polychlorinatedbiphenyl-77 induces adipocyte differentiation and proinflammatory adipokines and promotes obesity and atherosclerosis [J]. Environmental Health Perspectives, 2008, 116(6): 761-768
[10] Sanyal S, Agarwal N, Dudeja P K, et al. Effect of a single oral dose of DDT on lipid metabolism in protein-calorie malnourished monkeys [J]. Indian Journal of Biochemistry & Biophysics, 1982, 19(2): 111-114
[11] Narayan S, Dani H M, Misra U K. Changes in lipid profiles of liver microsomes of rats following intratracheal administration of DDT or endosulfan [J]. Journal of Environmental Science & Health. Part.B Pesticides Food Contaminants & Agricultural Wastes, 1990, 25(2): 243
[12] Rosen M B, Schmid J R, Corton J C, et al. Gene expression profiling in wild-type and PPARα-null mice exposed to perfluorooctane sulfonate reveals PPARα-independent effects [J]. PPAR Research, 2010, 2010(11): 794739
[13] 彭双清, 郝卫东, 伍一军. 毒理学替代法[M]. 第一版. 北京: 军事医学科学院出版社, 2009: 519-528
Peng S Q, Hao W D, Wu Y J. Toxicology Substitution Method [M]. The 1st edition.Beijing: Military Medical Science Academy of the PLA Press, 2009: 519-528 (in Chinese)
[14] Matsuda F, Yonekura-Sakakibara K, Niida R, et al. MS/MS spectral tag-based annotation of non-targeted profile of plant secondary metabolites [J]. Plant Journal, 2009, 57(3): 555-577
[15] T’Kindt R, Jorge L, Dumont E, et al. Profiling and characterizing skin ceramides using reversed-phase liquid chromatography-quadrupole time-of-flight mass spectrometry [J]. Analytical Chemistry, 2012, 84(1): 403-411
[16] T’Kindt R, Telenga E D, Jorge L, et al. Profiling over 1500 lipids in induced lung sputum and the implications in studying lung diseases [J]. Analytical Chemistry, 2015, 87(9): 4957-4964
[17] Xiao J F, Zhou B, Ressom H W. Metabolite identification and quantitation in LC-MS/MS-based metabolomics [J]. TrAC Trends in Analytical Chemistry, 2012, 32(1): 1-14
[18] Blackburn K, Mbeunkui F, Mitra S K, et al. Improving protein and proteome coverage through data-independent multiplexed peptide fragmentation [J]. Journal of Proteome Research, 2010, 9(7): 3621-3637
[19] Moran D, Cross T, Brown L M, et al. Data-independent acquisition (MSE) with ion mobility provides a systematic method for analysis of a bacteriophage structural proteome [J]. Journal of Virological Methods, 2014, 195(1):9-17
[20] Plumb R S, Johnson K A, Rainville P, et al. UPLC/MSEa new approach for generating molecular fragment information for biomarker structure elucidation [J]. Rapid Communications in Mass Spectrometry, 2006, 20(13):1989-1994

[22] Sarafian M H, Gaudin M, Lewis M R, et al. Objective set of criteria for optimization of sample preparation procedures for ultra-high throughput untargeted blood plasma lipid profiling by ultra performance liquid chromatography-mass spectrometry [J]. Analytical Chemistry, 2014, 86(12): 5766-5774
[23] Fahy E, Subramaniam S, Brown H A, et al. A comprehensive classification system for lipids [J]. European Journal of Lipid Science and Technology, 2005, 46(5): 337-364
[24] Sandra K, Pereira A S,Vanhoenacker G, et al. Comprehensive blood plasma lipidomics by liquid chromatography/quadrupole time-of-flight mass spectrometry [J]. Journal of Chromatography A, 2010, 1217(25): 4087-4099
[25] Al-Salhi R, Abdul-Sada A, Lange A, et al. The xenometabolome and novel contaminant markers in fish exposed to a wastewater treatment works effluent [J]. Environmental Science & Technology, 2012, 46(16):9080-9088
[26] Yan X, Chen D, Xu J, et al. Profiles of photosynthetic glycerolipids in three strains of Skeletonema determined by UPLC-Q-TOF-MS [J]. Journal of Applied Phycology, 2011, 23(2): 271-282
[28] 习聪, 陈艳华, 杨维, 等. 脂质组学血清样品处理方法及其快速高分辨液相色谱-质谱分析[J]. 分析化学, 2013, 41(9): 1308-1314
Xi C, Chen Y H, Yang W, et al. Development of method for serum preparation and lipidomics analysis based on rapid resolution liquid chromatography-mass spectrometry [J]. Analytical Chemistry, 2013, 41(9): 1308-1314 (in Chinese)
[29] Chapman J D, Goodlett D R, Masselon C D. Multiplexed and data-independent tandem mass spectrometry for global proteome profiling [J]. Mass Spectrometry Reviews, 2014, 33(6): 452-470
[30] Blackburn K, Mbeunkui F, Mitra S K, et al. Improving protein and proteome coverage through data-independent multiplexed peptide fragmentation [J]. Journal of Proteome Research, 2010, 9(7): 3621-3637
[31] Geromanos S J, Vissers J P, Silva J C, et al. The detection, correlation, and comparison of peptide precursor and product ions from data independent LC-MS with data dependent LC-MS/MS [J]. Proteomics, 2009, 9(6): 1683-1695
[32] Wang N, Li L. Exploring the precursor ion exclusion feature of liquid chromatography-electrospray ionization quadrupole time-of-flight mass spectrometry for improving protein identification in shotgun proteome analysis [J]. Analytical Chemistry, 2008, 80(12): 4696-4710
[33] 陈蓉, 王以美, 汪江山, 等. 液质联用代谢组学研究多氯联苯和二噁英对大鼠毒性作用[J]. 环境化学, 2013, 32(7): 1226-1235
Chen R, Wang Y M, Wang J S, et al. Study on toxic effects of PCBs and dioxins on rats by liquid chromatography-mass spectrometry [J]. Environmental Chemistry, 2013, 32(7): 1226-1235 (in Chinese)
[34] Fagone P, Jackowski S. Membrane phospholipid synthesis and endoplasmic reticulum function [J]. Journal of Lipid Research, 2009, 50(Supplement): S311-S316
[35] Lagace T A, Ridgway N D. The role of phospholipids in the biological activity and structure of the endoplasmic reticulum [J]. Biochimicaet Biophysica Acta, 2013, 1833(11): 2499-2510
[36] Veldhuizen R, Nag K, Orgeig S, et al. The role of lipids in pulmonary surfactant [J]. Biochimicaet Biophysica Acta, 1998, 1408(2-3): 90-108
[37] Wanders R J, van Roermund C W, Visser W F, et al. Peroxisomal fatty acid alpha- and beta-oxidation in health and disease:New insights [J]. Advances in Experimental Medicine & Biology, 2003, 544: 293-302
[38] Tomas Blom P S E I. Synthesis and biosynthetic trafficking of membrane lipids [J]. Cold Spring Harbor Perspectives in Biology, 2011, 3(8): 366-375
[39] Rooney S A, Young S L, Mendelson C R. Molecular and cellular processing of lung surfactant [J]. FASEB Journal Official Publication of the Federation of American Societies for Experimental Biology, 1994, 8(12): 957-967
[40] Fernández M B, Tonetto G M, Crapiste G H, et al. Hydrogenation of edible oil over Pd catalysts: A combined theoretical and experimental study [J]. Journal of Molecular Catalysis A Chemical, 2005, 237(s1-2): 67-79
◆
High Throughput Screening of Lipid Metabolites in Blood Based on the Data-independent Acquisition Mode
Li Wenjuan, Wan Yi*, Li Tong, Gao Shixiong, Hu Jianying
College of Urban and Environmental Sciences, Peking University, Beijing 100871, China
13 January 2017 accepted 20 February 2017
Lipid is a group of key components in biological processes and comprises diverse classes of molecules with critical functions in cellular energy storage, structure and signaling. It has been reported that environmental pollutants could interfere with the normal circulation and metabolism of biochemical molecular, leading to a disorder of lipid metabolism in organisms. In this study, a high throughput analytical method for lipid metabolites was developed based on UPLC-QTOF MS (ultra-high performance liquid chromatography quadrupole time-of-flight mass spectrometry) in the data-independent acquisition mode (DIA). The method was applied for analysis of lipid metabolites in human blood samples from a general population. 2 598 signals were detected and 1 780 lipid molecules were identified by the method. Of all the detected lipid metabolites, glycerol phospholipid is the predominant component (37%), followed by fatty acids (23%), sterol lipids (13%), glycerol lipids (10%), sphingolipids (9.0%), pregnenolone lipids (4.8%). The high throughput method established in this study provided an analytical technology for exploring the toxicology pathways of environmental pollutants, which could cause disorder of lipid metabolism to organisms.
lipidomics; DDA; DIA; UPLC-QTOF MS; ultra-high performance liquid chromatography quadrupole time-of-flight mass spectrometry
国家自然基金项目(21422701, 41330637)
李文娟(1992-),女,硕士研究生,研究方向为环境毒理化学,E-mail: lwenj2012@163.com
*通讯作者(Corresponding author), E-mail: wany@urban.pku.edu.cn
10.7524/AJE.1673-5897.20170113006
2017-01-13 录用日期:2017-02-20
1673-5897(2017)2-046-10
X171.5
A
万祎(1981—),男,环境地理学博士,研究员,主要研究方向为环境毒理化学,发表SCI学术论文50余篇。
李文娟, 万祎, 李桐, 等. 基于数据非依赖型采集质谱技术的血液脂质分子高通量分析[J]. 生态毒理学报,2017, 12(2): 46-55
Li W J, Wan Y, Li T, et al. High throughput screening of lipid metabolites in blood based on the data-independent acquisition mode [J]. Asian Journal of Ecotoxicology, 2017, 12(2): 46-55 (in Chinese)
