收缩压纵向轨迹与心房颤动的关系
2017-06-27杜鑫张芮英张莹施继红黄喆朱辰蕊李慧英魏晓明林黎明熊海亮刘妍季春鹏吴寿岭
杜鑫,张芮英,张莹,施继红,黄喆,朱辰蕊,李慧英,魏晓明,林黎明,熊海亮,刘妍,季春鹏,吴寿岭
收缩压纵向轨迹与心房颤动的关系
杜鑫,张芮英,张莹,施继红,黄喆,朱辰蕊,李慧英,魏晓明,林黎明,熊海亮,刘妍,季春鹏,吴寿岭
目的:探讨收缩压(SBP)纵向轨迹与心房颤动(房颤)的关系。
方法:以开滦研究中满足标准的对象组成研究队列。通过SAS Proc Traj程序确定观察对象2006~2007、2008~2009、2010~2011年健康体检的SBP纵向轨迹,生成5个不同的SBP轨迹组:低-稳定轨迹组、中-稳定轨迹组、中-高轨迹组、高-中轨迹组和高-稳定轨迹组。采用Log-Rank检验比较不同SBP轨迹组于2012~2013、2014~2015年2次健康体检时的房颤发病率的差异,采用多因素COX回归模型分析不同SBP轨迹组与房颤的关系。
结果:(1)40 727例纳入研究,平均年龄(51.81±11.54)岁,其中,男性30 693例(75.4%)。低-稳定轨迹组10 950例,中-稳定轨迹组19 158例,中-高轨迹组3 736例,高-中轨迹组4 702例,高-稳定轨迹组2 181例。(2)低-稳定轨迹组、中-稳定轨迹组、中-高轨迹组、高-中轨迹组和高-稳定轨迹组房颤发病率分别为:0.1%、0.2%、0.5%、0.5%、0.6%(P均<0.05)。(3)在多因素COX回归分析中,校正其他混杂因素后,与低-稳定轨迹相比,中-高轨迹、高-中轨迹、高-稳定轨迹均是新发房颤的危险因素,对应的HR(95%CI)分别为7.58(2.08~27.73)、5.30(1.88~14.95)、8.52(1.96~37.09)(P均<0.05)。排除有心肌梗死病史、脑卒中病史者后,进行敏感性分析,结果与以上主要研究结果趋势一致。
结论:SBP纵向轨迹水平升高是新发房颤的危险因素。
收缩压纵向轨迹;心房颤动
(Chinese Circulation Journal, 2017,32:584.)
心房颤动(房颤)是一种十分常见的心律失常,也是心肌梗死[1,2]、心力衰竭(心衰)[3]、心血管病死亡[4]和脑卒中[5]的重要危险因素。目前美国成年人中大约有230万人患有房颤(患病率为0.95%),到2050年将上升为560万[6]。而亚洲成年人中房颤的患病率接近1%[7],到2050年亚洲人群中将有7 200万人患有房颤,届时将是欧洲和美国人群房颤患病总人数的两倍[8-10]。高血压作为房颤和房颤患者发生脑卒中的独立危险因素,已被列入弗明翰心脏研究(FHS)和社区动脉粥样硬化研究(ARIC)建立的房颤风险模型[11,12]。但以往关于血压与房颤的研究大部分只采用了单次测量的血压水平[11-13],而未来血压水平受多种因素影响,如年龄、膳食、应用降压药以及影响血压水平的疾病发展等。因此单次测量血压值不足以准确地反映长期的血压水平对房颤发生的影响。
轨迹模型是一项基于多次重复测量值的数据分析技术,其遵循着同质的发展轨迹进行分组[14,15],可以评估长时血压变化趋势,研究不同血压轨迹组对靶器官损害的影响。Rahman等[16]对观察对象随访15年后发现最高收缩压(SBP)轨迹组发生房颤的风险是最低组的2.05倍(HR=2.05,95%CI:1.24~3.37)。Norby等[17]对观察对象随访25年后也发现SBP高-稳定轨迹组发生房颤的风险是低-稳定轨迹组的1.94倍(OR=1.94,95%CI:1.32~2.86)。以上两个研究均来源于美国人群,其结论需要在其他种族人群中得到验证。开滦研究(注册号:CHiCTR-TNC-11001489)是以功能社区人群为基础的心血管疾病危险因素研究,每两年进行一次包括血压、心电图检查在内的全面心血管风险因素评估,这为我们分析SBP纵向轨迹与新发房颤是否存在关联提供了机会。
1 资料与方法
2006~2007年(简称2006年度)由开滦总医院等共计11家医院对开滦集团在职及离退休职工进行了第一次健康体检,收集相关资料。此后分别于2008~2009、2010~2011、2012~2013、2014~2015年(分别简称2008、2010、2012、2014年度)由参加第一次体检的医务人员在相同地点对同一人群按第一次体检的时间顺序分别进行第二、三、四、五次健康体检,人体测量、生化指标检测均同第一次健康体检。我们以6年为暴露期,通过SAS Proc Traj程序确定观察对象2006、2008、2010年度3次健康体检的SBP纵向轨迹,生成5个不同的SBP轨迹组:低-稳定轨迹组、中-稳定轨迹组、中-高轨迹组、高-中轨迹组和高-稳定轨迹组。并随访2010年度至2014年度健康体检间房颤发生情况。
资料收集:通过调查问卷的方式获得观察对象的年龄、性别、吸烟、饮酒、及是否有心肌梗死、脑卒中病史等信息资料。人体测量学指标、生化指标检测见本课题组已发表的文献[18]。此外,我们将心房扑动患者也视为房颤进行分析。新发房颤:观察对象于2006、2008、2010年度健康体检间心电图检查结果示无房颤或房扑,2012和(或)2014年度健康体检时有房颤或房扑发生者。高血压[19]:SBP≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压(DBP)≥90 mmHg或正在服用降压药物。糖尿病[20]:空腹血糖(FBG)≥7.0 mmol/L或<7.0 mmol/L但有确切的糖尿病病史或正在服用降糖药物。
统计学方法:健康体检数据均由各医院经统一培训的专人录入。轨迹模型通过SAS Proc Traj程序完成[21,22]。由于SBP为连续变量,采用CNORM模式,首先确定轨迹的组数,再进一步确定每组轨迹的多项式阶。我们应用贝叶斯信息准则(BIC)及分组后的平均概率(AvePP)来选择最佳轨迹模型和评估轨迹的拟合程度,保证每组所占比例在5%以上,最终我们分别得出5组SBP轨迹,分别均以2、2、2、2、2为多项式阶的轨迹模型为最佳模型。正态性计量资料以均数±标准差表示,多组间比较采用单因素方差分析,并进行两两比较,方差齐用LSD检验,方差不齐则用Dunnett’s T3检验;不符合正态分布的计量资料经对数转换成正态分布后,再应用相应参数检验(方差分析)。计数资料用N(%)表示,组间比较用χ2检验。采用Log-rank检验分析不同SBP轨迹组的房颤发病率情况。采用多因素COX回归模型分析不同SBP轨迹分组对房颤的影响,在模型中除校正了年龄、性别外,还校正了基线SBP(2010年SBP)、体重指数(BMI)、吸烟、饮酒、高血压、糖尿病、心肌梗死、脑卒中病史。P<0.05(双侧检验)为差异有统计学意义。敏感性分析:已有研究表明一方面心肌梗死、脑卒中是发生房颤的危险因素[11,12],而另一方面房颤也会增加发生心肌梗死、脑卒中的风险[23,24],因此为了排除心肌梗死、脑卒中病史对研究结果的影响,我们分别排除了有心肌梗死、脑卒中病史的观察对象后重复了多因素COX回归模型分析。
2 结果
均参加了开滦集团2006、2008、2010年度健康体检者57 927例,其中排除2006、2008、2010年度健康体检时心电图缺失者1 245例,排除2006、2008、2010年度健康体检时确诊为房颤者286例,排除虽然参加了2006、2008、2010年度健康体检但2次及2次以上SBP缺失者196例,排除2012、2014年度健康体检均未参加者或虽参加了体检但心电图资料缺失者15 473 例,最终40 727例观察对象纳入统计学分析。
以观察对象2010年度健康体检的信息资料为基线信息,在40 727例观察对象中,平均年龄(51.81±11.54)岁,其中,男性30 693例(75.4%)。低-稳定轨迹组10 950例,中-稳定轨迹组19 158例,中-高轨迹组3 736例,高-中轨迹组4 702例,高-稳定轨迹组2 181例。与其他SBP轨迹组相比,高-稳定轨迹组观察对象的年龄、SBP、总胆固醇(TC)、高敏C-反应蛋白(hs-CRP)、BMI、高血压、糖尿病、脑卒中病史人群比例水平均最高,并且差异具有统计学意义(P<0.05,表1)。
不同SBP轨迹分组房颤发生情况:我们对观察对象平均随访了(5.01±0.37)年,期间房颤发生率为0.2%(90/40 727),其中低-稳定轨迹组、中-稳定轨迹组、中-高轨迹组、高-中轨迹组、高-稳定轨迹组的房颤发生率分别为0.1%(6/10 950)、0.2%(29/19 158)、0.5%(18/3 736)、0.5%(24/4 702)、0.6%(13/2 181)。随着SBP轨迹由低-稳定轨迹组升高至高-稳定轨迹组,房颤的发生率也随之升高,并且差异有统计学意义(P<0.001)。
表1 观察对象5个不同收缩压轨迹组的一般情况比较(
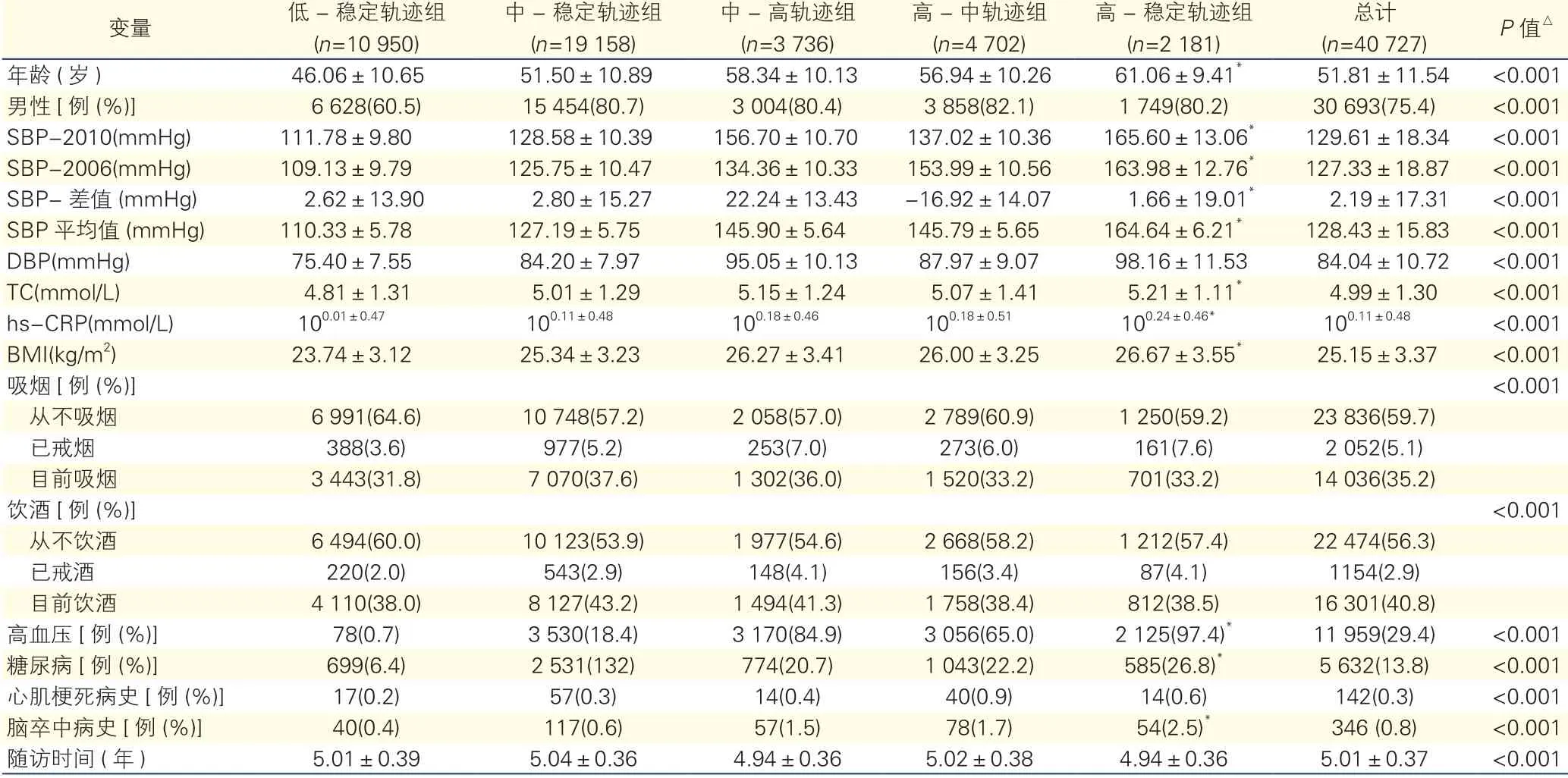
表1 观察对象5个不同收缩压轨迹组的一般情况比较(
注:SBP:收缩压;DBP:舒张压;BMI:体重指数;TC:总胆固醇;hs-CRP:高敏C-反应蛋白。1 mmHg=0.133 kPa。与其他SBP轨迹组相比*P<0.05。△P值为5个SBP轨迹组相比
变量低( -n=稳1定0 9轨5迹0)组中( -n=稳1定9 1轨5迹8)组中(n -=高3轨73迹6)组高(n -=中4轨70迹2)组高-(n稳=2定 1轨81迹)组(n=总40计 727)P值△年龄(岁)46.06±10.6551.50±10.8958.34±10.1356.94±10.2661.06±9.41*51.81±11.54<0.001男性[例(%)]6 628(60.5)15 454(80.7)3 004(80.4)3 858(82.1)1 749(80.2)30 693(75.4)<0.001 SBP-2010(mmHg)111.78±9.80128.58±10.39156.70±10.70137.02±10.36165.60±13.06*129.61±18.34<0.001 SBP-2006(mmHg)109.13±9.79125.75±10.47134.36±10.33153.99±10.56163.98±12.76*127.33±18.87<0.001 SBP-差值(mmHg)2.62±13.902.80±15.2722.24±13.43-16.92±14.071.66±19.01*2.19±17.31<0.001 SBP平均值(mmHg)110.33±5.78127.19±5.75145.90±5.64145.79±5.65164.64±6.21*128.43±15.83<0.001 DBP(mmHg)75.40±7.5584.20±7.9795.05±10.1387.97±9.0798.16±11.5384.04±10.72<0.001 TC(mmol/L)4.81±1.315.01±1.295.15±1.245.07±1.415.21±1.11*4.99±1.30<0.001 hs-CRP(mmol/L)100.01±0.47100.11±0.48100.18±0.46100.18±0.51100.24±0.46*100.11±0.48<0.001 BMI(kg/m2)23.74±3.1225.34±3.2326.27±3.4126.00±3.2526.67±3.55*25.15±3.37<0.001吸烟[例(%)]<0.001从不吸烟6 991(64.6)10 748(57.2)2 058(57.0)2 789(60.9)1 250(59.2)23 836(59.7)已戒烟388(3.6)977(5.2)253(7.0)273(6.0)161(7.6)2 052(5.1)目前吸烟3 443(31.8)7 070(37.6)1 302(36.0)1 520(33.2)701(33.2)14 036(35.2)饮酒[例(%)]<0.001从不饮酒6 494(60.0)10 123(53.9)1 977(54.6)2 668(58.2)1 212(57.4)22 474(56.3)已戒酒220(2.0)543(2.9)148(4.1)156(3.4)87(4.1)1154(2.9)目前饮酒4 110(38.0)8 127(43.2)1 494(41.3)1 758(38.4)812(38.5)16 301(40.8)高血压[例(%)]78(0.7)3 530(18.4)3 170(84.9)3 056(65.0)2 125(97.4)*11 959(29.4)<0.001糖尿病[例(%)]699(6.4)2 531(132)774(20.7)1 043(22.2)585(26.8)*5 632(13.8)<0.001心肌梗死病史[例(%)]17(0.2)57(0.3)14(0.4)40(0.9)14(0.6)142(0.3)<0.001脑卒中病史[例(%)]40(0.4)117(0.6)57(1.5)78(1.7)54(2.5)*346 (0.8)<0.001随访时间(年)5.01±0.395.04±0.364.94±0.365.02±0.384.94±0.365.01±0.37<0.001
影响新发房颤的多因素COX回归模型分析(表2):以新发房颤为因变量(定义无新发房颤为1,有新发房颤为2),以不同的SBP轨迹分组为自变量(以低-稳定轨迹组为参照组),进行多因素COX回归模型分析。模型三校正了年龄、性别、基线SBP、BMI、吸烟、饮酒、高血压、糖尿病、心肌梗死、脑卒中病史等混杂因素后,与低-稳定轨迹相比,中-高轨迹、高-中轨迹、高-稳定轨迹均是新发房颤的危险因素,对应的HR(95%CI)分别为7.58(2.08~27.73)、5.30(1.88~14.95)、8.52(1.96~37.09)。敏感性分析:为了排除心肌梗死、脑卒中病史对研究结果的影响,我们分别排除有心肌梗死、脑卒中病史的观察对象后重复了多因素COX回归模型分析,敏感性分析结果与以上主要研究结果趋势一致。
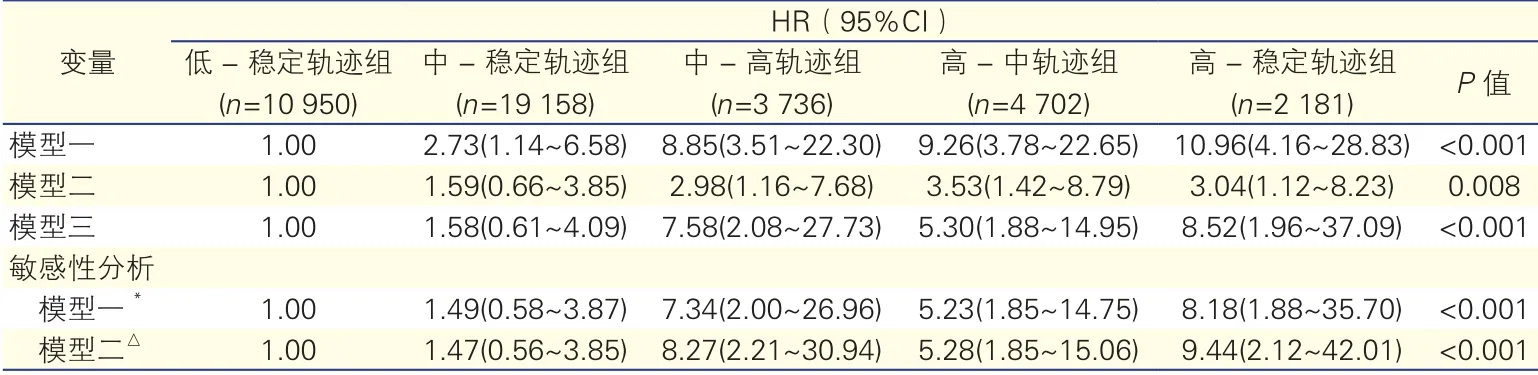
表2 不同收缩压轨迹组对新发房颤影响的多因素COX回归分析
3 讨论
基于40 727例观察对象,我们发现观察人群的SBP纵向轨迹确实存在异质性,我们确定了5个不同的SBP轨迹组,分别为低-稳定轨迹组、中-稳定轨迹组、中-高轨迹组、高-中轨迹组和高-稳定轨迹组,而且发现校正了包括基线SBP等混杂因素后,高-稳定轨迹组发生房颤的危险性最高。
据我们所知这是第一项有关亚洲人群SBP轨迹与新发房颤关联的研究。我们对观察对象平均随访(5.01±0.37)年后,发现随着SBP轨迹由低-稳定轨迹组升高至高-稳定轨迹组,房颤的发生率由0.1%上升至0.6%。Rahman 等[16]对观察对象随访15年后发现,随着个体SBP轨迹暴露水平的升高,房颤发生率由0.6%上升至34.2%。我们还发现尽管低-稳定轨迹组和中-稳定轨迹组的SBP水平均处于正常血压范围(均<140 mmHg),但SBP处于正常高值范围的中-稳定轨迹组的房颤发生率却是理想血压范围的低-稳定轨迹组的2倍。这表明SBP维持在正常高值范围内的人群发生房颤的风险高于理想SBP水平人群。Conen等[25]对女性人群随访48个月后发现,相较于SBP<120 mmHg组,120≤SBP<129 mmHg组(正常高值血压组)发生房颤的风险增加0.35倍(HR=1.35,95%CI:1.01~1.82)。Grudvold等[26]对男性人群随访35年后发现,相较于SBP<128 mmHg组,128≤SBP<138 mmHg组(正常高值血压组)发生房颤的危险增加50%(HR=1.50,95%CI:1.10~2.03) 因素。
我们还发现,校正了年龄、性别等混杂因素后,与低-稳定轨迹相比,中-高轨迹、高-中轨迹、高-稳定轨迹均是新发房颤的危险因素。这表明随着SBP轨迹水平的升高,发生房颤的风险增加。这与以往关于SBP轨迹对房颤影响的研究结果相一致。Rahman 等[16]研究表明,SBP纵向轨迹水平最高组发生新发房颤风险是水平最低组的2.05倍。Norby 等[17]研究表明,相较于SBP低-稳定轨迹组,长期高-稳定轨迹组发生房颤的风险最高(OR=1.94,95%CI:1.32~2.86)。另外,我们的研究也表明,校正了基线SBP后,SBP纵向轨迹对房颤的影响仍有意义,这表明SBP纵向轨迹对房颤的影响优于基线SBP。
我们的研究采用了轨迹模型的统计学方法,分析了源于多次测量的SBP轨迹对新发房颤的影响。SBP纵向轨迹可以反映出SBP累积暴露水平对新发房颤的影响,这就比以往只考虑了单次测量的SBP的研究更能全面准确地反映长期的SBP变化对新发房颤的影响。既往关于房颤风险模型的研究表明,单次测量的SBP水平越高,个体未来发生房颤的风险越高[11-13],但个体SBP水平受多种因素干扰,个体SBP水平发生变化后,未来发生房颤的风险是否会有所改变,这是单次测量的SBP水平无法说明的。
我们的研究有以下优势:首先,这是第一项有关亚洲人群SBP纵向轨迹与房颤关联性的研究;其次,相较于以往关于血压纵向轨迹与房颤关联性研究的最大样本量为18 556例[13],我们纳入统计学分析的样本更大。
[1] Soliman EZ, Safford MM, Muntner P, et al. Artrial fibrillation and the risk of myocardial infarction. JAMA Intern Med, 2014, 174: 107-114.
[2] Guo XY, Lin N, Du x, et al. Atrial fibrillation is associated with an increased risk of myocardial infarction: Insights from a meta-analysis. Atherosclerosis, 2016, 254: 1-7.
[3] Stewart S, Hart CL, Hole DJ, et al. A population-based study of the long-term risks associated with arterial fibrillation: 20-year follow-up of the Renfrew/Paisley study. Am J Med, 2002, 113: 359-364.
[4] Miyasaka Y, Barnes ME, Bailey KR, et al. Mortality trends in patients diagnosed with first atrial fibrillation: a 21-year community-based study. J Am Coll Cardiol, 2007, 49: 986-992.
[5] Lloyd-Jones D, Adams RJ, Brown TM, et al. Heart disease and stroke statistics--2010 Update: a report from the American Heart Association. Circulation, 2010, 121: e46-e215.
[6] Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for thythm management and sroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation(ATRIA) Study. JAMA, 2001, 285: 2370-2375.
[7] Lip GY, Brechin CM, Lane DA. The global burden of atrial fibrillation and stroke: a systematic review of the epidemiology of atrial fibrillation in regions outside North America and Europe. Chest, 2012, 142: 1489-1498.
[8] Tse HF, Wang YJ, Ahmed Ai-Abdullah M, et al. Stroke prevention in atrial fibrillation--an Asian stroke perspective. Heart Rhythm, 2013, 10: 1082-1088.
[9] Miyasaka Y, Barnes ME, Gersh BJ, et al. Secular trends in incidence of atrial fibrillation in Olmsted County, Minnesota, 1980 to 2000, and implications on the projections for future prevalence. Circulation, 2006, 114: 119-125.
[10] Krijthe BP, Kunst A, Benjamin EJ, et al. Projections on the number of individuals with atrial fibrillation in the European Union, from 2000 to 2060. Eur Heart J, 2013, 34: 2746-2751.
[11] Schnabel RB, Sullivan LM, Levy D, et al. Development of a risk score for atrial fibrillation(Framingham Heart Study): a community-based cohort study. Lancet, 2009, 373: 739-745.
[12] Chamberlain AM, Agarwal SK, Folsom AR, et al. A clinical risk score for atrial fibrillation in a biracial prospective cohort(from the Atherosclerosis Risk in Communities[ARIC] study). Am J Cardiol, 2011, 107: 85-91.
[13] Alonso A, Krijthe BP, Aspelund T, et al. Simple risk model predicts incidence of atrial fibrillation in a racially and geographically divese population: the CHARGE-AF consortium. J Am Heart Assoc, 2013, 2: e000102.
[14] Niyonkuru C, Wagner AK, Ozawa H, et al. Group-based trajectory analysis applications for prognostic biomarker model development in severe tbi: a practical example. J Neurotramua, 2013, 30: 938-945.
[15] Nagin DS. Analyzing developmental trajectories: A semiparametric, group based approach. Psychol Methods, 1999, 4: 139-157.
[16] Rahman F, Yin X, Larson MG, et al. Trajectories of risk factors and risk of new-onset atrial fibrillation in the framingham heart study. Hypertension, 2016, 68: 597-605.
[17] Norby FL, Soliman EZ, Chen LY, et al. Trajectories of cardiovascular risk factors and incidence of atrial fibrillation over a 25-year followup: the ARIC study (atherosclerosis risk in communities). Circulation, 2016, 134: 599-610.
[18] Wu SL, Huang ZR, Yang XC, et al. Prevalence of ideal cardiovascular health and its relationship with the 4-year cardiovascular events in a northern chinese industrial city. Circ Cardiovasc Qual Outcomes, 2012, 5: 487-493.
[19] 党爱民, 陈炳伟. 2013欧洲高血压学会/欧洲心脏病学会高血压管理指南更新要点解读. 中国循环杂志, 2013, 28: 401-403.
[20] 赵振燕, 吴永健. 2013欧洲心脏病学会(ESC)糖尿病、糖尿病前期及心血管疾病诊断指南概述. 中国循环杂志, 2013, 28: 572-575.
[21] Nagin DS, Odgers CL. Group-based trajectory modeling in clinical research. Annual review of clinical psychology. Annu Rev Clin Psychol, 2010, 6: 109-138.
[22] Jones BL, Nagin D, Roeder K. A SAS procedure based on mixture model for estimating developmental trajectories. sociological methods & research. Sociol Methods Res, 2001, 29: 374-393.
[23] Schmitt J, Duray G, Gersh BJ, et al. Atrial fibrillation in acute myocardial infatction: a sysytematic review of the incidence, clinical features and prognostic implications. Eur Heart J, 2009, 30: 1038-1045.
[24] Singer DE, Albers GW, Dalen JE, et al. Antithrombotic therapy in atrial fibrillation: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133: 546s-592s.
[25] Conen D, Tedrow UB, Koplan BA, et al. Influence of systolic and diastolic blood pressure on the Risk of incident atrial fibrillation in women. Circulation, 2009, 119: 2146-2152.
[26] Grundvold I, Skretteberg PT, Liestøl K, et al. Upper normal blood pressures predict Incident atrial fibrillation in healthy middle-aged men: a 35-year follow-up study. Hypertension, 2012, 59: 198-204.
Relationship Between Longitudinal Trajectory of Systolic Blood Pressure and Atrial Fibrillation Occurrence in Kailuan Group Population
DU Xin, ZHANG Rui-ying, ZHANG Ying, SHI Ji-hong, HUANG Zhe, ZHU Chen-rui, LI Hui-ying, WEI Xiao-ming, LIN Li-ming, XIONG Hai-liang, LIU Yan, JI Chun-peng, WU Shou-ling.
Department of Cardiology Second Unit, Kailuan General Hospital, Tangshan (063000),Hebei, China
WU Shou-ling,Email:drwusl@163.com.
Objective: To explore the relationship between longitudinal trajectory of systolic blood pressure (SPB) and atrial fibrillation (AF) in Kailuan group population.
Methods: Our study cohort consisted of 40727 participants with the specific criteria in Kailuan group, Tangshan. SAS Proc Traj procedure was used to identify longitudinal trajectories of SPB throughout 2006-2007, 2008-2009 and 2010-2011. There were 5 longitudinal trajectories generated: Low-stable group, n=10950, Moderate-stable group, n=19158, Moderatehigh stable group, n=3713, High-moderate stable group, n=4702 and High stable group, n=2181. Log-rank test was performed to compare AF incidence throughout 2012-2013 and 2014-2015 by physical examination among different groups; Multi Cox regression analysis was conducted to study the relationship among different SBP longitudinal trajectories and AF occurrence.
Results:①The mean age of participants was (51.81±11.54) years including 30693 (75.4%) male.②AF occurrence rates in Low-stable, Moderate-stable, Moderate-high stable, High-moderate stable and High stable groups were 0.1%, 0.2%, 0.5%, 0.5% and 0.6% respectively, all P<0.05.③Multi Cox regression analysis presented that with adjusted confoundingfactors, compared with the patients in Low-stable group, Moderate-high stable, High-moderate stable and High stable SBP longitudinal trajectories were the risk factors for new AF occurrence (HR=7.58, 95% CI 2.08-27.73), (HR=5.30, 95% CI 1.88-14.95) and (HR=8.52, 95% CI 1.96-37.09) respectively, all P<0.05. With excluded history of myocardial infarction/stroke, the sensitivity study showed the similar result with the major research trend.
Conclusion: Elevated long trajectory of SPB was the risk factor for new AF occurrence in Kailuan group population.
Longitudinal trajectory of systolic blood pressure; Atrial fibrillation
2016-12-24)
(编辑:王宝茹)
063000 河北省唐山市,华北理工大学附属开滦总医院 心内二科(杜鑫、施继红、黄喆、朱辰蕊、李慧英、魏晓明、林黎明、熊海亮、刘妍、季春鹏、吴寿岭);华北理工大学研究生院(张芮英);华北理工大学附属医院 超声科(张莹)
杜鑫 主治医师 硕士 研究方向:健康行为因素对心血管事件的影响 Email:552444475@qq.com 通讯作者:吴寿岭 Email: drwusl@163.com
R54
A
1000-3614(2017)06-0584-05
10.3969/j.issn.1000-3614.2017.06.013
