两种不同取材方法在胰岛细胞电镜定位及观察中的比较
2017-06-24张芳成孙小玲
张芳成,刘 乐,肖 艺,孙小玲,官 阳

两种不同取材方法在胰岛细胞电镜定位及观察中的比较
张芳成,刘 乐,肖 艺,孙小玲,官 阳
胰岛;胶原酶P;电镜
随着电子显微技术的发展,组织或细胞超微结构观察已成为医学研究和临床医学检测必不可少的手段[1-2]。胰岛为胰腺的内分泌部,由胰岛细胞聚集形成大小不等和形状不定的细胞团,散在分布于胰腺各处;其分泌的胰岛素和胰高血糖素可直接控制碳水化合物的代谢,调节机体的血糖水平[3]。胰岛细胞的结构改变对其激素分泌有较大影响,故观察胰岛细胞超微结构对了解胰岛功能状态有重要价值。健康成人体内大约分布有300万个胰岛细胞[4],占胰腺总体积的1%~2%[5]。由于胰岛无固定形状,体积小,分布分散,肉眼无法识别。加之电镜取材小,可观察的范围有限。如采用常规的电镜取材方法直接取材,以半薄切片定位来寻找胰岛细胞,费时、费力且效果不佳,还时常因定位不准确而导致实验失败。因此,寻找快速、精准地获取胰岛细胞的方法对提高工作效率十分必要。本实验通过比较直接取材法和胶原酶P灌注法的优良,旨在寻找高效、可行的胰岛电镜取材定位的方法。
1 材料与方法
1.1 实验动物 健康SD雄性大鼠12只,随机分为2组,每组6只。
1.2 主要仪器设备及试剂 (1)光学显微镜(Olympus),超薄切片机(Leica UC7),透射电镜(HITACHI HT7700)。(2)胶原酶P、HBSS洗液、Histopaque1083,均购自美国Sigma公司;戊二醛、锇酸、乙醇、丙酮、Epon812、甲苯胺蓝、醋酸铀、柠檬酸铅,均购自北京中兴百瑞公司。
1.3 方法
1.3.1 直接法 (1)取材:将大鼠麻醉后,沿腹正中线逐层剪开腹腔,在左上腹部找到脾脏,脾脏位于胃和左肾之间,为长条形,颜色与肝脏相近。脾脏内侧近脾门处可见灰白色的组织为胰尾部,可见明显分叶状,分离外周脂肪组织、血管和十二指肠及脾脏,切除胰尾,切成大小1 mm×1 mm×1 mm组织。(2)预固定:2.5%戊二醛预固定30 min以上,采用0.1 mol/L PBS冲洗3次×10 min。(3)固定:1%锇酸固定1 h,采用0.1 mol/L PBS冲洗3次×10 min。(4)脱水:梯度乙醇及丙酮逐级脱水。(5)浸透:丙酮 ∶环氧树脂 (1 ∶1)37 ℃浸透4 h,纯环氧树脂37 ℃浸透4 h。(6)包埋及聚合:60 ℃ 4 h,90 ℃ 12 h。(7)切片:在超薄切片机上,用玻璃刀切出1 μm厚的半薄切片,甲苯胺蓝染色,光镜下定位胰岛所在部位;再用钻石刀切出70 nm厚的超薄切片。(8)染色:醋酸铀与柠檬酸铅双染;HT7700透射电镜下观察。
1.3.2 胶原酶P灌注法 取材:断颈处死大鼠,打开腹腔,移开肝脏和十二指肠,暴露胆管,夹住胆管的十二指肠开口处,切除肝脏游离胆总管上端,经胆总管注射2~3 mL胶原酶溶液至胰腺,使胰腺膨胀,切取膨胀的胰腺,将胰腺转移至含有2~3 mL(0.5 mg/mL)胶原酶P的50 mL离心管内,38 ℃水浴箱孵育约5 min,将离心管移至冰上,加入预冷HBSS洗液至20 mL,剧烈振摇离心管10 s;1 300 r/min离心后弃掉上清,20 mL洗液再次混匀离心,弃掉上清液,加入10 mL Histopaque1083轻轻吹打混匀,倾斜离心管,沿管壁缓慢加入等量预冷HBSS溶液,水平离心机800 r/min离心14 min。用吸管小心吸出2层液面分界层处的胰岛细胞,加入预冷HBSS溶液混匀,800 r/min离心3 min。重复洗涤离心2次,将悬浮液转至100 mm2有盖培养皿内,显微镜下用P20自动移液器挑取胰岛,在培养皿内手动挑取重悬胰岛3次,避免外分泌细胞的污染。后续电镜制样方法与直接法(2)~(8)相同。

2 结果
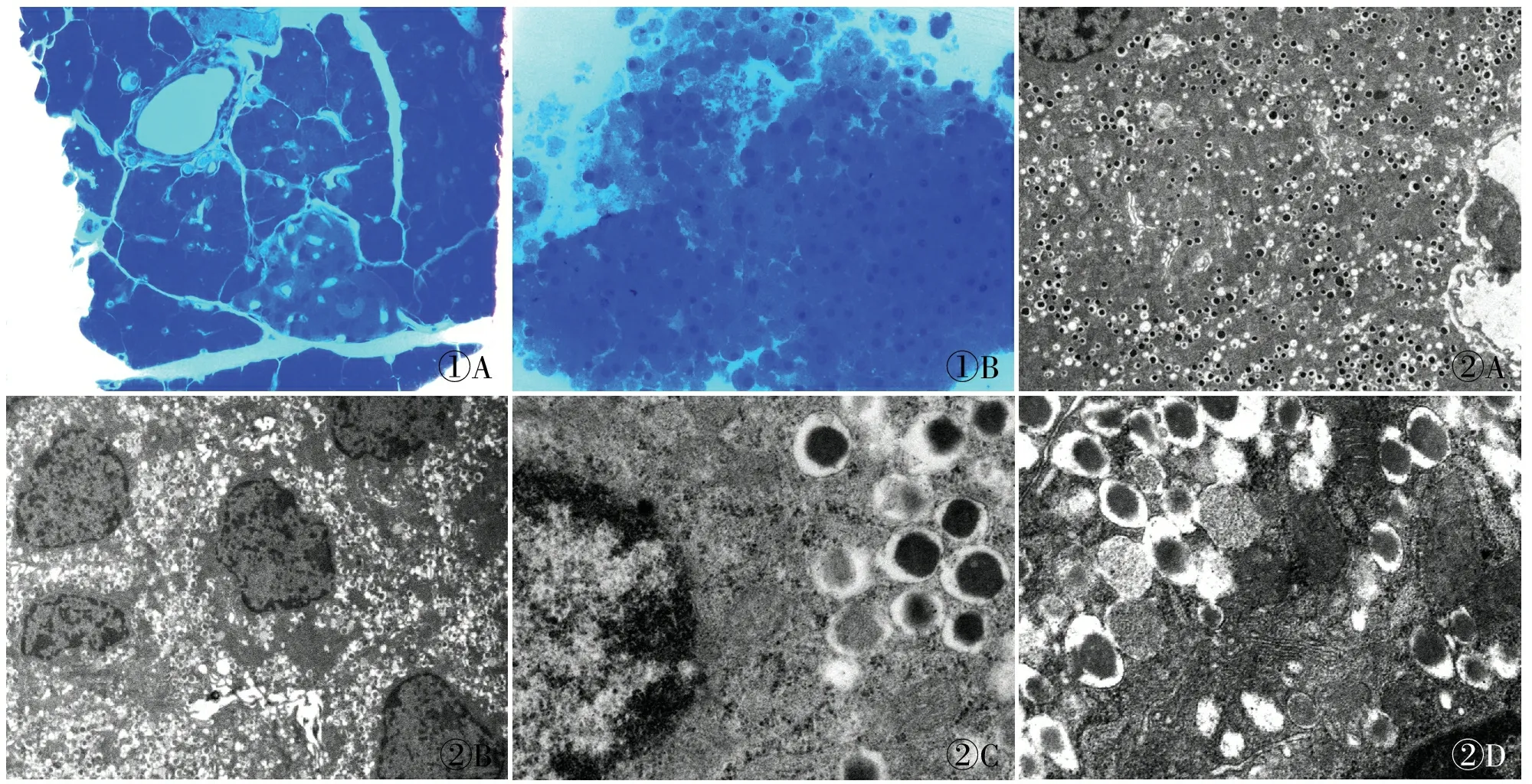
2.1 半薄切片定位时间 直接法经多次半薄切片及甲苯胺蓝染色,光镜下可见在较多胰腺腺泡中一淡染区域,周围有血管分布(图1A),直接法半薄切片定位胰岛细胞所需时间平均为(34.4±6.5) min;胶原酶P灌注法经半薄切片及甲苯胺蓝染色,光镜下可见较多大小一致的单个胰岛细胞(图1B),平均定位时间为(2.7±0.6) min,胶原酶P灌注法耗时明显低于直接法,差异有统计学意义(t=12.88,P<0.01)。
①A①B②A②B②C②D
图1 大鼠胰岛甲苯胺蓝染色:A.直接法;B.胶原酶P灌注法 图2 大鼠胰岛超微结构:A.直接法,透射电镜×1 000倍;B.胶原酶P灌注法,透射电镜×1 000倍;C.直接法,透射电镜×8 000倍;D.胶原酶P灌注法,透射电镜×8 000倍
2.2 胰岛细胞数量 直接法5个1 000倍视野(HT7700,1 000倍)可见胰岛细胞平均数量为(2.8 ± 1.0)个。胶原酶P灌注法同样倍数视野下平均细胞数量为(5.5±1.3)个。胶原酶P灌注法获取的胰岛细胞数量明显多于直接法,差异有统计学意义(t=8.55,P<0.01)。
2.3 胰岛细胞超微结构观察 超薄切片电镜下观察胰岛细胞胞核为圆形或卵圆形,核膜清晰完整,胞质内可见核糖体、粗面内质网、线粒体、高尔基器,另可见较多的膜包颗粒,即不同类型的内分泌颗粒。直接法和胶原酶P灌注法均可获得结构清晰完整的胰岛细胞(图2)。
3 讨论
透射电镜标本的制备技术精细,耗时较长。当标本较多时,切片量大,工作负担重,如长时间耗在半薄切片定位上,势必导致工作效率低下。此外,由于电镜标本大小仅为1 mm×1 mm×1 mm,限制标本的观察范围,影响超微结构观察的全面性[6]。因此,要在大片胰腺外分泌部中进行胰岛细胞的快速、精准定位,对于胰岛细胞的超微结构观察具有重要意义。
本实验结果显示,胶原酶P灌注法平均定位胰岛细胞的时间明显短于直接法。透射电镜前期制样过程耗时较长,如能缩短半薄切片定位时间,则可有效提高电镜切片效率,有利于科研及临床工作的开展。瞿文生等[7]认为,选取胰尾小血管周围的组织寻找胰岛是一种简便快捷的方法,省去了其他繁琐的步骤。该方法与本文描述的直接法类似;但由于胰岛解剖结构的特殊性、胰岛大小的差异性及分布密度的不均一性[3-5],导致后期半薄切片定位胰岛极为困难,须经反复多次的半薄切片及染色观察,才能在大片胰腺外分泌部中找见数量有限的胰岛细胞;有时甚至可能未找出胰岛而导致实验失败。同时,在取材过程中还可能出现挤压损伤胰岛细胞的超微结构,以致后期观察时不能获得清晰完整的电镜图片。也有研究表明[8],双硫腙溶液灌注后,有利于准确获取胰岛细胞;但该方法需先进行二甲胂酸钠灌注,再用固定液灌注后取材,还需严格把握灌注的压力及时间。采用胶原酶P灌注法,可直接分离获取纯度较高的胰岛细胞,半薄切片可以在较短时间内完成胰岛细胞定位。因此,胶原酶P灌注法是一种高效的胰岛细胞电镜取材法。
本实验在1 000倍透射电镜下,胶原酶P灌注法查见的胰岛细胞平均数量明显多于直接法,可较明显地提高胰岛细胞的观察效率。透射电镜观察通常存在切片较小而组织标本观察视野要尽可能大的矛盾[6]。因此,在有限的电镜视野中观察到较多数量的胰岛细胞,有利于实验者更为全面的判断胰岛细胞超微结构的改变,提高实验结果的准确率。目前,胶原酶P灌注法获得的胰岛细胞已广泛应用于体外胰岛细胞功能研究、胰岛细胞移植治疗Ⅰ型糖尿病等方面。该方法可获得数量较多、细胞存活率较高且生物学功能正常的胰岛细胞[5,9-10],胶原酶P灌注法还是一种切实可行的胰岛细胞电镜取材法。本实验结果显示,2种方法获取的胰岛细胞超微结构均保存完好,细胞器结构清晰,可满足实际工作需要。
综上所述,利用胶原酶P灌注法进行胰岛细胞电镜取材,用于胰岛细胞电镜定位及观察,可快速有效地获取数量较多的超微结构清晰的胰岛细胞,显著提高工作效率,有较好的实用价值;但胶原酶P取材相较于直接法操作过程繁杂,取材过程较为费时。因此,实验者可根据自身实验需求,合理选择实验方法。
[1] 张欠欠,马 莉,王逢会,等. 电镜技术在临床病理诊断中的应用[J]. 中国医疗前沿, 2011,6(4):65-67.
[2] 纪小龙,申明识,李维华,等. 电镜在诊断病理中的应用——2 183例分析[J]. 临床与实验病理学杂志, 1994,10(1):49-51.
[3] Wang X, Misawa R, Zielinski M C,etal. Regional differences in islet distribution in the human pancreas-preferential beta-cell loss in the head region in patients with type 2 diabetes[J]. PLoS One, 2013,8(6):e67454.
[4] Ionescu-Tirgoviste C, Gagniuc P A, Gubceac E,etal. A 3D map of the islet routes throughout the healthy human pancreas[J]. Sci Rep, 2015,5:14634.
[5] Hamelmann W, Esmeraldo R, Gray D W,etal. A simple method for isolation of islets from the rabbit pancreas[J]. Transplantation, 1994,58(3):390-392.
[6] 刘庆宏,何幼英,刘冰川. 多组织块集中树脂包埋法在透射电镜基础制样中的应用[J]. 临床误诊误治, 2013,26(12):46-48.
[7] 瞿文生,袁本利. 介绍一种实验动物胰岛电镜取材定位方法[J]. 临床与实验病理学杂志, 2010,26(4):501-502.
[8] 王心蕊,张凤兰,倪劲松,等. 胰岛电镜取材定位的新方法[J]. 白求恩医科大学学报, 1994,20(4):428-429.
[9] Pang X, Xue W, Feng X,etal. Experimental studies on islets isolation, purification and function in rats[J]. Int J Clin Exp Med, 2015, 8(11):20932-20938.
[10] Wang Y, Paushter D, Wang S,etal. Highly purified versus filtered crude collagenase: comparable human isletisolation outcomes[J]. Cell Transplant, 2011,20(11-12):1817-1825.
武汉大学人民医院超微病理中心,武汉 430000
张芳成,女,硕士,技师。Tel:(027)88041911-81488, E-mail:915821980@qq.com 官 阳,男,博士,主任医师,通讯作者。E-mail:guanyang@foxmail.com
时间:2017-5-17 23:54 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170517.2352.029.html
R 332
B
1001-7399(2017)05-0582-03
10.13315/j.cnki.cjcep.2017.05.029
接受日期:2017-02-22
