热激处理罗伊氏乳杆菌(Lactobacillusreuteri)增强其抗逆性的研究
2017-06-23杨帆,邹容
杨 帆,邹 容
(重庆文理学院林学与生命科学学院,重庆 402160)
热激处理罗伊氏乳杆菌(Lactobacillusreuteri)增强其抗逆性的研究
杨 帆,邹 容
(重庆文理学院林学与生命科学学院,重庆 402160)
为了研究热激对益生菌抗逆性的影响,本研究以罗伊氏乳杆菌(Lactobacillusreuteri)为实验对象,以存活率、抗性基因表达为指标,采用平板计数法研究了热激处理对罗伊氏乳杆菌在后续高温和高盐逆境下存活率提高的效果,并用qPCR方法检测基因表达水平。结果表明:热激预处理(40 ℃,30 min)罗伊氏乳杆菌之后,能显著(p<0.05)提高其在后续高温(45、48、51 ℃),高盐(0.1%、0.3%、0.7% NaCl,m/v)以及氧化逆境(H2O2,0.3、0.6、1.2 mmol/L)下的存活率。此外,热激预处理(40 ℃,30 min)还能显著(p<0.05)提高巯基过氧化物酶(thiol peroxidase)和抗氧化蛋白(peroxiredoxin)的转录表达水平。说明热激处理通过提高罗伊氏乳杆菌抗逆基因的表达,增强其对于后续逆境的抗性。该研究结果为益生菌的规模化应用提供了理论依据。
罗伊氏乳杆菌,抗逆性,基因表达,存活率,热激处理
随着抗生素在饲料中长期大量使用,其引发的微生物耐药性、食品安全和环境污染问题越来越受到人们的重视。益生菌是定植于宿主肠道系统内,能产生确切健康功效从而改善宿主微生态平衡、发挥有益作用的一类有益微生物,作为新型安全高效的饲料添加剂替代抗生素[1]。乳酸菌是益生菌的重要类群,罗伊氏乳杆菌(Lactobacillusreuteri)为革兰氏阳性细菌,存在于多种鸟类和哺乳动物肠道内,是国际公认的新型益生乳酸杆菌,具有较大理论研究和应用研究价值[2-3]。
然而,乳杆菌在作为饲料添加剂应用的过程中,会受到各种环境逆境(如高温、低温、高盐、氧化、酸胁迫等)的影响,从而影响其活力和有益功能[4-8]。然而,目前关于增强罗伊氏乳杆菌(L.reuteri)抗逆性的研究尚未见报道。为了充分发挥其作为饲料添加剂的应用前景,利用环保高效、操作简单的方法增强罗伊氏乳杆菌的抗逆性,本实验采用物理方法-热激预处理(40 ℃,30 min)罗伊氏乳杆菌之后,对其在后续高温、高盐以及氧化逆境的抗逆性做了研究。并在分子水平检测热激预处理对巯基过氧化物酶(thiol peroxidase)和抗氧化蛋白(peroxiredoxin)的表达水平的影响。该研究结果将为罗伊氏乳杆菌的规模化应用提供了理论依据。
1 材料与方法
1.1 材料与仪器

表1 抗逆基因和内参基因RT-qPCR扩增的引物序列Table 1 Primers of anti-stress and reference genes for RT-qPCR amplification
罗伊氏乳杆菌(L.reuteriCICC 6128) 中国工业微生物菌种保藏管理中心,是分离于鸡肠内的益生菌株;EasyPure RNA提取试剂盒 北京全式金生物技术有限公司;SuperScript III Platinum SYBR Green一步法 RT-qPCR 试剂盒 美国Invitrogen公司;胰蛋白胨、酵母提取物、NaCl、H2O2国药集团化学试剂有限公司。
HH-4Y型电热恒温水浴锅 上海启前电子科技有限公司;ABI Step One Plus型qPCR仪 美国Applied Biosystems公司。
1.2 乳杆菌菌株及热激处理
罗伊氏乳杆菌(L.reuteri)含有20 mL的LB液体培养基(胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,1 L无菌水,pH7.0)的50 mL锥形瓶内,37 ℃ 下,以200 r/min的转速培养16 h,使其OD值达到0.3左右。离心(5000×g,4 ℃,1 min)去掉培养基,然后将菌体重新悬浮于无菌水中,菌体浓度调OD值为1.0。之后将5 mL的OD值为1.0的L.reuteri悬浮液置于20 mL的锥形瓶中。根据预实验的结果,热激处理条件定为:40 ℃水浴热激处理30 min。未经过水浴热激处理的菌体作为对照。
1.3 逆境下存活率检测
将上述经过热激预处理(40 ℃,30 min)和未经过热激处理的罗伊氏乳杆菌分别置于后续高温(45、48、51 ℃水浴),高盐(0.1%、0.3%、0.7%,m/v的NaCl溶液)以及氧化逆境(0.3、0.6、1.2 mmol/L的H2O2溶液)下处理30 min。然后将菌液梯度浓度稀释,均匀涂布于LB固体培养基上,37 ℃下培养2 d。
将同一浓度梯度下的菌液均分为两等份,一份在逆境处理前涂布于LB固体培养基上,另一份在逆境处理后涂布于LB固体培养基上。按照上述条件培养,计数在培养基上生长出菌落数CFU,计算存活率。存活率用逆境处理前与处理后的菌体CFU比值(%)表示[9]。
1.4 抗逆基因的表达检测
罗伊氏乳杆菌在各个处理时间点的RNA提取,DNase处理和纯化使用的是EasyPure RNA提取试剂盒,步骤根据试剂盒提供的方案进行。纯化后的40 ng RNA用于RT-qPCR的分析,每个反应所用的引物是20 pmol,所用荧光染料和试剂盒为SuperScript III Platinum SYBR Green一步法RT-qPCR试剂盒,所用qPCR仪器的程序参数设置如下:cDNA合成48 ℃,30 min;变性95 ℃,5 min;60 ℃,20 s之后进行40个循环,95 ℃,5 s;95 ℃,15 s;60 ℃,1 min。以16S rRNA为内参基因[10-11],2-ΔΔCt的方法[12]表示目的基因巯基过氧化物酶(thiol peroxidase)和抗氧化蛋白(peroxiredoxin)的相对表达量(最新的研究报道在其它细菌中表明这两个基因参与抗逆应答[13-14],并且在罗伊氏乳杆菌中两者核酸序列在NCBI数据库中已公开,因此本研究选择检查这两个抗逆基因的表达)。引物序列参见表1。
1.5 数据分析
每个样品设3个平行,采用SPSS 20.0软件进行数据分析。测定结果以平均值±标准差表示。实验数据采用T检验分析差异,以p<0.05为显著差异。
2 结果与分析
2.1 热激处理对罗伊氏乳杆菌后续高温耐受性的影响
热激预处理(40 ℃,30 min)之后,将罗伊氏乳杆菌置于后续的高温、高盐和氧化逆境,分析比较热激预处理组和未热激对照组罗伊氏乳杆菌在上述逆境下的存活率。如图1所示,高温(45、48、51 ℃)下处理罗伊氏乳杆菌在半个小时,会导致其存活率下降。随着温度的提高,其存活率下降。然而,热激预处理组的罗伊氏乳杆菌在上述各个高温处理下的存活率均显著高于对照组(p<0.05),说明热激预处理可增强罗伊氏乳杆菌的抗热性,其原因可能在于热激预处理激活了细胞中的抗逆应答防御,对后续更高的热胁迫产生抗性。

图1 热激和对照组罗伊氏乳杆菌在后续高温下的存活率Fig.1 The survival of heat-shocked and control L. reuteri under the subsequent high temperature注:同一温度下,字母不同表示差异显著, p<0.05。图2、图3同。
2.2 热激处理对罗伊氏乳杆菌后续高盐耐受性的影响
如图2所示,高盐(0.1%、0.3%和0.7% NaCl,w/v)处理罗伊氏乳杆菌半个小时,会导致其存活率下降。随着盐浓度的提高,其存活率下降越显著。然而,热激预处理组的罗伊氏乳杆菌上述各个高盐浓度下的存活率均显著高于对照组(p<0.05),说明热激预处理可增强罗伊氏乳杆菌的耐盐性。其原因可能在于热激预处理激活了细胞中的抗逆应答防御,对后续的高盐胁迫产生交互保护。
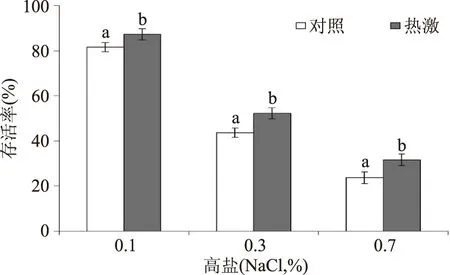
图2 热激和对照组罗伊氏乳杆菌在后续高盐下的存活率Fig.2 The survival of heat-shocked and control L. reuteri under the subsequent salt stress
2.3 热激处理对罗伊氏乳杆菌后续氧化耐受性的影响
如图3所示,氧化逆境(0.3、0.6、1.2 mmol/L H2O2)下处理罗伊氏乳杆菌在30 min,会导致其存活率下降。随着盐浓度的提高,其存活率下降越显著(p<0.05)。然而,热激预处理组的罗伊氏乳杆菌上述各个H2O2浓度下的存活率均显著高于对照组(p<0.05),说明热激预处理可增强罗伊氏乳杆菌的抗氧化性。其原因可能在于热激预处理激活了细胞中的抗逆应答防御,对后续的氧化胁迫产生交互保护。针对上述热激增强罗伊氏乳杆菌对后续高温、高盐和氧化耐受性的表型,笔者推测热激激活了细菌细胞中的特定抗性基因,于是进行了下一步抗性基因表达的检测。

图3 热激和对照组罗伊氏乳杆菌在后续氧化逆境下的存活率Fig.3 The survival of heat-shocked and control L. reuteri under the subsequent oxidative stress
2.4 热激处理对罗伊氏乳杆菌抗逆基因的表达
为了进一步研究热激处理提高罗伊氏乳杆菌抗逆性的机理,分别选取了适中的逆境(48 ℃、0.3% NaCl和0.6 mmol/L H2O2)检测热激预处理对抗逆相关的巯基过氧化物酶(thiol peroxidase)和抗氧化蛋白(peroxiredoxin)在转录水平表达的影响。巯基过氧化物酶(thiol peroxidase)在模式微生物酿酒酵母中可作为H2O2受体及氧化还原传导因子,在抗逆中起着信号转导作用[15];在蓝细菌中过量表达抗氧化蛋白(peroxiredoxin)可清除细胞中的活性氧(ROS),从而提高细菌的抗氧化能力[16]。本研究中,如图4所示,热激预处理组的罗伊氏乳杆菌上述各个所测逆境下巯基过氧化物酶(图4A)和抗氧化蛋白(图4B)的基因表达均显著高于对照组(p<0.05)。图5显示的是相对应的巯基过氧化物酶(图5A)和抗氧化蛋白(图5B)的qPCR扩增曲线图。

图4 热激和对照组罗伊氏乳杆菌在后续逆境下巯基过氧化物酶(A)和抗氧化蛋白(B)的基因表达Fig.4 The gene expression of thiol peroxidase(A) and peroxiredoxin(B)in heat-shocked and control L. reuteri under the subsequent stresses

图5 巯基过氧化物酶(A)和抗氧化蛋白(B)的qPCR扩增曲线图Fig.5 The qPCR amplification curve of thiol peroxidase(A)and peroxiredoxin(B)
3 结论
最新的研究表明巯基过氧化物酶(thiol peroxidase)和抗氧化蛋白(peroxiredoxin)在微生物对抗性应答的过程中起着关键作用[17-18]。本研究发现热激预处理作为简便环保的方法,可以提高罗伊氏乳杆菌中这两个抗逆相关基因的表达,从而增强对后续高温、高盐和氧化逆境的耐受性。此研究成果对于增强罗伊氏乳杆菌抗性,从而更好地应用于饲料添加剂提供了有效方法和理论基础。热激处理能否增强其他益生菌的抗逆性将会进一步深入研究。
[1]Santini C,Baffoni L,Gaggia F,et al. Characterization of probiotic strains:an application as feed additives in poultry against Campylobacter jejuni[J]. International Journal of Food Microbiology,2010(Suppl 1):98-108.
[2]朱振军,黄国宏,梁晓琳,等. 罗伊氏乳杆菌的益生特性及安全性分析[J]. 现代食品科技,2016(6):315-320.
[3]李文静,梁运祥,赵述淼. 3株罗伊氏乳杆菌生物学特性的分析比较[J]. 微生物学通报,2016,43(5):1035-1041.
[4]张玉磊,吴荣荣,张碧坚,等. 微胶囊化的嗜酸乳杆菌在极端环境下的生理特性研究[J]. 中国乳品工业,2006,34(12):7-12.
[5]Aazami N,Salehi Jouzani G,Khodaei Z,et al. Characterization of some potentially probiotic Lactobacillus strains isolated from Iranian native chickens[J]. Journal of General and Applied Microbiology,2014,60(6):215-221.
[6]潘艳,何胜江. 保护剂对冷干和贮存过程中乳杆菌存活率的影响[J]. 饲料工业,2010,31(6):36-39.
[7]袁峥,赵瑞香,牛生洋,等. 酸胁迫下嗜酸乳杆菌菌体形态的扫描电镜观察[J]. 食品工业科技,2012,33(24):199-201.
[8]田芬,陈俊亮,粘靖祺,等. 嗜酸乳杆菌和双歧杆菌益生特性的研究[J]. 食品工业科技,2012,33(7):139-142.
[9]Liu J,Wisniewski M,Droby S,et al. Effect of heat shock treatment on stress tolerance and biocontrol efficacy of Metschnikowia fructicola[J]. FEMS Microbiology Ecology,2011,76(1):145-155.
[10]Edwards K J,Saunders N A. Real-time PCR used to measure stress-induced changesin the expression of the genes of the alginate pathway of Pseudomonas aeruginosa[J]. Journal of Applied Microbiology,2001,91:29-37.
[11]McMillan M,Pereg L. Evaluation of reference genes for gene expression analysis using quantitative RT-PCR in Azospirillumbrasilense[J]. PLoS One,2014,9(5):e98162.
[12]Livak KJ,Schmittgen TD. Analysis of relative gene expressiondata using real-time quantitative PCR and the 2-ΔΔCtmethod[J]. Methods,2001,25(4):402-408.
[13]Sasoni N,Iglesias AA,Guerrero SA,et al. Functional thioredoxin reductase from pathogenic and free-living Leptospira spp[J]. Free Radical Biology and Medicine,2016,97:1-13.
[14]Pérez S,Taléns-Visconti R,Rius-Pérez S,et al. Redox signaling in the gastrointestinal tract[J]. Free Radical Biology and Medicine,2017,104:75-103.
[15]Delaunay A,Pflieger D,Barrault MB,et al. A thiol peroxidase is an H2O2receptor and redox-transducer in gene activation[J]. Cell,2002,111:471-481.
[16]Tailor V,Ballal A. Novel molecular insights into the function and the antioxidative stress response of a Peroxiredoxin Q protein from cyanobacteria[J]. Free Radical Biology and Medicine,2017,106:278-287.
[17]Hillmann F,Bagramyan K,Straβburger M,et al. The crystal structure of peroxiredoxin asp f3 provides mechanistic insight into oxidative stress resistance and virulence of Aspergillus fumigatus[J]. Scientific Reports,2016(6):33396.
[18]Zhang L B,Tang L,Ying S H,et al. Regulative roles of glutathione reductase and four glutaredoxins in glutathione redox,antioxidant activity,and iron homeostasis of Beauveria bassiana[J]. Applied Microbiology and Biotechnology,2016,100(13):5907-5917.
Improvement of stress tolerance ofLactobacillusreuteriby heat shock
YANG Fan,ZOU Rong
(Chongqing University of Arts and Sciences,College of Forestry & Life Science,Chongqing 402160,China)
In order to assay the effect of heat shock(HS)on the stress tolerance of the probiotic bacterium,Lactobacillusreuteriserves as the research objective in this study. The survival and gene expression ofL.reuteriunder stress condition has been determined via CFU counting method and qPCR analysis. The results showed that the HS pretreatment(40 ℃,30 min)significantly(p<0.05)increased the survival ofL.reuteriunder the subsequent heat stress(45,48,51 ℃),salt stress(0.1%,0.3%,0.7%,m/v)and oxidative stress(0.3,0.6,1.2 mmol/L),respectively. In addition,the HS pretreatment(40 ℃,30 min)markedly enhanced the transcriptional expression of thiol peroxidase and peroxiredoxin. It suggested that HS pretreatment could improve stress tolerance via increasing the expression of anti-stress genes. These results provide a theoretical basis for the large-scale application of probiotics.
Lactobacillusreuteri;stress tolerance;gene expression;survival;heat shock
2016-12-02
杨帆(1963-),男,硕士,教授,研究方向:益生菌的开发与利用,E-mail:yfan4103@163.com。
TS201.3
A
1002-0306(2017)11-0173-04
10.13386/j.issn1002-0306.2017.11.024
