浅析铁矿石中铁含量的测定
2017-06-23曹红波河北遵化市自来水公司河北遵化064200
曹红波(河北遵化市自来水公司, 河北 遵化 064200)
浅析铁矿石中铁含量的测定
曹红波(河北遵化市自来水公司, 河北 遵化 064200)
铁矿石分析方法常用的有滴定法,滴定法关键在于还原剂的选择上应符合绿色化学理念;分光光度法:Fe2+、Fe3+两种价态分别进行分析;原子吸收法作为裁决式分析。
铁元素;方法选择;测定
铁矿石与处理即样品液的制备:将铁矿石破碎、过筛后准确称取1.0g,至于250ml烧杯中,1ml(1+10)HCl溶液湿润,加20ml浓盐酸盖上表面皿,在通风橱中加热至微沸,保持20分钟,静置约1分钟后取出,用少量纯净水冲洗表面皿和烧杯壁;过滤、用25ml 80℃纯水清洗烧杯5次后移至200ml容量瓶中,稀释至刻度,摇匀备用,制成铁矿样品溶液。制备铁矿样溶解操作注意:①只加表面皿,在溶解过程不准许打开盖好的表面皿,防止溶液溅出引起试样损失。②保证铁完全溶解,以残渣接近白色为宜。③溶解过程保持微沸,不能把溶液蒸干,如果在20分钟内将要蒸干,可补加3~5ml,继续溶解。
1 试剂和仪器
(1)仪器:7-23分光光度仪;日立180-70型原子吸收分光光度计;铁空心阴极灯;完成试验所用玻璃仪器等。
(2)试剂:
滴定法所用试剂:①SnCl2溶液(100g· L-1):称取10g SnCl2·2 H2O溶于浓热HCl溶液中,加水稀释至100ml。②SnCl2溶液(50g· L-1):称取5g SnCl2·2 H2O溶于浓热HCl溶液中,加水稀释至100ml。③二苯胺磺酸钠(1g· L-1):称取1g二苯胺磺酸钠溶于1000ml水中;④1/6K2Cr2O7标准储备溶液(0.1mol/L):准确称取7.3545g经165℃干燥2小时,并冷却至室温的K2Cr2O7,溶于纯水中,移入1000ml容量瓶中,稀释至刻度,摇匀,此溶液浓度0.15mol/L。常用0.015mol/L K2Cr2O7使用液,即将0.15mol/L K2Cr2O7标准储备溶液稀释10倍。⑤H2SO4-H3PO4将150ml浓H2SO4缓慢加至700ml 纯水中,冷却后加150ml浓H3PO4,摇匀。
分光光度法测Fe2+所用试剂:①硫酸亚铁铵标准溶液(100µg·ml-1):称取0.7022g Fe(NH4)2Fe(SO4)2·6H2O,溶于(1+10)HCl溶液,移入1000ml容量瓶中,纯水稀释至刻度,要匀。②乙酸铵缓冲溶液pH=4.2:称取250 g乙酸铵,溶于150ml水中,再加入700ml冰乙酸,混匀。③盐酸羟胺溶液(100g/L):称取10 g盐酸羟胺溶于水中,稀释至100ml。④二氮杂菲溶液(1g/L):称取0.1g二氮杂菲溶于加有3滴(1+1)盐酸的水中,移入100ml容量瓶中,稀释至刻度,摇匀。
分光光度法测Fe3+所用试剂:①硫酸铁铵(100µg·ml-1):称取0.8634g FeNH4(SO4)2·12H2O,溶于(1+10)HCl溶液,移入1000ml容量瓶中 纯水稀释至刻度,要匀。②磺基水杨酸溶液(10 g·ml-1):称取磺基水杨酸10g,溶于100ml水中。
原子吸收法所用试剂1mg/L:①铁储备液(1.0mg·ml-1) 将1 g纯铁溶于20ml(1+1)盐酸中移入1000ml容量瓶中,稀释至刻度,摇匀。②铁标准使用液(100µg·ml-1):用移液管准确移取铁储备液10ml置于100ml容量瓶中,用蒸馏水稀释至刻度,摇匀。
公用试剂:①浓盐酸(比重1.19),直接使用或配制成符合实验要求所需的各浓度盐酸溶液。②取50ml样品液,至于1000ml容量瓶中纯水稀释至刻度,用于仪器分析。
2 滴定法分析
(1)滴定分析过程及说明:用浓盐酸溶液分解后,在浓、热HCl溶液中用过量的SnCl2将Fe3+还原为:Fe2+:FeCl3+SnCl2=FeCl2+SnCl4,对于过量的Sn2+对测定铁有干扰,经笔者多年试验经验,并请教唐山师院老师,以甲基橙为指示剂指示终点效果最理想,在Sn2+将Fe3+全部还原后,过量的Sn2+可将甲基橙(-N=N-)双键打开生成氢化甲基橙即(=N-N=)而退色,不仅指示终点,还消除过量的Sn2+,一举双得。
在Sn2+将Fe3+还原过程中盐酸浓度控制4mol·L-1左右,大于5.5mol·L-1Sn2+先将甲基橙还原,则不利于指示终点,小于3mol·L-1反应速度很慢,退色慢,终点难已指示。
将Fe3+还原Fe2+后,在1:1H2SO4-H3PO4介质中,二苯胺磺酸钠作指示剂,用K2Cr2O7标准滴定Fe2+,至紫红色。加入H3PO4的目的,由于生成Fe(HPO4)+,降低了铁电对的电动势,使二苯胺磺酸钠的变色点电动势落入滴定的突跃范围之内,减少了终点误差;生成无色的Fe(HPO4)+,消除了FeCl3的黄色,有利于终点观察,提高准确度。
在HCl溶液中用K2Cr2O7标准滴定Fe2+过程中, K2Cr2O7标准电极电势:E=1.33V,而Cl2/Cl=1.36V,故在通常环境下K2Cr2O7不与Cl-反应。尤其K2Cr2O7与Fe2+的氧化还原反应中不会诱导K2Cr2O7不与Cl-反应。因此在HCl溶液中用K2Cr2O7滴定Fe2+。

(2)分析步骤:精确移取25ml试样于250ml锥形瓶中,加入8ml浓HCl溶液,加热接近沸腾,加入5滴甲基橙指示剂,趁热边滴加100g· L-1SnCl2溶液边摇动锥形瓶,至溶液由橙色变红色,然后更换50g· L-1SnCl2溶液继续滴加至粉色,再由粉色退去。即可用自来水冷却锥形瓶外壁,然后加入50ml纯净水,加20ml H2SO4-H3PO4溶液,4滴二苯胺磺酸钠溶液,立即用K2Cr2O7标准溶液滴定,溶液颜色变化为无色→淡绿色→绿色加深→蓝紫消失渐慢,此时表明将将到终点,应小心滴加,出现两者混合色即蓝紫带灰时,半滴滴加,到溶液紫红色为终点。计算矿石中铁的含量:消耗0.015mol/L K2Cr2O7使用液10ml,则根据公式:


式中:C为K2Cr2O7使用液的浓度;V为消耗K2Cr2O7使用液的体积;6为化学计量数;55.845为铁的摩尔质量;G为铁的质量。
小结:①采用上述重铬酸钾法分析铁,操作比较复杂,加热过程必须小心、谨慎,缺点误差大。②改进并淘汰了传统方法,即用HgCl2氧化过量的SnCl2,但HgCl2和氧化后生成的Hg2Cl2都会造成环境污染;还有所谓环保一点SnCl2—Ti Cl3联合还原法,但该方法所用试剂较多,步骤多,相对成本也高,因此一并淘汰。③滴加SnCl2过程中,由高浓度更换到低浓度的目的是防止SnCl2过量太多,便于控制用量而影响准确度,便于显示终点。
3 分光光度法
分光光度法原理:通过被测金属与显色剂反应(或配位反应),生成有色物质在特定波长处,一定波程范围内对光的吸光程度,对该物质进行定性和定量分析的方法。
(1)分光光度法检测二价铁:在pH为3~9条件下,Fe2+与二氮杂菲生成稳定的橙色络合物,分析波长510nm。
分析步骤:
①取150ml锥形瓶7个分别加入硫酸亚铁铵标准溶液(100µg·ml-1)使用液,0.0、1.0、3.5、6、8、10ml,6号是试样8ml。各加纯水至50ml。0号是空白试验(空白调整零吸收),
②向水样及标准溶液分别加入4ml盐酸溶液,1ml盐酸羟胺溶液,煮沸,浓缩至约25ml,冷却至室温后,移入50ml比色管中。1~5浓度为:2、7、12、16、20µg·ml-1,6号是试样待测。
③向水样及标准系列比色管中各加2ml二氮杂菲溶液,摇匀后再加10ml乙酸铵缓冲溶液,加纯水至50ml,摇匀,静置15分钟。
④于波长510nm,用1cm比色皿,纯水作参比,测定1号~6号吸光度A:0.089、0.296、0.503、0.668、0.833,6号是试样吸光度0.671。
⑤数据处理:
a.在坐标纸上以铁的系列标准溶液的浓度为横坐标,吸光度为纵坐标绘制A-C标准曲线。图形如(原子吸收法测定铁中吸光度对浓度的坐标图)。
b.回归方程:将吸光度、及对应的浓度带入回归方程:
得一元回归方程:y = 0.0064 + 0.0413x
相关系数:R=0.99986,接近于1。吸光度与铁离子的浓度呈线性关系。试样吸光度A=0.671查表或代入回归方程得分析试样浓度C=16.092µg·ml-1,倒推铁矿样溶液中铁含量为402.3mg,即402.3mg/1000mg =40.23%。
(2)分光光度法检测三价铁:先将试样Fe2+用过硫酸铵氧化成Fe3+在pH为9~11条件下Fe3+与磺基水杨酸生成黄色络合物,分析波长425nm。
分析步骤:
①制作标准曲线:取50ml比色管6个,依次编号0~5分别加入1ml浓盐酸,标准溶液使用液0ml、1~5按下表,加4ml磺基水杨酸溶液,加氨水4ml,摇匀,使pH在9~11,加纯水至50ml。于波长425nm,用1cm比色皿,纯水作参比,测定吸光度A。0号是空白试验(空白调整零吸收),数据见表1。
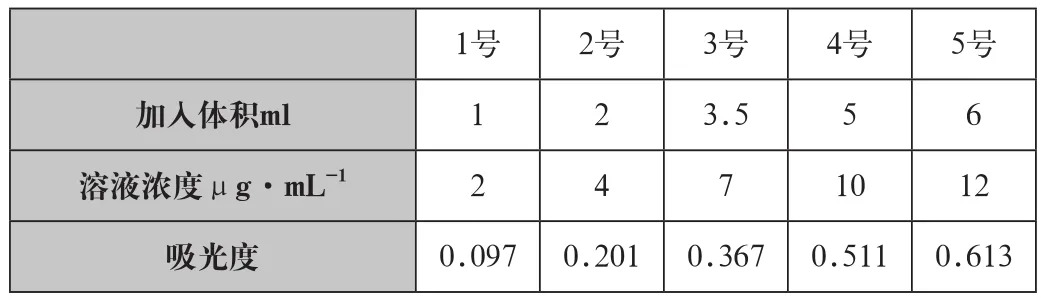
表1
②数据处理:
a.在坐标纸上以铁的系列标准溶液的浓度为横坐标,吸光度为纵坐标绘制A-C标准曲线(图略,图形同3-2分析步骤第3步),得一直线;图形如(原子吸收法测定铁中吸光度对浓度的坐标图)。
b.回归方程:将吸光度、及对应的浓度带入回归方程:得一元回归方程:y = 0.00592 + 0.0516x;计算相关系数:R=0.99998,接近于1。吸光度与铁离子的浓度呈线性关系。
(3)取试样溶液5ml至于150ml三角瓶中,加入1ml浓盐酸和8g过硫酸铵,加纯水至约50ml,煮沸,浓缩至约25ml,冷却至室温后,移入50ml比色管中。用纯水清洗三角瓶3次,每次用水量1.5ml,洗液并入比色管中,加4ml 磺基水杨酸溶液,加氨水4ml,摇匀,使pH在9~11,加纯水至50ml。于波长425nm,用1cm比色皿,测定吸光度A=0.513,查表或代入回归方程得分析试样浓度C=10.0566µg·ml-1,倒推铁矿样溶液中铁含量为402.264 mg,即402.264 mg/1000 mg =40.2264%,
小结:过硫酸铵易水解,在100℃左右易分解,水解、分解后产生硫酸铵,不影响实验。因此过硫酸铵是最佳氧化剂,不选择过硫酸钾或其它氧化剂的原因,以免增加分析液粘度,导致数据不准。
分光光度法总结:同一仪器分析检测同一溶液中不同价态的同一元素,显色剂不同,颜色不同,分析波长不同,比较结果非常接近,几乎相等。说明两种方法均可行,但笔者倾向二价铁分析方法,因盐酸羟胺稳定。
4 原子吸收法
原理:将含铁样品或铁标准溶液直接吸入分析火焰,在火焰中形成的铁原子对铁元素空心阴极灯发出特征电磁辐射产生吸收,吸收共振线的量与样品中该元素的含量呈正比,符合朗伯-比尔定律,将测得的样品吸光度和标准溶液的吸光度进行比较,确定样品中铁元素的含量及准确浓度。
分析步骤:(1)取150ml锥形瓶7个分别加入铁标准溶液使用液0ml、0.25ml 、0.5ml、1.0ml、2.0ml 、3.0ml,试样5ml,各加纯水至50ml试样。则此时对应的浓度为:0号是空白试验(空白调整零吸收),6号是试样(表2)。
实验以乙炔气为燃气,空气为助燃气,样品吸光度(图3)。
表2
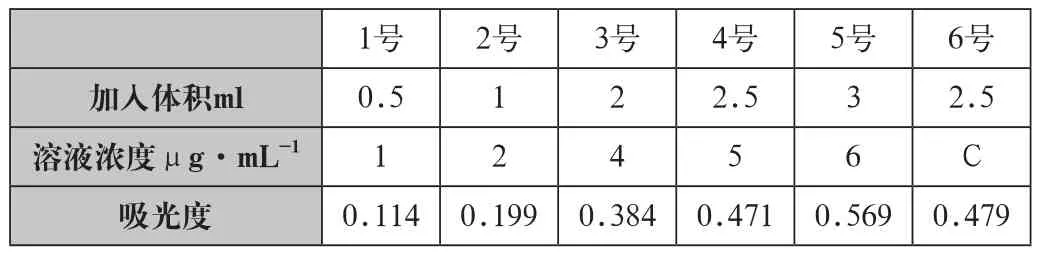
表3
(4)数据处理:
①回归方程计算:将吸光度、及对应的浓度带入回归方程:得一元回归方程:y = 0.0031 + 0.0788x;计算相关系数:R=0.99985,接近于1。吸光度与铁离子的浓度呈线性关系,试样吸光度A=0.479查表或代入回归方程得分析试样浓度C=5.0273µg·ml-1,倒推铁矿样溶液中铁含量为403.1mg,即403.1mg/1000mg =40.31%。
②在坐标纸上以铁的系列标准溶液的浓度为横坐标,吸光度为纵坐标绘制A-C标准曲线(图略,图形同3-2分析步骤第3步),得一直线。如下图:
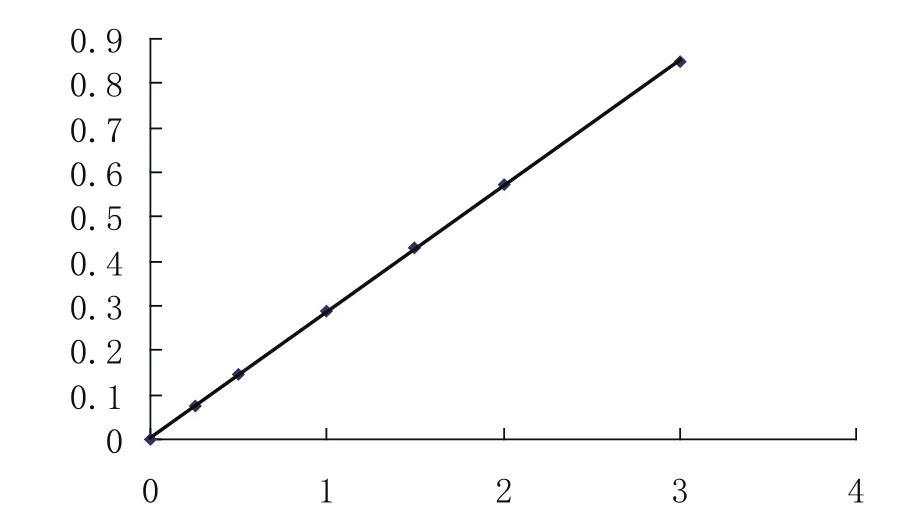
5 结语
作图法是不准确的,因为在坐标纸上千分位即使在放大镜下也不易找到精准的位置,但必须做出来,做出来心里有底,即如果几个点在一条直线上,或接近直线,那么就可以计算回归方程,否则只有重做实验;回归方程是准确的,如果相关系数R是小数点后有三个9以上即接近于1,成线性关系,那么数据可信、分析准确。
原子吸收分析法测定铁元素可不考虑铁的价态,
[1]曾泳淮.分析化学.高等教育出版社,2010.
[2]濮文虹.水质分析化学.华中科技大学出版社,2009. [3]黄秀莲.环境分析与监测.高等教育出版社,1989.
曹红波,化工工程师,长期从事水质检测工作。
