鱼糜中活泼羰基化合物在胶凝过程中的变化
2017-06-22付湘晋李忠海林亲录TyreLanier
付湘晋,刘 颖,李忠海,林亲录,Tyre C. Lanier
(1.长沙环境保护职业技术学院环境科学系,湖南长沙 410004;2.中南林业科技大学食品科学与工程学院,湖南长沙 410004;3.北卡州立大学食品生物工程与营养科学系,美国北卡罗来纳州,罗利 27695)
鱼糜中活泼羰基化合物在胶凝过程中的变化
付湘晋2,3,刘 颖1,*,李忠海2,林亲录2,Tyre C. Lanier3
(1.长沙环境保护职业技术学院环境科学系,湖南长沙 410004;2.中南林业科技大学食品科学与工程学院,湖南长沙 410004;3.北卡州立大学食品生物工程与营养科学系,美国北卡罗来纳州,罗利 27695)
本文采用五氟苯肼原位衍生化-固相微萃取-气相/质谱法检测了鲢鱼鱼糜、冷冻鱼糜及鱼糜凝胶中的三种活泼羰基化合物(RCCs):丙二醛(MDA)、4-羟基-己烯醛(HHE)、4-羟基-壬烯醛(HNE);并采用添加五氟苯肼清除RCCs,阻断RCCs-蛋白质反应,分析鱼糜中RCCs对鱼糜蛋白胶凝特性的影响。结果表明:新鲜鲢鱼糜中MDA(0.42±0.02) mg/kg、HHE(0.21±0.03) mg/kg含量高于HNE(0.07±0.00) mg/kg;冷冻鱼糜RCCs含量高于新鲜鱼糜,MDA、HHE、HNE含量分别为(1.14±0.03)、(0.86±0.03)、(0.18±0.02) mg/kg。新鲜鱼糜加热胶凝后,各RCC含量均显著上升(p<0.05),冷冻鱼糜加热胶凝后,各RCC含量均显著(p<0.05)下降;添加RCCs清除剂阻断RCCs-蛋白质反应后,冷冻鱼糜凝胶(40 ℃1 h-90 ℃30 min)强度从(243.52±25.04) g×cm下降到(190.53±20.33) g×cm(p<0.05);所以,RCCs加强了冷冻鱼糜凝胶的强度。RCCs对鱼糜凝胶的保水性无明显影响。
鱼糜,凝胶,活泼羰基化合物,丙二醛,4-羟基-己烯醛,4-羟基-壬烯醛
活泼羰基化合物(Active carbonyl compounds,RCCs)主要指α,β-不饱和醛、酮醛、二元醛,如丙烯醛(ACR)、4-羟基-己烯醛(HHE)、4-羟基-壬烯醛(HNE)、4-氧代-2-壬烯醛(ONE)、丙二醛(MDA)等,其反应活性非常强,双键能与亲核基团(如半胱氨酸的巯基,组氨酸的咪唑基,赖氨酸、精氨酸的氨基等)发生迈克尔加成反应[1-2],羰基可与游离氨基反应形成希夫碱。在体内,RCCs引起蛋白质结构变化,造起“羰基应激”,与衰老、肿瘤、阿尔茨海默病等均密切相关[3]。在食品中,RCCs引起蛋白质氧化,对食品颜色、风味、质构、保水性等均有显著影响,还参与或促进丙烯酰胺、生物胺、杂环胺等有毒物质的产生[4-6]。
肉类食品中RCCs主要源于多不饱和脂肪酸(PUFA)氧化。鱼肉富含PUFA,极易氧化产生RCCs。黄条鲱冷藏13 d,HHE从500 μg/kg增加到约2100 μg/kg[7];新鲜的秋刀鱼肉中HHE是(1698.8±793.6) μg/kg,在-20 ℃下贮藏3个月增加到6200 μg/kg,12个月增加到12000 μg/kg左右[8]。鱼糜中脂肪含量低于鱼肉,但冷冻鱼糜如果冻藏时间较长,也会发生明显的脂肪氧化[9];目前还未见鱼糜及冷冻鱼糜中RCCs的研究报道。
胶凝是鱼糜最主要的功能特性,RCCs影响鱼糜凝胶特性。李学鹏等报道,ACR可修饰肌原纤维蛋白致肌原纤维蛋白氧化,当ACR浓度大于0.1 mmol/L时,肌原纤维蛋白的凝胶性质劣化,凝胶强度、保水性降低;活性巯基对ACR较为敏感,ACR浓度为0.01 mmol/L时其含量减少了40.8%;电泳表明ACR能使蛋白质发生交联[10]。Zhou等报道,MDA诱导肌球蛋白交联,显著提高肌球蛋白凝胶强度,MDA含量为10 mmol/L时,凝胶强度升高3~4倍[11]。
上述研究均为模拟体系研究,并未有研究实际体系中RCCs对凝胶特性的影响的报道。本论文在鱼糜中添加RCCs清除剂五氟苯肼,阻断RCCs-蛋白质反应,以期能间接反映鱼糜中RCCs对鱼糜胶凝特性的影响。
1 材料与方法
1.1 材料与仪器
新鲜鲢鱼肉 约3 kg/尾,2016年1月捕捞自当地池塘,捕捞后1 h内人工宰杀、去头、去皮、去内脏,清洗干净,冰藏,12 h内冰藏运送至实验室采肉,进行鱼糜加工;2,6-二叔丁基-4-甲基苯酚(BHT)、五氟苯肼、1,1,3,3-四甲氧基丙烷 美国Sigma-Aldrich,分析纯;4-羟基-己烯醛(HHE)、4-羟基-壬烯醛(HNE) 美国Cayman Chemicals,分析纯;其他试剂 均为分析纯。
TA.XT Plus质构仪 英国SMSTA;Agilent 7890A GC气相-质谱联用仪 美国安捷伦,配5975C质谱检测器,HP-5MS毛细管柱30 m× 250 μm(i.d.)× 0.25 μm;固相微萃取头(涂层为聚二甲基硅氧烷,PDMS) Gerstel(Linthicum,MD,USA)。
1.2 实验方法
1.2.1 鱼糜的制备 新鲜鲢鱼鱼肉加入3倍冷水(4 ℃),搅拌后静置5 min,将上层水倒出,然后用纱布挤压脱水;漂洗3次,最后一次采用0.5%的冷食盐水漂洗。添加6%蔗糖、0.3%多聚磷酸钠,混匀,即得鱼糜[12]。
采用-18 ℃冻藏3个月的冷冻鱼糜为样品,研究冻藏对鱼糜中RCCs的影响。
1.2.2 鱼糜胶凝的制备 将鱼糜在1500 r/min下擂溃,空擂2 min后加冰调整最终水分含量至78%,加入3%食盐盐擂4 min;整个过程保持物料温度在10 ℃以下[13]。
擂溃时在鱼糜中添加2 mg/kg五氟苯肼阻断RCCs-蛋白质反应,与未加五氟苯肼的鱼糜凝胶比较凝胶强度、凝胶保水性,分析RCCs对凝胶特性的影响。
擂溃好的鱼糜灌装到不锈钢管(20 mm×150 mm)中,采用水浴加热,3个加热程序:40 ℃ 1 h-90 ℃ 30 min;60 ℃ 30 min-90 ℃ 30 min;90 ℃ 30 min;分别记为G40、G60、G90。加热后,立即自来水冷却,冷却至室温后,于4 ℃静置12 h;再室温静置2 h,测定凝胶强度、保水性[12]。
1.2.3 RCCs的测定 主要检测的RCCs包括MDA、HHE、HNE。参考Ruan等的方法[14],以五氟苯肼为衍生化试剂,采用固相微萃取-气相/质谱法(SPME-GC/MS)检测,外标法定量。
1.2.3.1 样品的前处理 将鱼糜及鱼糜凝胶绞碎,取绞碎样品(1±0.05) g,置于10 mL样品瓶,加5 mL蒸馏水,3.5 mL KH2PO4缓冲液(0.5 mol/L,pH4),BHT(1 mmol/L,200 μL),再加200 μL五氟苯肼(5 mg/mL)溶液,漩涡混匀10 min,用固相微萃取纤维插入式吸附60 min(室温)。
1.2.3.2 GC-MS参数 柱温程序50 ℃保温0.5 min,25 ℃/min升温至 150 ℃,再30 ℃/min至280 ℃;载气,氦气(99.999%),1.2 mL/min;电离方式EI,电离电压70 eV,灯丝发射电流为200 μA,离子源温度为200 ℃,接口温度300 ℃,扫描质量范围为33~450 amu。
1.2.4 凝胶强度测定 把凝胶切成25 mm 厚,用质构仪测定凝胶破断强度(g)和凝胶形变距离(cm),金属球形探头S 0.5(直径为5 mm),探头下降速度为6 cm/min[15]。凝胶强度按公式(1)计算:
凝胶强度(g×cm)=凝胶破断强度(g)×凝胶破断形变(cm)
式(1)
1.2.5 凝胶保水性(WHC)测定 取加热制备好的鱼糜凝胶2~3 g,称重W1,室温下5000×g离心10 min,弃去水分,称重W2[16],按公式(2)计算保水性(WHC):
式(2)
1.3 数据处理
所有实验重复3次。用SPSS软件进行数据的显著性分析。
2 结果与分析
2.1 新鲜鱼糜胶凝过程中RCCs的变化
新鲜鱼糜及凝胶中几种主要RCCs的含量见表1。新鲜鲢鱼糜中MDA含量为(0.42±0.02) mg/kg、HHE为(0.21±0.03) mg/kg,含量均高于HNE(0.07±0.00) mg/kg,这是因为鲢鱼糜中ω-3 PUFA含量较高,HHE源自ω-3 PUFA氧化,而HNE源自ω-6 PUFA氧化[7-8]。加热胶凝后,各RCCs含量均有所上升,其中G40上升显著(p<0.05),MDA、HHE、HNE均上升了约50%,可能是因为G40受热时间最长,脂肪氧化最严重[17]。
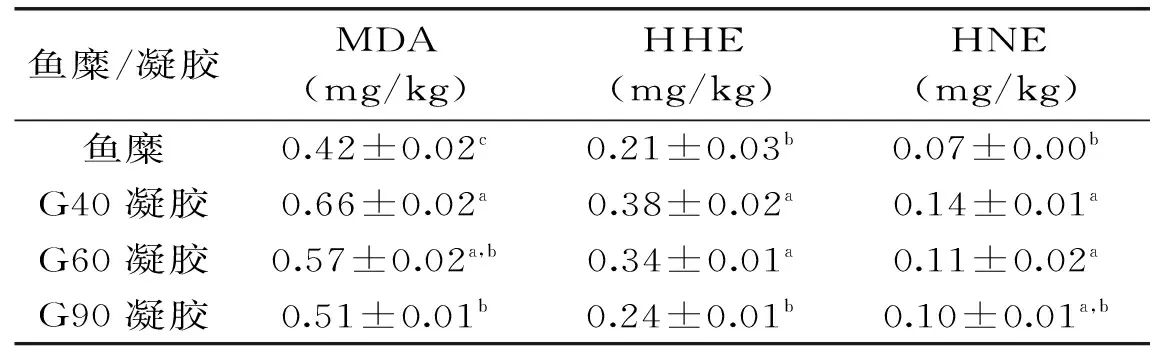
表1 新鲜鱼糜及其凝胶中RCCs的含量Table 1 The content of RCCs in fresh surimi and its gel
注:表中数据为平均值±标准偏差,n=3,a~b同列中数据的上标字母不同代表有显著差异(p<0.05)。表2~表4同。
2.2 冷冻鱼糜胶凝过程中RCCs的变化
冷冻鱼糜及凝胶中几种主要RCCs的含量见表2。与新鲜鱼糜类似,冷冻鱼糜中MDA(1.14±0.03) mg/kg、HHE(0.86±0.03) mg/kg含量高于HNE(0.18±0.02) mg/kg。与新鲜鱼糜(表1)相比,冷冻鱼糜RCCs含量显著增加(p<0.05),MDA、HHE、HNE分别增加了170%、410%、257%;这是因为冷冻鱼糜虽然在-20 ℃冻藏,但PUFA仍在缓慢氧化[9]。

表3 RCCs对鱼糜凝胶强度(g×cm)的影响Table 3 The effect of RCCs on the gel strength(g×cm)
注:A~B同行中数据的上标字母不同代表有显著差异(p<0.05)。表4同。

表4 RCCs对鱼糜凝胶保水性的影响Table 4 The effect of RCCs on the WHC of gel
加热胶凝后,各RCCs含量均显著(p<0.05)下降,其中90 ℃加热胶凝的凝胶(G90)RCCs的含量下降最明显,MDA、HHE、HNE均下降约50%;这一点与新鲜鱼糜胶凝中RCCs变化完全不同,新鲜鱼糜胶凝后,各RCCs含量增加。
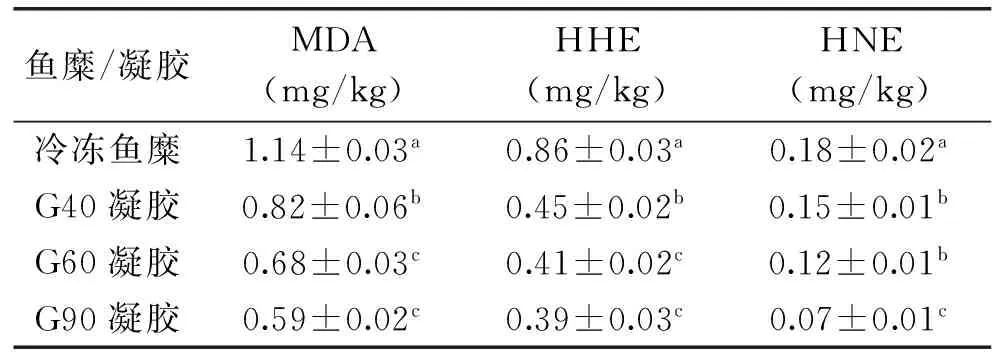
表2 冷冻鱼糜(-18 ℃、3个月)及其凝胶中RCCs的含量Table 2 The content of RCCs in frozen surimi(-18 ℃,3 month)and its gel
冷冻鱼糜胶凝后,其RCCs含量降低是本论文的新发现。鱼糜凝胶中检测到的RCCs含量取决于PUFA氧化生成RCCs的量及与氨基酸、肽、蛋白质反应消耗的RCCs的量[18]。本文测定结果表明,新鲜鱼糜胶凝过程中,RCCs生成量高于消减量,所以凝胶中检测到的RCCs含量高于鱼糜中RCCs含量。冷冻鱼糜则相反,冻藏后,RCCs已经累积较多;加热胶凝时,RCCs与氨基酸、肽、蛋白质反应消耗的量高于这个过程中PUFA氧化产生的RCCs,所以凝胶中RCCs检测量低于冷冻鱼糜。所以,冷冻鱼糜胶凝过程中,有大量RCCs与氨基酸、肽、蛋白质发生了反应。
2.3 RCCs对鱼糜凝胶强度的影响
鱼糜凝胶强度测定结果见表3。G40加热凝胶的强度最高,因为内源转谷氨酰胺酶促进蛋白交联;G60加热凝胶的强度最低,因为内源热稳定组织蛋白酶造成肌原纤维蛋白降解;这与已有的报道一致[19-20]。冷冻鱼糜凝胶与新鲜鱼糜凝胶相比,凝胶强度显著下降(p<0.05),这与蛋白质冷冻变性有关[21]。五氟苯肼对新鲜鱼糜凝胶没有显著影响,但冷冻鱼糜凝胶G40、G90的强度显著降低(p<0.05),G40、G90分别下降约20%、16%。
RCCs-蛋白质反应对凝胶强度的影响可归纳为两个方面:与蛋白质-SH反应则减少凝胶中S-S键交联,造成凝胶强度下降[22-23];RCCs有两个活性基团,如果分别与不同的蛋白质分子加合,则造成蛋白质交联,增强凝胶强度[11,24]。添加RCCs清除剂对新鲜鱼糜凝胶强度影响不大,但显著降低冷冻鱼糜凝胶的强度(表3),这是本论文的新发现。添加五氟苯肼后,RCCs被清除,RCCs参与的蛋白质交联反应被阻断,凝胶中蛋白质交联减少,凝胶强度下降;结合鱼糜及凝胶中RCCs含量变化(表1、表2),冷冻鱼糜中发生的RCCs-蛋白质反应多于新鲜鱼糜,所以添加RCCs清除剂对冷冻鱼糜的影响更大。
2.4 RCCs对鱼糜凝胶保水性的影响
鱼糜凝胶保水性测定结果见表4。G60加热凝胶的保水性最差,显著低于其他两种加热模式(p<0.05);G40和G90加热凝胶的保水性之间无显著差异;冷冻鱼糜凝胶的保水性显著低于新鲜鱼糜凝胶(p<0.05);这些与文献报道一致[12-13]。添加五氟苯肼对鱼糜凝胶保水性无显著影响。鱼糜凝胶的保水性主要由两方面决定:凝胶超微结构,超微结构越致密、均匀,凝胶保水性越好,同时,凝胶强度也越高;蛋白质亲水-疏水特性,蛋白质亲水性与凝胶保水性正相关[13,25]。本文测定结果表明,鱼糜凝胶保水性与凝胶强度(表3)变化趋势基本一致。模拟体系研究结果表明,少量RCCs对凝胶保水性无明显影响,而高含量RCCs显著降低凝胶保水性[10-11]。所以,五氟苯肼对鱼糜凝胶保水性无显著影响可能是因为冷冻鱼糜中RCCs的含量较低。
3 结论
白鲢鱼鱼糜及冷冻鱼糜中MDA、HHE含量高于HNE含量,与新鲜鱼糜相比冷冻鱼糜三种RCCs含量均显著增加(p<0.05)。冷冻鱼糜胶凝后,G90中RCCs含量减少最多,约为50%;添加五氟苯肼,清除RCCs,阻断RCCs-蛋白质反应,冷冻鱼糜凝胶G40的强度下降约20%;这表明RCCs参与了鱼糜胶凝反应,促进了冷冻鱼糜蛋白质交联。而添加五氟苯肼对鱼糜凝胶保水性无显著影响。
[1]Colzani M,Criscuolo A,Maddis D D,et al. A novel high resolution MS approach for the screening of 4-hydroxy-trans-2-nonenal sequestering agents[J]. Journal of Pharmaceutical and Biomedical Analysis,2014,91:108-118.
[2]LoPachin R M,Gavin T. Molecular Mechanisms of aldehyde toxicity:a chemical perspective[J]. Chem Res Toxicol,2014,27:1081-1091.
[3]Wang C,Weerapana E,Blewett M M. et al. A chemoproteomic platform to quantitatively map targets of lipid-derived electrophiles[J]. Nature Methods,2014,11:79-85.
[4]Zamora R,Alcón E,Hidalgo F J. Strecker-type degradation of phenylalanine initiated by 4-Oxo-2-alkenals in comparison to that initiated by 2,4-Alkadienals,4,5-Epoxy-2-alkenals,or 4-Hydroxy-2-nonenal[J]. J Agric Food Chem,2013,61(43):10231-10237.
[5]Papastergiadis A,Fatouh A,Jacxsens L,et al. Exposure assessment of malondialdehyde,4-Hydroxy-2-(E)-Nonenal and 4-Hydroxy-2-(E)-Hexenal through specific foods available in Belgium[J]. Food and Chemical Toxicology,2014,73:51-58.
[6]Surh J,Kwon H. Estimation of daily exposure to 4-hydroxy-2-alkenals in Korean foods containing n-3 and n-6 polyunsaturated fatty acids[J]. Food Addit Contam,2005,22:701-708.
[7]Sakai T,Matsushita Y,Sugamoto K,et al. Lipid peroxidation-derived hepatotoxic aldehyde,4-Hydroxy-2-hexenal,in fish[J]. Bioscience Biotechnology and Biochemistry,1997,61(8):1399-1400.
[8]Tanaka R,Naiki K,Tsuji K,et al. Effect of antioxidative treatments on lipid oxidation in skinless fillet of pacific sauryCololabissairain frozen storage[J]. J Food Process Pres,2013,37:325-334.
[9]Fu X,Xu S,Wang Z. Kinetics of lipid oxidation and off-odor formation in silver carp mince:The effect of lipoxygenase and hemoglobin[J]. Food Research International,2009,42(1):85-90.
[10]李学鹏,王祺,周凯,等. 丙烯醛氧化对大黄鱼肌肉组织和肌原纤维蛋白结构性质的影响[J]. 现代食品科技,2014,30(10):1-7.
[11]Zhou F,Zhao M,Su G,et al. Gelation of salted myofibrillar protein under malondialdehyde induced oxidative stress[J]. Food Hydrocolloids,2014,40:153-162.
[12]Fu X,Hayat K,Li Z,et al. Effect of microwave heating on the low-salt gel from silver carp(Hypophthalmichthysmolitrix)surimi[J]. Food Hydrocolloids,2012,27(2):301-308.
[13]Stevenson C D,Liu W,Lanier T C. Rapid heating of alaska pollock and chicken breast myofibrillar protein gels as affecting water-holding properties[J]. J Agric Food Chem,2012,60(40):10111-10117.
[14]Ruan E D,Aalhus J,Juárez M. A rapid,sensitive and solvent-less method for determination of malonaldehyde in meat by stir bar sorptive extraction coupled thermal desorption and gas chromatography/mass spectrometry with in situ derivatization[J]. Rapid Commun Mass Spectrom,2014,28:2723-2728.
[15]Fu X,Li Z,Wu Y. Using pH-shifting Process to recover proteins for low salt gel products from silver carp[J]. Advanced Materials Research,2012,556:1285-1289.
[16]Leksrisompong P N,Lanier T C,Foegeding E A. Effects of heating rate and pH on fracture and water-holding properties of globular protein gels as explained by micro-phase separation[J]. Journal of Food Science,2012,77(2):E60-E67.
[17]Kawai K,Matsuno K,Kasai H. Detection of 4-oxo-2-hexenal,a novel mutagenic product of lipid peroxidation,in human diet and cooking vapor[J]. Mutat Res,2006,603:186-192.
[18]Fuentes V,Estévez M,Ventanas J,et al. Impact of lipid content and composition on lipid oxidation and protein carbonylation in experimental fermented sausages[J]. Food Chemistry,2014,147(15):70-77.
[19]Liu H,Yin L,Zhang N,et al. Isolation of cathepsin B from the muscle of silver carp(Hypophthalmichthysmolitrix)and comparison of cathepsins B and L actions on surimi gel softening[J]. Food Chemistry,2008,110(2):310-318.
[20]Paker I,Sarah B,Jaczynski J,et al. The effect of organic acids on gelation characteristics of protein gels made from silver carp(Hypophthalmichthysmolitrix)protein recovered by isoelectric solubilization and precipitation[J]. LWT-Food Science and Technology,2013,53(1):37-43.
[21]MacDonald G A,Lanier T C,Swaisgood H E,et al. Mechanism for stabilization of fish actomyosin by sodium lactate[J]. J Agric Food Chem,1996,44(1):106-112.
[22]Jongberg S,Lund M N,Skibsted L H,et al. Competitive reduction of perferrylmyoglobin radicals by protein thiols and plant phenols[J]. J Agric Food Chem,2014,62(46):11279-11288.
[23]Yang J,Xiong Y L. Inhibition of lipid oxidation in Oil-in-Water emulsions by interface-adsorbed myofibrillar protein[J]. J Agric Food Chem,2015,63(40):8896-8904.
[24]Li C,Xiong Y L,Chen J. Protein oxidation at different salt concentrations affects the cross-linking and gelation of pork myofibrillar protein catalyzed by microbial transglutaminase[J]. Journal of Food Science,2013,78(6):C823-C831.
[25]Liu Z,Xiong Y L,Chen J. Identification of restricting factors that inhibit swelling of oxidized myofibrils during brine irrigation[J]. J Agric Food Chem,2009,57(22):10999-11007.
Effect of gelling on the active carbonyl compounds in surimi
FU Xiang-jin2,3,LIU Ying1,*,LI Zhong-hai2,LIN Qin-lu2,TYRE C. Lanier3
(1.Department of Environmental Science,Changsha Environmental Protectionl College,Changsha 410004,China;2.College of food Science and Engineering,Central South University of Forestry and Technology,Changsha 410004,China;3.Department of Food Bio Processing,and Nutrition Sciences,NC State University,Raleigh 27695,USA)
Three kinds of active carbonyl compounds(RCCs),malondialdehyde(MDA),4-hydroxy-2-hexenal(HHE),and 4-hydroxy-2-nonenal(HNE)in silver carp surimi and gel were determined using situ derivatization-SPME-GC-MS and the pentafluorophenyl hydrazine was the derivative agent. Furthermore,by adding pentafluorophenyl hydrazine to block RCCs-protein reaction,the effect of RCCs on surimi gel was analyzed. The content of MDA(0.42± 0.02) mg/kg,HHE(0.21±0.03) mg/kg were higher than HNE(0.07±0.00) mg/kg in fresh silver carp surimi. The content of MDA,HHE,HNE in frozen surimi were(1.14±0.03),(0.86±0.03),and(0.18±0.02) mg/kg,respectively,which were higher than that in fresh surimi. For gel from fresh surimi,because of heating,RCC content significantly increased(p<0.05),however,for gel from frozen surimi,RCC content significantly(p<0.05)decreased. RCCs had no effect on gel strength of fresh surimi,however,after adding RCCs blockers,gel strength of frozen surimi(40 ℃,1 h-90 ℃,30 min)decreased from(243.52±25.04) g×cm to(190.53±20.33) g×cm(p<0.05),so RCCs helped to enhance the gel strength of frozen surimi. RCCs had no significant effect on water holding capability of surimi gel.
surimi;gel;active carbonyl compounds;malondialdehyde;4-hydroxy-2-hexenal;4-hydroxy-2-nonenal
2016-09-19
付湘晋(1980-),男,博士,副教授,主要从事水产品深加工及食品安全方面的研究,E-mail:drxjfu@163.com。
*通讯作者:刘颖(1980-),女,硕士,讲师,主要从事食品深加工方面的研究,E-mail:314721423@qq.com。
国家留学基金(201408430270);湖南省2011协同创新中心(湘教通[2013]448号)。
TS254.1
A
1002-0306(2017)10-0072-04
10.13386/j.issn1002-0306.2017.10.006
