低氧状态下红景天苷经HIF-1α信号通路调节人成骨样MG-63细胞表型表达的研究
2017-06-22梅国华温晓昶毛立群
祁 琳,王 川,梅国华,温晓昶,毛立群,金 鑫,李 玲,王 越
(武警后勤学院附属医院 1.药材科, 2.口腔科,天津 300162;武警后勤学院 3.病原生物和免疫学教研室,4.基础医学实验技术教研室,5.药理学教研室,天津 300309)
低氧状态下红景天苷经HIF-1α信号通路调节人成骨样MG-63细胞表型表达的研究
祁 琳1,王 川2,梅国华3,温晓昶4,毛立群3,金 鑫5,李 玲5,王 越3
(武警后勤学院附属医院 1.药材科, 2.口腔科,天津 300162;武警后勤学院 3.病原生物和免疫学教研室,4.基础医学实验技术教研室,5.药理学教研室,天津 300309)
目的 研究低氧状态下红景天苷对成骨细胞表型表达的调控作用及其作用机制。方法 MTT法检测细胞增殖能力;采用Annexin V/PI双染法分析低氧诱导的细胞凋亡情况;磷酸苯二钠法检测成骨细胞分化的早期标志性基因碱性磷酸酶(ALP)活性;RT-PCR技术检测低氧诱导因子(HIF)-1α、血管内皮生长因子(VEGF)、抑癌基因VHL蛋白(pVHL)、骨钙素(OC)、成骨细胞特异性转录因子Runx2及Osterix mRNA表达水平;采用ELISA法检测VEGF及OC的蛋白表达水平和I型胶原的含量;Western blot技术检测HIF-1α、pVHL、Osterix、Runx2的蛋白表达水平;免疫荧光共聚焦显微镜技术观察HIF-1α的核转位情况;荧光素酶报告基因检测技术检测HIF-1α的转录活性。结果 低氧状态下红景天苷促进MG-63细胞增殖,抑制由低氧诱导的MG-63细胞凋亡,促进Osterix、Runx2表达及通过增加ALP活性、Ⅰ型胶原和OC含量促进成骨细胞分化成熟。进一步研究发现,低氧状态红景天苷可下调HIF-1α的表达及核转位,而上调其转录活性及下游靶基因VEGF的表达。结论 低氧状态下红景天苷通过调节HIF-1α/VEGF信号通路促进成骨细胞增殖和分化,同时抑制由低氧诱导的成骨细胞凋亡。
红景天苷;低氧诱导因子(HIF)-1α;成骨细胞;增殖;分化;凋亡;血管内皮生长因子(VEGF)
骨质疏松症是影响老年人健康及生活质量的严重问题,它是一种以骨量减少和骨微结构的破坏为特征,导致骨脆性增加和易于发生骨折的代谢性骨病。研究发现,生理性的骨量丢失常常发生在氧分压很低的地方,骨组织血供减少可导致骨量丢失。已有研究证实[1-2],绝经后骨质疏松骨组织血流减少、毛细血管数量降低,使成骨细胞处于低氧状态。大量的研究表明,缺血缺氧性疾病以及大气中的氧气降低,都会导致骨代谢的变化,从而引发骨量丢失,骨丢失过程中骨内血供较少所致的低氧信号与伴随的骨生成减少密切相关。
低氧诱导因子(hypoxia-inducible factor, HIF-1)是调节氧稳态的核心转录因子,目前研究认为HIF-1是诱导低氧基因和修复细胞内微环境的核心转录因子[3]。在生理和病理条件下,骨组织血供的减少会使骨系细胞处于低氧状态,成骨细胞位于骨小梁的表面,首先感受骨组织内血流变化和氧压力降低,故成骨细胞的低氧感应以及HIF-1α对成骨细胞功能的调控对于骨的塑形改造具有重要意义。低氧条件下骨形成与血管生成之间关系密切,软骨内成骨和骨折修复过程依赖于血管的侵入。最近研究发现[4],成骨细胞特异性HIF-1α基因敲除小鼠的骨生成能力明显减低,而抑癌基因VHL蛋白(von hippel-lindau protein, pVHL)敲除(HIF-1α过表达)小鼠的骨内血管生成和骨生成能力明显增加。HIF-1α可通过调节血管内皮生长因子(vascular endothelial growth factor, VEGF)使骨内新生血管增加,而促进骨发育和骨折愈合过程中的骨生成。上述结果表明,HIF-1α在骨形成耦联血管生成的过程中起重要的调控作用。
藏药红景天系景天科红景天属多年生草本或亚灌木植物,具有抗缺氧、促血管新生及抗骨质疏松等多种药理作用。多项研究表明其主要活性成分红景天苷具有肝保护[5]和神经保护[6-8]功效,这种保护作用主要得益于该化合物的抗氧化活性[9]。此外,另有研究报道[10]红景天苷还可通过上调HIF-1α表达并诱导其核转位从而抑制缺氧诱导的大鼠心肌细胞发生凋亡,提示红景天苷可通过激活HIF-1α信号通路发挥抗心肌缺氧作用。而红景天苷是否也通过激活HIF-1α信号通路,调节骨代谢与骨再生中发挥作用的研究尚未见报道。
本研究利用人成骨样MG-63细胞,探讨低氧状态下红景天苷经HIF-1α/VEGF信号通路对成骨细胞表型表达的调控作用,为全面深入阐明红景天苷促进骨生成的作用机制奠定基础,也为今后临床应用红景天苷治疗和预防骨质疏松症提供科学依据。
1 材料与方法
1.1 主要试剂与仪器 红景天苷(A0076)购自中国药品生物制品检定所,氯化钴(GF1826)为美国Sigma公司产品;MTT(303H0524)购自美国Sigma公司;Annexin V/PI凋亡试剂盒(B32057)购自美国的BioLegend公司;ALP测试盒(22209)为南京的建成生物工程研究所产品;TRIzol Reagent(P4525)为天根生化科技有限公司产品;HiFiScript cDNA Synthesis Kit(10144),2×Es Taq MasterMix(00201505) 购自北京康为世纪生物科技有限公司;人骨钙素(osteocalcin, OC)定量酶联检测试剂盒(B1015),人Ⅰ型胶原定量酶联检测试剂盒(B1517)为上海森雄公司产品。BCA蛋白定量试剂盒(IC111189)购自美国的Pierce公司。酶标仪购自美国的Bio-Rad公司;UV-1206型紫外分光光度计为日本的岛津产品;流式细胞仪为Beckman Coulter Cytomics FC500; JY96-Ⅱ超声细胞粉碎机购自宁波新芝科器研究所;TCS SP5激光扫描共聚焦显微镜购自Leica;凝胶成像分析系统为美国的GelPro 4.5;核酸定量仪购自德国Eppendorf公司。
1.2 细胞系和细胞培养 人成骨样细胞系MG-63为美国ATCC公司产品,购自武汉大学中国典型培养物保藏中心。使用含FBS(100 g·L-1)的高糖DMEM培养基培养,培养基中加入100 IU·L-1青霉素及100 mg·L-1链霉素。
1.3 细胞低氧损伤模型的建立 化学低氧模型建立:取状态良好的成骨细胞消化后接入平皿中,待细胞生长成单层的,饱和度达到90%左右,将细胞用含FBS(10 g·L-1)的DMEM代替正常培养基进行培养,并向其中加入氯化钴水溶液,使其终浓度为0.5 mmol·L-1,然后放入孵育箱培养24 h。
1.4 MTT法检测细胞增殖活性 取对数生长期的细胞用胰酶消化并计数,调整细胞浓度为8×107个·L-1, 100 μl/孔接种在96孔培养板中。24 h后,换含FBS(10 g·L-1)的高糖DMEM培养24 h使细胞同步化。加入红景天苷预处理(1、10、100、1 000 nmol·L-1),作用24 h后,加入氯化钴水溶液,使其终浓度为0.5 mmol·L-1,作用24 h。在结束培养前4 h,将96孔板离心(1 700 r·min-1,10 min),弃去上清。避光加入100 μL/孔MTT(0.5 g·L-1),5% CO2、37℃培养箱中继续培养4 h,离心,弃去上清,每孔加入DMSO 100 μL/孔,充分震荡,使细胞内的蓝紫色结晶充分溶解,用酶标仪测定各孔A492值。
1.5 流式细胞仪检测细胞凋亡 调整细胞浓度为6×108个·L-1,1 mL/孔接种在6孔培养板中。培养24 h后,更换含FBS(10 g·L-1)的高糖DMEM培养24 h使细胞同步化。加入药物预处理,设空白对照组及低氧对照组。药物作用24 h后,加入氯化钴水溶液,空白对照组及低氧对照组加入三蒸水。24 h后,将细胞收集于EP管中,并计数,离心(800 r·min-1,1 min),再用培基重悬,离心。弃去上清液,用PBS缓冲液洗两次后加入binding buffer,调整细胞浓度,使之为109个·L-1,从中吸取100 μL并加入5 μL Annexin Ⅴ和10 μL PI,避光孵育15 min后加入400 μL binding buffer。过300目筛网使之成为单个细胞悬液,然后上机。使用FlowJo 7.6软件分析实验结果。
1.6 ALP活性的测定 调整细胞浓度为2×108个·L-1(使用无酚红的完全培养基),以1 mL/孔接种在12孔板上。24 h后,使用含FBS(10 g·L-1)的无酚红DMEM高糖培养基同步化24 h。药物处理及低氧方法同上。结束培养,将培养液收集起来,离心(10 min,1 500 r·min-1),收集上清,进行细胞外ALP活性的测定。用0.01 mol·L-1PBS缓冲液将细胞洗涤3次,最后1次将PBS吸干,加入1 g·L-1的Triton X-100,500 μL/孔,反应3 min,使用加样器将其充分吹打,收集到1.5 ml的Ependorf管中,使用超声破碎仪将细胞破碎,离心(10 min,1 500 r·min-1),吸出上清,用于测定细胞内ALP的活性。
1.7 RT-PCR反应 调整细胞浓度为6×108个·L-1,将2 mL细胞液接种在60 mm培养皿中,药物处理及低氧方法同上,经D-Hank′s洗涤之后按照Trizol的试剂说明书进行提取RNA,逆转录后进行RT-PCR反应。逆转录反应条件参照说明书进行,PCR反应体系:cDNA 2.0 μL,2×Premix Taq 10 μL,上、下游引物各10 pmol,加双蒸水至总体积20 μL。PCR反应条件:94 ℃ 5 mins预变性;94 ℃ 30 s变性,59 ℃ 45 s退火,72 ℃ 1 min延伸,39个循环;72 ℃ 延伸10 mins。反应结束后,取PCR反应液5 μL于12 g·L-1琼脂糖凝胶电泳。结果应用Bio-Rad公司的Quantity One软件进行分析,以靶基因/ β-actin光密度的比值作为mRNA的相对表达丰度。
1.8 OC、人Ⅰ型胶原及VEGF的ELISA检测 接种细胞(2×108个·L-1)于12孔板中,1 ml/孔,按上述方法处理细胞后收集培养上清,按照ELISA试剂盒的说明书检测培养上清中OC与Ⅰ型胶原的含量。
1.9 HIF-1α、pVHL、Runx2及Osterix蛋白表达水平检测 调整细胞浓度为7.5×108个·L-1,取细胞液2 ml接种在60 mm培养皿中,药物处理及低氧方法同上。把蛋白自SDS-PAGE胶上转移到PVDF膜上后,将PVDF膜放入杂交袋中,向其中加入50 g·L-1的脱脂奶粉作为封闭液,封口后,放置在37 ℃恒温摇床上封闭1 h后,用50 g·L-1的脱脂奶粉将一抗稀释到合适的浓度,在37 ℃恒温摇床上慢速shaking 2 h后翻面放于4 ℃冰箱中过夜,慢速shaking, d2,在37 ℃恒温摇床上复温1 h后经TBST buffer在室温摇床上漂洗后再用50 g·L-1脱脂奶粉稀释的二抗置于37 ℃孵育1 h,使用TBST 漂洗之后再经TBS漂洗,然后和化学发光底物检测试剂盒的A、B混合液作用4 min,使用保鲜膜将其覆盖,用胶带将其固定,最后X-ray底片曝光。使用Scion Image软件进行分析,将靶蛋白/β-actin的灰度作为蛋白相对表达丰度。
1.10 细胞瞬时转染及荧光素酶报告基因的检测 按照LipofectamineTM2 000的说明书将HRE-luc和SV40-β gal 共转染至MG-63细胞。转染24 h后,换含10 g·L-1FBS高糖DMEM培养,加入红景天苷预处理(10、100 nmol·L-1),设对照组,作用24 h后,再加入氯化钴水溶液作用24 h,收集细胞裂解液,分别测定荧光素酶活性和β-半乳糖苷酶活性,以二者之比作为荧光素酶的相对活性。
1.11 免疫荧光共聚焦技术 调整细胞浓度为4×108个·L-1,取1 mL细胞悬液接种于放有盖玻片的6孔板中爬片,药物处理及低氧方法同上,结束培养后, PBS缓冲液漂洗细胞3次, 40 g·L-1多聚甲醛固定10~15 min, PBS缓冲液振荡洗涤细胞2~3次,用含5 g·L-1Triton X的PBS透化10 min, PBS缓冲液振荡洗涤细胞3次,使用含30 g·L-1BSA的封闭液,室温封闭60 min,加入一抗,4 ℃湿盒过夜,PBS缓冲液振荡洗涤细胞3次,加入FITC标记的二抗,室温湿盒避光2 h,用PBS缓冲液避光振荡洗涤细胞3次,DAPI复染细胞核,室温4 min,避光静置,用PBS缓冲液避光振荡洗涤细胞2次,封片,4 ℃避光保存,观察结果。
1.12 统计学处理 采用SPSS 13.0统计软件包进行统计学分析。组间比较采用单因素方差分析(One-Way ANOVA)。用Excel软件对所得数据进行分析、处理图表。
2 结果
2.1 低氧状态下红景天苷对MG-63细胞增殖功能的影响 选择1 nmol·L-1~1 000 nmol·L-1剂量范围的红景天苷预处理MG-63细胞,24 h后模拟低氧,如Fig 1所示,与正常对照组相比,低氧组可明显抑制MG-63细胞增殖活性,而红景天苷剂量组均明显促进细胞的增殖。
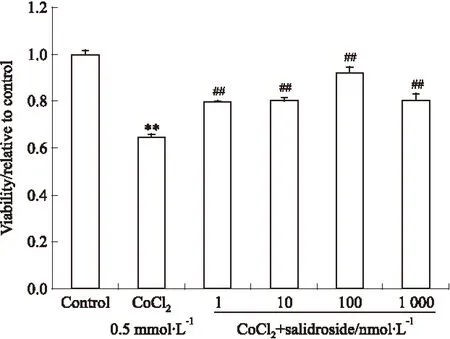
Fig 1 Regulation of proliferation in human osteoblastic MG-63 cell by salidroside for 2 days in hypoxia environment
Detection of cell proliferation by MTT;**P<0.01vsvehicle control;##P<0.01vshypoxia-treated sample
2.2 低氧状态下红景天苷对MG-63细胞凋亡功能的影响 模拟低氧处理MG-63细胞24 h,低氧诱导的细胞凋亡率明显增加,其凋亡率可达31.62%;与低氧模型组相比,红景天苷(10、100 nmol·L-1)预处理组的细胞凋亡率分别下降约10%和15%(Fig 2)。
Detection of cell apoptosis by Annexin V/PI double staining with flow cytometry;**P<0.01vsvehicle control;##P<0.01vshypoxia-treated sample
2.3 低氧状态下红景天苷对MG-63细胞分化功能的影响 为验证红景天苷是否通过增强ALP活性,增加Ⅰ型胶原含量,促进MG-63细胞的早期分化。首先模拟低氧处理MG-63细胞24 h,细胞内ALP活性及细胞上清中的I型胶原含量均明显降低;经红景天苷预处理细胞48、96、144 h后再诱导其低氧,分别测定细胞内的ALP活性及细胞上清中的Ⅰ型胶原含量,研究结果表明,红景天苷作用48 h后,能够明显增强细胞内的ALP活性(Fig 3),且红景天苷100 nmol·L-1组能明显改善由低氧导致的Ⅰ型胶原分泌量降低(Fig 4)。上述结果提示,红景天苷可能通过增强MG-63细胞ALP的活性及增加MG-63细胞分泌Ⅰ型胶原,促进MG-63细胞的早期分化。

Fig 3 The effect of salidroside on enhancing ALP activity of the MG-63 cells in hypoxia environment
Detection of ALP activity by ELISA;**P<0.01vsvehicle control;##P<0.01vshypoxia-treated sample

Fig 4 Regulation of type Ⅰ collagen synthesis in human osteoblastic MG-63 cells in hypoxia environment by salidroside
Detection of type Ⅰ collagen synthesis by ELISA;**P<0.01vscontrol group;##P<0.01vshypoxia-treated sample
细胞内OC的表达水平可影响MG-63细胞的晚期分化。模拟低氧处理MG-63细胞24 h后,细胞OC mRNA的转录水平明显下降,同时OC分泌量降低;经红景天苷预处理后,OC mRNA的转录水平及OC分泌量明显上升(Fig 5)。上述结果提示,红景天苷可能通过促进MG-63细胞OC mRNA的表达量及蛋白分泌量来促进MG-63细胞的晚期分化。

Fig 5 Effect of salidroside on OC expression in MG-63 cells in hypoxia environment
A:Detection of OC gene expression by RT-PCR; B: Detection of OC protein secretion by ELISA;*P<0.05vscontrol group;##P<0.01vshypoxia-treated sample
2.4 红景天苷对MG-63细胞特异性转录因子Runx2、Osterix表达的影响 模拟低氧处理MG-63细胞24 h后,细胞的Runx2 mRNA及蛋白表达水平明显下降;与低氧对照组相比,红景天苷预处理组Runx2 mRNA水平及蛋白表达量明显升高(Fig 6A,6B)。同时,低氧可使MG-63细胞的Osterix mRNA及蛋白的表达水平明显下降;红景天苷预处理组可明显上调Osterix mRNA及蛋白表达水平(Fig 7A,7B)。
2.5 红景天苷对MG-63细胞HIF-1α信号通路的影响 HIF-1α是骨代谢和骨再生过程中调节骨形成耦联血管生成的重要介导因子。应用Western blot、 RT-PCR及ELISA技术检测细胞内pVHL、HIF-1α和VEGF的表达水平。HIF-1α的上游调控基因pVHL能够识别HIF-1α,通过蛋白泛素化水解系统将其降解,模拟低氧处理MG-63细胞24 h后,pVHL的表达量明显降低,HIF-1α及其下游靶基因VEGF的表达水平明显上升;经红景天苷预处理后,与低氧组相比,pVHL mRNA及蛋白表达水平提高,在一定程度上抑制了其下游过表达的HIF-1α大量聚集造成的细胞损伤,而VEGF的表达量明显增加(Fig 8A、B、C)。

Fig 6 Effect of salidroside on Runx2 expression in MG-63 cells in hypoxia environment
A:Detection of Runx2 gene expression by RT-PCR; B: Detection of Runx2 protein expression by Western blot
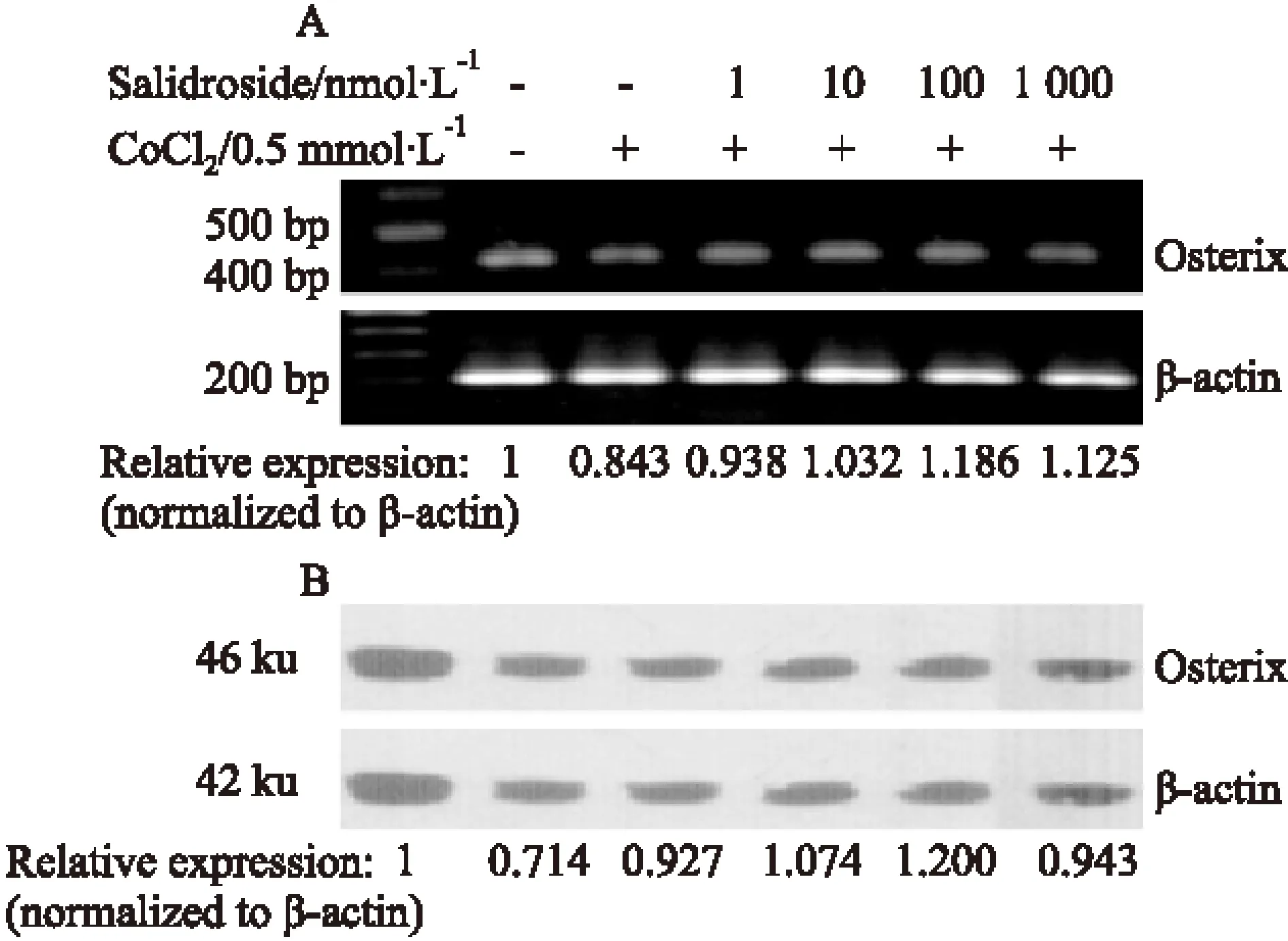
Fig 7 Effect of salidroside on Osterix expression in MG-63 cells in hypoxia environment
A: Detection of Osterix gene expression by RT-PCR; B: Detection of Osterix protein expression by Western blot
HIF-1由α和β两个亚基组成, HIF-1α必须转入细胞核内与HIF-1β形成二聚体后才转化为有活性的HIF-1。应用免疫荧光共聚焦显微镜技术观察低氧环境下红景天苷是否影响HIF-1α的核转录。结果显示,经红景天苷处理的MG63细胞与低氧组比较,细胞核中HIF-1α表达量有所降低(Fig 8E)。细胞瞬时转染及荧光素酶报告基因检测实验结果表明低氧可使HIF-1α基因启动子转录活性增加,而经红景天苷处理后,其转录活性较低氧组进一步增加(Fig 8D)。
3 讨论
近年来,红景天苷对骨的影响得到广泛地关注,研究发现[11-12],红景天苷通过激活HIF-1α及VEGF的表达促进心肌细胞增殖,降低低氧诱导的心肌细胞凋亡,增加细胞的存活率。另有文献报道,红景天苷抗凋亡的机制可能是激活PI(3)K/Akt信号通路,通过转录因子NF-κB激活抗凋亡蛋白Bcl-2及Bcl-x,同时通过抑制Bad、caspase-3及caspase-9活性影响凋亡信号通路[13-14]。本文研究证明,低氧环境下红景天苷可明显增加成骨细胞的存活率,明显降低其凋亡率,与Zhang和谭洪玲等报道一致[6,15]。

Fig 8 Effects of salidrosdie on components of HIF-1α pathway in MG-63 cells in a hypoxia environment
A: Detection of the mRNA levels of HIF-1α, pVHL and VEGF by semi-quantitative RT-PCR;B: Western blot analysis of HIF-1α and pVHL protein expression;C:The level of VEGF secretion into the cell culture supernatants was analysed by ELISA;D:Effect of salidroside on the transcriptional activity of HIF-1α;E:Effect of salidroside on the translocation of HIF-1α(Original section, ×400).**P<0.01vsvehicle control;##P<0.01vsCoCl2
ALP、Ⅰ型胶原、OC是成骨细胞体外分化的重要指标。ALP是参与骨等矿化组织代谢和再生的一种功能性标志酶,在成骨初期大量表达,其表达随着细胞分化的发展而增强[16],其活性反映了成骨细胞的早期分化能力。Ⅰ型胶原是细胞早期成骨分化的一个重要标志,它是骨有机质的主要成分,可以很好地反映骨代谢水平。OC是由分化后期成骨细胞特异性分泌的一种非胶原蛋白, 主要参与骨的生长发育,维持骨的正常矿化,是成骨细胞晚期分化、成熟的特异性标志物, 也是骨形成或骨转换的重要标志。本研究发现低氧会降低ALP活性,抑制细胞分泌I型胶原和OC,从而抑制成骨细胞的分化,这与高文魁等[17]研究结果一致。经红景天苷预处理后,ALP活性、Ⅰ型胶原含量及OC含量明显上升,提示低氧环境下红景天苷可以促进成骨细胞的早期及晚期分化能力。
Runx2又称核心接合因子α1,是成骨细胞分化成熟所必需的特异性转录因子。Runx2的表达是成骨细胞分化的开始,体外实验[18]表明Runx2可激活I型胶原、OC、骨钙蛋白等基因的启动子活性从而诱导其表达,促进成骨细胞的分化。Runx2缺失的小鼠由于成骨细胞分化不发生,导致膜内骨化和软骨内骨化完全缺失。Osterix是Runx2的下游转录基因,是继Runx2之后发现的成骨分化的关键转录因子,属锌指DNA结合蛋白。目前认为Runx 2在成骨细胞分化的起始阶段触发骨基质蛋白的形成,但同时又会使其维持在较早期的阶段而阻止成骨细胞的进一步分化,故Runx2的作用是提供大量的未成熟成骨细胞。而成骨细胞的最终分化成熟则需要Osterix的作用,缺乏Osterix的小鼠缺乏成骨细胞,没有颅骨内成骨和膜内成骨,同时成骨细胞分化的各种标志物的表达水平也严重降低或缺如。结合本研究结果推测,低氧状态下红景天苷可能通过上调Runx2、Osterix表达水平提高成骨细胞ALP活性、促进细胞分泌I型胶原和OC,进而影响成骨细胞分化。
细胞处在低氧状态时,HIF-1α大量聚集并转运到细胞核内和HIF-1β结合成复合物HIF-1,作为转录因子与低氧反应元件(hypoxia reaction element, HRE)结合,进一步激活诸如VEGF、红细胞生成素等上百种下游靶基因的转录,进而引发组织细胞的一系列耐氧适应性反应,改善组织或细胞的低氧状态。研究表明[19],HIF-1α对成骨细胞的调控作用对于骨组织的再生和塑形起着关键性作用。本研究发现,低氧环境下红景天苷可以明显下调MG63细胞HIF-1α的表达量,由此我们推测红景天苷可能对成骨细胞具有保护作用,降低细胞对低氧刺激产生的应激性反应强度。HIF-1的下游靶基因VEGF是促进血管生成最主要的生长因子,VEGF与骨的形成与修复密切相关,其表达水平直接影响到成骨的血供、形成速度与质量。VEGF的产生受局部氧浓度的调节,低氧可导致HIF-1表达量增加,进而刺激多种细胞分泌VEGF使其表达量上升[20]。我们研究发现,低氧环境下红景天苷可以明显下调HIF-1α表达及核转位,而荧光素酶报告基因检测结果表明红景天苷可使HIF-1α基因启动子转录活性增加,由此我们推测,低氧状态下红景天苷可能通过加速HIF-1α与HIF-1β结合,上调转录因子与HRE结合,进一步激活下游靶基因VEGF的转录,改善组织或细胞的低氧状态,从而促进成骨细胞的表型表达。
综上所述,红景天苷可能通过调节HIF-1α/VEGF信号通路来调控成骨细胞的增殖、分化及凋亡,这为全面深入阐明红景天苷促进骨生成的作用机制奠定基础,同时也为今后临床应用红景天苷治疗骨折和促进骨再生提供科学依据。
(致谢:本课题主要在武警后勤学院病原生物和免疫学教研室实验室完成,部分工作在院内重点实验室完成。由王越教授、李玲讲师以及3名硕士研究生祁琳、王川、张鹏共同完成,在此,向他们致以最衷心的感谢。)
[1] Vogt M T, Canley J A, Kuller L H, et al. Bone mineral density and blood flow to the lower extremities: the study of osteope rotic fractures[J].JBoneMinerRes, 1997, 12:283-9.
[2] Street J T, Lenehan B, deSchrijver K, et al. Hypoxia regulates the paracrine coupling of angiogenesis and bone formation[J].EurJOrthopSurgTraumatol, 2005, 15:214-25.
[3] Ivan M, Kondo K, Yang H, et al. HIF l alpha targeted for VHL-mediated destruction by praline hydroxylation:implications for O2 sensing[J].Science, 2001, 292:464-8.
[4] Wang Y, Wan C, Deng L, et al.The hypoxia-inducible factor alpha pathway couples angiogenesis to osteogenesis during skeletal development[J].JClinInvest, 2007,117(6):1616-26.
[5] Wu Y L, Lian L H, Jiang Y Z, et al. Hepatoprotective effects of salidroside on fulminant hepatic failure induced by D-galactosamine and lipopolysaccharide in mice[J].JPharmPharmacol,2009,61(10):1375-82.
[6] Zhang L, Yu H, Sun Y, et al. Protective effects of salidroside on hydrogen peroxide-induced apoptosis in SH-SY5Y human neuroblastoma cells[J].EurJPharmacol,2007,564(1-3):18-25.
[7] 赖文芳, 张小琴, 洪海棉, 等. 红景天苷对大鼠局灶性脑缺血/再灌注损伤的神经保护作用[J]. 中国药理学通报, 2015,31(6): 775-80.
[7] Lai W F, Zhang X Q, Hong H M, et al. Neuroprotective effects of salidroside on focal cerebral ischemia-reperfusion injury in rat[J].ChinPharmacolBull, 2015, 31(6): 775-80.
[8] Zhang W,He H,Song H, et al. Neuroprotective effects of salidroside in the MPTP mouse model of Parkinson′s disease: Involvement of the PI3K/Akt/GSK3β pathway[J].ParkinsonsDis,2016,10:1155-63.
[9] Yu S, Shen Y, Liu J, et al.Involvement of ERK1/2 pathway in neuroprotection by salidroside against hydrogen peroxide-induced apoptotic cell death[J].JMolNeurosci, 2010,40(3):321-31.
[10]张金平, 陈建宗, 刘安恒, 等. 红景天苷通过HIF-1途径对缺氧诱导心肌细胞凋亡的抑制作用[J]. 第四军医大学学报, 2008, 29(12): 1057-60.
[10]Zhang J P, Chen J Z, Liu A H, et al. Protective effect of salidroside on cardiomycyte against apoptosis induced by hypoxia via HIF-1 way[J].JFourthMilMedUniv, 2008, 29(12): 1057-60.
[11]Zhang J P, Liu A H, Hou R R, et al. Salidroside protects cardiomyocyte against hypoxia-induced death:A Hif-1α-activated and VEGF-mediated pathway[J].EurJPharmacol, 2009, 607(123):6-14.
[12]Wu Y L, Piao D M, Han X H, et al. Protective effects of salidroside against Acetaminophen-induced toxicity in mice[J].BiolPharmBull, 2008,31(8):1523-9.
[13]Xu Z W,Chen X,Jin X H,et al. SILAC-based proteomic analysis reveals that salidroside antagonizes cobalt chloride-induced hypoxic effects by restoring the tricarboxylic acid cycle in cardiomyocytes[J].JProteomics,2016,130:211-20.
[14]Zhao J F,Fu H Y,Yang F, et al. Inhibitory effect of salidroside on hypoxia-induced apoptosis of corpus cavernosum smooth muscle cells in rats[J].ZhonghuaNanKeXue,2014,20(4):309-14.
[15]谭洪玲, 马增春, 肖成荣, 等. 红景天苷对心肌细胞缺氧/复氧的保护作用[J]. 解放军药学学报, 2010,26(3):194-7.
[15]Tan H L, Ma Z C, Xiao C R, et al. The mechanism of salidroside on neonatal rat cardiocytes damaged by hypoxia/reoxygenation[J].PharmJChinPLA, 2010,26(3):194-7.
[16]Sun J S, Li Y Y, Liu M H, et al. Effects of coumestrol on neonatal and adult mice osteoblasts activities[J].JBiomedMaterResA, 2007,81(1):214-23.
[17]高文魁,王德元,李智钢, 等. 低氧条件下成骨细胞的增殖与分化[J]. 中国组织工程研究与临床康复,2011,15(46):8591-4.
[17]Gao W K, Wang D Y, Li Z G, et al. Effects of hypoxia on proliferation and differentiation of rat osteoblasts[J].JClinRehabilitTissEnginRes, 2011,15(46):8591-4.
[18]Komori T. Regulation of skeletal development by the Runx family of transcription factors[J].JCellBiochem,2005,95(3):445-53.
[19]Liu X D, Deng X F, Wang J, et al. Hypoxia- inducible factor 1-α plays a critical role in regulating the function of osteoblasts[J].ShanghaiCommunUniverJ(Med), 2007,27:298-302.
[20]高秀芳,施海明,山 缨,等.红景天对低氧条件下内皮细胞HIF-1α、HIF-1β和VEGF表达的影响[J].中华中医药杂志, 2010,25(4):582-5.
[20]Gao X F, Shi H M, Shan Y, et al. Effect of aqueous extract of Radix et Rhizome Rhodiolae on expressions of HIF-1α,HIF-1β and VEGF in endothelial cells exposed to hypoxia[J].CJTCMP, 2010,25(4):582-5.
Effect of salidroside on regulating phenotypic expression of human osteoblast-like MG-63 cells through HIF-1α signal passway
QI Lin1,WANG Chuan2,MEI Guo-hua3,WEN Xiao-chang4,MAO Li-qun3,JIN Xin5, LI Ling5,WANG Yue3
(1.DeptofPharmacy; 2.DeptofStomatology,theAffiliatedHospitalofCollegeofLogistics,CPAF,Tianjin300162,China;3.DeptofPathogenicBiologyandImmunology; 4.TeachingandResearchBasicMedicalExperimentTechnology; 5.DeptofPharmacology,CollegeofLogistics,CPAF,Tianjin300309,China)
Aim To investigate the effect of salidroside on the phenotypic expression of osteoblast and the possible molecular mechanism in hypoxia environment.Methods MTT, Annexin V/PI double staining, alkaline phosphatase(ALP) activity assay and enzyme-linked immnosorbent assay(ELISA) were performed respectively to detect the effect of salidroside on regulating phenotypic expression of MG-63 cells exposed to hypoxia. Then RT-PCR and Western blot were conducted to detect the expression levels of Osterix and Runx2 which were related to differentiation. At last, we investigated the expression levels of components of the HIF-1α pathway by RT-PCR,Western blot and ELISA, respectively. Immunofluorescence confocal microscope technology and luciferase reporter assay were performed to explore nuclear translocation and transcriptional activity of HIF-1α.Results Salidroside could markedly promote MG-63 cell proliferation, inhibit hypoxia-induced apoptosis, stimulate cell differentiation and promote expression levels of components of the HIF-1α pathway in hypoxia environment.Conclusion Salidroside could regulate phenotypic expression of MG-63 cells through HIF-1α/VEGF signaling pathway in hypoxia environment.
salidroside; hypoxia-inducible factor(HIF)-1α;osteoblast; proliferation; differentiation; apoptosis; vascular endothelial growth factor(VEGF)
时间:2017-5-25 17:44 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170525.1744.036.html
2017-01-15,
2017-03-05
国家自然科学基金资助项目(No 81273520,81572852);天津市自然科学基金资助项目(No 15JCYBJC28900, 12JCZDJC26300);武警后勤学院科学技术研究项目(No WHJ201508, WHJ201509, WYKFM201609)
祁 琳(1987-),女,硕士生,研究方向:抗骨病药物分子机制,E-mail:qilin19870728@sina.com; 王 川(1986-),男,硕士生,研究方向:口腔种植外科,E-mail:wangchuan920@qq.com; 李 玲(1976-),女,博士,讲师,研究方向:抗骨病药物分子机制,通讯作者,E-mail:liling5257@126.com; 王 越(1968-),女,博士,教授,研究方向:抗骨病药物分子机制,通讯作者,E-mail:wangyue6808@126.com
10.3969/j.issn.1001-1978.2017.06.018
A
1001-1978(2017)06-0836-08
R284.1;R329.24;R329.25;R681;R845.22;R977.6
